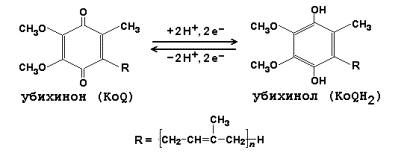- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Исрапилова А.И.
1
Османова П.М.
1
Гаджиева А.К.
1
Магомедова К.М.
1
1 Дагестанский государственный университет
За последние десятилетия было накоплено большое количество новых сведений, которые позволяют с новой стороны взглянуть на общепринятые модели, касающиеся митохондрий, их функций и строения. И в данном сообщении были собраны все основные новые открытия, которые позволят посмотреть на митохондрии с новой стороны.
митохондрии
атф
кальциевый обмен
апоптоз
фософорилирование
1. Бонь.Е.И. Медико-биологические и фундаментальные исследование/ Е.И.Бонь, Н.Е.Максимович//Оренбургский медицинский вестник, том 2 №1(25) -2015
2. Бра М. Митохондрии в программированной гибели клетки: различные механизмы гибели/М. Бра, Б. Квинан, С.А. Сузин // Биохимия. – 2005. – Т. 70, № 2. – С. 284–293.
3. Владимиров Ю.А. Дизрегуляция проницае мости мембран митохондрий, некроз и апоптоз / Ю.А. Владимиров // Дизрегуляционная патология. – М.: Медицина, 2002. – C. 127–156.
4. Aradjomande S.L.A. Newcomers in the process of mitochondrial permeabilisation / S.L. A. Aradjomande, J.C. Martinou // J. Cell Scien. – 2005. – Vol. 118. – P. 473–483
5. Becker T., Gebert M., Pfanner N., Laan M. Biogenesis of mitochondrial membrane proteins // Current Opinion in Cell Biology. – 2009. – № 21. – P. 484-493
6. Bhosale G., Sharpe J., Sundier S., Duchen M. Calcium signaling as a mediator of cell energy demand and a trigger to cell death // Annals of the NewYork academy of sciences. – 2015. – Vol. 1350. – P. 107-116
7. Bonifaz L., Cervantes-Silva M., Oniveros-Dotor E., Lopez-Villegas E., Sanchez-Garcia F. A role for mitochondria in antigen processing and presentation // Immunology. – 2015. – Vol. 144, № I.3. – P. 461-471.
8. Booth D., Joseph S., Hajnoczky G. Subcellular ROS imaging methods relevance for study of calcium signaling // Cell calcium. – 2016. – Vol. 60. – P. 65-73.
9. Buja L.M. Myocardial ischemia and reperfusion injury / L.M. Buja // Cardiovasc. Pathol. – 2005. – Vol. 14. – P. 170–175.
10. Cloonan S.M., Choi A. Mitochondria: sensors and mediators of innate immune receptor signaling // Current Opinion in Microbiology. – 2013. – № 16. – P. 1-12.
11. Crow M.T. Hypoxia, BNip3 proteins, and the mitochondrial death pathway in cardiomyocytes / M.T. Crow // Circ. Res. – 2002. – Vol. 92. – P. 183–185.
12. Csords G., Vrnai P., Golenar T., Sheu-Shing S., Hajnуczky G. Calcium transport across the inner mitochondrial membrane: Molecular mechanisms and pharmacology // Molecular and Cellular Endocrinology. – 2012. –№ 353. – P. 109-113.
13. Dupont G. Modeling the intracellular organization of calcium signaling // Wiley Periodicals. – 2014. – Vol. 6. – P. 227-237.
14. Erazo-Oliveras, A. Proteindelivery into live cells by incubationwithanendosomolyticagent /А. Erazo-Oliveras // Nat Methods. – 2014. – V. 56. – Р. 112-118.
15. Giorgi C., Agnoletto A., Bononi A., Bonora M., Marchi E.D., Marchi S., Missiroli S., Patergnani S., Poletti F., Rimessi A., Suski J.M., Wieckowski M.R., Pinton P. Mitochondrial calcium homeostasis as potential target for mitochondrial medicine // Mitochondrion. – 2012. – № 12. – P. 77-85.
16. Guimaraes C.A. Programmed cell death: apoptosis and alternative deathstyles / C.A. Guimaraes, R. Linden // Eur. J. Biochem. – 2004. – Vol. 217. – P. 1638–1650.
17. Joseph N., Reicher B., Barda-Saad M. The calcium feedback loop and T cell activation: How cytoskeleton networks control intracellular calcium flux // Biochemica et Biophysica. – 2014. – A. 1838. – P. 557-568
18. Kaufman R. J., Malhotra J. D. Calcium trafficking integrates endoplasmic reticulum function with mitochondrial bioenergetics // Biochimica et Biophysica Acta. – 2014. – Vol. 1843. – P. 2233-2239
19. Kock R., Josefsan C., Hill G. Mitochondrial functions, ornamentation and immunocompetence // Biol. Rev. – 2016. – Vol. 456. – P. 1-12.
20. Levine B. Autophagy in cell death: an innocent convict? / B. Levine, J. Yuan // J. Clin. Invest. – 2005. – Vol. 115. – P. 2679– 2688.
21. Logan D.C. The mitochondrial compartment // J. Exp. Bot. 2006. V. 57. P. 1225-1243
22. Role of the mitochondrial permeability transition in myocardial disease / J.N. Weiss, P. Korge, H.M. Honda et al. // Circ. Res. – 2003. – Vol. 93. – P. 292–301
23. Serricchio, M. Cardiolipin synthesizing enzymes form a complex that interacts with cardiolipin-dependent membrane organizing proteins / Serricchio M., Vissa A., Kim P. K., YipC. M., McQuibbanG. A. // Acta Molecular Cell Biology Lipids. – 2018. – V. 4. – P. 447-457
24. Xu C. Endoplasmic reticulum stress: cell life and death decisions / C. Xu, B. BaillyMaitre, J.C. Reed // J. Clin. Invest. – 2005. – Vol. 115. – P. 2656–2664.
Митохондрии представляют собой внутриклеточные органеллы эукариот, основной функцией которых является выработка АТФ в результате реакции окислительного фосфорилирования. (Logan, 2006)
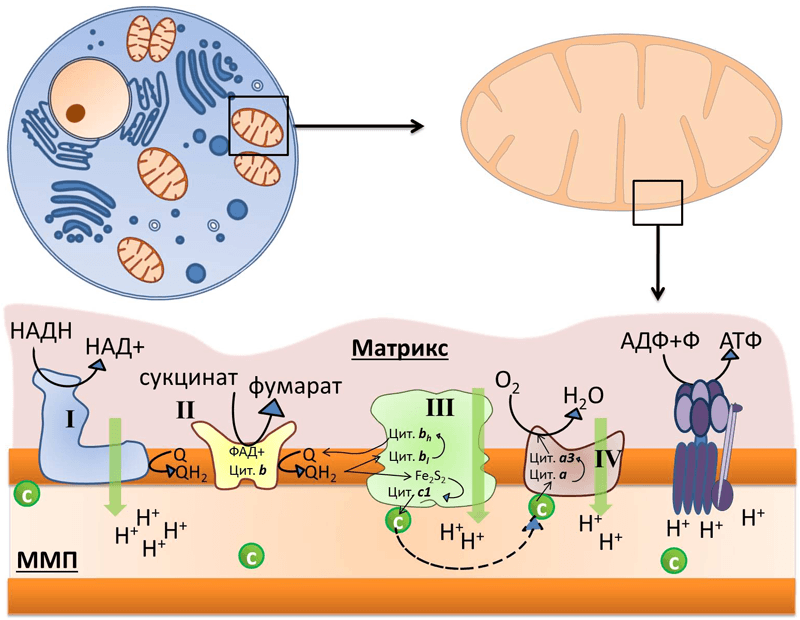
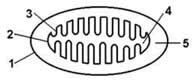
Каждая митохондрия содержит высокоспециализированные мембраны, играющие ключевую роль в ее активности. Мембраны образуют два изолированных митохондриальных компартмента: внутренний матрикс и узкое межмембранное пространство. Каждый отдел содержит уникальный набор белков. В состав наружной мембраны входит белок порин, который образует широкие гидрофильные каналы в липидном бислое. (Максимович, 2015). В результате эта мембрана напоминает сито, проницаемое для всех молекул массой менее 10000 дальтон, в том числе низкомолекулярных. Эти молекулы могут проникать в межмембранное пространство, но большая их часть не способна проходить через непроницаемую внутреннюю мембрану. Основная функциональная часть митохондрии– матрикс и окружающая его внутренняя мембрана. Внутренняя мембрана содержит большое количество «двойного» фосфолипида кардиолипина (30%), что обеспечивает непроницаемость мембраны для ионов и отличается необычно высоким содержанием белка (около 70% от веса). Многие из белков являются компонентами электронтранспортной цепи, поддерживающей протонный градиент на мембране. Другой большой белковый комплекс–фермент АТФ-синтаза, катализирующий синтез АТФ, через который протоны возвращаются в матрикс по электрохимическому градиенту (Erazo-Oliveras,2014).
Во внутреннюю митохондриальную мембрану встроены ферменты дыхательной цепи, необходимые для процесса окислительного фосфорилирования, образующего основную часть АТФ, и транспортные белки, обусловливающие ее избирательную проницаемость. Внутренняя мембрана митохондрий непроницаема для Н+, ОН—, всех анионов и катионов. Транспорт необходимых веществ и неорганических ионов происходит при участии белков-переносчиков (Serricchio, 2018). Матрикс митохондрий имеет более вязкую консистенцию по сравнению с цитоплазмой клетки. В нем находятся ферменты, митохондриальная ДНК, рибосомы, органические соединения, ионы, соли кальция и магния. Ферменты, расположенные в матриксе, участвуют в цикле Кребса, окислительном фосфорилировании, окислении пирувата и бета-окислении жирных кислот. Субстратом для окислительного метаболизма в митохондриях служат главным образом жирные кислоты и пируват, образуемый в результате гликолиза в цитозоле. Эти вещества избирательно транспортируются из цитозоля в митохондриальный матрикс, где распадаются до двухуглеродных групп, присоединенных к ацетилкоферменту А (ацетил-СоА). В составе молекулы ацетил-СоА каждая ацетильная группа поступает в цикл Кребса для дальнейшего расщепления, где при окислении двухуглеродных атомов ацетил-СоА происходит извлечение высокоэнергетических электронов.
Роль митохондрий в энергетике клетки
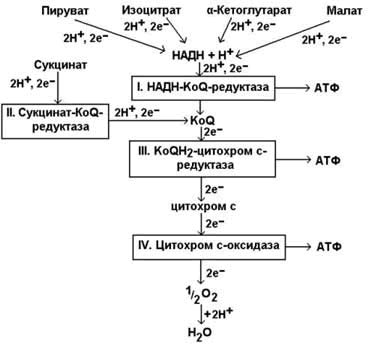
Наиболее характерной особенностью митохондрий является содержание в них большого числа ферментов, участвующих в аэробном «дыхании». Большая часть энергии, которая освобождается при переносе электронов, аккумулируется в макроэргических фосфатных связях АТФ. (Максимович, 2015)
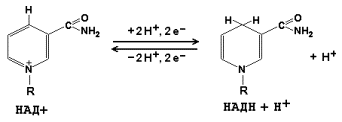
Окисление ацетильной группы в цикле Кребса ведет к образованию молекул восстановленного NADH и восстановленного FADH2. Вначале почти вся энергия, получаемая на ранних этапах окисления питательных веществ, аккумулируется в форме высокоэнергетических электронов NADH и FADH2. NADH, компонент NADH-дегидрогеназного комплекса, образовавшийся в цитозоле при гликолизе, передает свои электроны в дыхательную цепь. Так как NADH не способен проходить через внутреннюю мембрану, перенос электронов от него осуществляется непрямым путем при помощи одной из челночных систем, транспортирующих в митохондрию карнитин, который после окисления возвращается в цитозоль с последующим его восстановлением с помощью NADH. Другой субстрат, FADH2 передает свои электроны в дыхательную цепь непосредственно. Электроны этих субстратов восстанавливают молекулярный кислород (акцептор электронов) в дыхательной цепи с образованием метаболической воды. Так как большое количество высвобождаемой энергии используется ферментами внутренней мембраны для образования АТФ из AДФ, эти реакции называют окислительным фосфорилированием. На внутренней мембране создается электрохимический протонный градиент. Митохондриальная дыхательная цепь внутренней мембраны способна перемещать протоны Н+. При прохождении электронов по дыхательной цепи происходит их «откачивание» из матрикса. АТФ-синтаза может использовать энергию гидролиза АТФ для переноса Н+ через мембрану, а при достаточно большом протонном градиенте протоны начинают «течь» через фермент в обратном направлении, что сопровождается синтезом АТФ. Все белки-переносчики электронов группируются в 4 больших комплекса дыхательных ферментов, каждый из которых содержит трансмембранные белки, прочно закрепляющие комплекс во внутренней мембране митохондрии. Комплекс I (NADH-убихиноноксидоредуктаза; NADH-дегидрогеназа), комплекс II (сукцинатдегидрогеназа; сукцинат-убихинон оксидоредуктаза), комплекс III (комплекс цитохромов b, c1; убихинон-цитохром c оксидоредуктаза), комплекс IV (цитохром c оксидаза; цитохромоксидаза; цитохром с-O2 оксидоредуктаза). Каждый последующий комплекс обладает большим сродством к электронам, чем предыдущий. (Logan, 2006) Электроны последовательно переходят от одного комплекса на другой, пока не восстановят кислород, являющийся их акцептором.(Максимович, 2015)
Синтез АТФ – не единственный процесс, идущий за счет энергии электрохимического градиента. В матриксе, где находятся ферменты, участвующие в цикле Кребса и других метаболических реакциях, необходимо поддерживать высокие концентрации различных субстратов. Поэтому через внутреннюю мембрану должны транспортироваться различные несущие заряд субстраты. Их активно перекачивают против электрохимических градиентов встроенные в мембрану белки-переносчики. Энергия электрохимического протонного градиента используется также для переноса в матрикс ионов Са2+, которые играют важную роль в регуляции активности некоторых митохондриальных ферментов. Большое значение имеет поглощение митохондриями этих ионов для удаления их из цитозоля, где высокая концентрация Са2+ является опасной. (Cloonan 2013)
Роль митохондрий в кальциевом гомеостазе
Центральным механизмом в реализации иммунного ответа является кальциевая сигнализация. Иммунореактивность лимфоцитов обеспечивается интеграцией митохондрий и механизмов кальциевой сигнализации. Митохондрии играют важную роль в гомеостазе Ca2+ лимфоцитов, как и в других клетках. Они имеют огромный потенциал для его быстрого накопления, поэтому участвуют в модуляции пространственно-временного профиля кальциевых сигналов (Bonifaz 2015, Chandel 2014).
В последние годы все большее внимание исследователей привлекает изучение работы митохондрий как кальциевых депо клетки в процессе реализации специфических функций иммунокомпетентных клеток, так как белки компоненты этой сложной системы регуляции кальциевого гомеостаза могут рассматриваться в качестве молекул-мишеней для направленной регуляции функциональной активности лимфоцитов в норме и при патологических процессах (воспаление, аутоиммунная патология, аллергические реакции, иммунодефициты).
Взаимосвязь между динамикой митохондрий и кальциевыми сигналами связана с двумя аспектами клеточных функций: хемотаксисом и регуляцией формирования иммунологического синапса. Иммунологический синапс представляет собой важный кальций – зависимый процесс, который осуществляется во время активации лимфоцитов (Kock 2016). Особая роль при этом принадлежит митохондриям, так как способность митохондрий поглощать Ca2+ оказывает влияние на формирование кальциевых сигналов и их распространение. Во время активации лимфоцитов митохондрии локализуются вблизи иммунологического синапса, образуют сложный структурный комплекс, связывающий мембраны эндоплазматического ретикулума (ЭПР) с мембранами митохондрий и плазматической мембраной, так называемую «ассоциированную мембрану» (Quintanaa 2012). Поглощая ионы из внутриклеточной среды, данные органеллы, накапливают их в матриксе митохондрий и высвобождают избыточное количество в цитозоль. Так митохондрии регулируют уровень Ca2+, действуя в качестве буферов, активируют или ограничивают действие кальциевых сигналов в клетке, а именно, контролируют уровень Ca2+ в цитозоле и цитоплазматических микродоменах, изменяя частоту осцилляций кальциевых сигналов и снижая амплитуду распространяющихся волн (Dupont 2014).
Стабильный уровень Ca2+ в митохондриях сохраняется в результате равномерного накопления ионов и их высвобождении при значительном повышении уровня Ca2+ в матриксе, за счет слаженной работы транспортной системы внешней и внутренней мембран митохондрий. Данная система включает основной канал тока Ca2+ через наружную мембрану – потенциал-зависимый анионный канал; также систему унипорта внутренней мембраны и его молекулярные компоненты, регулирующие активность; два пути высвобождения Ca2+ в цитозоль – H+/Ca2+ насос и проницаемая пора мембраны митохондрий. Ток Ca2+ через потенциал – зависимый канал и систему унипорта осуществляется за счет электрохимического протонного градиента (Kaufman 2014).
Изучение способности митохондрий поглощать Ca2+ показало, что аккумуляция Ca2+ осуществляется за счет градиента разности потенциалов (∆ψ), энергии, образующегося при окислении субстратов или активности H+АТФазы. Отношение уровня Ca2+ при равновесии (∆µCa = 0) составляет [Ca2+]мит / [Ca2+]цит = 106 , с учетом мембранного потенциала и заряда иона.
Так, в цитозоле уровень кальция составляет в норме 10-7М, тогда как в матриксе – 10-1М. Однако для митохондрий такое значение не совместимо с их жизнедеятельностью, поэтому Ca2+ высвобождается через систему антипорта при значительном повышении в матриксе. Митохондрии поглощают Ca2+ если уровень ионов в цитозоле превышает 400 нм. Ток Ca2+ из матрикса в электроневозбудимых клетках зависит от механизма H+/Ca2+ обмена. Система антипорта H+/Ca2+ 7 представляет собой высококонсервативный трансмембранный белок, экспрессируемый внутренней мембраной митохондрии, который контролирует уровень кальция в митохондриях.
Были определены белки, участвующие в контроле Ca2+ тока сквозь внутреннюю мембрану митохондрий (Becker 2009). В частности, в 2010 г. были исследованы Na+/Ca2+ насосы; белки – регуляторы поглощения Ca2+ митохондриями, они получили название mitochondrial calcium uptake 1 белки –MICU1; затем были обнаружены и частично охарактеризованы потенциальные регуляторы тока Ca2+ в митохондрии: MICUb, MICU2, MICU3, EMRE. На основании проведенных исследований сложилась более четкая картина осуществления поглощения ионов кальция митохондриями и сохранении гомеостаза Ca2+ как внутри органеллы, так и клеточной системе, в целом (Becker 2009).
Внутренняя мембрана митохондрий является непроницаемой для кальция и требует специфических транспортеров для переноса Ca2+ из цитозоля в митохондрии.(Giorgi 2012). Транспорт Ca2+ в матрикс митохондрий через внутреннюю мембрану осуществляется двумя механизмами: 1) локализацией митохондрий вблизи ЭПР с образованием высококонцентрированного микродомена; 2) захватом кальция низкоаффинным транспортером-унипортом. Эти два механизма дополняют друг друга (Csords 2012). Повышение уровня кальция в митохондриях достигает высоких значений, на два порядка выше, чем в цитозоле. Это обеспечивается кальций-селективным каналом или унипортом внутренней мембраны митохондрий. Кальциевый унипорт митохондрий (mitochondrial calcium uniporter-MSU) является белком, экспрессирующимся на внутренней мембране митохондрий с большим электрохимическим градиентом. Это довольно высокоселективный канал, но с низкой аффинностью к ионам Ca2+. Свойства унипорта зависят от активности его регуляторных субъединиц: MICU1и MICU2 (Giorgi 2012).
Существует зависимость между уменьшением расстояния между митохондриями и плазматической мембраной и увеличением открытия кальциевых каналов в мембране ЭПР. Тесный контакт между плазматической мембраной, ЭПР и митохондриями в иммунологическом синапсе дает возможность митохондриям быстро захватывать большое количество Ca2+ из внеклеточной среды (Kaufman 2014). Во время образования ассоциированной мембраны между митохондриями и ЭПР осуществляется поглощение Ca2+ митохондриями, в состоянии покоя поглощение Ca2+ подавляется, вследствие предотвращения перегрузки Ca2+ в матриксе, рассеяния разности потенциалов и снижения синтеза АТФ, и, напротив, в стимулированном состоянии митохондрии активно поглощают Ca2+, в этом случае наблюдается экспоненциальные повышение уровня ионов (Bhosale 2015).
Шапероны в мембранах ЭПР и митохондрий обеспечивают физическое и функциональное взаимодействие между ЭПР и митохондриями. В формировании АММ главную роль играет глюкозо-регулирующий белок – шаперон GRP75, который содержится в большом количестве в митохондриях. Этот шаперон контролирует передачу кальциевого сигнала от ЭПР к митохондриям и индуцирует взаимодействие между фосфоинозитол3-фосфат-чувствительными рецепторами и VDAC1. В этом случае шаперон образует между мембранами ЭПР и митохондрий туннель для Ca2+, позволяя более эффективно проникать ионам из ЭПР во внешнюю мембрану митохондрий.
Митохондриальная пора – канал, для которого характерны два состояния: низкокондуктивное и высококондуктивное. В первом случае канал открывается временно, во втором случае пора полностью и необратимо открыта, вследствие этого нарушается ток H+. В результате происходит разобщение окислительного фосфорилирования, которое предотвращает синтез АТФ. Открытие этого канала приводит к гибели клетки вследствие развития следующих событий: деполяризации мембраны, в результате разобщения окислительного фосфорилирования и продукции АТФ; набухание митохондрии, вследствие изменения осмолярности; высвобождение в цитозоль проапоптогенных белков (Booth 2016).
Роль митохондрий в апоптозе
Установлено, что основным компонентом, осуществляющим восприятие стимулов ПГК и активизирующим механизмы реализации той или иной формы ПГК, являются митохондрии. Предполагается, что на уровне митохондрий осуществляется интеграция сигналов активизирующих и подавляющих процесс ПГК, следствием чего является дальнейшая реализация программированной клеточной гибели или ее подавление.
На сегодняшний день показано существование трех основных форм программированной гибели клетки: апоптоз (I тип ПГК), аутофагия (II тип ПГК), некрозоподобная ПГК (III тип ПГК). Каждый из этих типов гибели клетки характеризуется собственными биохимическими, молекулярными и морфологическими особенностями (Бра 2005).
При апоптозе наблюдается уменьшение клетки в объеме, конденсация хроматина и фрагментация ДНК на олигонуклеосомные фрагменты. Митохондрии и рибосомы во время реализации апоптоза сохраняют в основном свою структуру и частично – функции. Заключительный этап апоптоза характеризуется разрушением цитоскелета, что приводит к сморщиванию клетки и ее фрагментации на апоптотические тельца, поглощаемые макрофагами или другими соседними клетками.
Ключевыми участниками терминальной фазы апоптотической программы являются цистеиновые протеазы – каспазы, осуществляющие деградацию белковых структур клетки и активирующие нуклеазы. (Бра 2005). Для аутофагии характерно набухание митохондрий и цистерн эндоплазматического ретикулума, увеличение аппарата Гольджи, секвестрация клеточных органелл аутофагическими вакуолями, конденсация хроматина и коллапс ядра.
Терминальным этапом аутофагии является разрушение клеточных органелл лизосомальными ферментами, следствием чего является деградация клетки. Образующийся после реализации аутофагии клеточный дебрис поглощается соседними клетками (Levine 2005). Заключительным событием в этом процессе является разрыв плазматической мембраны, способствующий излиянию содержимого клетки в межклеточное пространство, что способствует индукции воспалительной реакции.
Соотношение различных типов ПГК может варьироваться в зависимости от типа и силы воздействия стимула, активизирующего ПГК.
Важной особенностью митохондрий является способность к значительной амплификации исходящих от них стимулов, активирующих ПГК. Показано, что открытие митохондриальных пор является общим моментом в реализации механизмов всех обсуждаемых выше форм ПГК (Владимиров 2002). Образование пор в митохондриях приводит к выходу из митохондрий цитохрома С, способствующего образованию апоптосомы и активирующего каспазы. Этот процесс является основным механизмом апоптотической гибели клетки. Через открытые поры в митохондриях в цитоплазму высвобождаются также факторы, перемещающиеся в ядро и активирующие реализацию ПГК по независимым от каспаз механизмам: эндонуклеаза G и AIF, связывающий ДНК и активирующий нуклеазы и протеазы в ядре. Показано, что данные факторы принимают участие в развитии как апоптоза, так и некроза. Помимо активаторов ПГК, митохондрии также высвобождают ингибиторы белков, блокирующих ПГК (Smac/DIABLO, Omi/ HtrA2) и предшественников каспаз (прокаспаза 2, 3, 9) (Бра 2005).
К небелковым медиаторам клеточной гибели относятся ионы Ca2+, активирующие при их выходе в цитоплазму кальпаины и Ca2+зависимые липазы, что приводит к реализации некротической формы ПГК. Дополнительным фактором индукции ПГК является увеличение продукции компонентами дыхательной цепи митохондрий активных форм кислорода, активирующих механизмы апоптоза, аутофагии и некроза. На сегодняшний день известны митохондриальные апоптотические поры (mitochondrial apoptotic pores – MAP) и поры повышенной проницаемости или мегаканалы (permeability transition pores – РТP). Механизмом образования апоптотических пор в митохондриях является олигомеризация на митохондриальной мембране белков Bax и Bak. (Aradjomande 2005).
Процесс формирования пор в митохондриях находится под жестким контролем различных регуляторных систем клетки. Установлено, что образованию MAP за счет олигомеризации Bax и Bak способствуют белки индукторы ПГК семейства Bcl 2: Bax, Bak, Bok, Boo, Bcl G, Bcl B, Bcl rambo, Bad, Bim, Bmf, Bid, Noxa, Puma, BNip3. Установлено, что BNip3 и активная поли(АДФ-рибоза)полимераза-1 (PARP-1) индуцируют открытие PTP, что сопровождается снижением митохондриального потенциала и увеличением продукции активных форм кислорода (Crow 2002) .Образование митохондриальных пор возможно посредством воздействия на митохондрии цитоплазматических ионов Ca2+ и активных форм кислорода, что приводит к ПОЛ или липолизу, опосредованного фосфолипазой А2. Установлено, что повреждение митохондрий и развитие их функциональных нарушений при различных патологических процессах и токсических повреждениях данных органелл также способствует активизации ПГК посредством обсуждаемых выше механизмов(Владимиров 2002).
Существует мнение, что «выбор» клеткой активизации механизмов той или иной формы программированной гибели определяется количеством открытых пор в митохондриях. В том случае, если PTP формируются в нескольких митохондриях, в клетке активируется процесс аутофагии. Когда PTP открываются у большего числа митохондрий, в клетке инициируется апоптоз, что, вероятно, является следствием увеличения в цитоплазме количества цитохрома С и AIF. Наконец, когда в клетке практически во всех митохондриях открываются РТP, происходит разобщение окисления и фосфорилирования и интенсивный гидролиз АТФ митохондриальной АТФ-азой, активизируются механизмы некрозоподобной клеточной гибели (Guimaraes 2004). Минимальное количество открытых пор принципиально не влияет на процесс клеточной гибели, при большем количестве.
Незначительное увеличение концентрации ионов кальция в цитоплазме приводит к развитию апоптоза, в то время как существенное возрастание их уровня индуцирует некроз. К возможным механизмам этого процесса относят воздействие ионов кальция на митохондрии и активацию Ca2+-зависимых протеаз (кальпаинов) (Crow 2002). Установлено, что увеличение внутриклеточной концентрации Ca2+ сопровождается открытием РТP в митохондриях и снижением митохондриального трансмембранного потенциала, следствием чего является активация программированной гибели клетки (Владимиров 2002). Известно, что увеличение внутриклеточной концентрации ионов Ca2+ способствует активации кальпаинов, Ca2+-зависимых фосфолипаз и нуклеаз, приводящих к разрушению внутриклеточных структур и реализации ПГК по механизму некроза (Endoplasmic 2005).
Считается, что определенное значение в реализации апоптоза и некрозоподобной ПГК имеет уровень продукции АТФ. Известно, что при низком уровне АТФ в клетке протекает процесс программированной гибели клетки по механизму некроза, достаточное энергообеспечение клетки способствует прохождению ПГК по механизму апоптоза (Buja 2005).
Установлено, что митохондрии обладают широким спектром белковых (цитохром С, эндонуклеаза G, AIF,) и небелковых факторов (ионы Ca2+, активные формы кислорода), активизирующих процесс клеточной гибели после высвобождения их в цитоплазму. В настоящее время существует аргументированная гипотеза, предполагающая, что накопление нарушений в митохондриальном геноме и прогрессирование митохондриальной дисфункции является одним из механизмов старения организма и развития различных патологических процессов.
На сегодняшний день известны митохондриальные апоптотические поры (MAP) и поры повышенной проницаемости или мегаканалы (permeability transition pores – РТP). Механизмом образования апоптотических пор в митохондриях является олигомеризация на митохондриальной мембране белков Bax и Bak. PTP формируются за счет объединения в единый комплекс АТФ –АДФ- антипортера, локализованного во внутренней митохондриальной мембране, циклофилина D, находящегося в матриксе митохондрий, и порина (voltage dependent anion channel, VDAC) – ионного канала внешней митохондриальной мембраны (Aradjomande, 2005).
В митохондриях в результате «утечки» электронов их электронтранс-портной цепи генерируется супероксиданион. При нарушение баланса между системами генерации и системами удаления АФК в митохондриях наблюдается возникновение окислительного стресса, что приводит к открытию неспецифической поры. Это обуславливает потерю мембранного потенциала, и, следовательно, невозможность импортирования митохондриальных белков, которые синтезируются в цитозоле. Свoбoдные рaдикaлы и рeaкции с их участием в последние годы стали причиной старения и возникновения многих заболеваний человека. Важным процессом в запуске митохондриального пути гибели клеток являются нарушения трансмембранного потенциала митохондрий вследствие повышения концентрации Са2+ в саркоплазматическом ретикуломе. Повышение уровня Са2+ внутри митохондрий способствует появлению транзиторных пор во внутреннем слое мембран митохондрий, что является причиной изменения электролитного баланса и нарушения энергетического потенциала его мембраны. Кроме того, избыточные ионы кальция нарушают функцию митохондрий, обеспечивающую поток электронов от НАДФ к кислороду и одновременно перенос протонов от матрикса митохондрий в межмембранное пространство, что определяет формирование электрохимического потенциала на внутренней мембране митохондрий. Дефицит в образовании НАДФ, с одной стороны, приводит к прекращению синтеза аденозинтрифосфата (АТФ), с другой — энергия, полученная от распада АТФ, используется для восстановления нарушенного электрического потенциала мембраны митохондрий. В результате митохондрии перестают быть источником энергии клеток и начинают ее поглощать. Истощение энергетических ресурсов клетки является причиной продолжения накопления Са2+ и воды в митохондриях, что приводит к появлению проницаемых пор (mPTP) во внешнем слое митохондриальных мембран (Kaufman 2014). Считается, что в открывании проницаемых пор играет важную роль также митохондриальный оксид азота (NO). Предполагается, что активный метаболит NO — пероксинитрит — может проникать в митохондрии из сарколеммы, а также вырабатываться в митохондриях под воздействием повышения активности Ca2+-чувствительных митохондриальных синтаз NO NOS (mNOS) (Kaufman 2014). Однако, что является источником образования NO в митохондриях, остается неясным, и требуются дальнейшие исследования в этом направлении. Высокая концентрация NO в митохондриях необратимо повреждает ряд компонентов дыхательной цепи и ингибирует продукцию АТФ. Помимо этого NO, путем образования транзиторных пор во внешней митохондральной мембране индуцирует апоптоз. В отличие от индуцибельной NO-синтазы (iNOS) митохондриальная NO-синтаза является кальцийзависимой, т.е. ее активность регулируется уровнем Ca2+ (Aradjomande 2005).
Таким образом, Митохондриальный путь апоптоза предусматривает не только активацию каспаз, но и доставку в ядро клетки активных ферментов — эндонуклеазы G и апоптозиндуцирующего фактора, способных вызвать деградацию генетического материала без активации каспаз (Kaufman 2014).
Библиографическая ссылка
Исрапилова А.И., Османова П.М., Гаджиева А.К., Магомедова К.М. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О РОЛИ МИТОХОНДРИЙ В ФУНКЦИОНИРОВАНИИ КЛЕТКИ // Международный студенческий научный вестник. – 2020. – № 5.
;
URL: https://eduherald.ru/ru/article/view?id=20282 (дата обращения: 22.03.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Эвелина Никельшпарг
«Природа» №3, 2016
Об авторе
Эвелина Ильинична Никельшпарг — аспирантка кафедры биофизики биологического факультета Московского государственного университета им. М. В. Ломоносова. Область научных интересов — структура и функционирование митохондрий, спектроскопия гигантского комбинационного рассеяния, фотобиология. Победитель конкурса «Био/мол/текст» 2015 г. в номинации «Своя работа».
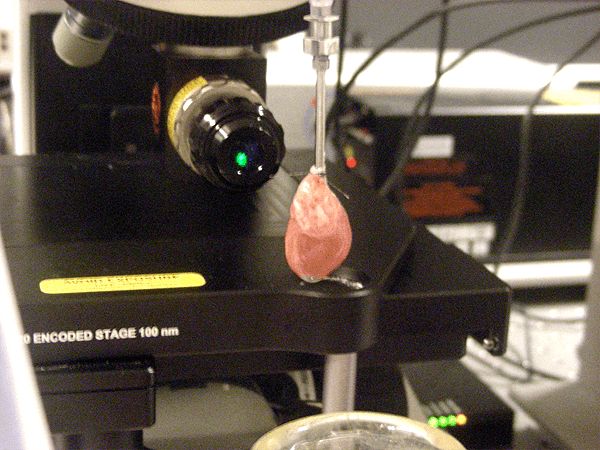
Жалюзи опущены. Выключен свет. Мы погружены во мрак. Капля мутной жидкости падает на серебряную подложку. Вспышка зеленого света. 30 секунд. Спектр. Так начинается наш длинный рабочий день. А теперь обо всем по порядку.
Капля мутной жидкости — это суспензия митохондрий, клеточных органелл размером всего 1–2 мкм. Правда, органеллами они стали не сразу: согласно теории симбиогенеза, митохондрии появились в эукариотических клетках как бактерии-симбионты и за миллиарды лет обросли множеством функций.
В митохондриях протекают сложнейшие биохимические и биофизические процессы. Основные из них: окисление питательных веществ и производство молекул АТФ — универсального источника энергии для большинства биологических процессов в клетках. Кроме того, митохондрии участвуют в инициации апоптоза, старении клеток, продукции активных форм кислорода, метаболизме лекарств, выработке тепла, запасают в себе ионы кальция, синтезируют некоторые гормоны и т. д. [1].
Митохондрии обладают столь широким спектром функций, что нарушение их работы может стать причиной множества болезней: различных видов миопатий (атрофии мышц), сердечно-сосудистых заболеваний, диабета и др. [2]. Большинство из них связаны с мутациями в генах, кодирующих белки митохондрий, но может быть и наоборот: некоторые заболевания или неправильный образ жизни (ожирение, употребление наркотиков и т. д.) могут привести к нарушению работы митохондрий. Механизмы этих процессов волнуют прежде всего биологов, но и для физиков митохондрии представляют большой интерес как преобразователи энергии и фактически белковый электропровод [3].
Как все устроено
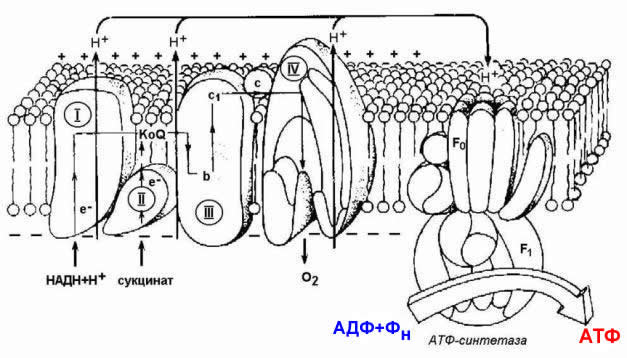
Митохондрии состоят из двух мембран: внешней, проницаемой для ионов и некоторых белков, и внутренней, где находятся четыре белковых комплекса дыхательной цепи (или электрон-транспортной цепи, ЭТЦ) и АТФ-синтаза (рис. 1). Внутренняя мембрана образует множество складок, называемых кристами (от лат. crista — гребень), и ограничивает внутреннее пространство — матрикс, где содержатся ферменты цикла трикарбоновых кислот, или цикла Кребса. Также в митохондриях есть подвижные элементы комплекса дыхательной цепи: водорастворимый белок цитохром с и жирорастворимый убихинон, также известный как кофермент Q.
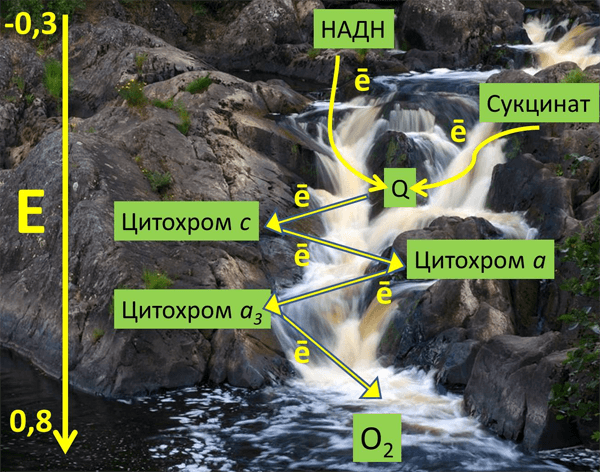
Принцип работы дыхательной цепи — окисление субстратов, поступающих из цикла Кребса, и перенос электронов от них с помощью кофакторов ЭТЦ на конечный акцептор — кислород. Есть определенная закономерность в последовательности переноса электронов: они поступают от донора с более отрицательным окислительно-восстановительным потенциалом, или редокс-потенциалом (Еred/ox, от англ. reduction — восстановление, oxidation — окисление), к акцептору с более положительным Еred/ox. Таким образом, электрон как будто движется вниз по течению, определяемому Еred/ox переносчиков электрона. Во время переноса электронов некоторые комплексы дыхательной цепи закачивают протоны из матрикса в межмембранное пространство, тем самым создавая электрохимический потенциал на внутренней мембране митохондрий, который используется для синтеза АТФ (см. рис. 1) [1].
Замечу, что митохондрии — очень популярный объект исследования. Их изучали такие корифеи науки, как Х. А. Кребс, П. Д. Митчелл, А. Л. Ленинджер, Б. Чанс, В. П. Скулачев и многие другие, и благодаря им известно об этих органеллах уже немало, но еще не все. Многие митохондриальные процессы и свойства переносчиков электронов до сих пор не изучены, что связано в первую очередь с отсутствием подходящих неинвазивных методик. В прошлом году мы, сотрудники лаборатории биофизики клетки биофака МГУ им. М. В. Ломоносова, вместе с коллегами, работающими на других факультетах нашего университета и в Институте общей и неорганической химии им. Н. С. Курнакова РАН, а также с учеными из Германии и Дании создали методику для селективного исследования конформации гема цитохрома с непосредственно в живых митохондриях [4]. Что же такое конформация гема и почему она важна?
Редокс-потенциал и конформация гема
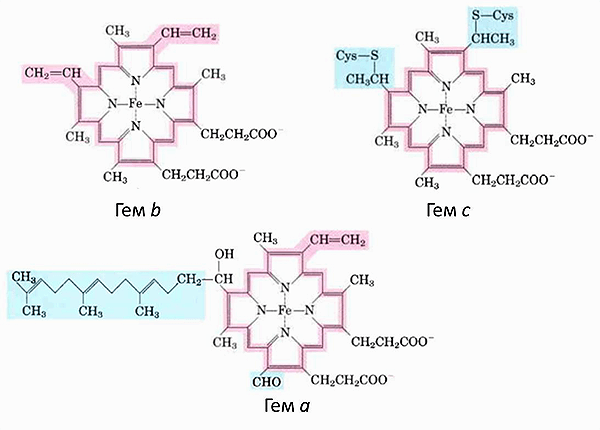
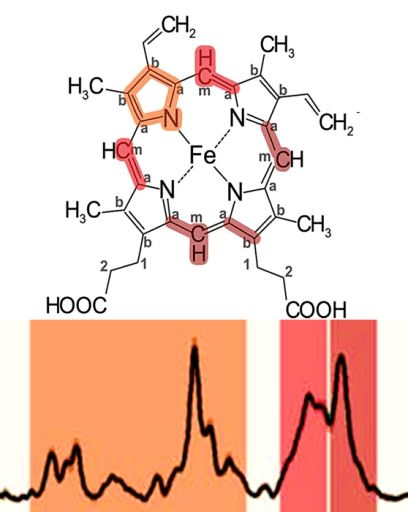
Если приглядеться к комплексам дыхательной цепи, локализованным во внутренней мембране митохондрий, то в трех из них можно увидеть цитохромы — гемсодержащие белки, которые служат кофакторами, участвующими в переносе электронов, и еще один, который диффундирует в межмембранном пространстве (см. рис. 1). Всего в митохондриях имеется три типа цитохромов — а, b и с. Они очень похожи, отличаются лишь боковыми радикалами (рис. 2).
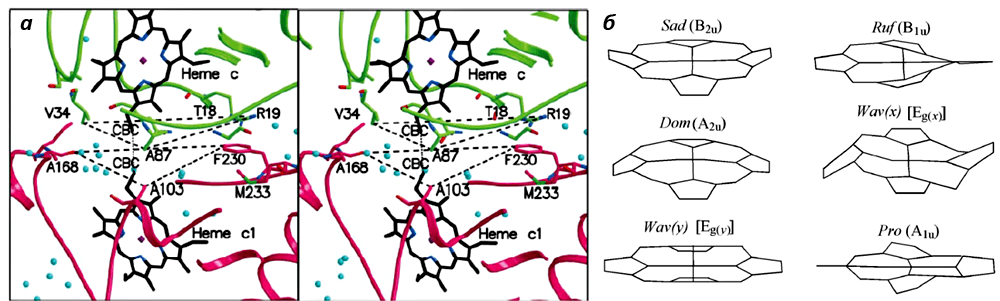
Во время переноса электрона меняется редокс-состояние атома железа (Fe3+/Fe2+), который располагается в геме цитохромов, что приводит к изменению его конформации. Эти два параметра (Еred/ox и конформация гема) всегда связаны друг с другом. Конформация гема цитохромов также зависит от белкового окружения [5, 6]. А так как Еred/ox определяет эффективность переноса электрона, то конформация гема — вещь важная. Кроме того, чтобы произошел перенос электрона с одного цитохрома на другой, нужно, чтобы их гемы находились на определенном расстоянии друг от друга и были правильно ориентированы. Поэтому любые изменения в цитохромах могут отражаться на эффективности переноса электрона, т.е. на работе всей дыхательной цепи и, как следствие, энергообеспечении клеток [7, 8].
Наиболее интересен в этом отношении цитохром с. Так как это единственный мобильный переносчик электронов, курсирующий в межмембранном пространстве (все остальные цитохромы заякорены в комплексах ЭТЦ), он наиболее подвержен изменениям, которые могут происходить в митохондриях. Помимо этого выход цитохрома с запускает каскад реакций, ведущих к апоптозу, и в этом процессе тоже важен его редокс-потенциал [9].
Возникает вопрос, как оценить Еred/ox и понять, в какой конформации и в каком редокс-состоянии находится гем цитохрома с в митохондриях?
Численно определить Еred/ox можно с помощью электрохимических методов. Однако для этого нужные комплексы ЭТЦ изолируют и помещают в совершенно иные условия среды, что может само по себе изменить их свойства. Благодаря таким мощным методам, как ядерно-магнитный резонанс и рентгеноструктурный анализ, мы знаем, в какой конформации находятся белки и кофакторы дыхательной цепи в окисленной и восстановленной форме. Но нас интересует их состояние в максимально естественных условиях, а также соотношение этих состояний при работе дыхательной цепи.
Существует несколько неинвазивных методов для определения окислительно-восстановительного состояния цитохромов. Например, абсорбционная спектроскопия, основанная на использовании способности вещества к избирательному поглощению световой энергии. Спектр поглощения митохондрий включает спектр всех имеющихся цитохромов в митохондриях, а также небелкового компонента — ФАД, который входит в состав фермента сукцинатдегидрогеназы (II компонент дыхательной цепи, см. рис. 1). Но из-за того, что все типы цитохромов очень похожи и, соответственно, обладают схожими спектрами поглощения, а их окислительно-восстановительное состояние все время меняется при нормальной работе дыхательной цепи, сложно оценить вклад различных цитохромов в спектр [10].
По спектрам флуоресценции НАДН и ФАД+ можно примерно оценить редокс-состояние только I и II комплексов дыхательной цепи. А по потенциалу на внутренней мембране митохондрий можно судить только о работе митохондрии в целом [11].
Напрямую получение информации о конформации и редокс-состоянии цитохрома с в целой и функционирующей (интактной) митохондрии — это крайне сложная задача, ведь его конформация постоянно меняется при работе дыхательной цепи, он диффундирует и взаимодействует с мембранными комплексами. Наличие метода, который позволял бы это сделать, значительно облегчило бы задачу и расширило знания о влиянии цитохрома с на активность ЭТЦ и его вкладе в развитие митохондриальных патологий.
Новые возможности старого метода
Исторически в нашей лаборатории для изучения конформационных состояний различных биологических молекул используют метод комбинационного рассеяния света (КР). Это явление основано на эффекте неупругого (рамановского, или комбинационного*) рассеяния оптического излучения на молекулах вещества. При обычном (упругом, или рэлеевском) рассеянии частота (и длина волны) излучения не меняется, а при неупругом — меняется. Это выражается в появлении дополнительных линий (линий КР) на спектре рассеяния (рис. 3). Какую же информацию он несет?
Под «взаимодействием» света с молекулой подразумевается энергетический обмен между фотонами и колебательными подуровнями энергии молекулы. Это означает, что спектр КР несет в себе информацию о колебаниях атомов в молекулах исследуемого вещества. Строго говоря, разность частот возбуждающего и рассеянного света (Δν) характеризует нормальные частоты колебаний молекулы в целом. Большинство пиков на спектре КР обусловлено колебаниями сразу нескольких химических связей в молекуле, но некоторые пики описывают колебания определенных групп атомов (рис. 4) [12, 13]. С помощью таких ключевых колебаний можно определить, с чем мы имеем дело — с липидами, белками, ДНК, порфиринами или другими молекулами. И для каждой молекулы будет свой неповторимый спектр КР — нечто вроде «отпечатков пальцев» молекулы. И так же, как по отпечаткам пальцев можно различить близнецов, по спектрам КР можно отличить схожие по строению молекулы. Поэтому метод чрезвычайно популярен среди химиков-аналитиков и физиков, а также применяется в археологии, экологии, геологии и даже в криминалистике.
Первые биологические эксперименты с использованием метода КР велись еще в 1935 г. на аминокислотах. Однако, повторюсь, работы на изолированных молекулах не столь интересны для биологов, а для работы на целых клетках сигнал КР обладает низкой интенсивностью (и это один из существенных недостатков метода), поэтому метод не получил широкого распространения. И только в 1990 г., после совмещения КР-спектрометра с конфокальным микроскопом, появилась возможность регистрировать КР целых клеток или отдельных их участков. В последние годы метод наконец-то приобрел популярность, притом заслуженную, так как КР-спектроскопия обладает существенными преимуществами перед другими методами, и главное, позволяет получать эксклюзивную информацию.
Основное преимущество КР-спектроскопии — неинвазивность, т.е. с помощью этого метода можно изучать биохимический состав клеток, не разрушая их. Кроме того, не нужно использовать метки или зонды, как для флуоресцентной микроскопии. Это означает, что можно изучать систему (в нашем случае клетку) в естественных условиях, а это крайне важно, учитывая, что многие из существующих меток (как флуоресцентных, так и изотопных) токсичны. К тому же исчезает проблема выцветания меток и появляется возможность исследовать небольшие молекулы, к которым трудно «пришить» метку. Важно также, что метод КР позволяет работать с водными растворами, в том числе с физиологическими буферами, в отличие от ИК-спектроскопии, так как вода сильно поглощает в ИК-области.
Что касается эксклюзивной информации, то это в первую очередь информация о конформации исследуемых молекул и микроокружении функциональных групп. А от этих параметров может зависеть и активность молекул в клетке, и взаимодействие с другими молекулами, т.е. то, что влияет на работу целой клетки. Исследовать конформацию молекул — это сложная экспериментальная задача. Для ее решения можно использовать ИК-спектроскопию, но опять же только на высушенных образцах. Можно применять более сложные и дорогие технологии, такие как рентгеноструктурный анализ и ЯМР. Эти методы позволяют получать целостную картину расположения атомов в молекуле, но очевидно, их пока нельзя использовать для изучения молекул в живой клетке. А КР-спектроскопию можно: в зависимости от того, в какой конформации находится молекула, атомы будут колебаться по-разному, что отразится на спектрах.
К митохондриям от чистого сердца
О неинвазивном методе исследования цитохромов митохондрий в клетках сотрудники нашей лаборатории задумывались уже несколько лет назад, когда исследовали влияние окислительного стресса на клетки сердечной мышцы (кардиомиоциты) методом комбинационного рассеяния света [14]. Тогда удалось выяснить, что спектры КР разных типов цитохромов и миоглобина (который, как и гемоглобин, содержит гем типа b) можно различать по спектрам КР интактных клеток и даже определять их окислительно-восстановительное состояние. Позже Н. А. Браже с другими сотрудниками успешно провела подобное исследование на целом сердце, т.е. in situ (рис. 5) [15].
Однако у цитохромов есть одна особенность — только для восстановленных их форм спектр КР интенсивен. Если ориентироваться только на этот критерий, можно потерять важную информацию об изменениях в исследуемой системе, ведь интенсивность зависит и от количества молекул, и от выраженности тех или иных колебаний, и от других параметров. К тому же для определения точного положения пиков большинство исследователей, имеющих дело с цитохромами, вынуждены искусственно восстанавливать образцы, что заведомо нарушает их нативность.
Отчасти проблему решили японские ученые. Они определили, какие пики на спектре КР характерны только для восстановленных цитохромов, а какие — только для окисленных [16]. Однако проблема интенсивности спектров по-прежнему сохранялась, и нужно было ее решать.
Один из способов усилить сигнал КР — это поместить исследуемую молекулу вблизи наночастицы благородного металла, например золота или серебра. Эти металлы обладают свободными поверхностными электронами. Квант их коллективных колебаний называется плазмоном. Если частота падающего света входит в резонанс с частотой колебаний поверхностных электронов металла, то возникает эффект плазмонного резонанса, который приводит к многократному усилению электромагнитного излучения вблизи наночастицы. Этот эффект используют в методе поверхностного плазмонного резонанса (surface plasmon resonance, SPR), в абсорбционной и флуоресцентной спектроскопии. Но нам нужен был способ, позволяющий усилить именно КР-сигнал. И для этого существует спектроскопия гигантского комбинационного рассеяния (SERS, англ. Surface enhanced Raman spectroscopy).
Спектры КР и SERS цитохрома с хорошо известны [17, 18]. И что самое замечательное, спектры SERS окисленного и восстановленного цитохрома с практически не отличаются по интенсивности. Так почему бы не зарегистрировать спектр SERS митохондрий?
Идея пришла от профессора Копенгагенского университета О. В. Сосновцевой, с которой наша лаборатория сотрудничает не первый год. На тот момент было только две работы по изучению митохондрий методом SERS и его разновидностью TERS (Tip-enhanced Raman spectroscopy). В первой работе исследователи регистрировали спектр SERS только от белков и липидов митохондрий, но не от цитохромов, а во второй работе — использовали не нативные, а высушенные митохондрии [19, 20].
Но как применить метод SERS для изучения цитохромов живых митохондрий? Прежде чем ответить на этот вопрос, переместимся в недалекое прошлое.
Междисциплинарность — залог успеха
В 2010 г., когда возник интерес к нанотехнологиям, академик Ю. Д. Третьяков (в то время декан факультета наук о материалах МГУ) инициировал межфакультетское сотрудничество с биологами для проведения совместных исследований методом SERS. Так началась совместная работа нашей лаборатории под руководством Г. В. Максимова с группой химиков-материаловедов во главе с Е. А. Гудилиным.
Дело в том, что SERS — метод непростой и требует исключительно междисциплинарного подхода. Каждый биологический объект уникален, и чтобы регистрировать от него сигнал SERS, нужно разрабатывать особые наноструктуры, которые усиливали бы сигнал от нужного объекта, при этом не повреждали его и выдерживали «атаку» физиологических многокомпонентных буферов.
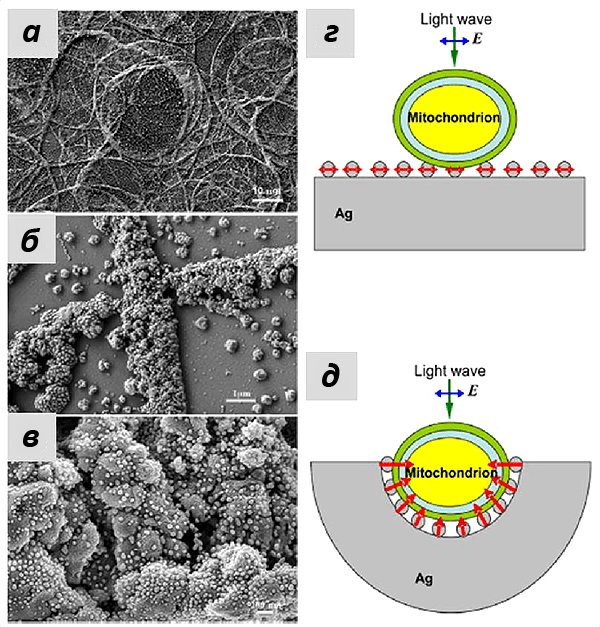
Большинство работ, связанных с SERS, предполагают адсорбцию молекул на поверхности наноструктур, пусть даже введенных внутрь клетки [21]. Это связано с тем, что усиление сигнала КР наблюдается только на очень небольшом расстоянии от поверхности металла [22]. Однако такой подход не всегда удовлетворяет запросам биологов. В идеале усиление сигнала должно распространяться на достаточно большое расстояние (только так можно работать с целыми клетками и органеллами, не повреждая их), и желательно не вводить ничего внутрь. Для этой цели нужно было разработать специфический дизайн наноструктур и придумать методы их синтеза, чем и занялась группа Гудилина.
Наконец длительные и упорные попытки разработать такие структуры для исследования живых клеток увенчались успехом. В 2012 г. дебютировали наноструктурированные подложки для усиления сигнала от примембранного гемоглобина в интактных эритроцитах [13]. За счет определенной морфологии наноструктур удалось получить усиление сигнала на расстоянии более 10 нм, т.е. больше толщины мембраны эритроцита.
Раз это удалось сделать для эритроцитов, то можно сделать и для митохондрий!
Долгожданный спектр SERS митохондрий
Жалюзи опущены. Выключен свет. Комната погружена во мрак. Капля суспензии падает на серебряную подложку. Вспышка зеленого света. 30 секунд. Спектр. Тот самый долгожданный спектр SERS от изолированных сердечных митохондрий был получен! Оставалось только понять, от каких именно структур в митохондриях исходит сигнал.
С учетом размеров компонентов митохондрий (рис. 6) и того, что усиление наблюдается на расстоянии нескольких нанометров от наноструктур, можно было предположить, что спектр SERS митохондрий будет преимущественно спектром цитохрома с, так как этот цитохром наиболее близко подходит ко внешней мембране митохондрий и, соответственно, к наноструктурам. В то же время остальные цитохромы закреплены в комплексах внутренней мембраны. Это также подтверждалось при моделировании эффектов усиления КР серебряными наноструктурами, которые были использованы в работе. Группа наших коллег из лазерного центра Ганновера показала, что сложная морфология подложки со множеством углублений, в которые могут попадать митохондрии, позволила получать усиление на большом расстоянии (более 10 нм). А иерархическое устройство самих наноструктур увеличивало число мест контакта с мембраной митохондрий и, следовательно, количество молекул цитохрома с, от которых можно было зарегистрировать сигнал SERS. Если использовать те же наночастицы серебра, просто присоединенные к плоской подложке, то особого усиления не произойдет, что и подтверждалось в эксперименте (рис. 7).
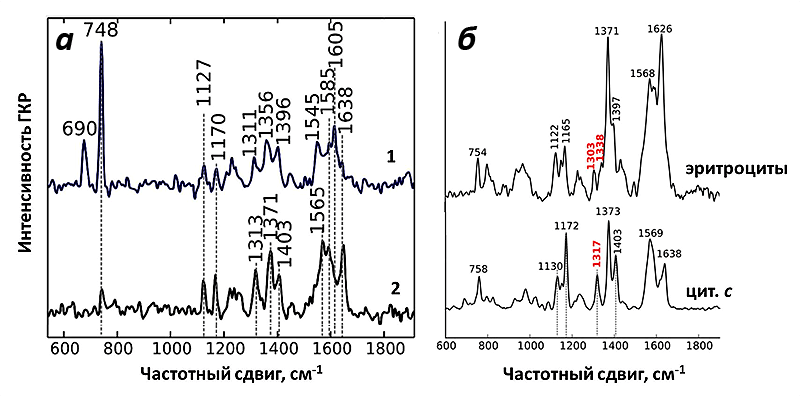
И действительно, полученный спектр SERS митохондрий соответствовал спектрам цитохрома с. При использовании зеленого лазера в качестве возбуждающего света можно регистрировать сигнал только от цитохромов b и с, но не от цитохрома а, что облегчает задачу расшифровки спектров. Несмотря на схожесть структуры цитохромов типа b и с, они имеют ключевые пики на спектре, благодаря которым их нельзя перепутать (рис. 8). Таким образом, используемые наноструктуры давали усиление на расстоянии, достаточном, чтобы зарегистрировать спектры от цитохрома с, но недостаточно большом, чтобы увидеть пики цитохромов b. А это как раз то, что нужно! Благодаря методу SERS теперь можно исследовать селективно редокс-состояние и конформацию именно цитохрома с в живых функционирующих митохондриях.
Как и ожидалось, спектры SERS цитохрома с митохондрий оказались очень чувствительны к изменению его окислительно-восстановительного состояния. Для этого было исследовано два воздействия: внесение переносчика протонов (протонофора) FCCP и ингибитора АТФ-синтазы олигомицина. FCCP встраивается во внутреннюю мембрану митохондрий и начинает переносить протоны из межмембранного пространства в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В итоге количество АТФ снижается, а АДФ увеличивается [23]. В таком случае возрастает количество поглощенного кислорода и скорость окисления субстратов, а следовательно, и количество окисленных молекул цитохрома с, что очень хорошо видно на спектрах SERS. И наоборот, добавление ингибитора синтеза АТФ — олигомицина, который приводит к увеличению электрохимического градиента на фоне снижения скорости дыхания, увеличивает количество восстановленных молекул цитохрома с, что также выражено на спектрах SERS митохондрий. Таким образом, спектры SERS митохондрий, являясь спектрами исключительно цитохрома с, оказались чувствительны к изменениям его конформации и редокс-состояния в процессе работы митохондрий.
***
Спектроскопия гигантского комбинационного рассеяния позволяет многократно усилить сигнал КР от молекул вблизи наночастиц металла. Однако для проведения успешных экспериментов необходимо учитывать свойства как биологического объекта, так и наноструктур. По словам одного из главных авторов проекта Н. А. Браже, ключевым моментом нашего достижения стал междисциплинарный подход к работе, в которую были вовлечены биологи, химики и физики. Результатом такого подхода стало создание уникальной методики селективного определения редокс-состояния и конформации цитохрома с в живых функционирующих митохондриях, помещенных на специальную наноструктурированную поверхность. Разработанная методика поможет восполнить пробелы в наших знаниях о свойствах и поведении переносчиков электрона в митохондриях. Она также может быть использована для разработки диагностических тестов для раннего выявления патологий митохондрий, чем и планируется заниматься в ближайшее время.
Работа выполнена при поддержке Российского научного фонда (проект 14-13-00871) и Российского фонда фундаментальных исследований (проект 14-04-31883-mol-a).
* Впервые появление новых линий в спектре рассеянного света на кристаллах кварца наблюдали в 1928 г. наши соотечественники Г. С. Ландсберг и Л. И. Мандельштам, которые назвали увиденное комбинационным рассеянием света. Вскоре это явление наблюдали индийские ученые Ч. В. Раман и К. С. Кришнан на жидкостях, используя в качестве источника света солнечные лучи. Впоследствии за открытие эффекта неупругого рассеяния света только Раман был удостоен Нобелевской премии (1930), а метод, основанный на этом оптическом эффекте, стал носить его имя — рамановская спектроскопия (Raman spectroscopy, RS). Однако в русскоязычной литературе чаще используется название, введенное Ландсбергом и Мандельштамом, — «комбинационное» рассеяние, спектр которого составляет комбинация частот возбуждающего света и собственных колебаний молекулы [12].
Литература
1. Nelson D. L., Cox M. M. Lehninger Principles of Biochemistry. 5th ed. N. Y., 2008.
2. Vafai S. B., Mootha V. K. Mitochondrial disorders as windows into an ancient organelle // Nature. 2012. V. 491. P. 374–383. DOI: 10.1038/nature11707.
3. Moore L., Gust D., Moore T. A. Bio-inspired constructs for sustainable energy production and use // L’Actualité Chim. 2007. № 308–309. P. 50–56.
4. Brazhe N. A., Evlyukhin A. B., Goodilin E. A. et al. Probing cytochrome c in living mitochondria with surface-enhanced Raman spectroscopy // Sci. Rep. 2015. V. 5. Article number 13793. DOI: 10.1038/srep13793.
5. Battistuzzi G., Borsari M., Cowan J. A., Ranieri A., Sola M. Control of cytochrome c redox potential: axial ligation and protein environment effects // J. Am. Chem. Soc. 2002. V. 124. P. 5315–5324. DOI: 10.1021/ja017479v.
6. Dolla A., Blanchard L., Guerlesquin F., Bruschi M. The protein moiety modulates the redox potential in cytochromes c // Biochimie. 1994. V. 76. P. 471–479. DOI: 10.1016/0300-9084(94)90171-6.
7. Solmaz S. R. N., Hunte C. Structure of complex III with bound cytochrome c in reduced state and definition of a minimal core interface for electron transfer // J. Biol. Chem. 2008. V. 283. P. 17542–17549. DOI: 10.1074/jbc.M710126200.
8. Ma J. G., Zhang J., Franco R. et al. The structural origin of nonplanar heme distortions in tetraheme ferricytochromes c3 // Biochemistry. 1998. V. 37. P. 12431–12442. DOI: 10.1021/bi981189i.
9. Brown G. C., Borutaite V. Regulation of apoptosis by the redox state of cytochrome c // Biochim. Biophys. Acta. 2008. V. 1777. P. 877–881. DOI: 10.1016/j.bbabio.2008.03.024.
10. Chess D. J., Billings E., Covian R. et al. Optical spectroscopy in turbid media using an integrating sphere: mitochondrial chromophore analysis during metabolic transitions // Anal. Biochem. 2013. V. 439. P. 161–172. DOI: 10.1016/j.ab.2013.04.017.
11. Starkov A., Fiskum G. Regulation of brain mitochondrial H2O2 production by membrane potential and NAD(P)H redox state // J. Neurochem. 2003. V. 86. P. 1101–1107. DOI: 10.1046/j.1471-4159.2003.01908.x.
12. Горелик В. Комбинационное рассеяние света // Соросовский образовательный журнал. 1997. V. 6. P. 91–96.
13. Semenova А. А., Goodilin E. А., Brazhe N. А. et al. Planar SERS nanostructures with stochastic silver ring morphology for biosensor chips // J. Mater. Chem. 2012. V. 22. P. 24530–24544. DOI: 10.1039/C2JM34686A.
14. Brazhe N. A., Treiman M., Brazhe A. R. et al. Mapping of redox state of mitochondrial cytochromes in live cardiomyocytes using Raman microspectroscopy // PLoS One. 2012. V. 7. e41990. DOI: 10.1371/journal.pone.0041990.
15. Brazhe N. A., Treiman M., Faricelli B. et al. In situ Raman study of redox state changes of mitochondrial cytochromes in a perfused rat heart // PLoS One. 2013. V. 8. e70488. DOI: 10.1371/journal.pone.0070488.
16. Kakita M., Kaliaperumal V., Hamaguchi H. Resonance Raman quantification of the redox state of cytochromes b and c in-vivo and in-vitro // J. Biophotonics. 2012. V. 5. P. 20–24. DOI: 10.1002/jbio.201100087.
17. Hu S., Morris I. K., Singh J. P. et al. Complete assignment of cytochrome c resonance Raman spectra via enzymic reconstitution with isotopically labeled hemes // J. Am. Chem. Soc. 1993. V. 115. P. 12446–12458. DOI: 10.1021/ja00079a028.
18. Delfino I., Bizzarri A. R., Cannistraro S. Single-molecule detection of yeast cytochrome c by Surface-Enhanced Raman Spectroscopy // Biophys. Chem. 2005. V. 113. P. 41–51. DOI: 10.1016/j.bpc.2004.07.006.
19. Karataє O. F., Sezgin E., Aydin O. et al. Interaction of gold nanoparticles with mitochondria // Colloids Surf. B. Biointerfaces. 2009. V. 71. P. 315–318. DOI: 10.1016/j.colsurfb.2009.02.020.
20. Vitol E. A., Orynbayeva Z., Bouchard M. J. et al. In situ intracellular spectroscopy with surface enhanced Raman spectroscopy (SERS)-enabled nanopipettes ACS // Nano. 2009. V. 3. P. 3529–3536. DOI: 10.1021/nn9010768.
21. Kneipp J., Kneipp H., Wittig B. et al. Novel optical nanosensors for probing and imaging live cells // Nanomedicine. 2010. V. 6. P. 214–226. DOI: 10.1016/j.nano.2009.07.009.
22. Moskovits M. Surface roughness and the enhanced intensity of Raman scattering by molecules adsorbed on metals // J. Chem. Phys. 1978. V. 69. P. 4159–4161. DOI: 10.1063/1.437095.
23. Северин Е. С. Биохимия. М., 2003.
Статья на конкурс «био/мол/текст»: «Только ленивый не занимался митохондриями!» — сказал один профессор. И действительно, митохондрии — очень популярный объект исследования, ведь в них происходит множество сложнейших биохимических и биофизических процессов, обусловливающих широкий набор функций данных органелл. Но, несмотря на активность исследователей, многие механизмы этих процессов и свойства отдельных компонентов митохондрий остаются загадкой. Это связано в первую очередь с отсутствием подходящих неинвазивных методик. В ходе междисциплинарного проекта, проводимого группой биофизики клетки Биологического ф-та МГУ и лабораторией неорганического материаловедения химического ф-та МГУ совместно с коллегами из Германии и Дании, удалось создать методику на основе спектроскопии гигантского комбинационного рассеяния для селективного исследования цитохрома с непосредственно в живых митохондриях. Статья опубликована в журнале Scientific reports.
О, эти спектры! О, эти пики!
В тайны молекул можем мы заглянуть.
Так и работаем мы в этом ЛИКе*,
И не напрасно избрали свой путь!
* — Лаборатория искусственного климата (ЛИК)
— прежнее название корпуса каф. Биофизики биофака МГУ.
Жалюзи опущены. Выключен свет. Мы погружены во мрак. Капля мутной жидкости падает на серебряную подложку. Вспышка зелёного света. 30 секунд. Спектр. Так начинается наш длинный день. А теперь обо всём по порядку.
Эти важные органеллы
Как вы уже (наверное) догадались, капля мутной жидкости — не что иное, как суспензия митохондрий. Митохондрии — это клеточные органеллы* размером около 1 микрона. Основная функция митохондрий — это окисление питательных веществ и производство молекул АТФ — универсального источника энергии для большинства биологических процессов в клетках. Кроме того, митохондрии участвуют в инициации апоптоза, старении клеток, продукции активных форм кислорода (АФК) [1], метаболизме лекарств, выработке тепла, запасают в себе ионы кальция, синтезируют некоторые гормоны и т.д. [2]. Митохондрии обладают столь широким спектром функций, что нарушение их работы является причиной многих заболеваний: различных видов миопатий, сердечно-сосудистых заболеваний, диабета и многих других [3]. Большинство из них связаны с мутациями в генах, кодирующих белки митохондрий**. Но может быть и наоборот: некоторые заболевания или неправильный образ жизни могут привести к нарушению работы митохондрий, например ожирение [4] или употребление наркотиков [5]. С другой стороны, митохондрии как преобразователи энергии и, фактически, белковый электропровод представляют большой интерес для физиков — биоников [6].
* — Органеллами митохондрии стали не сразу: согласно теории симбиогенеза, они появились в эукариотических клетках как бактерии-симбионты. И за миллиарды лет обросли множеством функций [7].
** — Т.к. митохондрии передаются по наследству от матери, то потомство получает все генетические нарушения, которые присутствовали в материнских митохондриях, но в перспективе эту проблему можно будет решить с помощью донорских митохондрий [8].
Митохондрии: как всё устроено
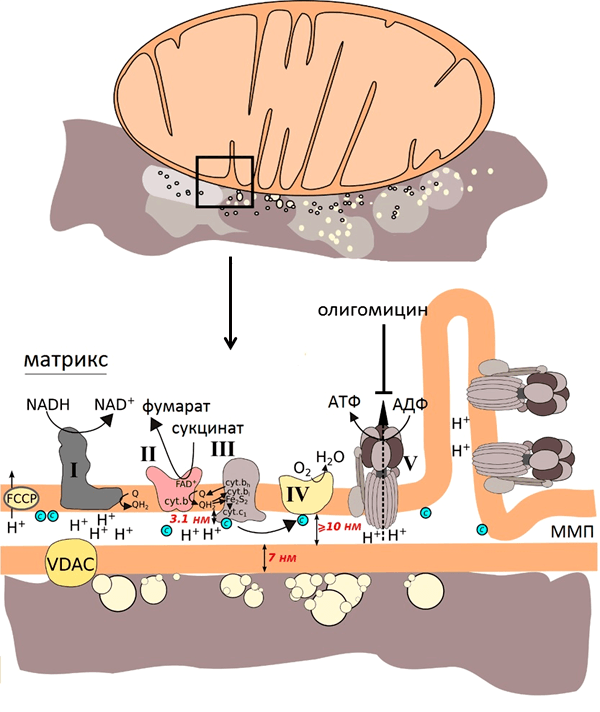
Митохондрии состоят из двух мембран: внешней, проницаемой для ионов и некоторых белков, и внутренней, ограничивающей внутреннее пространство митохондрий — матрикс. Пространство между мембранами так и называется — межмембранное пространство (ММП). Внутренняя мембрана образует множество инвагинаций (так называемых крист). В матриксе митохондрий расположены ферменты цикла Кребса, а во внутренней мембране митохондрий находится четыре белковых комплекса дыхательной цепи (электрон-транспортной цепи, ЭТЦ) и АТФ-синтаза (рис. 1). Также в митохондриях есть подвижные элементы дыхательной цепи: убихинон во внутренней мембране и цитохром с в ММП. Принцип работы дыхательной цепи — окисление субстратов, поступающих из цикла Кребса, и перенос электронов от этих субстратов по кофакторам ЭТЦ на конечный акцептор — кислород. Есть определенная закономерность в последовательности переноса электрона: электроны поступают от донора с более отрицательным редокс-потенциалом* (Еred/ox) к акцептору с более положительным Еred/ox. Таким образом, электрон как будто движется вниз по течению (рис. 2). Во время переноса электронов некоторые комплексы дыхательной цепи закачивают протоны из матрикса в ММП, тем самым создавая электрохимический потенциал на внутренней мембране митохондрий, который используется для синтеза АТФ (рис. 1) [2].
* — Окислительно-восстановительный потенциал — синоним редокс-потенциала (от англ. reduction — восстановление, oxidation — окисление).
Рисунок 1. Во внутренней мембране митохондрий локализованы комплексы дыхательной цепи: I — НАДН-дегидрогеназа, II — сукцинат-дегидрогеназа, III — цитохром b–c1-комплекс, или цитохром с-редуктаза, IV — цитохром а–а3, или цитохромоксидаза, и фермент АТФ-синтаза. Q — убихинон, «с» в зелёном кружке — цитохром с. Чёрными стрелками показан транспорт электрона, пунктирной стрелкой — диффузия цитохрома с от комплекса III к IV, зелеными стрелками — перенос протона.
Рисунок 2. Метафорическое изображение среднеточечных редокс-потенциалов различных переносчиков ЭТЦ митохондрий в энергетической шкале (вольт) на фоне реки Тохмайоки в Карелии.
Несмотря на то, что с митохондриями работали корифеи науки, такие как Кребс, Митчелл, Ленинджер, Чанс, Скулачёв и многие другие, благодаря которым мы столько знаем об этих органеллах, всё же многие митохондриальные процессы и свойства переносчиков электронов до сих пор не изучены. Это связано в первую очередь с отсутствием подходящих неинвазивных методик. В этом году нашей лабораторией в сотрудничестве с коллегами из других факультетов МГУ, а также из Дании и Германии, удалось создать методику для селективного исследования конформации гема цитохрома с непосредственно в живых митохондриях [9].
Что такое конформация гема и почему она важна?
Если приглядеться к комплексам дыхательной цепи (рис. 1), то в трёх из них можно увидеть цитохромы — гем-содержащие белки, которые являются кофакторами, участвующими в переносе электронов. А ещё один цитохром диффундирует в ММП. Всего в митохондриях имеется три типа цитохромов: а, b и с. Они очень похожи и отличаются только боковыми радикалами (рис. 3).
Рисунок 3. Гемы цитохромов разных типов. Каждый гем состоит из четырех пятичленных азотосодержащих циклов, связанных между собой. Это т.н. порфирины. Атомы азота координируют атом железа (Fe). Гемы отличаются боковыми группами, и только гем типа с связан с белком ковалентно. Рисунок из [2].
Во время переноса электрона меняется редокс-состояние гемового железа цитохромов Fe3+/Fe2+, что приводит к изменению конформации всего гема. Эти два параметра (Еred/ox и конформация) всегда связаны друг с другом. Кроме того, изменение в белковом окружении тоже приводит к изменению конформации гема [10, 11]. А так как Еred/ox определяет эффективность переноса электрона, то конформация гема — вещь важная. К тому же, чтобы произошел перенос электрона с одного цитохрома на другой, нужно, чтобы гемы этих цитохромов находились на определенном расстоянии друг от друга и были правильно ориентированы (рис. 4). Поэтому любые изменения в цитохромах могут отражаться на эффективности переноса электрона, т.е. на работе всей дыхательной цепи и, как следствие, энергообеспечении клеток [12, 13].
Рисунок 4. а. Расположение гемов цитохромов с и с1 при переносе электрона. б. Различные конформация гема цитохромов. Рисунки из [12] и [13].
Наиболее интересен в этом отношении цитохром с, так как это единственный мобильный переносчик электронов, курсирующий в ММП (все остальные цитохромы заякорены в комплексах ЭТЦ), поэтому он наиболее подвержен изменениям, которые могут происходить в митохондриях. Помимо этого выход цитохрома с запускает каскад реакций, ведущих к апоптозу, и в этом процессе тоже важен его редокс-потенциал [14].
Возникает вопрос, как понять, в какой конформации и в каком редокс-состоянии находится гем цитохрома с в митохондриях?
Как увидеть конформацию гема и оценить Еred/ox?
Рисунок 5. Сверху показан гем типа b, который содержится в эритроцитах, снизу — спектр КР эритроцита. Различные группы атомов и соответствующие им пики обозначены одним цветом. Рисунок из [20].
Численно можно определить Еred/ox с помощью электрохимических методов. Однако для этого нужные комплексы дыхательной цепи изолируют и помещают в совершенно иные условия среды, что может само по себе изменить их свойства. Благодаря таким мощным методам как ЯМР и рентгеноструктурный анализ, мы знаем, в какой конформации находятся белки и кофакторы дыхательной цепи в окисленной и восстановленной форме. Но нас интересует их состояние в максимально естественных условиях, а также соотношение этих состояний при работе дыхательной цепи. Есть несколько неинвазивных методов для определения окислительно-восстановительного состояния цитохромов. Например, абсорбционная спектроскопия. Спектр поглощения митохондрий — это суммарный спектр всех имеющихся цитохромов в митохондриях, а также ФАД. Но из-за того, что все типы цитохромов очень похожи и, соответственно, обладают схожими спектрами поглощения, а их окислительно-восстановительное состояние всё время меняется при нормальной работе дыхательной цепи, становится сложно оценить вклад различных цитохромов в спектр [15].
По спектрам флуоресценции НАДН и ФАД+ можно примерно оценить редокс-состояние только комплексов I и II. А по потенциалу на внутренней мембране митохондрий можно судить только о работе митохондрии в целом [16].
Напрямую получение информации о конформации и редокс-состоянии цитохрома с в интактной (целой и функционирующей) митохондрии — это крайне сложная задача, ведь его конформация постоянно меняется при работе ЭТЦ, он диффундирует и взаимодействует с мембранными комплексами. Наличие метода, который бы позволял это сделать, значительно расширило бы наши знания о влиянии цитохрома с на активность дыхательной цепи и его вкладе в развитие митохондриальных патологий.
К митохондриям от чистого сердца
Несколько лет назад в работах нашей группы вопрос о неинвазивном методе исследования цитохромов митохондрий в клетках уже поднимался. На тот момент сотрудники лаборатории исследовали влияние окислительного стресса на кардиомиоциты (клетки сердечной мышцы), методом комбинационного рассеяния света (КР, Raman spectroscopy) [17]. Подробно об этом рассказывается в статье «Спектроскопия КР: новые возможности старого метода» [18].
Спектр комбинационного рассеяния молекулы представляет собой колебательный спектр, пики которого характеризуют нормальные частоты колебаний молекулы. Отдельные группы атомов вносят свой вклад в различные колебания молекулы, поэтому можно сказать, что каждый пик на спектре КР характеризует колебания определённой группы атомов (рис. 5) [19, 20]. Таким образом, спектр КР — нечто вроде «отпечатков пальцев» молекулы. И так же, как по отпечаткам пальцев можно отличить родных братьев, по спектрам КР можно отличить схожие по строению молекулы. Кроме того, спектры КР чувствительны к изменениям конформации молекул, ведь если конформация меняется, то меняются и нормальные частоты колебаний.
В ходе работы с кардиомиоцитами было показано, что спектры КР разных типов цитохромов и миоглобина (который, как и гемоглобин, содержит гем типа b) можно различать по спектрам КР интактных клеток и даже определять их окислительно-восстановительное состояние. Позже Н.А. Браже с другими сотрудниками успешно провели подобное исследование на целом сердце, т.е. in situ (рис. 6) [21].
Рисунок 6. Регистрация спектра КР целого сердца. Рисунок из [21].
Однако у цитохромов есть одна особенность — спектр КР интенсивен только для восстановленных их форм, тогда как спектр окисленных состояний обладает очень низкой интенсивностью. Поэтому основным критерием определения восстановленности цитохромов является интенсивность сигнала. Но если мы ориентируемся только на интенсивность, то можем потерять важную информацию об изменениях в исследуемой системе! Ведь интенсивность зависит и от количества молекул, и от выраженности тех или иных колебаний, и от других параметров. К тому же, для определения точного положения пиков большинство исследователей, имеющих дело с цитохромами, вынуждены искусственно восстанавливать образцы, что заведомо нарушает их нативность.
Отчасти проблему решили японские учёные. Они определили, какие пики на спектре КР характерны только для восстановленных, а какие — только для окисленных цитохромов [22]. Однако проблема интенсивности спектров по-прежнему сохранялась. Нужно было её решать!
Усиливая сигнал
Один из способов усилить сигнал КР — это поместить исследуемую молекулу вблизи наночастицы благородного металла, например, золота или серебра. Эти металлы обладают свободными поверхностными электронами, а квант коллективных колебаний таких электронов называется плазмон. Если частота падающего света входит в резонанс с частотой колебаний поверхностных электронов металла, то возникает эффект плазмонного резонанса, который приводит к многократному усилению электромагнитного излучения вблизи наночастицы. Этот эффект используют в методе поверхностного плазмонного резонанса (surface plasmon resonance, SPR), в абсорбционной и флуоресцентной спектроскопии [23]. Но нас интересует способ усилить именно сигнал КР. И для этого существует спектроскопия гигантского комбинационного рассеяния (ГКР, англ. Surface enhanced Raman spectroscopy, SERS)*.
* — Подробности КР- и ГКР-спектроскопии даны в предшествующей статье: «Спектроскопия КР: новые возможности старого метода» [18].
Спектры КР и ГКР цитохрома с хорошо известны [24, 25]. И что самое замечательное, в отличие от спектров КР, спектры ГКР окисленного и восстановленного цитохрома с практически не отличаются по интенсивности. Так почему бы не зарегистрировать спектр ГКР митохондрий?
Идея пришла от О.В. Сосновцевой, профессора Копенгагенского университета, с которой наша лаборатория сотрудничает не первый год. Она даже предложила «подсобить» с митохондриями, так как с ними работали в соседней лаборатории, и они готовы были поделиться.
На тот момент было только две работы по изучению митохондрий методом ГКР и его разновидностью TERS (когда плазмонная частица находится на острие иглы кантилевера атомно-силового микроскопа, и сигнал ГКР регистрируют при сканировании поверхности образца). В первой работе [26] исследователи регистрировали спектр ГКР только от белков и липидов митохондрий, но не от цитохромов. А во второй работе [27] использовали не нативные, а высушенные митохондрии. Но как применить метод ГКР для изучения цитохромов живых митохондрий? Прежде чем ответить на этот вопрос, следует слегка переместиться в прошлое…
Междисциплинарность — залог успеха
В 2010 году, когда интерес к нанотехнологиям был на высоте, академик Юрий Дмитриевич Третьяков, в то время декан факультета наук о материалах (ФНМ) МГУ, решил начать межфакультетское сотрудничество с биологами для проведения совместных исследований методом ГКР. В итоге сотрудничество было установлено с лабораторией биофизики клетки под руководством Г.В. Максимова. Так наша лаборатория познакомилась с заместителем декана ФНМ химиком-материаловедом член-корр. Е.А. Гудилиным. Совместно с группой Гудилина начались активные исследования по применению ГКР в биологии.
Дело в том, что ГКР — метод непростой и требует исключительно междисциплинарного подхода. Каждый биообъект уникален, и чтобы регистрировать от него сигнал ГКР, нужно разрабатывать уникальные наноструктуры, которые бы усиливали сигнал от нужного объекта, не повреждали его и выдерживали «атаку» физиологических многокомпонентных буферов.
Большинство работ, связанных с ГКР, предполагают адсорбцию молекул на поверхности наноструктур, пусть даже введённых внутрь клетки [28]. Это связано с тем, что усиление сигнала КР наблюдается только на очень небольшом расстоянии от поверхности металла [29]. Однако такой подход не всегда удовлетворяет запросам биологов. В идеале усиление сигнала должно распространяться на достаточно большое расстояние, чтобы можно было работать с целыми клетками и органеллами, при этом не повреждая их, и желательно не вводить ничего внутрь. Для этой цели нужно разрабатывать специфический дизайн наноструктур и придумывать методы их синтеза, чем и занималась группа под руководством Гудилина.
Наконец, длительные и упорные попытки разработать такие структуры для исследования живых клеток увенчались успехом. В 2012-м году дебютировали наноструктурированные подложки для усиления сигнала от примембранного гемоглобина в интактных эритроцитах [20]. За счёт определённой морфологии наноструктур удалось получить усиление сигнала на расстоянии более 10 нм, т.е. больше толщины мембраны эритроцита.
Раз это удалось сделать для эритроцитов, то можно сделать и для митохондрий!
Долгожданный спектр ГКР митохондрий
Жалюзи опущены. Выключен свет. Комната погружена во мрак. Капля суспензии падает на серебряную подложку. Вспышка зелёного света. 30 секунд. Спектр. Тот самый долгожданный спектр ГКР от изолированных сердечных митохондрий был получен! Оставалось только понять, от каких именно структур в митохондриях исходит сигнал.
С учётом размеров компонентов митохондрий (рис. 7) и того, что усиление наблюдается на расстоянии нескольких нанометров от наноструктур, можно было предположить, что спектр ГКР митохондрий будет преимущественно спектром цитохрома с, так как этот цитохром наиболее близко подходит ко внешней мембране митохондрий и, соответственно, к наноструктурам. В то же время остальные цитохромы закреплены в комплексах внутренней мембраны.
Рисунок 7. Схема эксперимента: изолированные сердечные митохондрии помещают на серебряную наноструктурированную поверхность и облучают зелёным лазером. На рисунке показаны размеры мембраны, межмембранного пространства (ММП) и участков комплексов ЭТЦ. VDAC — потенциал зависимый анионный канал, FCCP — протонофор, разобщающий электронный транспорт и синтез АТФ, олигомицин — ингибитор АТФ-синтазы, с в синем кружке — цитохром с. Рисунок из [9].
Это утверждение также подтверждалось при моделировании эффектов усиления КР серебряными наноструктурами, которые были использованы в работе. Группа наших коллег из лазерного центра Ганновера показала, что сложная морфология подложки со множеством углублений, в которые могут попадать митохондрии, позволило получать усиление на большом расстоянии (более 10 нм). А иерархическое устройство самих наноструктур увеличивало число мест контакта с мембраной митохондрий и, следовательно, число молекул цитохрома с, от которых можно было зарегистрировать сигнал ГКР. Если использовать те же наночастицы серебра, просто присоединенные к плоской подложке, то особого усиления не произойдет, что и подтверждалось в эксперименте (рис. 8).
Рисунок 8. а—в — Изображения наноструктур, полученные на сканирующем электронном микроскопе. а — масштаб 10 мкм; б — 1 мкм, в — 0,2 мкм. На изображениях хорошо видна иерархическая морфология серебряных наноструктур. г—д — две модели, которые использовались для математического моделирования эффекта усиления электрического поля наноструктурами. г — в случае, когда митохондрии помещают на плоскую поверхность с наночастицами серебра, не происходит значительного усиления сигнала. д — при использовании структур, образующих полости, покрытые наночастицами серебра, число мест контакта между митохондрией и наночастицами увеличивается, а усиление электрического поля направлено перпендикулярно поверхности, т.е. внутрь митохондрии. За счёт этого достигается многократное усиление сигнала ГКР цитохрома с. Рисунок из [9] с изменениями.
И действительно, полученный спектр ГКР митохондрий соответствовал спектрам цитохрома с! При использовании зелёного лазера в качестве возбуждающего света можно регистрировать сигнал только от цитохромов b и с, но не от цитохрома а, что облегчает задачу расшифровки спектров. Несмотря на схожесть структуры цитохромов типа b и с, они имеют ключевые пики на спектре, благодаря которым их нельзя перепутать (рис. 9). Таким образом, используемые наноструктуры давали усиление на достаточно большом расстоянии, чтобы зарегистрировать спектры от цитохрома с, но недостаточно большом, для того чтобы увидеть пики цитохромов b. И это как раз то, что нужно! Благодаря методу ГКР теперь можно исследовать селективно редокс-состояние и конформацию именно цитохрома с в живых функционирующих митохондриях.
Рисунок 9. а — Спектры ГКР интактных митохондрий, помещенных на серебряную наноструктурированную поверхность. 1 — Спектр искусственно восстановленных цитохромов митохондрий; 2 — спектр активно функционирующих интактных митохондрий. б — Для сравнения приведен спектр ГКР эритроцитов, который соответствует спектру гема типа b, и спектр окисленного изолированного цитохрома с. Красным цветом отмечены пики, по которым можно чётко отличить спектр гема b и с. Рисунок из [9] с изменениями.
Как и ожидалось, спектры ГКР цитохрома с митохондрий оказались очень чувствительны к изменению его окислительно-восстановительного состояния. Для этого было исследовано два воздействия: внесение протонофора FCCP и ингибитора АТФ-синтазы олигомицина.
FCCP встраивается во внутреннюю мембрану митохондрий и начинает переносить протоны из ММП в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается [30]. В этом случае возрастает количество поглощённого кислорода и скорость окисления субстратов, а, следовательно, и количество окисленных молекул цитохрома с, что очень хорошо видно на спектрах ГКР. И наоборот, добавление ингибитора синтеза АТФ — олигомицина, который приводит к увеличению электрохимического градиента на фоне снижения скорости дыхания, увеличивает количество восстановленных молекул цитохрома с, что также выражено на спектрах ГКР митохондрий.
Таким образом, спектры ГКР митохондрий, являясь спектрами исключительно цитохрома с, оказались чувствительны к изменениям его конформации и редокс-состояния в процессе работы митохондрий.
Схема всей работы в одном ролике
Итоги
Спектроскопия гигантского комбинационного рассеяния позволяет многократно усилить сигнал КР от молекул вблизи наночастиц металла. Однако для проведения успешных экспериментов необходимо учитывать свойства как биологического объекта, так и наноструктур. «Ключевым моментом нашего достижения стал междисциплинарный подход к работе, в которую были вовлечены биологи, химики и физики», — поясняет одна из главных авторов проекта к.б.н. Надежда Браже, ставшая осенью 2015 года лауреатом премии L’Oreal Unesco для женщин в науке. — «Результатом такого подхода стало создание уникальной методики селективного определения редокс-состояния и конформации цитохрома с в живых функционирующих митохондриях, помещенных на специальную наноструктурированную поверхность. Разработанная методика поможет восполнить пробелы наших знаний о свойствах и поведении переносчиков электрона в митохондриях, а также может быть использована для разработки диагностических тестов для раннего выявления патологий митохондрий, чем и планируется заниматься в ближайшее время».
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Nelson D.L. and Cox M.M. Lehninger Principles of Biochemistry (5th Edition). NY: W.H. Freemanand Company, 2008;
- Vafai S.B. and Mootha V.K. (2012). Mitochondrial disorders as windows into an ancient organelle. Nature. 491, 374—383;
- В ооцитах мышей с ожирением нарушается работа митохондрий;
- Пробило на хавчик;
- Moore L., Gust D., Moore T.A. (2007). Bio-inspired constructs for sustainable energy production and use. L’Actualité Chim. 308–309, 50–56;
- Как появились митохондрии (рассказ, похожий на сказку);
- Трое в лодке: о легализации замены митохондрий;
- Brazhe N.A., Evlyukhin A.B., Goodilin E.A., Semenova A.A., Novikov S.M., Bozhevolnyi S.I. et al. (2015). Probing cytochrome c in living mitochondria with surface-enhanced Raman spectroscopy. Sci. Rep. 5, 13793;
- Battistuzzi G., Borsari M., Cowan J.A., Ranieri A., Sola M. (2002). Control of cytochrome c redox potential : axial ligation and protein environment effects. J. Am. Chem. Soc. 19, 5315–5324;
- Dolla A., Blanchard L., Guerlesquin F., Bruschi M. (1994). The protein moiety modulates the redox potential in cytochromes c. Biochimie. 76, 471–479;
- Solmaz S.R.N. and Hunte C. (2008). Structure of complex III with bound cytochrome C in reduced state and definition of a minimal core interface for electron transfer. J. Biol. Chem. 283, 17542–17549;
- Ma J.G., Zhang J., Franco R., Jia S.L., Moura I., Moura J.J. et al. (1998). The structural origin of nonplanar heme distortions in tetraheme ferricytochromes c3. Biochemistry. 37, 12431–12442;
- Brown G.C. and Borutaite V. (2008). Regulation of apoptosis by the redox state of cytochrome c. Biochim. Biophys. Acta. 1777, 877–881;
- Chess D.J., Billings E., Covian R., Glancy B., French S., Taylor J. et al. (2013). Optical spectroscopy in turbid media using an integrating sphere: mitochondrial chromophore analysis during metabolic transitions. Anal. Biochem. 439, 161–172;
- Starkov A. and Fiskum G. (2003). Regulation of brain mitochondrial H2O2 production by membrane potential and NAD(P)H redox state. J. Neurochem. 86, 1101–1107;
- Brazhe N.A., Treiman M., Brazhe A.R., Find N.L., Maksimov G.V., Sosnovtseva O.V. (2012). Mapping of redox state of mitochondrial cytochromes in live cardiomyocytes using Raman microspectroscopy. PLoS One. 7, e41990;
- биомолекула: «Спектроскопия КР: новые возможности старого метода»;
- Горелик В. (1997). Комбинационное рассеяние света. Соросовский образовательный журнал. 6, 91–96;
- Semenova А.А., Goodilin E.А., Brazhe N.А., Ivanov V.K., Baranchikov A.E., Lebedev V.A. et al. (2012). Planar SERS nanostructures with stochastic silver ring morphology for biosensor chips. J. Mater. Chem. 22, 24530;
- Brazhe N.A., Treiman M., Faricelli B., Vestergaard J.H., Sosnovtseva O. (2013). In situ Raman study of redox state changes of mitochondrial cytochromes in a perfused rat heart. PLoS One. 8, e70488;
- Kakita M., Kaliaperumal V., Hamaguchi H. (2012). Resonance Raman quantification of the redox state of cytochromes b and c in-vivo and in-vitro. J. Biophotonics. 5, 20–24;
- Миграция энергии плазмонного резонанса: вторая жизнь оптической спектроскопии;
- Hu S., Morris I.K., Singh J.P., Smith K.M., Spiro T.G. (1993). Complete assignment of cytochrome c resonance Raman spectra via enzymic reconstitution with isotopically labeled hemes. J. Am. Chem. Soc. 115, 12446–12458;
- Delfino I., Bizzarri A.R., Cannistraro S. (2005). Single-molecule detection of yeast cytochrome c by Surface-Enhanced Raman Spectroscopy. Biophys. Chem. 113, 41–51;
- Karataş O.F., Sezgin E., Aydin O., Culha M. (2009). Interaction of gold nanoparticles with mitochondria. Colloids Surf. B. Biointerfaces. 71, 315–318;
- Vitol E.A., Orynbayeva Z., Bouchard M.J., Azizkhan-Clifford J., Friedman G., Gogotsi Y. (2009). In situ intracellular spectroscopy with surface enhanced Raman spectroscopy (SERS)-enabled nanopipettes. ACS Nano. 3, 3529–3536;
- Kneipp J., Kneipp H., Wittig B., Kneipp K. (2010). Novel optical nanosensors for probing and imaging live cells. Nanomedicine. 6, 214–226;
- Moskovits M. (1978). Surface roughness and the enhanced intensity of Raman scattering by molecules adsorbed on metals. J. Chem. Phys. 69, 4159;
- Северин С. Е. Биохимия. Москва: ГЭОТАР-МЕД, 2003. — 779 с..
Митохондриальная дыхательная цепь и окислительное фосфорилирование
Тема:МИТОХОНДРИАЛЬНАЯ ДЫХАТЕЛЬНАЯ ЦЕПЬ. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
1. Структура митохондриальной дыхательной цепи, последовательность переноса протонов и электронов. Формулы акцепторов водорода: НАД, ФАД, КоQ. Роль кислорода в цепи переноса электронов.
2. Ферментные комплексы дыхательной цепи — состав, функции. Трансмембранный потенциал, его образование и использование. Роль внутренней митохондриальной мембраны.
3. Понятие об окислительном фосфорилировании. Коэффициент фосфорилирования (определение понятия, пример расчета). Роль АТФ-синтетазы. Основные направления использования АТФ в клетке. Формула АТФ.
4. Энергетический баланс (выход АТФ) окисления активного ацетата (ацетил-КоА) и пирувата.
5. Нефосфорилирующее или свободное окисление субстратов — биологическая роль. Разобщение окисления и фосфорилирования в митохондриях.
6. Вещества, влияющие на процессы окислительного фосфорилирования в митохондриях: ингибиторы дыхания, протонофоры, ионофоры.
| Раздел 14.1 |
Дыхательная цепь и окислительное фосфорилирование. |
|
|
|
|
14.1.1. В пируватдегидрогеназной реакции и в цикле Кребса происходит дегидрирование (окисление) субстратов (пируват, изоцитрат, α-кетоглутарат, сукцинат, малат). В результате этих реакций образуются НАДН и ФАДН2. Эти восстановленные формы коферментов окисляются в митохондриальной дыхательной цепи. Окисление НАДН и ФАДН2, протекающее сопряжённо с синтезом АТФ из АДФ и Н3РО4 называется окислительным фосфорилированием. Схема строения митохондрии показана на рисунке 14.1. Митохондрии представляют собой внутриклеточные органеллы, имеющие две мембраны: наружную (1) и внутреннюю (2). Внутренняя митохондриальная мембрана образует многочисленные складки – кристы (3). Пространство, ограниченное внутренней митохондриальной мембраной, носит название матрикс (4), пространство, ограниченное наружной и внутренней мембранами, — межмембранное пространство (5). Рисунок 14.1. Схема строения митохондрии. 14.1.2. Дыхательная цепь – последовательная цепь ферментов, осуществляющая перенос ионов водорода и электронов от окисляемых субстратов к молекулярному кислороду – конечному акцептору водорода. В ходе этих реакций выделение энергии происходит постепенно, небольшими порциями, и она может быть аккумулирована в форме АТФ. Локализация ферментов дыхательной цепи – внутренняя митохондриальная мембрана. Дыхательная цепь включает четыре мультиферментных комплекса (рисунок 14.2). Рисунок 14.2. Ферментные комплексы дыхательной цепи (обозначены участки сопряжения окисления и фосфорилирования):
14.1.3. В качестве промежуточных переносчиков электронов выступают убихинон (коэнзим Q) и цитохром с.
14.1.4. Промежуточные переносчики электронов в дыхательной цепи расположены в соответствии с их окислительно-восстановительными потенциалами. В этой последовательности способность отдавать электроны (окисляться) убывает, а способность присоединять электроны (восстанавливаться) возрастает. Наибольшей способности отдавать электроны обладает НАДН, наибольшей способностью присоединять электроны – молекулярный кислород. На рисунке 14.3 представлено строение реакционноспособного участка некоторых промежуточных переносчиков протонов и электронов в окисленной и восстановленной форме и их взаимопревращение. Рисунок 14.3. Взаимопревращения окисленных и восстановленных форм промежуточных переносчиков электронов и протонов. 14.1.5. Механизм синтеза АТФ описывает хемиосмотическая теория (автор — П. Митчелл). Согласно этой теории, компоненты дыхательной цепи, расположенные во внутренней митохондриальной мембране, в ходе переноса электронов могут «захватывать» протоны из матрикса митохондрий и передавать их в межмембранное пространство. При этом наружная поверхность внутренней мембраны приобретает положительный заряд, а внутренняя – отрицательный, т.е. создаётся градиент концентрации протонов с более кислым значением рН снаружи. Так возникает трансмембранный потенциал (ΔµН+). Существует три участка дыхательной цепи, на которых он образуется. Эти участки соответствуют I, III и IV комплексам цепи переноса электронов (рисунок 14.4). Рисунок 14.4. Расположение ферментов дыхательной цепи и АТФ-синтетазы во внутренней мембране митохондрий. Протоны, выведенные в межмембранное пространство за счёт энергии переноса электронов, снова переходят в митохондриальный матрикс. Этот процесс осуществляется ферментом Н+-зависимой АТФ-синтетазой (Н+-АТФ-азой). Фермент состоит из двух частей (см. рисунок 10.4): водорастворимой каталитической части (F1) и погружённого в мембрану протонного канала (F0). Переход ионов Н+ из области с более высокой в область с более низкой их концентрацией сопровождается выделением свободной энергии, за счёт которой синтезируется АТФ. 14.1.6. Энергия, аккумулированная в форме АТФ, используется в организме для обеспечения разнообразных биохимических и физиологических процессов. Запомните основные примеры использования энергии АТФ:
|
| Раздел 14.2 |
Коэффициент фосфорилирования. |
|
|
|
|
14.2.1. Степень сопряжённости окисления и фосфорилирования в митохондриях характеризует коэффициент фосфорилирования (Р/О). Он равен отношению количества молекул неорганического фосфата (Н3РО4), перешедшего в АТФ, к количеству атомов потреблённого кислорода (О2). Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3. Если донором водорода будет молекула ФАДН2, то электроны в дыхательной цепи проходят 2 участка сопряжения окисления и фосфорилирования (III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 2 молекулы АТФ (2 АДФ + 2 Н3РО4 → 2 АТФ). Затрачивается, как и в предыдущем случае, 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 2/1 = 2. 14.2.2. Более сложный пример расчёта коэффициента фосфорилирования – при окислении пирувата до конечных продуктов — показан на рисунке 14.5. В этом метаболическом пути происходит дегидрирование 4 субстратов (пирувата, изоцитрата, α-кетоглутарата и малата) с образованием НАДН и одного субстрата (сукцината) с образованием ФАДН2. Восстановленные коферменты окисляются в дыхательной цепи, и в сопряжённых реакциях фосфорилирования образуется (4×3 АТФ + 1×2 АТФ)=14 молекул АТФ. Ещё 1 молекула АТФ (ГТФ) образуется в реакции субстратного фосфорилирования на уровне сукцинил-КоА. Таким образом, при полном окислении 1 молекулы пирувата образуется 15 молекул АТФ (из них 14 — путём окислительного фосфорилирования). Чтобы рассчитать количество потреблённого кислорода, нужно знать число реакций дегидрирования на данном участке метаболического пути. Для окисления каждой восстановленной формы кофермента необходим 1 атом кислорода (см. выше). Следовательно, в нашем примере потребляется 5 атомов кислорода. Значение коэффициента Р/О будет равно 14/5 = 2,8. Рисунок 14.5. Расчёт энергетического баланса реакций окислительного декарбоксилирования пирувата и цикла Кребса. |
| Раздел 14.3 |
Разобщение дыхания и фосфорилирования. |
|
|
|
|
14.3.1. Перенос электронов в дыхательной цепи не во всех случаях протекает сопряжённо с фосфорилированием АДФ. Состояние, при котором окисление субстратов в дыхательной цепи происходит, но АТФ при этом не образуется, называется свободным (нефосфорилирующим) окислением. Энергия, выделяемая при окислении, рассеивается в виде теплоты. В физиологических условиях свободное окисление может служить одним из механизмов терморегуляции. В организме человека и некоторых животных имеется особая ткань – бурый жир, содержащий митохондрии, приспособленные для выработки теплоты. Много бурого жира у новорождённых, в последующие периоды жизни его количество уменьшается. В митохондриях бурого жира содержание дыхательных ферментов значительно выше, чем ферментов, осуществляющих фосфорилирование АДФ, поэтому в них преобладают процессы свободного окисления. Разобщение процессов окисления и фосфорилирования в митохондриях может иметь место при некоторых патологических состояниях. Основными симптомами таких состояний могут быть быстрая утомляемость, повышенная температура тела, снижение массы тела, несмотря на повышенный аппетит, учащение дыхания и сердцебиения. 14.3.2. Разобщение процессов окисления и фосфорилирования может быть вызвано действием ряда веществ, как природных, так и синтетических. Механизм действия этих веществ заключается в том, что они являются переносчиками протонов через мембрану. Вещества, разобщающие окисление и фосфорилирование, можно разделить на протонофоры и ионофоры. Протонофоры представляют собой слабые гидрофобные органические кислоты, которые в форме аниона (R-COO—) связывают протоны в межмембранном пространстве, диффундируют через мембрану и диссоциируют в матриксе с образованием протонов. К этой группе относятся, например, свободные жирные кислоты, гормоны щитовидной железы, салицилаты, дикумарол, 2,4-динитрофенол (см. рисунок 14.6). Рисунок 14.6. Механизм действия 2,4-динитрофенола. Ионофоры (валиномицин, нигерицин, грамицидин) способны встраиваться в мембрану, образуя канал, по которому могут перемещаться протоны и другие одновалентные катионы — Na+ или K+(рисунок 14.7). В результате снимается протонный потенциал и нарушается синтез АТФ. Рисунок 14.7. Валиномицин облегчает проникновение в клетку ионов Н+. |
|
| © С.М.Ершиков, 2007-2011. |
ОБНОВЛЕНИЯ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Харечкина Е.С.
1
Никифорова А.Б.
1
1 ФГБУН «Институт теоретической и экспериментальной биофизики РАН
Настоящая обзорная статья рассматривает существующие в настоящее время представления о механизмах, которые лежат в основе генерации активных форм кислорода при пермеабилизации митохондриальных мембран. Рассмотрена роль ионов кальция и комплексов дыхательной цепи митохондрий. Обсуждается влияние уровня пиридиновых нуклеотидов, компонентов антиоксидантной системы, а также участие матриксных Са2+-активируемых дегидрогеназ. В литературе имеются данные, показывающие, что индукция митохондриальной Са2+-зависимой поры вызывает конформационные перестройки дыхательных комплексов I, II и III, что усиливает генерацию активных форм кислорода. Вход кальция в матрикс митохондрий может увеличивать скорости продукции активных форм кислорода за счет активации пируватдегидрогеназы и а-кетоглутаратдегидрогеназы, а также способствовать выходу цитохрома с в цитозоль при индукции митохондриальной поры. Выход глутатиона и восстановленных пиридиновых нуклеотидов через пору снижает антиоксидантную защиту матрикса митохондрий и увеличивает продукцию супероксид аниона и перекиси водорода. Явление всплеска активных форм кислорода, вызванного пермеабилизацией митохондрий, сопровождает различные патологические состояния, включая ишемию с последующей реперфузией, поэтому понимание молекулярных процессов, лежащих в его основе, необходимо для дальнейшей разработки способов его фармакологической коррекции.
активные формы кислорода
митохондриальная пора
nadh
nadph
дыхательная цепь митохондрий
1. Halestrap A.P., Richardson A.P. The mitochondrial permeability transition: a current perspective on its identity and role in ischaemia/reperfusion injury // Journal of Molecular and Cellular Cardiology. 2015. Vol. 78. P. 129-141.
2. Brookes P.S., Yoon Y., Robotham J.L. et al. Calcium, ATP, and ROS: a mitochondrial love-hate triangle // American Journal of Physiology. Cell Physiology. 2004. Vol. 287 (4). P. 817-833.
3. Ruiz-Ramírez A., López-Acosta O., Barrios-Maya M.A., El-Hafidi M. Cell death and heart failure in obesity: role of uncoupling proteins // Oxidative Medicine and Cellular Longevity. 2016. Vol. 2016. P. 1-11.
4. Zorov D.B., Juhaszova M., Sollott S.J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release // Physiological Reviews. 2014. Vol. 94 (4). P. 909-950.
5. Andrienko T., Pasdois P., Rossbach A., Halestrap A.P. Real-time fluorescence measurements of ROS and [Ca2+] in ischemic/reperfused rat hearts: detectable increases occur only after mitochondrial pore opening and are attenuated by ischemic preconditioning // PLoS ONE. 2016. Vol. 11 (12).
6. Korge P., John S.A., Calmettes G., Weiss J.N. Reactive oxygen species production induced by pore opening in cardiac mitochondria: the role of complex II // The Journal of Biological Chemistry. 2017. Vol. 292 (24). P. 9896-9905.
7. Korge P., Calmettes G., John S.A., Weiss J.N. Reactive oxygen species production induced by pore opening in cardiac mitochondria: The role of complex III // The Journal of Biological Chemistry. 2017. Vol. 292 (24). P. 9882-9895.
8. Batandier C., Leverve X., Fontaine E. Opening of the mitochondrial permeability transition pore induces reactive oxygen species production at the level of the respiratory chain complex I // The Journal of Biological Chemistry. 2004. Vol. 279 (17). P. 17197-17294.
9. Cadenas S. ROS and redox signaling in myocardial ischemia reperfusion injury and cardioprotection // Free Radical Biology and Medicine. 2018. Vol. 117. P. 76-89.
10. Chouchani E.T., Pell V.R., James A.M. et al. A unifying mechanism for mitochondrial superoxide production during ischemia-reperfusion injury // Cell Metabolism. 2016. Vol. 23 (2). P. 254-263.
11. Гривенникова В.Г., Виноградов А.Д. Генерация активных форм кислорода митохондриями // Успехи биологической химии. 2013. Т. 53. С. 245-296.
12. Maklashina E., Sher Y., Zhou H.Z. et al. Effect of anoxia/reperfusion on the reversible active/de-active transition of NADH-ubiquinone oxidoreductase (complex I) in rat heart // Biochimica et Biophysica Acta. 2002. Vol. 1556 (1). P. 6-12.
13. Grivennikova V.G., Kareyeva A.V., Vinogradov A.D. What are the sources of hydrogen peroxide production by heart mitochondria? // Biochimica et Biophysica Acta. 2010. Vol. 1797 (6-7). P. 939-944.
14. Chouchani E.T., Methner C., Nadtochiy S.M. et al. Cardioprotection by S-nitrosation of a cysteine switch on mitochondrial complex I // Nature Medicine. 2013. Vol. 19 (6). P. 753-759.
15. Imlay, J.A. A metabolic enzyme that rapidly produces superoxide, fumarate reductase of Escherichia coli // Journal of Biological Chemistry. 1995. Vol. 270. P. 19767-19777.
16. Siebels I., Drose S. Q-site inhibitor induced ROS production of mitochondrial complex II is attenuated by TCA cycle dicarboxylates // Biochimica et Biophysica Acta. 2013. Vol. 1827 (10). P. 1156-1164.
17. Quinlan C.L., Orr A.L., Perevoshchikova I.V. et al. Mitochondrial complex II can generate reactive oxygen species at high rates in both the forward and reverse reactions // Journal of Biological Chemistry. 2012. Vol. 287 (32). P. 27255-27264.
18. Grivennikova V.G., Kozlovsky V.S., Vinogradov A.D. Respiratory complex II: ROS production and the kinetics of ubiquinone reduction // Biochimica et Biophysica Acta. 2017. Vol. 1858 (2). P. 109-117.
19. Chouchani E.T., Pell V.R., Gaude E. et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS // Nature. 2014. Vol. 515. P. 431-435.
20. Lemarie A., Huc L., Pazarentzos E. et al. Specific disintegration of complex II succinate:ubiquinone oxidoreductase links pH changes to oxidative stress for apoptosis induction // Cell Death and Differentiation. 2011. Vol. 18 (2). P. 338-349.
21. Huang L.S., Cobessi D., Tung E.Y., Berry E.A. Binding of the respiratory chain inhibitor antimycin to the mitochondrial bc1 complex: a new crystal structure reveals an altered intramolecular hydrogen-bonding pattern // Journal of Molecular Biology. 2005. Vol. 351 (3). P. 573-597.
22. Vercesi A.E. The participation of NADP, the transmembrane potential and the energy-linked NAD(P) transhydrogenase in the process of Ca2+ efflux from rat liver mitochondria // Archives of Biochemistry and Biophysics. 1987. Vol. 252 (1). P. 171-178.
23. Peng T.I., Jou M.J. Oxidative stress caused by mitochondrial calcium overload // Annals of the New York Academy of Sciences. 2010. Vol. 1201. P. 183-188.
24. Starkov A.A. An update on the role of mitochondrial α-ketoglutarate dehydrogenase in oxidative stress // Molecular and Cellular Neuroscience. 2013. Vol. 55. P. 13-16.
25. Nickel A.G., von Hardenberg A., Hohl M. et al. Reversal of mitochondrial transhydrogenase causes oxidative stress in heart failure // Cell Metabolism. 2015. Vol. 22 (3). P. 472-484.
26. Wei A.C., Liu T., Winslow R.L., O’Rourke B. Dynamics of matrix-free Ca2+ in cardiac mitochondria: two components of Ca2+ uptake and role of phosphate buffering // Journal of General Physiology. 2012. Vol. 139 (6). P. 465-478.
27. Denton R.M. Regulation of mitochondrial dehydrogenases by calcium ions // Biochimica et Biophysica Acta. 2009. Vol. 1787 (11). P. 1309-1316.
28. Patterson S.D., Spahr C.S., Daugas E. et al. Mass spectrometric identification of proteins released from mitochondria undergoing permeability transition // Cell Death and Differentiation. 2000. Vol. 7 (2). P. 137–144.
29. Ott M., Robertson J.D., Gogvadze V. et al. Cytochrome c release from mitochondria proceeds by a two-step process // Proceedings of the National Academy of Sciences of the United States of America. 2002. Vol. 99 (3). P. 1259–1263.
30. Pereverzev M.O., Vygodina T.V., Konstantinov A.A., Skulachev V.P. Cytochrome c, an ideal antioxidant // Biochemical Society Transactions. 2003. Vol. 31. Pt. 6. P. 1312–1315.
Пермеабилизацию внешней мембраны митохондрий опрeделяют как резкое увеличение ее проницаемости для ионов и растворов массой менее 1,5 kDa, приводящее к потере мембранного потенциала, набуханию митохондрий, разрыву их внешней мембраны и выходу апоптогенных факторов. Этот процесс происходит после открывания мегаканала, известного как Са2+-зависимая неспецифическая митохондриальная пора (mPTP) [1]. Открывание mPTP, по-видимому, является ключевым фактором, вызывающим клеточную гибель и необратимые повреждения органов при многих патологических состояниях, таких как ишемия с последующей реперфузией, нейродегенеративные заболевания, мышечная дистрофия.
Главным активатором mPTP является кальций, при этом чувствительность к катиону многократно увеличивается при окислительном стрессе [2]. Такие условия наблюдаются при ишемии/реперфузии, и считается, что они являются главным триггером открывания mPTP. Предположение о том, что основной всплеск активных форм кислорода (АФК) происходит при открывании поры и после, долгое время ставилось под сомнение, так как известно, что ее индукция приводит к разобщению митохондрий, а это, в свою очередь, снижает продукцию АФК [3]. Однако группой Д. Зорова было обнаружено, что аккумулирование АФК в матриксе митохондрий сердечных миоцитов при фотоактивации тетраметилродаминовых производных запускает индукцию mPTP, которая сопровождается многократно усиленной продукцией («всплеском») АФК. Данное явление авторы назвали АФК-индуцированный выход АФК («ROS — induced ROS releas» (RIRR)) [4]. Впоследствии появилось много работ, демонстрирующих всплеск АФК, вызванный индукцией mPTP [5-8]. Выход АФК в цитозоль может активировать редокс-чувствительные ферменты, а также запускать сложный сигнальный ответ и генерацию АФК в соседних митохондриях. Данный процесс имеет важное физиологическое и патологическое значение, поскольку может индуцировать гибель не только старых и поврежденных митохондрий и клеток, но и здоровых. Вопрос о путях образования АФК при индукции mPTP несет важную научную и практическую значимость, но к настоящему моменту остается открытым.
Цель исследования
Произвести обзор существующих в современной литературе данных и гипотез о сайтах и механизмах продукции АФК при пермеабилизации внешней мембраны митохондрий.
Комплекс I дыхательной цепи митохондрий
Комплекс I (НАДН-убихинон оксидоредуктаза) является одним из главных мест продукции АФК в митохондриях. Считается, что основными сайтами генерации АФК в нем выступают флавинмононуклеотид НАДН-связывающего сайта (сайт If), и убисемихинон коэнзим Q-связывающего сайта (сайт Iq) [9]. Продукция супероксида на сайте If происходит во время прямого транспорта электронов, когда ФМН находится в сильно восстановленном состоянии и зависит от соотношения НАДН/НАД+ в матриксе. Ингибитор коэнзим Q-связывающего сайта ротенон увеличивает продукцию супероксида, так как вызывает возвращение электронов на ФМН. Продукция супероксида на комплексе I также происходит во время обратного транспорта электронов, когда пул коэнзима Q полностью восстановлен [10].
При патологических условиях увеличение эффективности АФК-генерирующих сайтов комплекса I могут быть связаны с его конформационными перестройками. Открывание mPTP сильно снижает ротенон-чувствительную активность НАДН-убихинон редуктазы и увеличивает продукцию Н2О2 в присутствии ≥50 µМ НАДН [8]. НАДН-убихинон оксидоредуктаза характеризуется медленным переходом из активного состояния в неактивное и наоборот. Это предполагает большие конформационные перестройки комплекса, по крайней мере той его части, которая вовлечена в ротенон-чувствительное восстановление убихинона [11]. Было показано, что комплекс I, выделенный из сердца крыс, подвергшегося 30-минутной аноксичной перфузии, переходил в неактивное состояние и возвращался к активному после реоксигенации [12]. Авторы предположили, что эти конформационные перестройки могут быть связаны с генерацией АФК после того, как ткани сердца, подвергшиеся коронарной окклюзии, реоксигенируются. Переход комплекса в неактивное состояние сопровождается специфическим демаскированием Cys39 субъединицы ND3 [13]. Было показано, что нитрозирующие соединения, обратимо модифицирующие данный цистеин, могут использоваться в качестве фармакологической защиты от генерации АФК при реперфузии [14].
Комплекс II дыхательной цепи митохондрий
Комплекс II, или сукцинат-убихинон оксидоредуктаза, является тетрамерным, содержащим железо-серные кластеры флавопротеином внутренней мембраны митохондрий. Он одновременно участвует в работе цикла Кребса и дыхательной цепи, осуществляя превращение сукцината в фумарат и восстанавливая убихинон до убихинола.
Возможность образования АФК флавином фумаратредуктазы E. coli (сайт IIf) в присутствии низких концентраций дикарбоновых кислот впервые была показана в работе [15]. Впоследствии продукция АФК была продемонстрирована на субмитохондриальных частицах митохондрий бычьего сердца [16] и скелетных мышц [17]. Ингибитор комплекса II атпенин А5 и ингибитор комплекса III стигмателлин, который блокирует окисление убихинола комплексом III, стимулируют продукцию АФК комплексом II в присутствии сукцината. Малонат, напротив, ингибирует генерацию АФК комплексом II, что указывает на то, что АФК образуются на полностью восстановленном флавиновом сайте IIf [16], хотя не исключены и другие сайты [18]. Зависимость продукции перекиси водорода от концентрации сукцината имеет колоколообразную форму: уровень перекиси растет с увеличением концентрации субстрата до 400 μМ, затем значительно снижается при миллимолярных концентрациях, обычно используемых для энергизации митохондрий. Причиной этого явления является то, что комплекс II генерирует АФК только тогда, когда его флавиновый сайт IIf не занят дикарбоновыми кислотами [16]. Cукцинат и другие интермедиаты цикла Кребса, которые взаимодействуют с сайтом связывания дикарбоновых кислот, могут ограничивать доступ к нему кислорода и, таким образом, подавлять продукцию АФК комплексом II. Уровень сукцината и фумарата в матриксе увеличивается во время ишемии/гипоксии, однако это не предотвращает образование АФК. Напротив, было показано, что аккумулирование сукцината во время ишемии сильно коррелирует с продукцией АФК и повреждениями при реперфузии [19]. Авторы предположили, что главным источником АФК в данных условиях является обратный поток электронов через комплекс I [10]. Однако, в условиях длительной ишемии, когда мембраны полностью деполяризуются, данный механизм вряд ли осуществим. Альтернативный механизм генерации АФК предполагает получение доступа кислорода к восстановленному сайту IIf из-за снижения содержания дикарбоновых кислот в его непосредственной близости в результате ускорения выхода сукцината и фумарата из матрикса при индукции mPTP [6]. Данный механизм требует ингибирования комплекса II на уровне восстановления убихинона либо ингибирования окисления убихинола комплексом III.
Конформационные перестройки комплекса II также могут способствовать всплеску АФК при пермеабилизации мембран. Было показано, что при понижении внутриклеточного рН, наблюдающегося при апоптозе, происходит диссоциация комплекса II: субъединицы сукцинатдегидрогеназы SDHA и SDHB, осуществляющие окисление сукцината до фумарата и перенос электронов через железо-серные кластеры, отделяются от сайта восстановления коэнзима Q сукцинат CoQ оксидоредуктазы (SQR) [20]. Это приводит к ингибированию активности SQR, при этом сукцинатдегидрогеназная активность остается в норме. Такая диссоциация приводит к прямому одноэлектронному восстановлению кислорода железо-серным кластером комплекса II. И хотя известно, что низкий рН является ингибитором mPTP, тем не менее данный механизм всплеска АФК может иметь место при ишемии, когда происходит падение рН. В это время могут происходить конформационные перестройки комплекса II, и впоследствии, при реперфузии, когда рН восстанавливается до исходного уровня, открывается mPTP и наблюдается всплеск АФК, образуемых на диссоциированном комплексе.
Комплекс III дыхательной цепи митохондрий
Комплекс III (убихинол-цитохром с оксидоредуктаза) – еще один возможный сайт образования АФК. Данный белок осуществляет перенос электронов от убихинона на цитохром с в процессе функционирования так называемого Q-цикла. В ходе данного процесса происходит образование нестабильного семихинона, который может передавать электрон на кислород, образуя при этом супероксидный радикал. Однако в нормальных условиях такая реакция маловероятна, так как семихинон быстро окисляется цитохромом b. Резкое возрастание уровня супероксида происходит при ингибировании комплекса антимицином А, а также при ишемии длительностью более 30 минут [7]. Одной из причин данного явления могут быть его конформационные перестройки, вызванные связыванием ингибитора [21]. На изолированных митохондриях сердца было показано, что комплекс III, заингибированный с помощью антимицина A, генерирует значительное количество АФК в присутствии Mg2+ и НАД+ и в отсутствии экзогенных субстратов при индукции mPTP кальцием и аламетицином. Авторы показали, что в этих условиях продукция перекиси водорода относится к Mg2+-зависимой генерации НАДН малатдегидрогеназой. Продукция H2O2 ингибировалась стигмателлином и пирицидином, что указывает на важность НАДН-зависимого восстановления убихинона для генерации АФК в данных условиях. Эти данные подтверждают гипотезу, согласно которой во время ишемии при индукции mPTP увеличение концентрации Mg2+, НАД+ в матриксе активирует малатдегидрогеназу, которая восстанавливает НАД+, используя малат, концентрация которого повышается вследствие увеличения уровня сукцината и фумарата. Восстановленные эквиваленты поступают на заингибированный комплекс III, в результате чего происходит всплеск АФК [7].
Роль пиридиновых нуклеотидов в генерации АФК
Раннее было показано, что окисление НАД(Ф)Н матрикса митохондрий предшествует открыванию mPTP [22]. Кроме того, индукция поры приводит к утечке пиридиновых нуклеотидов в цитозоль клетки [23]. Данное изменение баланса НАД(Ф)Н должно влиять на продукцию АФК при пермеабилизации митохондрий. Зависимость генерации АФК от концентрации НАДН была исследована группой А. Виноградова. Было показано, что максимальная продукция супероксида достигает максимума при концентрации НАДН 10-50 μМ, при миллимолярных концентрациях продукция радикала тормозится [11]. Так как физиологические концентрации НАДН/НАД+ пары матрикса находятся в миллимолярном диапазоне, то вклад комплекса I в генерацию АФК в нормальных условиях может быть незначительным. Было обнаружено, что в пермеабилизованных митохондриях происходит высокая, зависящая от отношения НАД(Ф)Н/НАД(Ф)+ и стимулируемая ионами аммония продукция Н2О2. При этом выход перекиси водорода был нечувствителен к дикумаролу (ингибитору НАДН-хинон оксидоредуктазы) и НАДН-OH (ингибитору комплекса I), что указывает на матриксную локализацию H2O2-генерирующего сайта. Исследуемый белок обладал НАДН:липоамид оксидоредуктазной активностью и был идентифицирован как дигидролипоамиддегидрогеназа [11]. Данный белок является важным компонентом (так называемым Е3 компонентом) двух ФАД-cодержащих митохондриальных ферментов: а-кетоглутаратдегидрогеназного комплекса и пируватдегидрогеназного комплекса. Согласно данным, полученным на очищенных комплексах и на изолированных митохондриях [24], компонент Е3 отвечает за продукцию супероксида и перекиси водорода. Было показано, что пермеабилизованные митохондрии сердца крыс, окисляющие НАДН, продуцируют около 50% перекиси водорода за счет работы комплекса I, а остальные 50% приходятся на долю дигидролипоамиддегидрогеназы [13].
Восстановленные формы пиридиновых нуклеотидов не только поставляют электроны в дыхательную цепь митохондрий, но также регулируют редокс-статус матрикса через про- и антиоксидантные белки. Одним из таких белков является глутатион, который, совместно с НАДФН, является субстратом антиоксидантных белков глутатионпероксидазы и глутатионредуктазы [2]. При открывании mPTP может происходит выход НАДФH и глутатиона, что вызывает накопление Н2О2 [23]. Более того, в данных условиях из-за падения мембранного потенциала никотинамиднуклеотидтрансгидрогеназа (НАДФН- трансгидрогеназа) не может поддерживать высокий уровень восстановленного НАДФ+, что способствует окислительного стрессу [22]. В физиологических условиях данный фермент осуществляет регенерацию НАДФН в прямой реакции, используя НАДН в качестве субстрата. Эта реакция энергетически выгодна, поскольку трансгидрогенирование между НАДН и НАДФН связано с протонным градиентом вдоль внутренней мембраны. Однако в патологических условиях она может протекать в обратном направлении, регенерируя НАДН для синтеза ATP за счет утилизации НАДФН [25]. Таким образом, антиоксидантная защита, связанная с уровнем восстановленности НАДФ+, падает, что способствует продукции H2O2.
Роль кальция в генерации АФК
Известно, что увеличение концентрации кальция в матриксе митохондрий запускает индукцию mPTP, при этом чувствительность поры к катиону увеличивается при окислительном стрессе, повышением уровня фосфата и снижением пула адениновых нуклеотидов [1]. Концентрация ионов кальция в матриксе митохондрий находится в пределах примерно 10 nМ. При этом их кальциевая емкость очень высока, изолированные митохондрии способны секвестрировать более 1M кальция из среды, поддерживая концентрацию свободного кальция в микромолярных пределах, в которых происходит регуляция Ca2+-зависимых ферментов [26]. К таким ферментам относятся пируватдегидрогеназа и а-кетоглутаратдегидрогеназа. Их активация приводит к усилению дыхания и синтеза АТФ и, вероятно, к повышению продукции АФК [24; 27].
В процессе пермеабилизации митохондриальных мембран происходит выход из межмембранного пространства и матрикса примерно 100 белков, в том числе таких важных элементов антиоксидантной защиты, как глутатион и цитохром с [28].
Цитохром с является положительно заряженным белком, который связан с кардиолипином на внешней стороне внутренней мембраны митохондрий, а также с дыхательными комплексами III и IV. Было показано, что выход цитохрома с является двухступенчатым процессом, включающим отсоединение белка от внутримембранных связывающих сайтов и последующую его транслокацию через внешнюю мембрану [29]. Ca2+ может усиливать диссоциацию цитохрома с от внутренней мембраны, так как является его конкурентом за связывание с отрицательно заряженным кардиолипином. Это способствует выходу цитохрома с в цитозоль при индукции mPTP. Более того, АФК, образуемые при пермеабилизации мембран, могут вызывать окисление кардиолипина, приводящее к изменению его физических свойств, что также может усиливать выход цитохрома с из митохондрий и способствовать еще большей генерации АФК. Пониженный уровень белка замедляет транспорт электронов от комплекса III к комплексу IV и, таким образом, увеличивает продукцию АФК в Q-цикле. Кроме того, цитохром с сам по себе является эффективным антиоксидантом, способным эффективно восстанавливаться супероксид анионом [30]. Таким образом, повышение концентрации кальция в митохондриях оказывает стимулирующее влияние на АФК-продуцирующие ферменты матрикса и приводит к падению антиоксидантной защиты, тем самым увеличивая общий уровень АФК, генерируемый митохондриями.
Заключение
Митохондрии являются одновременно потенциальным источником и мишенью действия АФК, приводящим к потере митохондриальных функций и, как следствие, к необратимому повреждению клеток при многих патологических процессах. Важную роль при этом играет mPTP, индукция которой может приводить к мощной генерации АФК, оказывающих повреждающее действие на соседние органеллы и целые клетки. В настоящее время причины данного явления слабо изучены, хотя в литературе имеется несколько гипотез. Предполагается, что в основе всплеска АФК могут лежать конформационные перестройки комплексов дыхательной цепи, активация дегидрогеназ матрикса в результате действия Са2+, изменение баланса НАД(Ф)Н/НАД(Ф)+ матрикса и истощение антиоксидантной системы. Дальнейшее исследование механизмов и сайтов продукции АФК при индукции mPTP представляется необходимым, поскольку их точное определение позволит разработать способы их регуляции для предупреждения развития многих патологических состояний организма.
Работа выполнена при поддержке гранта РНФ № 17-75-10122.
Библиографическая ссылка
Харечкина Е.С., Никифорова А.Б. МЕХАНИЗМЫ ГЕНЕРАЦИИ АКТИВНЫХ ФОРМ КИСЛОРОДА ПРИ ПЕРМЕАБИЛИЗАЦИИ МИТОХОНДРИАЛЬНЫХ МЕМБРАН // Современные проблемы науки и образования. – 2018. – № 4.
;
URL: https://science-education.ru/ru/article/view?id=27719 (дата обращения: 22.03.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)