Во время физической работы в клетках мышечной ткани человека усиливается
Спрятать пояснение
Пояснение.
Любая физическая работа сопровождается изменением скорости метаболических процессов в организме, появлением биохимических сдвигов в работающих мышцах, во внутренних органах и в крови. При выполнении физической нагрузки в организме повышается скорость катаболических процессов, сопровождающихся выделением энергии и синтезом АТФ, при одновременном снижении скорости анаболизма, потребляющего значительное количество АТФ для обеспечения различных синтезов. Такое изменение направленности метаболизма приводит к улучшению энергообеспечения работающих мышц, к повышению мощности и продолжительности работы.
Примечание.
Катаболизм — энергетический обмен; анаболизм — пластический обмен
ЕГЭ
Справочник
ЕГЭ
Биология
5.3 Внутренняя среда организма человека. Группы крови. Переливание крови. Иммунитет. Обмен веществ и превращение энергии в организме человека. Витамины.
Внимательно прочитайте текст задания и выберите верный ответ из списка
Задание 2301
Во время физической работы в клетках мышечной ткани человека
усиливается
Ответы:
синтез липидов
синтез ферментов
пластический обмен
энергетический обмен
— Правильный ответ
Репетиторы
по
биологии
Найти репетитора
Другие задачи на эту тему
Задание 1706
Задание 1756
Задание 1806
Задание 1855
Задание 1878
Задание 1904
Задание 1954
Задание 1970
Задание 2004
Задание 2020
ЕГЭ
Справочник
© 2023 ЕГЭ.Справочник24. Все права защищены.
Предметы
Русский язык
Математика профильная
Физика
Химия
Информатика и ИКТ
Биология
История
География
Английский язык
Немецкий язык
Французский язык
Обществознание
Испанский язык
Литература
Математика базовая
Вопрос №
1
Развитие организма животного от момента образования зиготы до рождения изучает наука
генетика
физиология
экология
эмбриология
Вопрос №
2
Центриоль представляет собой
структурную единицу клеточного центра
малую субъединицу рибосомы
первичную перетяжку хромосомы
структурную единицу аппарата Гольджи
Вопрос №
3
Совокупность реакций синтеза органических веществ из неорганических с использованием энергии света называ-ют
хемосинтезом
фотосинтезом
брожением
гликолизом
Вопрос №
4
При митозе хромосомы расходятся к полюсам клетки в
анафазе
метафазе
профазе
телофазе
Вопрос №
5
Из эктодермы зародыша образуется
нервная система
печень
поджелудочная железа
сердечная мышца
Вопрос №
6
У кареглазого мужчины и голубоглазой женщины родились три кареглазых девочки и один голубоглазый мальчик. Ген карих глаз доминирует. Каковы генотипы родителей?
отец АА, мать аа
отец Аа, мать АА
отец аа и мать аа
отец Аа, мать аа
Вопрос №
7
Изменение структуры молекулы ДНК под воздействием ультрафиолетовых лучей представляет собой
соотносительную изменчивость
модификационную изменчивость
генную мутацию
комбинативную изменчивость
Вопрос №
8
Эффект гетерозиса обусловлен
возникновением доминантных мутаций у родителей
действием естественного отбора
увеличением гетерозиготности особей
накоплением в генотипе потомства рецессивных мутаций
Вопрос №
9
Чем отличаются грибы от растений
имеют клеточное строение
поглощают из почвы воду и минеральные соли
бывают как одноклеточными, так и многоклеточными
не содержат в клетках хлоропластов и хлорофилла
Вопрос №
10
Зародышевый мешок у цветковых растений — это
сформированный женский гаметофит
крайне редуцированный спорофит
сфоpмиpованный мужской гаметофит
крайне редуцированный женский спорофит
Вопрос №
11
Для голосеменных растений в отличие от покрытосеменных характерно
размножение семенами
автотрофное питание
наличие вегетативных органов
отсутствие цветка и плода
Вопрос №
12
К классу Паукообразные относится
домашний клоп
чесоточный клещ
циклоп
вошь
Вопрос №
13
Птицы отличаются от пресмыкающихся наличием в скелете
шейного отдела позвоночника
крестцового отдела позвоночника
цевки
грудной клетки
Вопрос №
14
Во время физической работы в клетках мышечной ткани человека усиливается
синтез липидов
синтез ферментов
энергетический обмен
пластический обмен
Вопрос №
15
Желчь и поджелудочный сок по протокам попадает в
желудок
двенадцатиперстную кишку
отделы толстой кишки
прямую кишку
Вопрос №
16
Надпочечники являются железами
внешней секреции
внутренней секреции
пищеварительной секреции
смешанной секреции
Вопрос №
17
В каком из мест кожа человека обладает наибольшей чувствительностью?
спина
ладони
губы
подошвы
Вопрос №
18
Если транспортировка раненого с наложенным жгутом к врачу продолжается более двух часов, то следует
затянуть жгут как можно туже
рядом с первым жгутом наложить второй
ослабить жгут на некоторое время, а потом вновь затянуть
снять жгут совсем, чтобы избежать омертвления тканей
Вопрос №
19
В результате взаимодействия движущих сил эволюции происходит
размножение организмов
изоляция
мутационный процесс
образование новых видов в природе
Вопрос №
20
К какому критерию вида следует отнести совокупность факторов среды обитания лютика едкого?
географическому
генетическому
морфологическому
экологическому
Вопрос №
21
В направлении приспособления организмов к среде обитания действует
искусственный отбор
естественный отбор
наследственная изменчивость
борьба за существование
Вопрос №
22
Какой экологический фактор оказывает сильное воздействие на изменение луговой экосистемы?
преобладание консументов второго порядка
видовой состав редуцентов
интенсивный выпас скота
обильное выпадение снега
Вопрос №
23
Организмы продуценты, консументы, редуценты — основные структурные компоненты
биогеоценоза
вида
популяции
биосферы
Вопрос №
24
Наибольшая роль человека в биогенной миграции атомов состоит в
вовлечении в биологический круговорот химических элементов
увеличении скорости круговорота воды
регулировании численности растений и животных
регулировании численности микроорганизмов
Вопрос №
25
Верны ли следующие формулировки генетических законов?
А. При дигибридном скрещивании у гибридов каждая пара признаков наследуется независимо от других и даёт с ними разные сочетания.
Б. Пары альтернативных признаков не смешиваются и при образовании гамет по одному переходят в них в чи-стом виде.
верно только А
верно только Б
верны обе формулировки
обе формулировки неверны
Синтез и распад белка в скелетных мышцах человека во время и после упражнений

Авторы: Vinod Kumar, Philip Atherton, Kenneth Smith, Michael J. Rennie.
Перевод — Сергей Струков.
Скелетные мышцы демонстрируют удивительную пластичность в ответ на изменения типа, продолжительности и интенсивности нагрузки, которые могут вызвать гипертрофию или атрофию, ограниченную гиперплазию и дифференциальную экспрессию множества белков и даже целых органелл, таких как митохондрии, с результирующими изменениями метаболизма субстратов и белков. С целью лучшего описания упражнения традиционно подразделяются на «аэробные / на выносливость» и «с отягощением (силовые)». Основное видимое отличие упражнений на выносливость (то есть повторяющихся низкоинтенсивных сокращений, которые могут выполняться продолжительное время) – смещение фенотипа в сторону возрастания количества волокон с более высокими окислительными способностями, в то время как повторные упражнения с отягощением (представляющие собой сокращения высокой интенсивности) вызывают гипертрофию волокон (и, вероятно, некоторую гиперплазию вследствие активации клеток-сателлитов). В реальности присутствует существенное «перекрытие» между вариантами ответов, это происходит вследствие восприятия и распределения мышцей сигналов в ответ на активность, которые приводят к постоянной адаптации к специфичной природе, интенсивности и продолжительности упражнений. В предлагаемом обзоре упражнения будут разделяться на «резистивные» (с дополнительным отягощением) и «нерезистивные» (без отягощения)…
…Целью обзора является описание регуляции обмена мышечных белков у человека во время и после упражнения, влияния на него факторов окружающей среды, таких как тип нутриентов, состав и уровень потребления, а также полового диморфизма и возраста. В обзоре представлены следующие темы:
- методики изучения обмена в мышцах человека;
- упражнения и общий мышечный белковый баланс;
- синтез мышечного протеина (СМП) и упражнения с отягощением (во время и после упражнения);
- СМП в упражнениях без отягощения (во время и после);
- распад мышечного протеина (РМП) и упражнения (во время и после упражнений с отягощениями и без них);
- влияние пищи (и синергия с упражнениями) на обмен мышечных белков;
- влияние продолжительной тренировки на метаболизм мышечных белков;
- пол и упражнения;
- старение и упражнения.
Мы включили в обзор три таблицы, в которых суммированы наиболее исчерпывающие исследования в данной области, проведенные в последние два-три десятилетия, освещающие специфичные переменные: возраст и пол, тип выполняемых упражнений, нутрициональные манипуляции, а также изменения в синтезе и распаде белков, позволяющие читателю ознакомиться с работами в данной области. Мы также включили рисунок, схематически отображающий основные клеточные сигнальные пути, вовлеченные в регуляцию синтеза мышечного белка в ответ на упражнения и прием пищи, – так, где возможно, мы кратко опишем связанные с этим изменения активности регуляторных путей как итог изменений их статуса фосфорилирования.
Мы ограничимся явлениями, происходящими в течение минут и часов (реже дней, исключительно для эффектов тренировки) во время или после упражнения. Изменения во время упражнения отражают активацию метаболических приоритетов в направлении переноса энергии для мышечной работы при множественных изменениях, таких как ингибирование синтеза белка, увеличение трансаминирования и окисления аминокислот – скорее сопровождающее явление, нежели специфическая функциональная адаптация в ответ на упражнения. Изменения в обмене мышечного белка в период после упражнений больше отражает приспособительное ремоделирование (например, увеличение синтеза группы миофибриллярных протеинов, ведущей к гипертрофии). Мы не будем обсуждать изменения в уровнях транскрипции генов.
Упражнения и общий баланс белка в мышцах
Мышечная масса поддерживается путем регулирования баланса между СМП и РМП. Общее увеличение мышечной массы возможно только в случае, если СМП превышает РМП, то есть при положительном белковом балансе, и наоборот. Во время отдыха в состоянии голода (правильнее называть постабсорбтивное состояние) общий баланс белка отрицательный, а позитивный баланс обычно наблюдается только, когда во время еды восполняются потери мышечного белка, поддерживая стабильную массу мышц. После упражнений в состоянии голода, независимо от увеличения СМП (см. ниже), общий баланс белка становится даже более негативным, не достигая положительных величин, так как уровень РМП, повышенный перед упражнениями, также повышается (13). Тем не менее, когда протеин или аминокислоты потребляются после тренировки, общий баланс белка становится положительным, так как СМП подавляет РМП, который может быть пониженным сам по себе (111).
СМП и упражнения с отягощениями
Во время упражнений
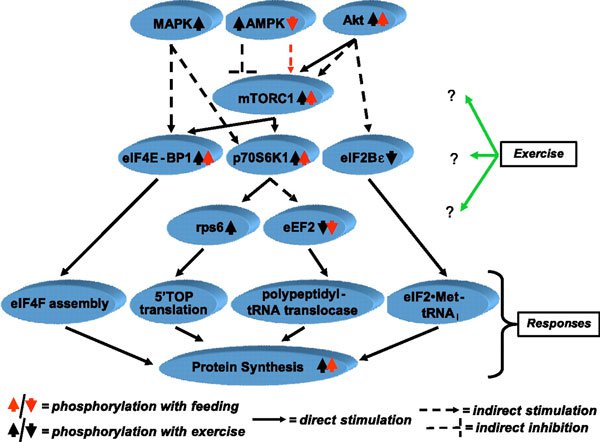
Измерения СМП человека, сделанные во время выполнения упражнений с отягощениями, редки, так как большинство исследований применяют тренировку короче минимального периода времени (около часа), которое требуется современным методикам для оценки проявления строгих изменений меченных стабильных изотопов. Также упражнения прерывистые, используются подходы повторяющихся сокращений, разделенные периодами отдыха, при которых мышца не пребывает в состоянии покоя, что усложняет интерпретацию полученных данных, особенно при методе, основанном на A-V пробах и кровотоке. Данные исследований мышц грызунов (24) и людей (37, 43) показывают угнетение СМП во время упражнений с отягощением. В то же время в работах, использовавших метод растворенных A-V меток, не увеличивался уровень поглощения меток, то есть синтез белка в мышцах ног не изменялся (39). Противоречие между ранними исследованиями (37) и более поздними данными (39), возможно, вызвано методологическими различиями (использование метода прямого включения против метода растворенных меток A-V) или является результатом различий в объеме выполненной работы. Обнаруженное резкое понижение СМП вызвано сокращением этапов инициации и элонгации при трансляции мРНК (63) из-за уменьшения фосфорилирования связывающего белка 4Е 1 (4ЕВР-1), эффектора, запускаемого мишенью рапамицина млекопитающих (mTOR), и тенденции к увеличению фосфорилирования фактора элонгации эукариотов 2 (eEF2) – отрицательного регулятора элонгации пептидной цепи (37) (рис. 1).
Рис. 1. МАРК – митогенактивированная протеинкиназа; АМРК – АМФ-активированная протеинкиназа; Akt – протеинкиназа В; mTORC1 – мишень рапамицина млекопитающих С1; eIF4E-BP1, eIF2Bε, eIF4F и eIF2: белок, связывающий фактор инициации эукариотов 4Е, 2Bε, 4Fb 2; p70S6K1 – 70-кДа S6 протеинкиназа 1; rps6 – рибосомный протеин s6; eEF2 – фактор элонгации эукариот 2; 5’TOP, 5-терминальный олигопиримидин; tRNAi – инициатор тРНК.
Bylund-Fellenius и коллеги (24) наблюдали вызванные сокращением понижение СМП в перфузированной электростимулированной мышце крысы, активность АТФ миозина вызвала повышение коэффициента АМФ/АТФ, вследствие чего, вероятно, оказывается стимулирующее воздействие на активность АМФ-активированной протеинкиназы (АМРК) (52), что вызывает ингибирование сигнальных эффектов комплекса туберозного склероза 2 на mTOR и уменьшает фосфорилирование 4ЕВР-1 (18). Активность АМРК действительно повышается на >30 % после выполнения упражнений с отягощением (37), но важность ингибирования mTOR при выполнении упражнений не определена, так, синтез белка повышается после выполнения упражнений независимо от продолжающегося повышения фосфорилирования АМРК (37).
Недавние работы также продемонстрировали эффективность предварительного потребления аминокислот на СМП во время упражнения. После ночного голодания испытуемые приняли 0,35 г/кг сухой массы тела незаменимых аминокислот и 0,5 г/кг сухой массы тела сахарозы за час до упражнений (10 х 10, 70 % РМ). СМП понизился во время выполнения упражнений, но не ниже исходного уровня, наблюдаемого в контрольной, не потреблявшей добавок группе (43). Подобным образом прием белка перед и во время 2-часовой прерывающейся тренировки с отягощениями, включающей упражнения для всего тела, повышал общий белковый баланс и СМП во время выполнения упражнений (7).
После упражнений
Общепринято, что упражнения с отягощениями вызывают увеличение СМП в восстановительном периоде (29, 71, 131). Действительно, тренировка с отягощением может увеличивать уровень СМП после упражнений в 2–5 раз, и этот эффект наблюдается более 48 часов у сытых субъектов (85). В других сообщениях (37, 100) обнаруживали угнетение СМП непосредственно после напряженной сократительной активности. В нашей лаборатории обычно наблюдаемые изменения не превышали исходные при оценке включения меток в белки первые 1–1,5 часа (66), тогда как другие этого не делали (37, 100), тем не менее большинство оценивающих исследователей свидетельствуют, что любое повышение после упражнения меньше вначале и увеличивается впоследствии (38, 66). Стимуляция синтеза белка у нетренированных людей после упражнений с отягощениями происходит в митохондриальном и миофибриллярном пулах (123). Более того, мы недавно исследовали влияние тренировки с отягощением на СМП в широком диапазоне интенсивности упражнений: от 20 до 90 % РМ при эквивалентной общей работе (1620–1800 единиц) в постабсорбтивном состоянии у молодых (24 ± 6 лет) и пожилых (70 ± 5 лет) мужчин в течение 4 часов после окончания занятия (66). Результаты показывают, что величина синтеза миофибриллярных белков зависит от интенсивности, увеличиваясь от 20 %, и достигает плато между 60 и 90 % РМ. Требуются дополнительные исследования для выяснения влияния объема работы и адаптивного ответа обмена мышечного белка при различной интенсивности нагрузки.
Молекулярный механизм стимулирующего эффекта упражнений с отягощением интенсивно изучался в последние годы – сначала на грызунах (2, 4, 19), а когда усовершенствовалась аналитическая техника – на человеческих мышцах (1, 34, 36, 37, 61, 66). Доступные в настоящее время данные, наиболее точно описывающие сигнальные пути во время и непосредственно после упражнений в состоянии голода и насыщения, представлены на рис. 1. Детальное описание активации процессов фосфорилирования или активности сигнальных молекул, регулирующих клеточный СМП в ответ на упражнения с отягощением, выходит за рамки настоящего обзора. Вкратце активация сигнальных молекул, регулирующих трансляцию и синтез белка, таких как Akt (протеинкиназа В), митогенактивируемая протеинкиназа, mTOR и его эффекторы, такие как эукариотический фактор инициации 4EBP-1, p70S6k1 (70-кДа протеинкиназаS6) и рибосомная протеинкиназа s6, связаны с увеличением СМП в период после упражнения (1, 36, 37. 61, 66). Тем не менее, необходимо выяснить временную зависимость и продолжительность этих ответов, а также дозозависимые характеристики, как и потенциальную роль в адаптивном ответе мышц на однократные и хронические упражнения.
В отношении клеточных сигнальных путей мы полагаем, что в настоящее время у нас нет точного понимания связи между изменениями в сигналах и СМП или РМП. В частности, непонятно, действует ли молекула как простой переключатель сигнального пути или как усилитель, модулирующий результирующую метаболическую реакцию. Данные исследований действия инсулина на мышцы человека слишком упрощенны, чтобы объяснить отдельные физиологические влияния на синтез или распад белка путем воздействия на степень фосфорилирования рассматриваемых молекул (50). Эту информацию можно более элегантно отобразить на основе данных зависимости от дозы и времени, собранных в нашей лаборатории (16, 17, 66).
СМП и упражнения без отягощения
Во время упражнений
Вероятно, во время бега СМП у грызунов понижается (35). Более поздние исследования зафиксировали уменьшение СМП на 26 % у крыс во время 2-часового бега на тредмилле (46). В основе изменений СМП во время 30-минутного бега мышей на тредмилле, возможно, лежит повышение активности АМРК и подавление общего уровня трансляции мРНК, а также сигнального пути mTOR (125). У людей общий уровень синтеза белка понижался во время ходьбы в гору при 40 % максимального потребления кислорода (VO2max) (93), и подобные изменения наблюдаются во время 2-часовой ходьбы при 60 % VO2max (22). СМП является значительной частью общего синтеза белка организмом, также известно, что отношение АДФ к АТФ значительно уменьшается при упражнениях без отягощения (24), на этом основании можно сделать вывод: во время ходьбы или бега у людей понижается СМП, но практически нет данных, подтверждающих это. Фактически во время ходьбы на тредмилле при 40 % VO2max (27) нет существенных изменений в СМП сравнительно с уровнем во время отдыха, тем не менее исходный уровень мог быть необычно низким по отношению ко дню без тренировки, что, вероятно, привело к ложно негативным выводам. Также, возможно, выбран недостаточный уровень интенсивности упражнений: велоэргометрия в течение часа при 70 % VO2max, выполняемая молодыми здоровыми субъектами, приводила к активации мышечной АМРК-α2 (42), измеренной в квадрицепсе с помощью биопсии непосредственно после упражнения; в подобном исследовании продолжительностью 90 минут отмечена значительная, вызванная Са2+ активация кальмодулинзависимой протеинкиназы еЕF2 киназы, совместно (и, возможно, как результат) с ингибированием активности еЕF2 и (в итоге) удлинение белковой цепи у здоровых мужчин в постабсорбтивном состоянии (97). Эти результаты противоречат гипотезе о снижении СМП во время езды на велосипеде и бега, тем не менее технически сложно организовать исследование, в котором у субъектов, упражняющихся продолжительное время и со значительной нагрузкой, можно удовлетворительно отследить обмен белка во время упражнения, но это возможно. Задача ожидает своего решения.
После упражнений
После ходьбы на тредмилле при 40 % VO2max в постабсорбтивном состоянии СМП в различных мышцах увеличивался на 45 % (26); о подобных изменениях сообщал и Sheffield-Mooreetal (101). Еще большее увеличение уровня синтеза миофибриллярной фракции могут вызывать более интенсивные упражнения у сытых молодых мужчин, 1 час маховых упражнений ногами ̴̴ 70 % РМ удвоили уровень синтеза миофибриллярного белка в квадрицепсе на 24 часа, синтез оставался повышенным еще более 72 часов (76).
Эти результаты можно было бы считать случайностью, так как обычно упражнения этого типа (которые скорее увеличивают биогенез митохондрий) не вызывают гипертрофию и, следовательно, не стимулируют синтез миофибриллярных белков, но накопившиеся данные развеивают сомнения. Описанные нами факты обнаружены у нетренированных субъектов, в этом случае и отягощения, и велоэргометрия стимулируют синтез белков и миофибрилл и митохондрий, возможно, в результате общего анаболического сигнала после упражнений, в то же время у тренированных не повышается синтез миофибрилл после велоэргометрии и не наблюдается синтез митохондриальных белков после однократной тренировки с отягощениями (123).
Степень изменений СМП в ответ на упражнения, вероятно, зависит от того, производится или нет существенная «ударная» сила, например, после интенсивного плавания СМП у здоровых людей существенно не изменяется (113). Тем не менее, важно отметить, что измерения проводились после длительной тренировки, выполненной натощак. Кроме того, испытуемые были хорошо тренированы, а долговременная тренировка увеличивает базальный уровень СМП и уменьшает СМП в ответ на однократное воздействие упражнений (86, 87, 102).
В настоящее время существует много описаний активирующих фосфорилирование сигналов, которые могут лежать в основе изменений СМП после однократного выполнения упражнений без отягощения, а также изменений СМП самого по себе (например, увеличение сигналов mTOR, уменьшение еEF2, митогенактивирующей протеинкиназы и т. д.) (1, 11, 74, 98). Количественно наблюдаемые изменения сходны с происходящими в ответ на упражнения с отягощениями, и действительно, различия в ответ на однократные упражнения, при которых мышцы ног работают в разных режимах, «силовом» и «на выносливость», незначительны у тех же нетренированных людей (123). Это означает, что любое значительное увеличение сократительной активности или возможности утилизации субстратов нетренированными мышцами ведет к сходному анаболическому ответу. Тем не менее после периода тренировки СМП становится более чувствительным к специфическому типу упражнений, вызывая синтез отдельных субклеточных белковых фракций (митохондриальной или миофибриллярной), впоследствии проявляясь в фенотипических изменениях, характерных для разных видов тренировки (123). Фенотипические изменения, вероятно, возникают в результате повторного выполнения каждого из видов упражнений с отягощениями или «динамических». В настоящее время существует ограниченное количество данных о влиянии тренировки на активацию фосфорилирования сигнальных белков, этого недостаточно для возможности предсказания влияния на обмен протеинов изменений фосфорилирования.
РМП и упражнения
Во время упражнений с отягощениями
Только метод, основанный на A-V растворенных меченых аминокислотах, обсуждаемый ранее, доступен в настоящее время, однако его точность в данном случае весьма сомнительна. Насколько нам известно, только в двух исследованиях отслеживали уровень растворения меток «во время» упражнения (в действительности – во время отдыха между подходами) в постабсорбтивном состоянии; в этих исследованиях наблюдаемый уровень фенилаланина, показателя распада белка, не повышался во время отдыха (39, 114). Возможно, это объясняется тем, что протеолиз в мышцах происходит преимущественно через АТФ-зависимую убиквитинпротеазную систему (3), отношение АДФ к АТФ увеличивается во время упражнений, что может быть причиной его (распада) подавления во время выполнения упражнений, как в случае синтеза белка (см. выше).
После упражнений с отягощениями
Какой бы ни была неопределенность для периода упражнений, несомненно, что в постабсорбтивном состоянии после упражнения протеолиз в мышцах увеличивается, как показано с помощью растворенных меток (13, 15) и методом оценки уровня фракционного распада (ФРУ) (65). Перед упражнениями мышцы имели отрицательный баланс аминокислот, и эта ситуация лишь немного улучшалась при выполнении интенсивных упражнений с отягощениями, потому что, в то время как СМП увеличивался вдвое, ФРУ, существенно больший, чем ФРУ в постабсорбтивном состоянии, также увеличивался на 30–50 % спустя 3 часа, таким образом поддерживался отрицательный баланс (13, 85, 86). Тем не менее повышение распада в мышцах меньше по времени, чем уровень фракционального синтеза (24 часа по сравнению с 48) (85).
РМП и упражнения без отягощения
Неясны изменения РМП во время упражнений без отягощения. Во множестве экспериментов с циклическими упражнениями отмечали увеличение высвобождения аминокислот из нижних конечностей (72, 73) и на основании этого делали вывод о повышении протеолиза. Тем не менее высвобождение аминокислот объясняется скорее ингибированием синтеза белка, что приводит к недостаточной компенсации распада, и в результате из аминокислотного пула высвобождаются свободные аминокислоты.
Не вызывает сомнений, что в постабсорбтивном состоянии после упражнений без отягощений (45 минут ходьбы на тредмилле при 40 % VO2max) протеолиз в скелетных мышцах повышается как у молодых, так и у пожилых мужчин. В нижних конечностях увеличение протеолиза наблюдается через 10 и исчезает через 60 минут, но только у молодых субъектов (101).
Противоположные результаты получены с помощью микродиализа: концентрация 3МеН в диализате не изменялась от 6 до 72 часов после маховых упражнений одной ногой в течение часа при ̴ 70 % РМ (55). Возможно, это объясняется тем, что протеолизу подвергались «немиофибриллярные» протеины, при этом 3МеН не образуется, но более вероятно, что этот метод вообще не подходит для оценки мышечного протеолиза (13, 85, 95).
Сигнальные пути и РМП
Сигнальные пути, контролирующие РМП и протеолиз в мышцах человека, не определены. Различные протеолитические пути (включая лизосомальный, активируемый кальцием и убиквитин-протеосомо-зависимую систему, каспазы и металлопротеазы, а также неспецифические ди- и трипептидазы) вовлечены в ремоделирование мышц вследствие упражнений, но долевое участие каждого из них непонятно.
Увеличение активности активируемых кальцием протеаз и металлопротеаз отмечено в мышцах крысы во время и после бега на тредмилле (9, 25). Существует ограниченное количество сообщений об измерениях острых изменений производительности или контроля путей мышечного протеолиза у людей. В мышцах грызунов обнаружены две мышечные убиквитинлигазы, F-box мышечной атрофии (MAFbx) и мышечный reallyinterestingnovelgene fingerprotein 1 (MuRF1), стимулирующие протеолиз (3). Исследования экспрессии протеолитических генов в мышцах молодых субъектов спустя 4 часа после упражнений с отягощением, особенно экспрессии генов убиквитинапротеосом, показали увеличение активности MARFbxи MuRF1мРНК, но без существенных изменений в forkheadbox 3AмРНК (91). Парадоксально, но эксперименты нашей группы обнаружили снижение активности MARFbxм РНК в первые 24 часа после упражнений с отягощениями, которое означало увеличение РМП в посттренировочном состоянии (65). Это может быть связано с объемом и видом упражнения, выполняемого в последнем исследовании, где испытуемые выполняли подъемы на ступеньку с дополнительным отягощением, составлявшим 25 % от их массы тела, до полного утомления, а также со временем измерения. С другой стороны, в нашей лаборатории ранее не обнаружено прямой зависимости между РМП и экспрессией MARFbx (50). В любом случае существует и активируется множество путей, тем не менее интересно представить, как интактные миофибриллярные белки могут «реконструироваться» или ремоделироваться таким образом, чтобы оставалось место для вновь созданных протеинов, которые, согласно нескольким исследованиям (101, 113), синтезируются в течение часов после стимуляции упражнением.
Влияние потребления пищи на СМП и упражнения

Упражнение с отягощением и еда синергически повышают СМП и ведут к положительному белковому балансу после упражнения, большему, чем просто потребление пищи (14). Несколько групп отметили, что потребление аминокислот или протеина, совместно с углеводами или без них, после упражнений с отягощением (14, 21, 33, 64, 77, 79, 90, 108, 112) или без отягощений (76) дополнительно усиливали СМП. Например, увеличение СМП на 145 % по сравнению с исходным состоянием происходило, когда после упражнений потреблялись обогащенные лейцином незаменимые аминокислоты с углеводами, тогда как без действия нутриентов СМП увеличивался на 41 % (36). Усиливающий эффект потребления пищи после упражнений, видимо, вызван увеличением количества аминокислот, а не глюкозы в крови (20, 77).
Кривая дозозависимого увеличения СМП после упражнения и потребления белка (80) имеет сходную форму с наблюдаемой в покое (17) с небольшим сдвигом влево вверх под влиянием упражнений. Таким образом, работы показывают синергизм между едой и упражнением. Также не выявлено преимуществ при потреблении большого количества белка (>20 г, что на самом деле немного) с целью повышения накопления мышечного протеина, максимально эффективная доза составляет, вероятно, 15–20 г высококачественного белка: мясного, яичного или соевого.
Время потребления пищи
Нет единого мнения, что приводит к большему СМП: потребление аминокислот до или после упражнений. Так, сообщалось (114), что прием незаменимых аминокислот с углеводами непосредственно перед упражнениями с отягощениями вызвал большее поглощение аминокислот нижними конечностями, но эти результаты трудно проверить количественно, так как они получены не в состоянии покоя и увеличение потребления некорректно отражает размер физиологического повышения (в 20 раз), вероятно, имеет место артефакт – захват аминокислот из внутримышечного пула. Более того, недавно показано путем прямого измерения синтеза отдельных фракций у людей, что потребление пищи за 1 час до интенсивных упражнений с отягощениями не приводит к дополнительному повышению СМП в течение 2 часов после окончания нагрузки (43). Таким образом, в очередной раз показано, что метод растворенных меток предоставляет количественно и качественно различающиеся результаты по сравнению с «включением» меченых аминокислот.
В то время как остается невыясненным, когда лучше потреблять белок для максимального СМП в ответ на упражнения, существуют результаты непрямых измерений в отношении долговременной тренировки, таких как гипертрофия, показывающие, что у молодых и пожилых людей происходит большее увеличение мышечной силы и массы, если белок потребляется непосредственно после упражнений, чем через несколько часов (40, 53, 67).
Качество белка
Большой интерес представляет предположение, что белки различного «биологического качества» и усвояемости могут быть более или менее эффективны для обеспечения мышц аминокислотами после упражнений. Недавние работы Филлипса и коллег (53, 124) выявили преимущество сывороточного белка перед казеином, соевым протеином и белком цельного молока относительно общего включения в белки мышц. В то же время нет доказательств в пользу преимуществ молочного протеина в сравнении мясным, яичным или соевым (78).
Анаболические сигнальные пути
Молекулярный механизм, лежащий в основе увеличения стимулирующего СМП эффекта еды после упражнений, связан с большим повышением фосфорилирования mTOR, p70S6K1 и 4EBP-1, чем только при выполнении упражнений (рис. 1) (36, 61, 64).
Влияние упражнений и приема пищи на РМП
Аминокислоты сами по себе оказывают, по крайней мере небольшое (50), ингибирующее влияние на распад белка в нижних конечностях у человека, особенно в присутствии инсулина, но эффект меньший, чем наблюдающийся у животных. Подавление разрушения белка в мышцах предплечья человека происходит после введения смеси аминокислот с разветвленной боковой цепью (68, 69). Большинство физиологических эффектов аминокислот на РМП в покое, вероятно опосредовано повышением секреции инсулина. Тем не менее несколько исследователей сообщили, что увеличение биодоступности аминокислот после упражнений не ингибирует существенно РМП человека (14, 21, 70, 90, 112).
Влияние тренировки на метаболизм мышечного белка
Продолжительные упражнения с отягощениями увеличивают средний поперечник волокон и вызывают гипертрофию мышц. Тем не менее мы преимущественно игнорируем временную зависимость изменений и точный механизм происходящего, который должен включать активацию СМП и ремоделирования, а также разрушение «отработавших» белков и РМП. Несколько работ отметили, что тренировка с отягощением увеличивает базальный уровень СМП (5, 86). Также было показано, что даже кратковременная (2 недели) тренировка с отягощениями увеличивает СМП в покое, но данные сложно интерпретировать в связи с тем, что СМП измеряли кратковременно (между 3 и 18 часами) после последнего занятия, и увеличение СМП могло быть следствием срочного влияния упражнений, а не тренировки самой по себе (54, 129, 131). В подтверждение увеличения СМП в покое вследствие упражнений зафиксировано повышение фосфорилирования Akt-mTOR-p70S6k (123). Тем не менее есть противоположные данные, полученные в той же лаборатории, в отношении долговременной тренировки (109). Мы с коллегами оценивали срочный эффект упражнений (велоэргометрия) с отягощением и без него в разных нижних конечностях одних и тех же субъектов после 10 недель тренировки на синтез миофибриллярных и митохондриальных белков: в ноге, тренировавшейся с отягощением, отмечено повышение синтеза миофибриллярного белка в состоянии покоя, тогда как тренировка без отягощения увеличила только синтез митохондриального белка (123). Эти результаты указывают на то, что повторные специфические нагрузки увеличивают синтез отдельных белковых фракций не в результате кратковременной модуляции активности трансляции, а за счет активации специфических программ транскрипции генов (65, 91).
Также отмечалось ингибирование СМП после однократной тренировки в результате долговременных упражнений (86). Тем не менее в той же лаборатории недавно обнаружено ̴ 48 % увеличение СМП после одной тренировки в результате 12 недель долговременного выполнения занятий, включающих упражнения с отягощениями (62). Эти различия объясняются относительно низким стимулом в тренированном состоянии вследствие применения аналогичной абсолютной интенсивности перед и после тренировки в предыдущем исследовании (62). Однако мы с коллегами также зафиксировали понижение синтетического ответа (̴ 30 %) после однократного занятия в конечности, «тренировавшейся» с отягощением, при аналогичной относительной интенсивности (123).
Имеются свидетельства не только различий величины ответных изменений СМП, но и временные различия: долговременные упражнения с отягощениями вызывают более быстрое, но кратковременное повышение СМП, чем однократное занятие у нетренированных (109). Таким образом, тренировочный статус – важный параметр, когда оценивается ответ мышц на однократные упражнения.
Сообщалось об увеличении СМП в латеральной широкой мышце в покое на 22 % в результате 16 недель велоэргометрии без отягощения (45 минут при 80 % максимальной ЧСС, 3–4 дня в неделю) (102). Вероятно, умеренное повышение общего фракционного синтеза белка было результатом более высокого увеличения синтеза в митохондриальной и/или саркоплазматической фракции. Даже спустя 4 недели после программы ходьбы/бега при 65–85 % максимальной ЧСС отмечался умеренно повышенный общий фракционный синтез белка (~17 %); тем не менее, отмечается парадоксальное явление: увеличение общего фракционного синтеза белка (~40 %) приводит к более отрицательному белковому балансу (87).
Если упражнения без отягощения вызывают увеличение СМП, почему же тогда не происходит гипертрофии мышц? Увеличение СМП после динамических упражнений может быть, в частности, связано с повышением синтеза белков, которые ответственны за адаптационные изменения при этом виде упражнений, то есть за увеличение объема митохондрий, активность митохондриальных энзимов и синтез белка в митохондриях (48, 57). В поддержку этого Шорт с коллегами сообщили об увеличении синтеза белков, транспортирующих глюкозу, белков митохондрий, уровня митохондриальных энзимов и 22 % увеличении общего СМП в покое вследствие 16-недельной программы «аэробных» упражнений (102, 103). Недавно Wilkinson et al. (123) показали, что повторные динамические упражнения продолжительностью более 10 недель увеличивают только синтез митохондриальных белков и не оказывают влияния на синтез белков миофибрилл или на общее фосфорилирование Akt-mTOR-p70S6k у молодых здоровых людей. На уровне транскрипции «негипертрофические» упражнения (30 минут бега при 75 % VO2max) увеличивают относительное содержание мРНК и транскрипцию различных миогенных и метаболических генов (для миогенной дифференциации гексокиназы II и пируватдегидрогеназной киназы 4) после упражнения, которое достигает максимума через 4–8 часов и возвращается к исходному уровню через 24 часа (126). Кумулятивным эффектом этого преходящего увеличения вследствие повторной динамической тренировки является адаптация мышц, наблюдаемая при упражнениях без отягощения (31).
Адаптивные изменения к динамическим упражнениям проявляются в подавлении АМРК, внеклеточной, регулирующей сигналы киназы 1/2 и активности сигналов mTOR после 10 дней интенсивных велоэргометрических нагрузок: 45–60 мин при 75–90 % у здоровых людей (11). Увеличение экспрессии специфичных мышечных коактиваторов транскрипции, активирующего пролиферацию рецептор-ү коактиватора-1α пероксисом (PPAR-1α), также может быть связано с адаптивным ответом на динамические упражнения, приводящим к биогенезу митохондрий и увеличению окислительной способности (88, 89). Тем не менее физиологическая роль PPAR-1α в адаптивном ответе мышц на тренировку нуждается в подробном изучении.
Половые различия в метаболизме мышечных белков и упражнения

Тем не менее, согласно нашим и другим сообщениям, у женщин после менопаузы исходный уровень СМП на ~20 – 30 % выше, чем у мужчин (56, 105), и незначительно реагирует на прием пищи (105), таким образом, различия в метаболизме белка проявляются с возрастом, вероятно, в результате изменения в гормональном статусе. Изменения возникают независимо от композиции тела, так, нами были обследованы субъекты с ожирением (ИМТ 36–38) (105), в отличие от эксперимента группы Nair’s (56), сообщавшей об аналогичных различиях в базальном уровне СМП. Известно, что пожилые женщины демонстрируют меньшую гипертрофию (~33 %), чем мужчины, в ответ на тренировку с отягощением (3 дня в неделю, 26 недель) (6), вероятно, из-за неспособности поддерживать адаптивный ответ на хроническое тренирующее воздействие; так, пожилые мужчины увеличивают базальный уровень СМП на ~50 % после 3 месяцев тренировки, тогда как пожилые женщины только на ~15 % (104)
Влияние возраста на метаболизм мышечного белка и упражнения

Тогда как другие исследователи сообщали о запаздывании ответной реакции на упражнения с отягощениями у пожилых людей (38), мы не обнаружили подобного эффекта (66). Эти расхождения могут быть вызваны меньшим объемом упражнений, использованных в эксперименте, и обстоятельством, что субъекты изучались в состоянии голода после ночного сна (66). Подобный «притупленный» анаболический эффект наблюдался у стариков в ответ на прием пищи, расцененный как снижение чувствительности и способности к анаболическому ответу на прием аминокислот отдельно (32) и в сочетании с глюкозой (118).
Худший анаболический ответ СМП на упражнения с отягощением в мышцах пожилых людей, видимо, связан со снижением активации восходящего сигнала пути mTOR и повышением активности АМРК по сравнению с мышцами молодых людей (38). В исследованиях на грызунах обнаружено снижение активации сигнального пути mTOR после упражнений с отягощениями и повышение активности АМРК у пожилых крыс по сравнению с молодыми животными (45, 83, 111).
Недостаточное количество данных об РМП в ответ на упражнения у стариков. Используя метод растворенных A-V меток, обнаружено некоторое увеличение распада белка в состоянии покоя у пожилых людей (119). Тем не менее, по нашим данным, нет различий в базальном РМП, но «нормальное» ингибирование РМП инсулином существенно ниже у стариков (122). Видимо, «притупленный анаболизм» – широко распространенное явление в стареющих мышцах.
Минимизация потерь мышечной ткани, поддержание массы и функций мышц – основная цель при старении; мы должны понять синергию между упражнениями и приемом пищи, а также разработать надлежащую стратегию тренировок и питания для пожилых людей.
Выводы
Подводя итог, можно констатировать, что мышцы показывают удивительную пластичность в ответ на упражнения. Во время упражнений с отягощениями и без них СМП подавляется, тогда как после тренировки – повышается как в голодном, так и в сытом состоянии. Эта стимуляция проявляет зависимость от дозы и величины воздействия; тем не менее, для выяснение роли рабочей нагрузки требуются дополнительные исследования. Независимо от различий в нагрузке и наличия (или отсутствия) отягощения, сократительная активность вызывает сходный срочный анаболический ответ в нетренированных мышцах. Однако после периода тренировок срочный ответ уменьшается и зависит от вида упражнений: с отягощением или без отягощения и стимулирует синтез белков миофибрилл (с отягощением) или митохондрий (без отягощения), вероятно, отражая адаптивные изменения в зависимости от вида упражнения. Активация РМП во время упражнения с отягощением или без остается невыясненной. Тем не менее существует достаточно данных, подтверждающих увеличение РМП после обоих видов упражнений. Общее увеличение мышечной массы (СМП – РМП) после упражнений проявляется только при повышении доступности аминокислот во время постнагрузочного периода. Приблизительно 20 г высококачественного белка, например молочного, достаточно для инициации максимального синтетического ответа и, соответственно, общего увеличения массы мышц.
С возрастом уменьшается синтез белка миофибрилл в ответ на упражнение и потребление пищи, последние данные свидетельствуют о существовании половых различий в обмене мышечного белка, особенно об уменьшении ответа на упражнения у пожилых женщин.
Активация АМРК в результате клеточных запасов энергии играет важную роль в ингибировании синтеза белка. Увеличение синтеза белка после упражнений опосредуется активацией передачи сигналов mTOR и последующих эффекторов. Связь времени и величины ответа между упражнениями и фосфорилированием регуляторов клеточных сигнальных путей, вовлеченных в синтез и деградацию белка, только начинает выясняться. Несмотря на то что эти процессы фосфорилирования в основном качественно проявляются в результате анаболических стимулов, таких как упражнения, требуется гораздо больше работ для расшифровки сигналов, которые их включают или выключают и в конечном счете контролируют адаптивный ответ, например, мышечную гипертрофию или биогенез митохондрий. Конечно, в настоящее время невозможно напрямую связать размеры активации обмена мышечных белков с фосфорилированием сигнальных молекул. Когда мы сможем сделать это, мы будем гораздо ближе к нашей цели – пониманию регуляции мышечной массы и функции и разработке стратегии максимизации поддержания мышц в здоровье и болезни.
Источник: https://journals.physiology.org/
Источники:
1.
Aronson D., Violan M.A., Dufresne S.D., Zangen D., Fielding R.A.,
Goodyear L.J. Exercise stimulates the mitogen-activated protein kinase pathway in human skeletal muscle. J ClinInvest, 99: 1251–1257, 1997.
Medline
2.
Atherton P.J., Babraj J., Smith K., Singh J., Rennie M.J., Wackerhage H. Selective activation of AMPK-PGC-1alpha or PKB-TSC2-mTOR signaling can explain specific adaptive responses to endurance or resistance training-like electrical muscle stimulation. FASEB J, 19: 786–788, 2005.
Abstract/FREE FullText
3.
Attaix D., Ventadour S., Codran A., Bechet D., Taillandier D., Combaret L.The ubiquitin-proteasome system and skeletal muscle wasting. Essays Biochem, 41: 173–186, 2005.
CrossRef Medline
4.
Baar K., Esser K. Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol Cell Physiol, 276: C120–C127, 1999.
Abstract/FREE Full Text
5.
Balagopal P., Schimke J.C., Ades P., Adey D., Nair K.S. Age effect on transcript levels and synthesis rate of muscle MHC and response to resistance exercise. Am J Physiol Endocrinol Metab, 280: E203–E208, 2001.
Abstract/FREE Full Text
6.
Bamman M.M., Hill V.J., Adams G.R., Haddad F., Wetzstein C.J., Gower B.A., Ahmed A., Hunter G.R. Gender differences in resistance-training-induced myofiber hypertrophy among older adults. J Gerontol A BiolSciMedSci, 58: 108–116, 2003.
Medline
7.
Beelen M., Koopman R., Gijsen A.P., Vandereyt H., Kies A.K., Kuipers H., Saris W.H., van Loon L.J. Protein coingestion stimulates muscle protein synthesis during resistance-type exercise. Am J Physiol Endocrinol Metab, 295: E70–E77, 2008.
Abstract/FREE Full Text
8.
Beelen M., Tieland M., Gijsen A.P., Vandereyt H., Kies A.K., Kuipers H., Saris W.H., Koopman R., van Loon L.J. Coingestion of carbohydrate and protein hydrolysate stimulates muscle protein synthesis during exercise in young men, with no further increase during subsequent overnight recovery. J Nutr, 138: 2198–2204, 2008.
Abstract/FREE FullText
9.
Belcastro A.N. Skeletal muscle calcium-activated neutral protease (calpain) with exercise .J ApplPhysiol, 74: 1381–1386, 1993.
Abstract/FREE FullText
10.
Bennet W.M., Connacher A.A., Scrimgeour C.M., Smith K., Rennie M.J. Increase in anterior tibialis muscle protein synthesis in healthy man during mixed amino acid infusion: studies of incorporation of [1‑13C]leucine. ClinSci (Lond), 76: 447–454, 1989.
Medline
11.
Benziane B., Burton T.J., Scanlan B., Galuska D., Canny B.J., Chibalin A.V., Zierath J.R., Stepto N.K. Divergent cell signaling after short-term intensified endurance training in human skeletal muscle. Am J Physiol Endocrinol Metab, 295: E1427–E1438, 2008.
Abstract/FREE Full Text
12.
Bier D.M.. Stable isotopes in biosciences, their measurement and models for amino acid metabolism. Eur J Pediatr, 156, Suppl 1: S2–S8, 1997.
CrossRef
Medline
13.
Biolo G., Maggi S.P., Williams B.D., Tipton K.D., Wolfe R.R. Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol Endocrinol Metab, 268: E514–E520, 1995.
Abstract/FREE Full Text
14.
Biolo G., Tipton K.D., Klein S., Wolfe R.R. An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am J Physiol Endocrinol Metab, 273: E122–E129, 1997.
Abstract/FREE Full Text
15.
Biolo G., Williams B.D., Fleming R.Y., Wolfe R.R. Insulin action on muscle protein kinetics and amino acid transport during recovery after resistance exercise. Diabetes, 48: 949–957, 1999.
Abstract
16.
Bohe J., Low A., Wolfe R.R., Rennie M.J. Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. J Physiol, 552: 315–324, 2003.
Abstract/FREE FullText
17.
Bohe J, Low J.F., Wolfe R.R., Rennie M.J. Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol, 532: 575–579, 2001.
Abstract/FREE FullText
18.
Bolster D.R., Crozier S.J., Kimball S.R., Jefferson L.S. AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling. J BiolChem, 277: 23977–23980, 2002.
Abstract/FREE FullText
19.
Bolster D.R., Kubica N., Crozier S.J., Williamson D.L., Farrell P.A., Kimball S.R., Jefferson L.S. Immediate response of mammalian target of rapamycin (mTOR)-mediated signaling following acute resistance exercise in rat skeletal muscle. J Physiol, 553: 213–220, 2003.
Abstract/FREE FullText
20.
Borsheim E., Cree M.G., Tipton K.D., Elliott T.A., Aarsland A., Wolfe R.R. Effect of carbohydrate intake on net muscle protein synthesis during recovery from resistance exercise. J ApplPhysiol, 96: 674–678, 2004.
Abstract/FREE FullText
21.
Borsheim E., Tipton K.D., Wolf S.E., Wolfe R.R. Essential amino acids and muscle protein recovery from resistance exercise. Am J Physiol Endocrinol Metab, 283: E648–E657, 2002.
Abstract/FREE Full Text
22.
Bowtell J.L., Leese G.P., Smith K., Watt P.W., Nevill A., Rooyackers O., Wagenmakers A.J., Rennie M.J. Modulation of whole body protein metabolism, during and after exercise, by variation of dietary protein. J ApplPhysiol, 85: 1744–1752, 1998.
Abstract/FREE FullText
23.
Brodsky I.G., Balagopal P., Nair K.S. Effects of testosterone replacement on muscle mass and muscle protein synthesis in hypogonadal men – a clinical research center study. J Clin Endocrinol Metab, 81: 3469–3475, 1996.
Abstract
24.
Bylund-Fellenius A.C., Ojamaa K.M., Flaim K.E., Li J.B., Wassner S.J., Jefferson L.S. Protein synthesis versus energy state in contracting muscles of perfused rat hindlimb. Am J Physiol Endocrinol Metab, 246: E297–E305, 1984.
Abstract/FREE Full Text
25.
Carmeli E., Moas M., Lennon S., Powers S.K. High intensity exercise increases expression of matrix metalloproteinases in fast skeletal muscle fibres. ExpPhysiol, 90: 613–619, 2005.
Abstract/FREE FullText
26.
Carraro F., Hartl W.H., Stuart C.A., Layman D.K., Jahoor F., Wolfe R.R. Whole body and plasma protein synthesis in exercise and recovery in human subjects. Am J Physiol Endocrinol Metab, 258: E821–E831, 1990.
Abstract/FREE Full Text
27.
Carraro F., Stuart C.A., Hartl W.H., Rosenblatt J., Wolfe R.R. Effect of exercise and recovery on muscle protein synthesis in human subjects. Am J Physiol Endocrinol Metab, 259: E470–E476, 1990.
Abstract/FREE Full Text
28.
Cheng K.N., Dworzak F., Ford G.C., Rennie M.J., Halliday D. Direct determination of leucine metabolism and protein breakdown in humans using l-[1-13C,15N]-leucine and the forearm model. Eur J ClinInvest, 15: 349–354, 1985.
Medline
29.
Chesley A., MacDougall J.D., Tarnopolsky M.A., Atkinson S.A., Smith K. Changes in human muscle protein synthesis after resistance exercise. J ApplPhysiol, 73: 1383–1388, 1992.
Abstract/FREE FullText
30.
Chinkes D., Klein S., Zhang X.J., Wolfe R.R. Infusion of labeled KIC is more accurate than labeled leucine to determine human muscle protein synthesis. Am J Physiol Endocrinol Metab, 270: E67–E71, 1996.
Abstract/FREE Full Text
31.
Coffey V.G., Hawley J.A. The molecular bases of training adaptation. SportsMed, 37: 737–763, 2007.
CrossRef Medline
32.
Cuthbertson D., Smith K., Babraj J., Leese G., Waddell T., Atherton P., Wackerhage H., Taylor P.M., Rennie M.J. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J, 19: 422–424, 2005.
Abstract/FREE FullText
33.
Cuthbertson D.J., Babraj J., Smith K., Wilkes E., Fedele M.J., Esser K., Rennie M. Anabolic signaling and protein synthesis in human skeletal muscle after dynamic shortening or lengthening exercise. Am J Physiol Endocrinol Metab,290: E731–E738, 2006.
Abstract/FREE Full Text
34.
Deldicque L., Atherton P., Patel R., Theisen D., Nielens H., Rennie M.J., Francaux M. Decrease in Akt/PKB signalling in human skeletal muscle by resistance exercise. Eur J ApplPhysiol, 104: 57–65, 2008.
CrossRef Medline
35.
Dohm G.L., Tapscott E.B., Barakat H.A., Kasperek G.J. Measurement of in vivo protein synthesis in rats during an exercise bout. BiochemMed, 27: 367–373, 1982.
CrossRef Medline
36.
Dreyer H.C., Drummond M.J., Pennings B., Fujita S., Glynn E.L., Chinkes D.L., Dhanani S., Volpi E., Rasmussen B.B. Leucine-enriched essential amino acid and carbohydrate ingestion following resistance exercise enhances mTOR signaling and protein synthesis in human muscle. Am J Physiol Endocrinol Metab, 294: E392–E400, 2008.
Abstract/FREE Full Text
37.
Dreyer H.C., Fujita S., Cadenas J.G., Chinkes D.L., Volpi E., Rasmussen B.B. Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol, 576: 613–624, 2006.
Abstract/FREE FullText
38.
Drummond M.J., Dreyer H.C., Pennings B., Fry C.S., Dhanani S., Dillon E.L., Sheffield-Moore M., Volpi E., Rasmussen B.B. Skeletal muscle protein anabolic response to resistance exercise and essential amino acids is delayed with aging. J ApplPhysiol, 104: 1452–1461, 2008.
Abstract/FREE FullText
39.
Durham W.J., Miller S.L., Yeckel C.W., Chinkes D.L., Tipton K.D., Rasmussen B.B., Wolfe R.R. Leg glucose and protein metabolism during an acute bout of resistance exercise in humans. J ApplPhysiol, 97: 1379–1386, 2004.
Abstract/FREE FullText
40.
Esmarck B., Andersen J.L., Olsen S., Richter E.A., Mizuno M., Kjaer M. Timing of postexercise protein intake is important for muscle hypertrophy with resistance training in elderly humans. J Physiol, 535: 301–311, 2001.
Abstract/FREE FullText
41.
Forbes G.B. The effect of anabolic steroids on lean body mass: the dose response curve. Metabolism, 34: 571–573, 1985.
CrossRef Medline
42.
Fujii N., Hayashi T., Hirshman M.F., Smith J.T., Habinowski S.A., Kaijser L., Mu J., Ljungqvist O., Birnbaum M.J., Witters L.A., Thorell A., Goodyear L.J. Exercise induces isoform-specific increase in 5′AMP-activated protein kinase activity in human skeletal muscle. BiochemBiophysResCommun, 273: 1150–1155, 2000.
CrossRef
Medline
43.
Fujita S., Dreyer H.C., Drummond M.J., Glynn E.L., Volpi E., Rasmussen B.B. Essential amino acid and carbohydrate ingestion prior to resistance exercise does not enhance post-exercise muscle protein synthesis. J ApplPhysiol. Inpress.
44.
Fujita S., Rasmussen B.B., Bell J.A., Cadenas J.G., Volpi E. Basal muscle intracellular amino acid kinetics in women and men. Am J Physiol Endocrinol Metab, 292: E77–E83, 2007.
Abstract/FREE Full Text
45.
Funai K., Parkington J.D., Carambula S., Fielding R.A. Age-associated decrease in contraction-induced activation of downstream targets of Akt/mTor signaling in skeletal muscle. Am J Physiol Regul Integr Comp Physiol, 290: R1080–R1086, 2006.
Abstract/FREE Full Text
46.
Gautsch T.A., Anthony J.C., Kimball S.R., Paul G.L., Layman D.K., Jefferson L.S. Availability of eIF4E regulates skeletal muscle protein synthesis during recovery from exercise. Am J Physiol Cell Physiol, 274: C406–C414, 1998.
Abstract/FREE Full Text
47.
Glover E.I., Phillips S.M., Oates B.R., Tang J.E., Tarnopolsky M.A., Selby A., Smith K., Rennie M.J. Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. J Physiol, 586: 6049–61, 2008.
Abstract/FREE FullText
48.
Gollnick P.D., Saltin B. Significance of skeletal muscle oxidative enzyme enhancement with endurance training. ClinPhysiol, 2: 1–12, 1982.
Medline
49.
Goodpaster B.H., Chomentowski P., Ward B.K., Rossi A., Glynn N.W., Delmonico M.J., Kritchevsky S.B., Pahor M., Newman A.B. Effects of physical activity on strength and skeletal muscle fat infiltration in older adults: a randomized controlled trial. J ApplPhysiol, 105: 1498–1503, 2008.
Abstract/FREE FullText
50.
Greenhaff P.L., Karagounis L., Peirce N., Simpson E.J., Hazell M., Layfield R., Wackerhage H., Smith K., Atherton P., Selby A., Rennie M.J. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin-ligases and protein turnover in human muscle. Am J Physiol Endocrinol Metab, 295: E595–E604, 2008.
Abstract/FREE Full Text
51.
Halliday D., McKeran R.O. Measurement of muscle protein synthetic rate from serial muscle biopsies and total body protein turnover in man by continuous intravenous infusion of l-(α-15N)lysine. ClinSciMolMed, 49: 581–590, 1975.
Medline
52.
Hardie D.G. AMPK: a key regulator of energy balance in the single cell and the whole organism. Int J Obes (Lond), 32, Suppl4: S7–S12, 2008.
53.
Hartman J.W., Tang J.E., Wilkinson S.B., Tarnopolsky M.A., Lawrence R.L., Fullerton A.V., Phillips S.M. Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am J ClinNutr, 86: 373–381, 2007.
Abstract/FREE FullText
54.
Hasten D.L., Pak-Loduca J., Obert K.A., Yarasheski K.E. Resistance exercise acutely increases MHC and mixed muscle protein synthesis rates in 78–84 and 23–32 yr olds. Am J Physiol Endocrinol Metab, 278: E620–E626, 2000.
Abstract/FREE Full Text
55.
Haus J.M., Miller B.F., Carroll C.C., Weinheimer E.M., Trappe T.A. The effect of strenuous aerobic exercise on skeletal muscle myofibrillar proteolysis in humans. Scand J MedSciSports, 17: 260–266, 2007.
Medline
56.
Henderson G.C., Dhatariya K., Ford G.C., Klaus K.A., Basu R., Rizza R.A., Jensen M.D., Khosla S., O’Brien P., Nair K.S. Higher muscle protein synthesis in women than men across the lifespan, and failure of androgen administration to amend age-related decrements. FASEB J, 23: 631–641, 2009.
Abstract/FREE FullText
57.
Hoppeler H. Exercise-induced ultrastructural changes in skeletal muscle. Int J SportsMed, 7: 187–204, 1986.
Medline
58.
Isidori A.M., Giannetta E., Greco E.A., Gianfrilli D., Bonifacio V., Isidori A., Lenzi A., Fabbri A. Effects of testosterone on body composition, bone metabolism and serum lipid profile in middle-aged men: a meta-analysis. ClinEndocrinol (Oxf), 63: 280–293, 2005.
CrossRef Medline
59.
Jahn L.A., Barrett E.J., Genco M.L., Wei L., Spraggins T.A., Fryburg D.A. Tissue composition affects measures of postabsorptive human skeletal muscle metabolism: comparison across genders. J ClinEndocrinolMetab, 84: 1007–1010, 1999.
Abstract/FREE FullText
60.
Jaleel A., Short K.R., Asmann Y.W., Klaus K.A., Morse D.M., Ford G.C., Nair K.S. In vivo measurement of synthesis rate of individual skeletal muscle mitochondrial proteins. Am J Physiol Endocrinol Metab, 295: E1255–E1268, 2008.
Abstract/FREE Full Text
61.
Karlsson H.K., Nilsson P.A., Nilsson J., Chibalin A.V., Zierath J.R., Blomstrand E. Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am J Physiol Endocrinol Metab, 287: E1–E7, 2004.
Abstract/FREE Full Text
62.
Kim P.L., Staron R.S., Phillips S.M. Fasted-state skeletal muscle protein synthesis after resistance exercise is altered with training. J Physiol, 568: 283–290, 2005.
Abstract/FREE FullText
63.
Kimball S.R., Farrell P.A., Jefferson L.S. Invited Review: Role of insulin in translational control of protein synthesis in skeletal muscle by amino acids or exercise. J ApplPhysiol, 93: 1168–1180, 2002.
Abstract/FREE FullText
64.
Koopman R., Wagenmakers A.J., Manders R.J., Zorenc A.H., Senden J.M., Gorselink M., Keizer H.A., van Loon L.J. Combined ingestion of protein and free leucine with carbohydrate increases postexercise muscle protein synthesis in vivo in male subjects. Am J Physiol Endocrinol Metab, 288: E645–E653, 2005.
Abstract/FREE Full Text
65.
Kostek M.C., Chen Y.W., Cuthbertson D.J., Shi R., Fedele M.J., Esser K.A., Rennie M.J. Gene expression responses over 24 h to lengthening and shortening contractions in human muscle: major changes in CSRP3, MUSTN1, SIX1, and FBXO32. PhysiolGenomics, 31: 42–52, 2007.
Abstract/FREE FullText
66.
Kumar V., Selby A., Rankin D., Patel R., Atherton P., Hildebrandt W., Williams J., Smith K., Seynnes O., Hiscock N., Rennie M.J. Age-related differences in the dose-response of muscle protein synthesis to resistance exercise in young and old men. J Physiol, 587: 211–217, 2009.
Abstract/FREE FullText
67.
Levenhagen D.K., Gresham J.D., Carlson M.G., Maron D.J., Borel M.J., Flakoll P.J. Postexercise nutrient intake timing in humans is critical to recovery of leg glucose and protein homeostasis. Am J Physiol Endocrinol Metab, 280: E982–E993, 2001.
Abstract/FREE Full Text
68.
Louard R.J., Barrett E.J., Gelfand R.A. Effect of infused branched-chain amino acids on muscle and whole-body amino acid metabolism in man. ClinSci (Lond), 79: 457–466, 1990.
Medline
69.
Louard R.J., Barrett E.J., Gelfand R.A. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism, 44: 424–429, 1995.
CrossRef Medline
70.
Louis M., Poortmans J.R., Francaux M., Berre J., Boisseau N., Brassine E., Cuthbertson D.J., Smith K., Babraj J.A., Waddell T., Rennie M.J. No effect of creatine supplementation on human myofibrillar and sarcoplasmic protein synthesis after resistance exercise. Am J Physiol Endocrinol Metab, 285: E1089–E1094, 2003.
Abstract/FREE Full Text
71.
MacDougall J.D., Gibala M.J., Tarnopolsky M.A., MacDonald J.R., Interisano S.A., Yarasheski K.E. The time course for elevated muscle protein synthesis following heavy resistance exercise. Can J ApplPhysiol, 20: 480–486, 1995.
Medline
72.
MacLean D.A., Graham T.E., Saltin B. Branched-chain amino acids augment ammonia metabolism while attenuating protein breakdown during exercise. Am J Physiol Endocrinol Metab, 267: E1010–E1022, 1994.
Abstract/FREE Full Text
73.
MacLean D.A., Graham T.E., Saltin B. Stimulation of muscle ammonia production during exercise following branched-chain amino acid supplementation in humans. J Physiol, 493: 909–922, 1996.
Abstract/FREE FullText
74.
Mascher H., Andersson H., Nilsson P.A., Ekblom B., Blomstrand E. Changes in signalling pathways regulating protein synthesis in human muscle in the recovery period after endurance exercise. ActaPhysiol (Oxf), 191: 67–75, 2007.
CrossRef Medline
75.
Miller B.F., Hansen M., Olesen J.L., Flyvbjerg A., Schwarz P., Babraj J.A., Smith K., Rennie M.J., Kjaer M. No effect of menstrual cycle on myofibrillar and connective tissue protein synthesis in contracting skeletal muscle. Am J Physiol Endocrinol Metab, 290: E163–E168, 2006.
Abstract/FREE Full Text
76.
Miller B.F., Olesen J.L., Hansen M., Dossing S., Crameri R.M., Welling R.J., Langberg H., Flyvbjerg A., Kjaer M., Babraj J.A., Smith K., Rennie M.J. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol, 567: 1021–1033, 2005.
Abstract/FREE FullText
77.
Miller S.L., Tipton K.D., Chinkes D.L., Wolf S.E., Wolfe R.R. Independent and combined effects of amino acids and glucose after resistance exercise. MedSciSportsExerc, 35: 449–455, 2003.
CrossRef Medline
78.
Millward D.J., Jackson A.A. Protein/energy ratios of current diets in developed and developing countries compared with a safe protein/energy ratio: implications for recommended protein and amino acid intakes. PublicHealthNutr, 7: 387–405, 2004.
CrossRef Medline
79.
Moore D.R., Phillips S.M., Babraj J.A., Smith K., Rennie M.J. Myofibrillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening contractions. Am J Physiol Endocrinol Metab, 288: E1153–E1159, 2005.
Abstract/FREE Full Text
80.
Moore D.R., Robinson M.J., Fry J.L., Tang J.E., Glover E.I., Wilkinson S.B., Prior T., Tarnopolsky M.A., Phillips S.M. Ingested protein dose-response of muscle and albumin prtoein synthesis after resistance exercise in young men. Am J ClinNutr, 89: 161–168, 2008.
CrossRef Medline
81.
Nair K.S., Jaleel A., Asmann Y.W., Short K.R., Raghavakaimal S. Proteomic research: potential opportunities for clinical and physiological investigators. Am J Physiol Endocrinol Metab, 286: E863–E874, 2004.
Abstract/FREE Full Text
82.
Parise G., Mihic S., MacLennan D., Yarasheski K.E., Tarnopolsky M.A. Effects of acute creatine monohydrate supplementation on leucine kinetics and mixed-muscle protein synthesis. J ApplPhysiol, 91: 1041–1047, 2001.
Abstract/FREE FullText
83.
Parkington J.D., LeBrasseur N.K., Siebert A.P., Fielding R.A. Contraction-mediated mTOR, p70S6k, and ERK1/2 phosphorylation in aged skeletal muscle. J ApplPhysiol, 97: 243–248, 2004.
Abstract/FREE FullText
84.
Phillips S.M., Parise G., Roy B.D., Tipton K.D., Wolfe R.R., Tamopolsky M.A. Resistance-training-induced adaptations in skeletal muscle protein turnover in the fed state. Can J PhysiolPharmacol, 80: 1045–1053, 2002.
CrossRef
Medline
85.
Phillips S.M., Tipton K.D., Aarsland A., Wolf S.E., Wolfe R.R. Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am J Physiol Endocrinol Metab, 273: E99–E107, 1997.
Abstract/FREE Full Text
86.
Phillips S.M., Tipton K.D., Ferrando A.A., Wolfe R.R. Resistance training reduces the acute exercise-induced increase in muscle protein turnover. Am J Physiol Endocrinol Metab, 276: E118–E124, 1999.
Abstract/FREE Full Text
87.
Pikosky M.A., Gaine P.C., Martin W.F., Grabarz K.C., Ferrando A.A., Wolfe R.R., Rodriguez N.R. Aerobic exercise training increases skeletal muscle protein turnover in healthy adults at rest. J Nutr, 136: 379–383, 2006.
Abstract/FREE FullText
88.
Pilegaard H., Richter E.A. PGC-1alpha: important for exercise performance? J ApplPhysiol, 104: 1264–1265, 2008.
FREE FullText
89.
Pilegaard H., Saltin B., Neufer P.D. Exercise induces transient transcriptional activation of the PGC-1alpha gene in human skeletal muscle. J Physiol, 546: 851–858, 2003.
Abstract/FREE FullText
90.
Rasmussen B.B., Tipton K.D., Miller S.L., Wolf S.E., Wolfe R.R. An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J ApplPhysiol, 88: 386–392, 2000.
Abstract/FREE FullText
91.
Raue U., Slivka D., Jemiolo B., Hollon C., Trappe S. Proteolytic gene expression differs at rest and after resistance exercise between young and old women. J Gerontol A Biol Sci Med Sci, 62: 1407–1412, 2007.
Abstract/FREE Full Text
92.
Rennie M.J. An introduction to the use of tracers in nutrition and metabolism.ProcNutrSoc, 58: 935–944, 1999.
Medline
93.
Rennie M.J., Edwards R.H., Davies C.T., Krywawych S., Halliday D., Waterlow J.C., Millward D.J. Protein and amino acid turnover during and after exercise. Biochem Soc Trans, 8: 499–501, 1980.
Medline
94.
Rennie M.J., Edwards R.H., Halliday D., Matthews D.E., Wolman S.L., Millward D.J. Muscle protein synthesis measured by stable isotope techniques in man: the effects of feeding and fasting. ClinSci (Lond), 63: 519–523, 1982.
Medline
95.
Rennie M.J., Phillips S., Smith K. Reliability of results and interpretation of measures of 3-methylhistidine in muscle interstitium as marker of muscle proteolysis. J ApplPhysiol, 105: 1380–1381, 2008.
FREE FullText
96.
Rooyackers O.E., Adey D.B., Ades P.A., Nair K.S. Effect of age on in vivo rates of mitochondrial protein synthesis in human skeletal muscle. ProcNatlAcadSci USA, 93: 15364–15369, 1996.
Abstract/FREE FullText
97.
Rose A.J., Broholm C., Kiillerich K., Finn S.G., Proud C.G., Rider M.H., Richter E.A., Kiens B. Exercise rapidly increases eukaryotic elongation factor 2 phosphorylation in skeletal muscle of men. J Physiol, 569: 223–228, 2005.
Abstract/FREE FullText
98.
Sakamoto K., Arnolds D.E., Ekberg I., Thorell A., Goodyear L.J. Exercise regulates Akt and glycogen synthase kinase-3 activities in human skeletal muscle. BiochemBiophysResCommun, 319: 419–425, 2004.
CrossRef Medline
99.
Sakamoto K., Goodyear L.J. Invited Review: Intracellular signaling in contracting skeletal muscle. J ApplPhysiol, 93: 369–383, 2002.
Abstract/FREE FullText
100.
Sheffield-Moore M., Paddon-Jones D., Sanford A.P., Rosenblatt J.I., Matlock A.G., Cree M.G., Wolfe R.R. Mixed muscle and hepatic derived plasma protein metabolism is differentially regulated in older and younger men following resistance exercise. Am J Physiol Endocrinol Metab, 288: E922–E929, 2005.
Abstract/FREE Full Text
101.
Sheffield-Moore M., Yeckel C.W., Volpi E., Wolf S.E., Morio B., Chinkes D.L., Paddon-Jones D., Wolfe R.R. Postexercise protein metabolism in older and younger men following moderate-intensity aerobic exercise. Am J Physiol Endocrinol Metab, 287: E513–E522, 2004.
Abstract/FREE Full Text
102.
Short K.R., Vittone J.L., Bigelow M.L., Proctor D.N., Nair K.S. Age and aerobic exercise training effects on whole body and muscle protein metabolism. Am J Physiol Endocrinol Metab, 286: E92–E101, 2004.
Abstract/FREE Full Text
103.
Short K.R., Vittone J.L., Bigelow M.L., Proctor D.N., Rizza R.A., Coenen-Schimke J.M., Nair K.S. Impact of aerobic exercise training on age-related changes in insulin sensitivity and muscle oxidative capacity. Diabetes, 52: 1888–1896, 2003.
Abstract/FREE FullText
104.
Smith G., Villareal D., Sinacore D., Shah K., Mittendorfer B. The anabolic response to exercise training is greater in older men than older women. In: APS Intersociety Meeting: The Integrative Biology of Exercise V, September 24–27, 2009, Hilton Head, SC. Bethesda, MD: Am. Physiol. Soc., 2008, p. 17.2.
105.
Smith G.I., Atherton P., Villareal D.T., Frimel T.N., Rankin D., Rennie M.J., Mittendorfer B. Differences in muscle protein synthesis and anabolic signaling in the postabsorptive state and in response to food in 65–80 year old men and women. PLoS ONE3: e1875, 2008.
CrossRef
Medline
106.
Smith K., Barua J.M., Watt P.W., Scrimgeour C.M., Rennie M.J. Flooding with l-[1-13C]leucine stimulates human muscle protein incorporation of continuously infused l-[1-13C]valine. Am J Physiol Endocrinol Metab, 262: E372–E376, 1992.
Abstract/FREE Full Text
107.
Smith K., Rennie M.J. The measurement of tissue protein turnover. BaillieresClinEndocrinolMetab, 10: 469–495, 1996.
CrossRef
Medline
108.
Tang J.E., Manolakos J.J., Kujbida G.W., Lysecki P.J., Moore D.R., Phillips S.M. Minimal whey protein with carbohydrate stimulates muscle protein synthesis following resistance exercise in trained young men. ApplPhysiolNutrMetab, 32: 1132–1138, 2007.
CrossRef
Medline
109.
Tang J.E., Perco J.G., Moore D.R., Wilkinson S.B., Phillips S.M. Resistance training alters the response of fed state mixed muscle protein synthesis in young men. Am J Physiol Regul Integr Comp Physiol, 294: R172–R178, 2008.
Abstract/FREE Full Text
110.
Thomson D.M., Gordon S.E. Diminished overload-induced hypertrophy in aged fast-twitch skeletal muscle is associated with AMPK hyperphosphorylation. J ApplPhysiol, 98: 557–564, 2005.
Abstract/FREE FullText
111.
Tipton K.D., Borsheim E., Wolf S.E., Sanford A.P., Wolfe R.R. Acute response of net muscle protein balance reflects 24-h balance after exercise and amino acid ingestion. Am J Physiol Endocrinol Metab, 284: E76–E89, 2003.
Abstract/FREE Full Text
112.
Tipton K.D., Ferrando A.A., Phillips S.M., Doyle D. Jr., Wolfe R.R. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol Endocrinol Metab, 276: E628–E634, 1999.
Abstract/FREE Full Text
113.
Tipton K.D., Ferrando A.A., Williams B.D., Wolfe R.R. Muscle protein metabolism in female swimmers after a combination of resistance and endurance exercise. J ApplPhysiol, 81: 2034–2038, 1996.
Abstract/FREE FullText
114.
Tipton K.D., Rasmussen B.B., Miller S.L., Wolf S.E., Owens-Stovall S.K., Petrini B.E., Wolfe R.R. Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am J Physiol Endocrinol Metab, 281: E197–E206, 2001.
Abstract/FREE Full Text
115.
Toth M.J., Poehlman E.T., Matthews D.E., Tchernof A., MacCoss M.J. Effects of estradiol and progesterone on body composition, protein synthesis, and lipoprotein lipase in rats. Am J Physiol Endocrinol Metab, 280: E496–E501, 2001.
Abstract/FREE Full Text
116.
Urban R.J., Bodenburg Y.H., Gilkison C., Foxworth J., Coggan A.R., Wolfe R.R., Ferrando A. Testosterone administration to elderly men increases skeletal muscle strength and protein synthesis. Am J Physiol Endocrinol Metab, 269: E820–E826, 1995.
Abstract/FREE Full Text
117.
Volpi E., Ferrando A.A., Yeckel C.W., Tipton K.D., Wolfe R.R. Exogenous amino acids stimulate net muscle protein synthesis in the elderly. J ClinInvest, 101: 2000–2007, 1998.
Medline
118.
Volpi E., Mittendorfer B., Rasmussen B.B., Wolfe R.R. The response of muscle protein anabolism to combined hyperaminoacidemia and glucose-induced hyperinsulinemia is impaired in the elderly. J ClinEndocrinolMetab, 85: 4481–4490, 2000.
Abstract/FREE FullText
119.
Volpi E., Sheffield-Moore M., Rasmussen B.B., Wolfe R.R. Basal muscle amino acid kinetics and protein synthesis in healthy young and older men. JAMA, 286: 1206–1212, 2001.
Abstract/FREE FullText
120.
Wagenmakers A.J. Tracers to investigate protein and amino acid metabolism in human subjects. ProcNutrSoc, 58: 987–1000, 1999.
Medline
121.
Welle S., Thornton C., Jozefowicz R., Statt M. Myofibrillar protein synthesis in young and old men. Am J Physiol Endocrinol Metab, 264: E693–E698, 1993.
Abstract/FREE Full Text
122.
Wilkes E., Selby A., Patel R., Rankin D., Smith K., Rennie M. Blunting of insulin-mediated proteolysis in leg muscle of elderly subjects may contribute to age-related sarcopenia (Abstract). ProcNutrSociety, 67 (OCE5): E153, 2008.
CrossRef
123.
Wilkinson S.B., Phillips S.M., Atherton P.J., Patel R., Yarasheski K.E., Tarnopolsky M.A., Rennie M.J. Differential effects of resistance and endurance exercise in the fed state on signaling molecule phosphorylation and protein synthesis in human muscle. J Physiol, 586: 3701–3717, 2008.
Abstract/FREE FullText
124.
Wilkinson S.B., Tarnopolsky M.A., Macdonald M.J., MacDonald J.R., Armstrong D., Phillips S.M. Consumption of fluid skim milk promotes greater muscle protein accretion after resistance exercise than does consumption of an isonitrogenous and isoenergetic soy-protein beverage. Am J ClinNutr, 85: 1031–1040, 2007.
Abstract/FREE FullText
125.
Williamson D.L., Kubica N., Kimball S.R., Jefferson L.S. Exercise-induced alterations in extracellular signal-regulated kinase 1/2 and mammalian target of rapamycin (mTOR) signalling to regulatory mechanisms of mRNA translation in mouse muscle. J Physiol, 573: 497–510, 2006.
Abstract/FREE FullText
126.
Yang Y., Creer A., Jemiolo B., Trappe S. Time course of myogenic and metabolic gene expression in response to acute exercise in human skeletal muscle. J ApplPhysiol, 98: 1745–1752, 2005.
Abstract/FREE FullText
127.
Yarasheski K.E. Exercise, aging, and muscle protein metabolism. J Gerontol A Biol Sci Med Sci, 58: M918–M922, 2003.
Abstract/FREE FullText
128.
Yarasheski K.E., Campbell J.A., Smith K., Rennie M.J., Holloszy J.O., Bier D.M. Effect of growth hormone and resistance exercise on muscle growth in young men. Am J Physiol Endocrinol Metab, 262: E261–E267, 1992.
Abstract/FREE Full Text
129.
Yarasheski K.E., Pak-Loduca J., Hasten D.L., Obert K.A., Brown M.B., Sinacore D.R. Resistance exercise training increases mixed muscle protein synthesis rate in frail women and men ≥76 yr old. Am J Physiol Endocrinol Metab, 277: E118–E125, 1999.
Abstract/FREE Full Text
130.
Yarasheski K.E., Smith K., Rennie M.J., Bier D.M. Measurement of muscle protein fractional synthetic rate by capillary gas chromatography/combustion isotope ratio mass spectrometry. BiolMassSpectrom, 21: 486–490, 1992.
CrossRef
Medline
131.
Yarasheski K.E., Zachwieja J.J., Bier D.M. Acute effects of resistance exercise on muscle protein synthesis rate in young and elderly men and women. Am J Physiol Endocrinol Metab, 265: E210–E214, 1993.
Abstract/FREE Full Text
132.
Zhang X.J., Chinkes D.L., Wolfe R.R. Measurement of muscle protein fractional synthesis and breakdown rates from a pulse tracer injection. Am J Physiol Endocrinol Metab, 283: E753–E764, 2002.
Abstract/FREE Full Text
Показать еще
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
Единственной формой углеводов, которая может всасываться в кишечнике, являются моносахара. Они всасываются главным образом в тонкой кишке, током крови переносятся в печень и к тканям. Основная часть поступающей с пищей глюкозы (около 70%) окисляется в тканях до воды и углекислого газа, около 25—28% пищевой глюкозы превращается в жир и только 2—5% ее синтезируется в гликоген. Гликоген печени представляет собой основной резерв углеводов в организме, достигая по своей массе у взрослого человека 150—200 г. Синтез гликогена происходит достаточно быстро, что, наряду с быстрой мобилизацией гликогена и поступлением глюкозы в кровь в процессе гликогенолиза, является одним из механизмов поддержания гликемии в константных пределах. Помимо печени в качестве депо гликогена выступают также мышцы. Однако запас гликогена в мышечной массе по отношению к всему гликогену организма составляет всего 1 — 2%. В мышцах под влиянием фермента фосфорилазы, которая активируется в начале мышечного сокращения, происходит усиленное расщепление гликогена, являющегося одним из источников энергии мышечного сокращения. При распаде мышечного гликогена процесс идет до образования пировиноградной и молочной кислот. Этот процесс называют гликолизом. В фазе отдыха из молочной кислоты в мышечной ткани происходит ресинтез гликогена.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
Характерной особенностью белкового обмена является его чрезвычайная разветвленность. Достаточно указать, что в обмене 20 аминокислот, входящих в состав белковых молекул, в организме животных участвуют сотни промежуточных метаболитов, тесно связанных с обменом углеводов и липидов. Число ферментов, катализирующих химические реакции азотистого обмена, также исчисляется сотнями. Собственно белки (протеины и протеиды), высокомолекулярные соединения, построенные из мономеров — аминокислот, занимают ведущее место среди органических элементов организма, составляя более 50 % сухой массы клетки. Как известно, белки в организме выполняют ряд важнейших биологических функций, а именно:
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
В организме постоянно происходит распад и синтез белков. Единственным источником синтеза нового белка являются белки пищи. В пищеварительном тракте белки ферментативно расщепляются ферментами до аминокислот и абсорбируются в тонкой кишке. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30 — 50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) — активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Перенос через щеточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+-зависимых механизмов симпорта, подобно переносу глюкозы.
Из аминокислот и простейших пептидов клетки тканей синтезируют собственный белок, который характерен только для данного организма. Белки не могут быть заменены другими пищевыми веществами, так как их синтез в организме возможен только из аминокислот. Вместе с тем белок может замещать собой жиры и углеводы, то есть использоваться для синтеза этих соединений. В тканях постоянно протекают процессы распада белка с последующим выделением из организма неиспользованных продуктов белкового обмена и параллельно с этим — синтез белков. Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы результате реакций трансаминирования и дезаминирования. Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных — глутамат, аланин, аспартат и соответствующие им кетокислоты — α—кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат. Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование — заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование — первая стадия дезаминирования большинства аминокислот, то есть начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется. В свою очередь дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение — мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования.
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Белки организма находятся в динамическом состоянии: из-за непрерывного процесса их разрушения и образования происходит обновление белков, скорость которого неодинакова для различных тканей. С наибольшей скоростью обновляются белки печени, слизистой оболочки кишечника, а также других внутренних органов и плазмы крови. Медленнее обновляются белки, входящие в состав клеток мозга, сердца, половых желез и еще медленнее — белки мышц, кожи и особенно опорных тканей (сухожилий, костей и хрящей). Важнейшими азотистыми продуктами распада белков, которые выделяются с мочой и потом, являются мочевина, мочевая кислота и аммиак. Преобладание в организме в данный момент времени синтеза или распада белка отражается понятием азотистого баланса — разностью между количеством азота, содержащегося в пище человека, и его уровнем в выделениях. Азотистым равновесием называют состояние, при котором количество выведенного азота равно количеству поступившего в организм. Азотистое равновесие наблюдается у здорового взрослого человека, если минимальное количество белков в пище соответствует 30-50 г/сут. Оптимальное количество поступления белка с пищей при средней физической нагрузке составляет около 100-120 г/сут. При положительном азотистом балансе количество азота в выделениях организма значительно меньше, чем содержание его в пище, то есть наблюдается задержка азота в организме. Положительный азотистый баланс отмечается у детей в связи с усиленным ростом, у женщин во время беременности, при усиленной спортивной тренировке, приводящей к увеличению мышечной массы, при заживлении обширных ран и при разрешении патологического процесса, связанного с выраженными системными нарушениями. Отрицательный азотистый баланс отмечается тогда, когда количество выделяющегося азота больше содержания его в пище, поступающей в организм. Отрицательный азотистый баланс наблюдается при белковом голодании, лихорадочных состояниях, нарушениях нейроэндокринной регуляции белкового обмена.
Некоторые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей в готовом виде. Эти аминокислоты принято называть незаменимыми, или эссенциальными. Экспериментально установлено, что из 20 входящих в состав белков аминокислот 12 синтезируются в организме (заменимые аминокислоты), а 8 не синтезируются (незаменимые аминокислоты) . К незаменимым аминоксилотам относятся: валин, метионин, треонин, лейцин, изолейцин, фенилаланин, триптофан и лизин. Две аминокислоты — аргинин и гистидин — у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты — тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина. Белки, содержащие весь необходимый набор аминокислот, называют биологически полноценными (табл. 1. 1. ). Наиболее высока биологическая ценность белков молока, яиц, рыбы, мяса. Биологически неполноценными называют белки, в составе которых отсутствует хотя бы одна аминокислота, которая не может быть синтезирована в организме. Неполноценными белками являются белки кукурузы, пшеницы, ячменя.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
|
1. Незаменимые Валин Лейцин Изолейцин Треонин Метионин Фенилаланин Триптофан Лизин |
2. Частично заменимые Гистидин Аргинин 3. Условно заменимые Цистеин Тирозин |
4. Заменимые Аланин Аспарагиновая кислота Аспарагин Глутаминовая кислота Глутамин Пролин Глицин Серин |
Жиры (липиды) по своей химической структуре представляют собой триглицериды — сложные эфиры глицерина и жирных кислот (табл. 1. 2). Изначально эти соединения были объединены в одну химическую группу по общему признаку растворимости: они не растворяются в воде, но растворяются в органических растворителях (эфир, спирт, бензол). Жиры делят на простые липиды (нейтральные жиры, воски), сложные липиды (фосфолипиды, гликолипиды, сульфолипиды) и стероиды (холестерин). Основная масса липидов представлена в организме человека нейтральными жирами — триглицеридами олеиновой, пальмитиновой, стеариновой, линолевой и линоленовой жирных кислот.
Таблица 1. 2. Классификация липидов организма человека.
|
1. Гликолипиды. |
Содержат углеводный компонент. |
|
2. Жиры. |
Эфиры глицерина и высших жирных кислот. Химическое название — ацилглицерины. Преобладают триацилглицерины. |
|
3. Минорные липиды. |
Свободные жирные кислоты, жирорастворимые витамины, биологически активные вещества липидной природы — простагландины и др. |
|
4. Стероиды. |
В основе строения — полициклическая структура циклопентанпергидрофенантрен-стеран. |
|
А. Стерины (спирты). |
Наиболее важен холестерин. |
|
В. Стериды. |
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина. |
|
5. Фосфолипипы. |
Отличительная особенность — остаток фосфорной кислоты в составе молекулы. |
Жиры растительного и животного происхождения имеют различный состав жирных кислот, определяющий их физические свойства и физиолого-биохимические эффекты. Жирные кислоты подразделяются на два основных класса — насыщенные и ненасыщенные. Насыщенность жира определяется количеством атомов водорода, которое содержит каждая жирная кислота (или, иначе, количеством двойных связей С=С). Жирные кислоты со средней длиной цепи (С8-С14) способны усваиваться в пищеварительном тракте без участия желчных кислот и панкреатической липазы, не депонируются в печени и подвергаются β-окислению. Животные жиры могут содержать насыщенные жирные кислоты с длиной цепи до двадцати и более атомов углерода, они имеют твердую консистенцию и высокую температуру плавления. Как известно высокое потребление насыщенных жирных кислот является важнейшим фактором риска развития диабета, ожирения, атеросклероза. К мононенасыщенным жирным кислотам относятся миристолеиновая и пальмитолеиновая кислоты (жиры рыб и морских млекопитающих), олеиновая (оливковое, сафлоровое, кунжутное, рапсовое масла). Мононенасыщенные жирные кислоты помимо их поступления с пищей в организме синтезируются из насыщенных жирных кислот и частично из углеводов. Жирные кислоты с двумя и более двойными связями между углеродными атомами называются полиненасыщенными – ПНЖК. Особое значение для организма человека имеют такие ПНЖК как линолевая, линоленовая, являющиеся структурными элементами клеточных мембран и обеспечивающие нормальное развитие и адаптацию организма человека к неблагоприятным факторам окружающей среды. ПНЖК являются предшественниками образующихся из них биорегуляторов – эйкозаноидов. Двумя основными группами ПНЖК являются кислоты семейств ω-6 и ω-3. Жирные кислоты ω-6 содержатся практически во всех растительных маслах и орехах. ω-3 жирные кислоты также содержатся в ряде масел (льняном, из семян крестоцветных, соевом). Основным пищевым источником ω-3 жирных кислот являются жирные сорта рыб и некоторые морепродукты. Из ПНЖК ω — 6 особое место занимает линолевая кислота, которая является предшественником наиболее физиологически активной кислоты этого семейства — арахидоновой. Арахидоновая кислота является преобладающим представителем ПНЖК в организме человека и служит субстратом для синтеза простагландинов и лейкотриенов.
Источниками жира в организме являются экзогенный жир, поступающий с пищей, и эндогенный жир, синтезируемый в печени из углеводов. Жир, всасывающийся из кишечника, поступает преимущественно в лимфу и в меньшем количестве — непосредственно в кровь. Большая часть жиров в организме находится в жировой ткани, меньшая часть входит в состав клеточных структур. В жировой ткани жир, находящийся в клетке в виде включений, легко выявляется при микроскопическом и гистохимическом исследованиях. Жировые вакуоли в клетках — это резервный жир, используемый для обеспечения прежде всего энергетических потребностей клетки. Больше всего запасного жира содержится в жировой ткани, а также в некоторых органах, например в печени и мышцах. Количество запасного жира зависит от характера питания, количества пищи, конституциональных особенностей, а также от величины расхода энергии при мышечной деятельности; количество же протоплазматического жира является устойчивым и постоянным. В жировой ткани нейтральный жир депонируется виде триглицеридов. Сложные липиды — фосфолипиды и гликолипиды — входят в состав всех клеток, но в большей степени в состав клеток нервной ткани. Общее количество жира в организме человека колеблется в широких пределах и в среднем составляет 10—20% от массы тела, а в случае патологического ожирения может достигать 50%. Суточная потребность взрослого человека в нейтральном жире составляет 70—80 г. У человека состав и свойства жира относительно постоянны. При употреблении пищи, содержащей даже небольшое количество жира, в теле человека жир все же откладывается в депо. При этом эндогенный жир имеет некоторые видовые особенности, однако видовая специфичность жиров выражена несравнимо меньше, чем видовая специфичность белков.
Основная биологическая роль жиров — обеспечение пластического и энергетического обмена в организме. Пластическая роль липидов состоит в том, что они входят в состав клеточных мембран, в значительной мере определяя их свойства. Фосфатиды и стерины входят в состав клеточных структур, в частности клеточных мембран, а также ядерного вещества и цитоплазмы. Исключительно важное физиологическое значение имеют стерины, в частности холестерин. Это вещество входит в состав клеточных мембран, является источником образования желчных кислот, а также гормонов коры надпочечников и половых желез, витамина D. Печень является практически единственным органом, поддерживающим уровень фосфолипидов в крови и местом синтеза эндогенного холестерина. В плазме крови холестерин находится в составе липопротеидных комплексов, с помощью которых и осуществляется его транспорт. У взрослых людей 67—70% холестерина плазмы крови находится в составе липопротеидов низкой плотности (ЛПНП), 9—10% — в составе липопротеидов очень низкой плотности (ЛПОНП) и 20—24% — в составе липопротеидов высокой плотности (ЛПВП). Давно доказано, что именно липопротеиды определяют уровень холестерина и динамику его обмена.
Энергетическая роль жиров определяется их максимальной среди всех биологических молекул энергоемкостью, более чем в два раза превышающую таковую углеводов или белков. При окислении 1 г жира выделяется 37, 7 кДж (9, 0 ккал) энергии. В отличие от углеводов жиры составляют энергетический резерв организма. Преимущество жира в качестве энергетического резерва заключается в том, что жиры являются более восстановленными веществами по сравнению с углеводами (в молекулах углеводов при каждом углеродном атоме есть кислород — группы -CHOH-; у жира имеются длинные углеводородные радикалы, в которых преобладают группы -CH2- — в них нет кислорода). От жира можно отнять больше водорода, который затем проходит по цепи митохондриального окисления с образованием АТФ. Еще одним преимуществом жира как энергетического резерва, в отличие от углеводов, является гидрофобность — он не связан с водой. Это обеспечивает компактность жировых запасов — они хранятся в безводной форме, занимая малый объем. В среднем, у человека запас чистых триацилглицеринов составляет примерно 13 кг. Этих запасов могло бы хватить на 40 дней голодания в условиях умеренной физической нагрузки. Для сравнения: общие запасы гликогена в организме — примерно 400 г; при голодании этого количества не хватает даже на одни сутки.
Катаболизм жира включает в себя три этапа: 1) гидролиз жира до глицерина и жирных кислот (липолиз) ; 2) трансформация глицерина с последующим вступлением продуктов в гексозобифосфатный путь, а также окисление жирных кислот до ацетил-КоА; 3) вступление вышеуказанных продуктов в цикл трикарбоновых кислот. Кроме указанных этапов к катаболизму жиров относят также окисление кетоновых тел и перекисное окисление липидов. Обмен полученного в результате липолиза глицерина может осуществляться несколькими путями. Значительная часть образовавшегося при гидролизе липидов глицерина используется для ресинтеза триглицеридов. Второй путь обмена глицерина — включение продукта его окисления в гликолиз или в глюконеогенез. Окисление жирных кислот осуществляется различными путями, наиболее значимым из них является β-окисление. В ходе β-окисления последовательно происходит активация жирной кислоты на мембране митохондрии и ее связывание с молекулой карнитина, прохождение комплекса нв внутреннюю поверхность мембраны митохондрии, внутримитохондриальное окисление жирной кислоты с образованием ацетил-КоА и АТФ.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
При обильном углеводном питании и отсутствии жиров в пище синтез жира в организме может происходить из углеводов. Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде. В норме у человека 25—30% углеводов пищи превращается в жиры. Превращение белка в жирные кислоты происходит, вероятнее всего, также через образование углеводов. С другой стороны и нейтральные жиры в энергетическом отношении могут быть заменены углеводами. Тем не менее жиры необходимы для нормальной жизнедеятельности. Известно, что длительное исключение жиров из пищевого рациона может явиться причиной возникновения целого ряда тяжелых метаболических нарушений. Отчасти это связано с отсутствием поступления в организм жирорастворимых витаминов (A, D, E, K). Но основная причина метаболических нарушений кроется в возникновении в организме дефицита незаменимых жирных кислот. Некоторые ненасыщенные жирные кислоты (с числом двойных связей более 1), например линолевая, линоленовая и арахидоновая, в организме человека и некоторых животных не образуются из других жирных кислот и поэтому являются незаменимыми. Особенно остро реагирует организм на дефицит незаменимой линолевой кислоты СН3- (СН2) 4 — СН = СН — СН2 — СН = СН — (СН2) 7 — СООН. Возможно это связано с тем, что эта ненасыщенная жирная кислота в организме человека служит предшественником арахидоновой кислоты, которая в свою очередь необходима для синтеза универсальных биорегуляторов — простагландинов. Основными пищевыми источниками полиненасыщенных жирных кислот, в том числе линолевой, являются растительные масла.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
31 мая 2016 г.