-
Наибольшее
повышение концентрации лактата в крови
отмечается при выполнении нагрузок в
зоне (субмаксимальной мощности) -
Основной
источник энергии при марафонском беге
(тканевое дыхание) -
Максимальное
потребление кислорода (МПК) у хорошо
тренированных спортсменов составляет
(6-7 л/мин) -
Максимальное
повышение кислотности наблюдается при
выполнении физических нагрузок
(лактатных) -
Быстрое
исчерпание запасов креатинфосфата в
мышцах наблюдается при выполнении
нагрузок в зоне (максимальной мощности) -
Увеличение
скорости реакции катаболизма во время
выполнения физических нагрузок
преимущественно вызывают гармоны
(катехоламины) -
Максимальное
повышение кислотности наблюдается при
беге на (1000 м) -
Основной
причиной закисления крови во время
тренировки является повышение в ней
концентрации (лактата) -
Предстартовую
гипергликемию вызывает гормон (адреналин) -
Силовые
качества преимущественно зависят от
содержания в мышцах (миофибрилл) -
Снижение
скорости реакции анаболизма во время
выполнения физических нагрузок
преимущественно вызывают гармоны
(кортикостероиды) -
Дольше всего максимальная скорость сохраняется у (тканевого дыхания)
-
Кетоновые
тела являются основным источником
энергии при беге на 10000м -
Для
предстартового состояния характерно
(повышение концентрации глюкозы в
крови) -
Наиболее
интенсивный распад мышечных белков
наблюдается при выполнении (силовых
нагрузках) -
Распад
гликогена в мышцах ускоряет гормон
(адреналин) -
Во
время физической работы синтез мышечных
белков замедляет гормон (кортикостерон) -
Силовые
нагрузки в первую очередь вызывают
повреждение в миоцитах (миофибрилл) -
Интенсивность
аэробных нагрузок преимущественно
зависит от содержания в мышцах
(митохондрий) -
Основной
источник энергии при выполнении очень
продолжительных нагрузок (кетоновые
тела) -
После
выполнения гликолитических нагрузок
pH
крови может иметь величину (7,1-7,2) -
Увеличение
энергообеспечения мышц во время
выполнения физических нагрузок
преимущественно вызывают гормоны
(катехоламины) -
При
выполнении алактатных нагрузок в мышцах
в первую очередь исчерпываются запасы
(креатинфосфата) -
увеличение
энергоснабжения мышц во время работы
называется гормоном (адреналином)
Глава 17
-
Основной
причиной утомления при беге на 10 000
м. является: Снижение в мышцах скорости
тканевого дыхания -
Максимальное
повышение кислотности наблюдается при
выполнении нагрузок: Лактатных -
Основной
причиной утомления при работе в зоне
максимальной мощности является: Снижение
в мышцах концентрации креатинфосфата -
Быстрое
исчерпание запасов креатинфосфата в
мышцах наблюдается при выполнении
нагрузок в зоне: Максимальной мощности -
Под
состоянием утомления понимают временное
снижение: Работоспособности -
Основной
причиной утомления при работе в зоне
умеренной мощности является: Снижение
в мышцах скорости тканевого дыхания -
Накопление
в крови молочной кислоты является
основной причиной утомления при работе
в зоне: Субмаксимальной мощности -
Основной
причиной утомления при выполнении
алактатных нагрузок является: Снижение
в мышцах концентрации креатинфосфата -
Максимальное
повышение кислотности наблюдается при
беге на: 1000 м -
Исчерпание
запасов креатинфосфата в мышцах является
основной причиной утомления при беге
на: 100 м -
Основной
причиной закисления крови во время
тренировки является повышение в ней
концентрации: Лактата -
Предельная
продолжительность выполнения алактатных
нагрузок: 15-20 сек -
Основной причиной
утомления при беге на 1000 м является:
Накопление в крови молочной кислоты -
Наиболее
интенсивный распад мышечных белков
наблюдается при выполнении: Силовых
нагрузок -
Основной
причиной утомления при марафонском
беге является: Снижение в мышцах
тканевого дыхания -
Одной
из причин повышения скорости
свободнорадикального окисления во
время мышечной работы является:
Повышенное поступление кислорода в
организм
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Синтез и распад белка в скелетных мышцах человека во время и после упражнений

Авторы: Vinod Kumar, Philip Atherton, Kenneth Smith, Michael J. Rennie.
Перевод — Сергей Струков.
Скелетные мышцы демонстрируют удивительную пластичность в ответ на изменения типа, продолжительности и интенсивности нагрузки, которые могут вызвать гипертрофию или атрофию, ограниченную гиперплазию и дифференциальную экспрессию множества белков и даже целых органелл, таких как митохондрии, с результирующими изменениями метаболизма субстратов и белков. С целью лучшего описания упражнения традиционно подразделяются на «аэробные / на выносливость» и «с отягощением (силовые)». Основное видимое отличие упражнений на выносливость (то есть повторяющихся низкоинтенсивных сокращений, которые могут выполняться продолжительное время) – смещение фенотипа в сторону возрастания количества волокон с более высокими окислительными способностями, в то время как повторные упражнения с отягощением (представляющие собой сокращения высокой интенсивности) вызывают гипертрофию волокон (и, вероятно, некоторую гиперплазию вследствие активации клеток-сателлитов). В реальности присутствует существенное «перекрытие» между вариантами ответов, это происходит вследствие восприятия и распределения мышцей сигналов в ответ на активность, которые приводят к постоянной адаптации к специфичной природе, интенсивности и продолжительности упражнений. В предлагаемом обзоре упражнения будут разделяться на «резистивные» (с дополнительным отягощением) и «нерезистивные» (без отягощения)…
…Целью обзора является описание регуляции обмена мышечных белков у человека во время и после упражнения, влияния на него факторов окружающей среды, таких как тип нутриентов, состав и уровень потребления, а также полового диморфизма и возраста. В обзоре представлены следующие темы:
- методики изучения обмена в мышцах человека;
- упражнения и общий мышечный белковый баланс;
- синтез мышечного протеина (СМП) и упражнения с отягощением (во время и после упражнения);
- СМП в упражнениях без отягощения (во время и после);
- распад мышечного протеина (РМП) и упражнения (во время и после упражнений с отягощениями и без них);
- влияние пищи (и синергия с упражнениями) на обмен мышечных белков;
- влияние продолжительной тренировки на метаболизм мышечных белков;
- пол и упражнения;
- старение и упражнения.
Мы включили в обзор три таблицы, в которых суммированы наиболее исчерпывающие исследования в данной области, проведенные в последние два-три десятилетия, освещающие специфичные переменные: возраст и пол, тип выполняемых упражнений, нутрициональные манипуляции, а также изменения в синтезе и распаде белков, позволяющие читателю ознакомиться с работами в данной области. Мы также включили рисунок, схематически отображающий основные клеточные сигнальные пути, вовлеченные в регуляцию синтеза мышечного белка в ответ на упражнения и прием пищи, – так, где возможно, мы кратко опишем связанные с этим изменения активности регуляторных путей как итог изменений их статуса фосфорилирования.
Мы ограничимся явлениями, происходящими в течение минут и часов (реже дней, исключительно для эффектов тренировки) во время или после упражнения. Изменения во время упражнения отражают активацию метаболических приоритетов в направлении переноса энергии для мышечной работы при множественных изменениях, таких как ингибирование синтеза белка, увеличение трансаминирования и окисления аминокислот – скорее сопровождающее явление, нежели специфическая функциональная адаптация в ответ на упражнения. Изменения в обмене мышечного белка в период после упражнений больше отражает приспособительное ремоделирование (например, увеличение синтеза группы миофибриллярных протеинов, ведущей к гипертрофии). Мы не будем обсуждать изменения в уровнях транскрипции генов.
Упражнения и общий баланс белка в мышцах
Мышечная масса поддерживается путем регулирования баланса между СМП и РМП. Общее увеличение мышечной массы возможно только в случае, если СМП превышает РМП, то есть при положительном белковом балансе, и наоборот. Во время отдыха в состоянии голода (правильнее называть постабсорбтивное состояние) общий баланс белка отрицательный, а позитивный баланс обычно наблюдается только, когда во время еды восполняются потери мышечного белка, поддерживая стабильную массу мышц. После упражнений в состоянии голода, независимо от увеличения СМП (см. ниже), общий баланс белка становится даже более негативным, не достигая положительных величин, так как уровень РМП, повышенный перед упражнениями, также повышается (13). Тем не менее, когда протеин или аминокислоты потребляются после тренировки, общий баланс белка становится положительным, так как СМП подавляет РМП, который может быть пониженным сам по себе (111).
СМП и упражнения с отягощениями
Во время упражнений
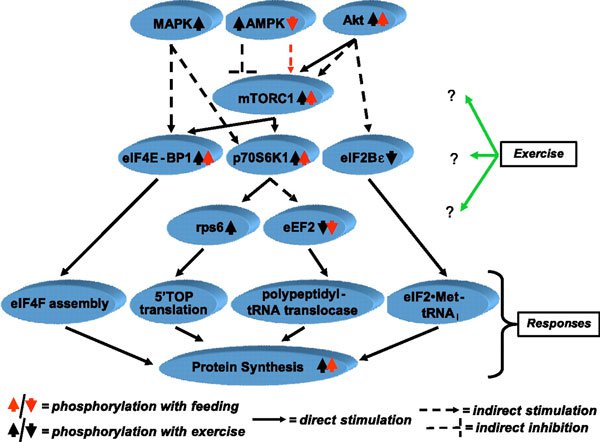
Измерения СМП человека, сделанные во время выполнения упражнений с отягощениями, редки, так как большинство исследований применяют тренировку короче минимального периода времени (около часа), которое требуется современным методикам для оценки проявления строгих изменений меченных стабильных изотопов. Также упражнения прерывистые, используются подходы повторяющихся сокращений, разделенные периодами отдыха, при которых мышца не пребывает в состоянии покоя, что усложняет интерпретацию полученных данных, особенно при методе, основанном на A-V пробах и кровотоке. Данные исследований мышц грызунов (24) и людей (37, 43) показывают угнетение СМП во время упражнений с отягощением. В то же время в работах, использовавших метод растворенных A-V меток, не увеличивался уровень поглощения меток, то есть синтез белка в мышцах ног не изменялся (39). Противоречие между ранними исследованиями (37) и более поздними данными (39), возможно, вызвано методологическими различиями (использование метода прямого включения против метода растворенных меток A-V) или является результатом различий в объеме выполненной работы. Обнаруженное резкое понижение СМП вызвано сокращением этапов инициации и элонгации при трансляции мРНК (63) из-за уменьшения фосфорилирования связывающего белка 4Е 1 (4ЕВР-1), эффектора, запускаемого мишенью рапамицина млекопитающих (mTOR), и тенденции к увеличению фосфорилирования фактора элонгации эукариотов 2 (eEF2) – отрицательного регулятора элонгации пептидной цепи (37) (рис. 1).
Рис. 1. МАРК – митогенактивированная протеинкиназа; АМРК – АМФ-активированная протеинкиназа; Akt – протеинкиназа В; mTORC1 – мишень рапамицина млекопитающих С1; eIF4E-BP1, eIF2Bε, eIF4F и eIF2: белок, связывающий фактор инициации эукариотов 4Е, 2Bε, 4Fb 2; p70S6K1 – 70-кДа S6 протеинкиназа 1; rps6 – рибосомный протеин s6; eEF2 – фактор элонгации эукариот 2; 5’TOP, 5-терминальный олигопиримидин; tRNAi – инициатор тРНК.
Bylund-Fellenius и коллеги (24) наблюдали вызванные сокращением понижение СМП в перфузированной электростимулированной мышце крысы, активность АТФ миозина вызвала повышение коэффициента АМФ/АТФ, вследствие чего, вероятно, оказывается стимулирующее воздействие на активность АМФ-активированной протеинкиназы (АМРК) (52), что вызывает ингибирование сигнальных эффектов комплекса туберозного склероза 2 на mTOR и уменьшает фосфорилирование 4ЕВР-1 (18). Активность АМРК действительно повышается на >30 % после выполнения упражнений с отягощением (37), но важность ингибирования mTOR при выполнении упражнений не определена, так, синтез белка повышается после выполнения упражнений независимо от продолжающегося повышения фосфорилирования АМРК (37).
Недавние работы также продемонстрировали эффективность предварительного потребления аминокислот на СМП во время упражнения. После ночного голодания испытуемые приняли 0,35 г/кг сухой массы тела незаменимых аминокислот и 0,5 г/кг сухой массы тела сахарозы за час до упражнений (10 х 10, 70 % РМ). СМП понизился во время выполнения упражнений, но не ниже исходного уровня, наблюдаемого в контрольной, не потреблявшей добавок группе (43). Подобным образом прием белка перед и во время 2-часовой прерывающейся тренировки с отягощениями, включающей упражнения для всего тела, повышал общий белковый баланс и СМП во время выполнения упражнений (7).
После упражнений
Общепринято, что упражнения с отягощениями вызывают увеличение СМП в восстановительном периоде (29, 71, 131). Действительно, тренировка с отягощением может увеличивать уровень СМП после упражнений в 2–5 раз, и этот эффект наблюдается более 48 часов у сытых субъектов (85). В других сообщениях (37, 100) обнаруживали угнетение СМП непосредственно после напряженной сократительной активности. В нашей лаборатории обычно наблюдаемые изменения не превышали исходные при оценке включения меток в белки первые 1–1,5 часа (66), тогда как другие этого не делали (37, 100), тем не менее большинство оценивающих исследователей свидетельствуют, что любое повышение после упражнения меньше вначале и увеличивается впоследствии (38, 66). Стимуляция синтеза белка у нетренированных людей после упражнений с отягощениями происходит в митохондриальном и миофибриллярном пулах (123). Более того, мы недавно исследовали влияние тренировки с отягощением на СМП в широком диапазоне интенсивности упражнений: от 20 до 90 % РМ при эквивалентной общей работе (1620–1800 единиц) в постабсорбтивном состоянии у молодых (24 ± 6 лет) и пожилых (70 ± 5 лет) мужчин в течение 4 часов после окончания занятия (66). Результаты показывают, что величина синтеза миофибриллярных белков зависит от интенсивности, увеличиваясь от 20 %, и достигает плато между 60 и 90 % РМ. Требуются дополнительные исследования для выяснения влияния объема работы и адаптивного ответа обмена мышечного белка при различной интенсивности нагрузки.
Молекулярный механизм стимулирующего эффекта упражнений с отягощением интенсивно изучался в последние годы – сначала на грызунах (2, 4, 19), а когда усовершенствовалась аналитическая техника – на человеческих мышцах (1, 34, 36, 37, 61, 66). Доступные в настоящее время данные, наиболее точно описывающие сигнальные пути во время и непосредственно после упражнений в состоянии голода и насыщения, представлены на рис. 1. Детальное описание активации процессов фосфорилирования или активности сигнальных молекул, регулирующих клеточный СМП в ответ на упражнения с отягощением, выходит за рамки настоящего обзора. Вкратце активация сигнальных молекул, регулирующих трансляцию и синтез белка, таких как Akt (протеинкиназа В), митогенактивируемая протеинкиназа, mTOR и его эффекторы, такие как эукариотический фактор инициации 4EBP-1, p70S6k1 (70-кДа протеинкиназаS6) и рибосомная протеинкиназа s6, связаны с увеличением СМП в период после упражнения (1, 36, 37. 61, 66). Тем не менее, необходимо выяснить временную зависимость и продолжительность этих ответов, а также дозозависимые характеристики, как и потенциальную роль в адаптивном ответе мышц на однократные и хронические упражнения.
В отношении клеточных сигнальных путей мы полагаем, что в настоящее время у нас нет точного понимания связи между изменениями в сигналах и СМП или РМП. В частности, непонятно, действует ли молекула как простой переключатель сигнального пути или как усилитель, модулирующий результирующую метаболическую реакцию. Данные исследований действия инсулина на мышцы человека слишком упрощенны, чтобы объяснить отдельные физиологические влияния на синтез или распад белка путем воздействия на степень фосфорилирования рассматриваемых молекул (50). Эту информацию можно более элегантно отобразить на основе данных зависимости от дозы и времени, собранных в нашей лаборатории (16, 17, 66).
СМП и упражнения без отягощения
Во время упражнений
Вероятно, во время бега СМП у грызунов понижается (35). Более поздние исследования зафиксировали уменьшение СМП на 26 % у крыс во время 2-часового бега на тредмилле (46). В основе изменений СМП во время 30-минутного бега мышей на тредмилле, возможно, лежит повышение активности АМРК и подавление общего уровня трансляции мРНК, а также сигнального пути mTOR (125). У людей общий уровень синтеза белка понижался во время ходьбы в гору при 40 % максимального потребления кислорода (VO2max) (93), и подобные изменения наблюдаются во время 2-часовой ходьбы при 60 % VO2max (22). СМП является значительной частью общего синтеза белка организмом, также известно, что отношение АДФ к АТФ значительно уменьшается при упражнениях без отягощения (24), на этом основании можно сделать вывод: во время ходьбы или бега у людей понижается СМП, но практически нет данных, подтверждающих это. Фактически во время ходьбы на тредмилле при 40 % VO2max (27) нет существенных изменений в СМП сравнительно с уровнем во время отдыха, тем не менее исходный уровень мог быть необычно низким по отношению ко дню без тренировки, что, вероятно, привело к ложно негативным выводам. Также, возможно, выбран недостаточный уровень интенсивности упражнений: велоэргометрия в течение часа при 70 % VO2max, выполняемая молодыми здоровыми субъектами, приводила к активации мышечной АМРК-α2 (42), измеренной в квадрицепсе с помощью биопсии непосредственно после упражнения; в подобном исследовании продолжительностью 90 минут отмечена значительная, вызванная Са2+ активация кальмодулинзависимой протеинкиназы еЕF2 киназы, совместно (и, возможно, как результат) с ингибированием активности еЕF2 и (в итоге) удлинение белковой цепи у здоровых мужчин в постабсорбтивном состоянии (97). Эти результаты противоречат гипотезе о снижении СМП во время езды на велосипеде и бега, тем не менее технически сложно организовать исследование, в котором у субъектов, упражняющихся продолжительное время и со значительной нагрузкой, можно удовлетворительно отследить обмен белка во время упражнения, но это возможно. Задача ожидает своего решения.
После упражнений
После ходьбы на тредмилле при 40 % VO2max в постабсорбтивном состоянии СМП в различных мышцах увеличивался на 45 % (26); о подобных изменениях сообщал и Sheffield-Mooreetal (101). Еще большее увеличение уровня синтеза миофибриллярной фракции могут вызывать более интенсивные упражнения у сытых молодых мужчин, 1 час маховых упражнений ногами ̴̴ 70 % РМ удвоили уровень синтеза миофибриллярного белка в квадрицепсе на 24 часа, синтез оставался повышенным еще более 72 часов (76).
Эти результаты можно было бы считать случайностью, так как обычно упражнения этого типа (которые скорее увеличивают биогенез митохондрий) не вызывают гипертрофию и, следовательно, не стимулируют синтез миофибриллярных белков, но накопившиеся данные развеивают сомнения. Описанные нами факты обнаружены у нетренированных субъектов, в этом случае и отягощения, и велоэргометрия стимулируют синтез белков и миофибрилл и митохондрий, возможно, в результате общего анаболического сигнала после упражнений, в то же время у тренированных не повышается синтез миофибрилл после велоэргометрии и не наблюдается синтез митохондриальных белков после однократной тренировки с отягощениями (123).
Степень изменений СМП в ответ на упражнения, вероятно, зависит от того, производится или нет существенная «ударная» сила, например, после интенсивного плавания СМП у здоровых людей существенно не изменяется (113). Тем не менее, важно отметить, что измерения проводились после длительной тренировки, выполненной натощак. Кроме того, испытуемые были хорошо тренированы, а долговременная тренировка увеличивает базальный уровень СМП и уменьшает СМП в ответ на однократное воздействие упражнений (86, 87, 102).
В настоящее время существует много описаний активирующих фосфорилирование сигналов, которые могут лежать в основе изменений СМП после однократного выполнения упражнений без отягощения, а также изменений СМП самого по себе (например, увеличение сигналов mTOR, уменьшение еEF2, митогенактивирующей протеинкиназы и т. д.) (1, 11, 74, 98). Количественно наблюдаемые изменения сходны с происходящими в ответ на упражнения с отягощениями, и действительно, различия в ответ на однократные упражнения, при которых мышцы ног работают в разных режимах, «силовом» и «на выносливость», незначительны у тех же нетренированных людей (123). Это означает, что любое значительное увеличение сократительной активности или возможности утилизации субстратов нетренированными мышцами ведет к сходному анаболическому ответу. Тем не менее после периода тренировки СМП становится более чувствительным к специфическому типу упражнений, вызывая синтез отдельных субклеточных белковых фракций (митохондриальной или миофибриллярной), впоследствии проявляясь в фенотипических изменениях, характерных для разных видов тренировки (123). Фенотипические изменения, вероятно, возникают в результате повторного выполнения каждого из видов упражнений с отягощениями или «динамических». В настоящее время существует ограниченное количество данных о влиянии тренировки на активацию фосфорилирования сигнальных белков, этого недостаточно для возможности предсказания влияния на обмен протеинов изменений фосфорилирования.
РМП и упражнения
Во время упражнений с отягощениями
Только метод, основанный на A-V растворенных меченых аминокислотах, обсуждаемый ранее, доступен в настоящее время, однако его точность в данном случае весьма сомнительна. Насколько нам известно, только в двух исследованиях отслеживали уровень растворения меток «во время» упражнения (в действительности – во время отдыха между подходами) в постабсорбтивном состоянии; в этих исследованиях наблюдаемый уровень фенилаланина, показателя распада белка, не повышался во время отдыха (39, 114). Возможно, это объясняется тем, что протеолиз в мышцах происходит преимущественно через АТФ-зависимую убиквитинпротеазную систему (3), отношение АДФ к АТФ увеличивается во время упражнений, что может быть причиной его (распада) подавления во время выполнения упражнений, как в случае синтеза белка (см. выше).
После упражнений с отягощениями
Какой бы ни была неопределенность для периода упражнений, несомненно, что в постабсорбтивном состоянии после упражнения протеолиз в мышцах увеличивается, как показано с помощью растворенных меток (13, 15) и методом оценки уровня фракционного распада (ФРУ) (65). Перед упражнениями мышцы имели отрицательный баланс аминокислот, и эта ситуация лишь немного улучшалась при выполнении интенсивных упражнений с отягощениями, потому что, в то время как СМП увеличивался вдвое, ФРУ, существенно больший, чем ФРУ в постабсорбтивном состоянии, также увеличивался на 30–50 % спустя 3 часа, таким образом поддерживался отрицательный баланс (13, 85, 86). Тем не менее повышение распада в мышцах меньше по времени, чем уровень фракционального синтеза (24 часа по сравнению с 48) (85).
РМП и упражнения без отягощения
Неясны изменения РМП во время упражнений без отягощения. Во множестве экспериментов с циклическими упражнениями отмечали увеличение высвобождения аминокислот из нижних конечностей (72, 73) и на основании этого делали вывод о повышении протеолиза. Тем не менее высвобождение аминокислот объясняется скорее ингибированием синтеза белка, что приводит к недостаточной компенсации распада, и в результате из аминокислотного пула высвобождаются свободные аминокислоты.
Не вызывает сомнений, что в постабсорбтивном состоянии после упражнений без отягощений (45 минут ходьбы на тредмилле при 40 % VO2max) протеолиз в скелетных мышцах повышается как у молодых, так и у пожилых мужчин. В нижних конечностях увеличение протеолиза наблюдается через 10 и исчезает через 60 минут, но только у молодых субъектов (101).
Противоположные результаты получены с помощью микродиализа: концентрация 3МеН в диализате не изменялась от 6 до 72 часов после маховых упражнений одной ногой в течение часа при ̴ 70 % РМ (55). Возможно, это объясняется тем, что протеолизу подвергались «немиофибриллярные» протеины, при этом 3МеН не образуется, но более вероятно, что этот метод вообще не подходит для оценки мышечного протеолиза (13, 85, 95).
Сигнальные пути и РМП
Сигнальные пути, контролирующие РМП и протеолиз в мышцах человека, не определены. Различные протеолитические пути (включая лизосомальный, активируемый кальцием и убиквитин-протеосомо-зависимую систему, каспазы и металлопротеазы, а также неспецифические ди- и трипептидазы) вовлечены в ремоделирование мышц вследствие упражнений, но долевое участие каждого из них непонятно.
Увеличение активности активируемых кальцием протеаз и металлопротеаз отмечено в мышцах крысы во время и после бега на тредмилле (9, 25). Существует ограниченное количество сообщений об измерениях острых изменений производительности или контроля путей мышечного протеолиза у людей. В мышцах грызунов обнаружены две мышечные убиквитинлигазы, F-box мышечной атрофии (MAFbx) и мышечный reallyinterestingnovelgene fingerprotein 1 (MuRF1), стимулирующие протеолиз (3). Исследования экспрессии протеолитических генов в мышцах молодых субъектов спустя 4 часа после упражнений с отягощением, особенно экспрессии генов убиквитинапротеосом, показали увеличение активности MARFbxи MuRF1мРНК, но без существенных изменений в forkheadbox 3AмРНК (91). Парадоксально, но эксперименты нашей группы обнаружили снижение активности MARFbxм РНК в первые 24 часа после упражнений с отягощениями, которое означало увеличение РМП в посттренировочном состоянии (65). Это может быть связано с объемом и видом упражнения, выполняемого в последнем исследовании, где испытуемые выполняли подъемы на ступеньку с дополнительным отягощением, составлявшим 25 % от их массы тела, до полного утомления, а также со временем измерения. С другой стороны, в нашей лаборатории ранее не обнаружено прямой зависимости между РМП и экспрессией MARFbx (50). В любом случае существует и активируется множество путей, тем не менее интересно представить, как интактные миофибриллярные белки могут «реконструироваться» или ремоделироваться таким образом, чтобы оставалось место для вновь созданных протеинов, которые, согласно нескольким исследованиям (101, 113), синтезируются в течение часов после стимуляции упражнением.
Влияние потребления пищи на СМП и упражнения

Упражнение с отягощением и еда синергически повышают СМП и ведут к положительному белковому балансу после упражнения, большему, чем просто потребление пищи (14). Несколько групп отметили, что потребление аминокислот или протеина, совместно с углеводами или без них, после упражнений с отягощением (14, 21, 33, 64, 77, 79, 90, 108, 112) или без отягощений (76) дополнительно усиливали СМП. Например, увеличение СМП на 145 % по сравнению с исходным состоянием происходило, когда после упражнений потреблялись обогащенные лейцином незаменимые аминокислоты с углеводами, тогда как без действия нутриентов СМП увеличивался на 41 % (36). Усиливающий эффект потребления пищи после упражнений, видимо, вызван увеличением количества аминокислот, а не глюкозы в крови (20, 77).
Кривая дозозависимого увеличения СМП после упражнения и потребления белка (80) имеет сходную форму с наблюдаемой в покое (17) с небольшим сдвигом влево вверх под влиянием упражнений. Таким образом, работы показывают синергизм между едой и упражнением. Также не выявлено преимуществ при потреблении большого количества белка (>20 г, что на самом деле немного) с целью повышения накопления мышечного протеина, максимально эффективная доза составляет, вероятно, 15–20 г высококачественного белка: мясного, яичного или соевого.
Время потребления пищи
Нет единого мнения, что приводит к большему СМП: потребление аминокислот до или после упражнений. Так, сообщалось (114), что прием незаменимых аминокислот с углеводами непосредственно перед упражнениями с отягощениями вызвал большее поглощение аминокислот нижними конечностями, но эти результаты трудно проверить количественно, так как они получены не в состоянии покоя и увеличение потребления некорректно отражает размер физиологического повышения (в 20 раз), вероятно, имеет место артефакт – захват аминокислот из внутримышечного пула. Более того, недавно показано путем прямого измерения синтеза отдельных фракций у людей, что потребление пищи за 1 час до интенсивных упражнений с отягощениями не приводит к дополнительному повышению СМП в течение 2 часов после окончания нагрузки (43). Таким образом, в очередной раз показано, что метод растворенных меток предоставляет количественно и качественно различающиеся результаты по сравнению с «включением» меченых аминокислот.
В то время как остается невыясненным, когда лучше потреблять белок для максимального СМП в ответ на упражнения, существуют результаты непрямых измерений в отношении долговременной тренировки, таких как гипертрофия, показывающие, что у молодых и пожилых людей происходит большее увеличение мышечной силы и массы, если белок потребляется непосредственно после упражнений, чем через несколько часов (40, 53, 67).
Качество белка
Большой интерес представляет предположение, что белки различного «биологического качества» и усвояемости могут быть более или менее эффективны для обеспечения мышц аминокислотами после упражнений. Недавние работы Филлипса и коллег (53, 124) выявили преимущество сывороточного белка перед казеином, соевым протеином и белком цельного молока относительно общего включения в белки мышц. В то же время нет доказательств в пользу преимуществ молочного протеина в сравнении мясным, яичным или соевым (78).
Анаболические сигнальные пути
Молекулярный механизм, лежащий в основе увеличения стимулирующего СМП эффекта еды после упражнений, связан с большим повышением фосфорилирования mTOR, p70S6K1 и 4EBP-1, чем только при выполнении упражнений (рис. 1) (36, 61, 64).
Влияние упражнений и приема пищи на РМП
Аминокислоты сами по себе оказывают, по крайней мере небольшое (50), ингибирующее влияние на распад белка в нижних конечностях у человека, особенно в присутствии инсулина, но эффект меньший, чем наблюдающийся у животных. Подавление разрушения белка в мышцах предплечья человека происходит после введения смеси аминокислот с разветвленной боковой цепью (68, 69). Большинство физиологических эффектов аминокислот на РМП в покое, вероятно опосредовано повышением секреции инсулина. Тем не менее несколько исследователей сообщили, что увеличение биодоступности аминокислот после упражнений не ингибирует существенно РМП человека (14, 21, 70, 90, 112).
Влияние тренировки на метаболизм мышечного белка
Продолжительные упражнения с отягощениями увеличивают средний поперечник волокон и вызывают гипертрофию мышц. Тем не менее мы преимущественно игнорируем временную зависимость изменений и точный механизм происходящего, который должен включать активацию СМП и ремоделирования, а также разрушение «отработавших» белков и РМП. Несколько работ отметили, что тренировка с отягощением увеличивает базальный уровень СМП (5, 86). Также было показано, что даже кратковременная (2 недели) тренировка с отягощениями увеличивает СМП в покое, но данные сложно интерпретировать в связи с тем, что СМП измеряли кратковременно (между 3 и 18 часами) после последнего занятия, и увеличение СМП могло быть следствием срочного влияния упражнений, а не тренировки самой по себе (54, 129, 131). В подтверждение увеличения СМП в покое вследствие упражнений зафиксировано повышение фосфорилирования Akt-mTOR-p70S6k (123). Тем не менее есть противоположные данные, полученные в той же лаборатории, в отношении долговременной тренировки (109). Мы с коллегами оценивали срочный эффект упражнений (велоэргометрия) с отягощением и без него в разных нижних конечностях одних и тех же субъектов после 10 недель тренировки на синтез миофибриллярных и митохондриальных белков: в ноге, тренировавшейся с отягощением, отмечено повышение синтеза миофибриллярного белка в состоянии покоя, тогда как тренировка без отягощения увеличила только синтез митохондриального белка (123). Эти результаты указывают на то, что повторные специфические нагрузки увеличивают синтез отдельных белковых фракций не в результате кратковременной модуляции активности трансляции, а за счет активации специфических программ транскрипции генов (65, 91).
Также отмечалось ингибирование СМП после однократной тренировки в результате долговременных упражнений (86). Тем не менее в той же лаборатории недавно обнаружено ̴ 48 % увеличение СМП после одной тренировки в результате 12 недель долговременного выполнения занятий, включающих упражнения с отягощениями (62). Эти различия объясняются относительно низким стимулом в тренированном состоянии вследствие применения аналогичной абсолютной интенсивности перед и после тренировки в предыдущем исследовании (62). Однако мы с коллегами также зафиксировали понижение синтетического ответа (̴ 30 %) после однократного занятия в конечности, «тренировавшейся» с отягощением, при аналогичной относительной интенсивности (123).
Имеются свидетельства не только различий величины ответных изменений СМП, но и временные различия: долговременные упражнения с отягощениями вызывают более быстрое, но кратковременное повышение СМП, чем однократное занятие у нетренированных (109). Таким образом, тренировочный статус – важный параметр, когда оценивается ответ мышц на однократные упражнения.
Сообщалось об увеличении СМП в латеральной широкой мышце в покое на 22 % в результате 16 недель велоэргометрии без отягощения (45 минут при 80 % максимальной ЧСС, 3–4 дня в неделю) (102). Вероятно, умеренное повышение общего фракционного синтеза белка было результатом более высокого увеличения синтеза в митохондриальной и/или саркоплазматической фракции. Даже спустя 4 недели после программы ходьбы/бега при 65–85 % максимальной ЧСС отмечался умеренно повышенный общий фракционный синтез белка (~17 %); тем не менее, отмечается парадоксальное явление: увеличение общего фракционного синтеза белка (~40 %) приводит к более отрицательному белковому балансу (87).
Если упражнения без отягощения вызывают увеличение СМП, почему же тогда не происходит гипертрофии мышц? Увеличение СМП после динамических упражнений может быть, в частности, связано с повышением синтеза белков, которые ответственны за адаптационные изменения при этом виде упражнений, то есть за увеличение объема митохондрий, активность митохондриальных энзимов и синтез белка в митохондриях (48, 57). В поддержку этого Шорт с коллегами сообщили об увеличении синтеза белков, транспортирующих глюкозу, белков митохондрий, уровня митохондриальных энзимов и 22 % увеличении общего СМП в покое вследствие 16-недельной программы «аэробных» упражнений (102, 103). Недавно Wilkinson et al. (123) показали, что повторные динамические упражнения продолжительностью более 10 недель увеличивают только синтез митохондриальных белков и не оказывают влияния на синтез белков миофибрилл или на общее фосфорилирование Akt-mTOR-p70S6k у молодых здоровых людей. На уровне транскрипции «негипертрофические» упражнения (30 минут бега при 75 % VO2max) увеличивают относительное содержание мРНК и транскрипцию различных миогенных и метаболических генов (для миогенной дифференциации гексокиназы II и пируватдегидрогеназной киназы 4) после упражнения, которое достигает максимума через 4–8 часов и возвращается к исходному уровню через 24 часа (126). Кумулятивным эффектом этого преходящего увеличения вследствие повторной динамической тренировки является адаптация мышц, наблюдаемая при упражнениях без отягощения (31).
Адаптивные изменения к динамическим упражнениям проявляются в подавлении АМРК, внеклеточной, регулирующей сигналы киназы 1/2 и активности сигналов mTOR после 10 дней интенсивных велоэргометрических нагрузок: 45–60 мин при 75–90 % у здоровых людей (11). Увеличение экспрессии специфичных мышечных коактиваторов транскрипции, активирующего пролиферацию рецептор-ү коактиватора-1α пероксисом (PPAR-1α), также может быть связано с адаптивным ответом на динамические упражнения, приводящим к биогенезу митохондрий и увеличению окислительной способности (88, 89). Тем не менее физиологическая роль PPAR-1α в адаптивном ответе мышц на тренировку нуждается в подробном изучении.
Половые различия в метаболизме мышечных белков и упражнения

Тем не менее, согласно нашим и другим сообщениям, у женщин после менопаузы исходный уровень СМП на ~20 – 30 % выше, чем у мужчин (56, 105), и незначительно реагирует на прием пищи (105), таким образом, различия в метаболизме белка проявляются с возрастом, вероятно, в результате изменения в гормональном статусе. Изменения возникают независимо от композиции тела, так, нами были обследованы субъекты с ожирением (ИМТ 36–38) (105), в отличие от эксперимента группы Nair’s (56), сообщавшей об аналогичных различиях в базальном уровне СМП. Известно, что пожилые женщины демонстрируют меньшую гипертрофию (~33 %), чем мужчины, в ответ на тренировку с отягощением (3 дня в неделю, 26 недель) (6), вероятно, из-за неспособности поддерживать адаптивный ответ на хроническое тренирующее воздействие; так, пожилые мужчины увеличивают базальный уровень СМП на ~50 % после 3 месяцев тренировки, тогда как пожилые женщины только на ~15 % (104)
Влияние возраста на метаболизм мышечного белка и упражнения

Тогда как другие исследователи сообщали о запаздывании ответной реакции на упражнения с отягощениями у пожилых людей (38), мы не обнаружили подобного эффекта (66). Эти расхождения могут быть вызваны меньшим объемом упражнений, использованных в эксперименте, и обстоятельством, что субъекты изучались в состоянии голода после ночного сна (66). Подобный «притупленный» анаболический эффект наблюдался у стариков в ответ на прием пищи, расцененный как снижение чувствительности и способности к анаболическому ответу на прием аминокислот отдельно (32) и в сочетании с глюкозой (118).
Худший анаболический ответ СМП на упражнения с отягощением в мышцах пожилых людей, видимо, связан со снижением активации восходящего сигнала пути mTOR и повышением активности АМРК по сравнению с мышцами молодых людей (38). В исследованиях на грызунах обнаружено снижение активации сигнального пути mTOR после упражнений с отягощениями и повышение активности АМРК у пожилых крыс по сравнению с молодыми животными (45, 83, 111).
Недостаточное количество данных об РМП в ответ на упражнения у стариков. Используя метод растворенных A-V меток, обнаружено некоторое увеличение распада белка в состоянии покоя у пожилых людей (119). Тем не менее, по нашим данным, нет различий в базальном РМП, но «нормальное» ингибирование РМП инсулином существенно ниже у стариков (122). Видимо, «притупленный анаболизм» – широко распространенное явление в стареющих мышцах.
Минимизация потерь мышечной ткани, поддержание массы и функций мышц – основная цель при старении; мы должны понять синергию между упражнениями и приемом пищи, а также разработать надлежащую стратегию тренировок и питания для пожилых людей.
Выводы
Подводя итог, можно констатировать, что мышцы показывают удивительную пластичность в ответ на упражнения. Во время упражнений с отягощениями и без них СМП подавляется, тогда как после тренировки – повышается как в голодном, так и в сытом состоянии. Эта стимуляция проявляет зависимость от дозы и величины воздействия; тем не менее, для выяснение роли рабочей нагрузки требуются дополнительные исследования. Независимо от различий в нагрузке и наличия (или отсутствия) отягощения, сократительная активность вызывает сходный срочный анаболический ответ в нетренированных мышцах. Однако после периода тренировок срочный ответ уменьшается и зависит от вида упражнений: с отягощением или без отягощения и стимулирует синтез белков миофибрилл (с отягощением) или митохондрий (без отягощения), вероятно, отражая адаптивные изменения в зависимости от вида упражнения. Активация РМП во время упражнения с отягощением или без остается невыясненной. Тем не менее существует достаточно данных, подтверждающих увеличение РМП после обоих видов упражнений. Общее увеличение мышечной массы (СМП – РМП) после упражнений проявляется только при повышении доступности аминокислот во время постнагрузочного периода. Приблизительно 20 г высококачественного белка, например молочного, достаточно для инициации максимального синтетического ответа и, соответственно, общего увеличения массы мышц.
С возрастом уменьшается синтез белка миофибрилл в ответ на упражнение и потребление пищи, последние данные свидетельствуют о существовании половых различий в обмене мышечного белка, особенно об уменьшении ответа на упражнения у пожилых женщин.
Активация АМРК в результате клеточных запасов энергии играет важную роль в ингибировании синтеза белка. Увеличение синтеза белка после упражнений опосредуется активацией передачи сигналов mTOR и последующих эффекторов. Связь времени и величины ответа между упражнениями и фосфорилированием регуляторов клеточных сигнальных путей, вовлеченных в синтез и деградацию белка, только начинает выясняться. Несмотря на то что эти процессы фосфорилирования в основном качественно проявляются в результате анаболических стимулов, таких как упражнения, требуется гораздо больше работ для расшифровки сигналов, которые их включают или выключают и в конечном счете контролируют адаптивный ответ, например, мышечную гипертрофию или биогенез митохондрий. Конечно, в настоящее время невозможно напрямую связать размеры активации обмена мышечных белков с фосфорилированием сигнальных молекул. Когда мы сможем сделать это, мы будем гораздо ближе к нашей цели – пониманию регуляции мышечной массы и функции и разработке стратегии максимизации поддержания мышц в здоровье и болезни.
Источник: https://journals.physiology.org/
Источники:
1.
Aronson D., Violan M.A., Dufresne S.D., Zangen D., Fielding R.A.,
Goodyear L.J. Exercise stimulates the mitogen-activated protein kinase pathway in human skeletal muscle. J ClinInvest, 99: 1251–1257, 1997.
Medline
2.
Atherton P.J., Babraj J., Smith K., Singh J., Rennie M.J., Wackerhage H. Selective activation of AMPK-PGC-1alpha or PKB-TSC2-mTOR signaling can explain specific adaptive responses to endurance or resistance training-like electrical muscle stimulation. FASEB J, 19: 786–788, 2005.
Abstract/FREE FullText
3.
Attaix D., Ventadour S., Codran A., Bechet D., Taillandier D., Combaret L.The ubiquitin-proteasome system and skeletal muscle wasting. Essays Biochem, 41: 173–186, 2005.
CrossRef Medline
4.
Baar K., Esser K. Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol Cell Physiol, 276: C120–C127, 1999.
Abstract/FREE Full Text
5.
Balagopal P., Schimke J.C., Ades P., Adey D., Nair K.S. Age effect on transcript levels and synthesis rate of muscle MHC and response to resistance exercise. Am J Physiol Endocrinol Metab, 280: E203–E208, 2001.
Abstract/FREE Full Text
6.
Bamman M.M., Hill V.J., Adams G.R., Haddad F., Wetzstein C.J., Gower B.A., Ahmed A., Hunter G.R. Gender differences in resistance-training-induced myofiber hypertrophy among older adults. J Gerontol A BiolSciMedSci, 58: 108–116, 2003.
Medline
7.
Beelen M., Koopman R., Gijsen A.P., Vandereyt H., Kies A.K., Kuipers H., Saris W.H., van Loon L.J. Protein coingestion stimulates muscle protein synthesis during resistance-type exercise. Am J Physiol Endocrinol Metab, 295: E70–E77, 2008.
Abstract/FREE Full Text
8.
Beelen M., Tieland M., Gijsen A.P., Vandereyt H., Kies A.K., Kuipers H., Saris W.H., Koopman R., van Loon L.J. Coingestion of carbohydrate and protein hydrolysate stimulates muscle protein synthesis during exercise in young men, with no further increase during subsequent overnight recovery. J Nutr, 138: 2198–2204, 2008.
Abstract/FREE FullText
9.
Belcastro A.N. Skeletal muscle calcium-activated neutral protease (calpain) with exercise .J ApplPhysiol, 74: 1381–1386, 1993.
Abstract/FREE FullText
10.
Bennet W.M., Connacher A.A., Scrimgeour C.M., Smith K., Rennie M.J. Increase in anterior tibialis muscle protein synthesis in healthy man during mixed amino acid infusion: studies of incorporation of [1‑13C]leucine. ClinSci (Lond), 76: 447–454, 1989.
Medline
11.
Benziane B., Burton T.J., Scanlan B., Galuska D., Canny B.J., Chibalin A.V., Zierath J.R., Stepto N.K. Divergent cell signaling after short-term intensified endurance training in human skeletal muscle. Am J Physiol Endocrinol Metab, 295: E1427–E1438, 2008.
Abstract/FREE Full Text
12.
Bier D.M.. Stable isotopes in biosciences, their measurement and models for amino acid metabolism. Eur J Pediatr, 156, Suppl 1: S2–S8, 1997.
CrossRef
Medline
13.
Biolo G., Maggi S.P., Williams B.D., Tipton K.D., Wolfe R.R. Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol Endocrinol Metab, 268: E514–E520, 1995.
Abstract/FREE Full Text
14.
Biolo G., Tipton K.D., Klein S., Wolfe R.R. An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am J Physiol Endocrinol Metab, 273: E122–E129, 1997.
Abstract/FREE Full Text
15.
Biolo G., Williams B.D., Fleming R.Y., Wolfe R.R. Insulin action on muscle protein kinetics and amino acid transport during recovery after resistance exercise. Diabetes, 48: 949–957, 1999.
Abstract
16.
Bohe J., Low A., Wolfe R.R., Rennie M.J. Human muscle protein synthesis is modulated by extracellular, not intramuscular amino acid availability: a dose-response study. J Physiol, 552: 315–324, 2003.
Abstract/FREE FullText
17.
Bohe J, Low J.F., Wolfe R.R., Rennie M.J. Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J Physiol, 532: 575–579, 2001.
Abstract/FREE FullText
18.
Bolster D.R., Crozier S.J., Kimball S.R., Jefferson L.S. AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling. J BiolChem, 277: 23977–23980, 2002.
Abstract/FREE FullText
19.
Bolster D.R., Kubica N., Crozier S.J., Williamson D.L., Farrell P.A., Kimball S.R., Jefferson L.S. Immediate response of mammalian target of rapamycin (mTOR)-mediated signaling following acute resistance exercise in rat skeletal muscle. J Physiol, 553: 213–220, 2003.
Abstract/FREE FullText
20.
Borsheim E., Cree M.G., Tipton K.D., Elliott T.A., Aarsland A., Wolfe R.R. Effect of carbohydrate intake on net muscle protein synthesis during recovery from resistance exercise. J ApplPhysiol, 96: 674–678, 2004.
Abstract/FREE FullText
21.
Borsheim E., Tipton K.D., Wolf S.E., Wolfe R.R. Essential amino acids and muscle protein recovery from resistance exercise. Am J Physiol Endocrinol Metab, 283: E648–E657, 2002.
Abstract/FREE Full Text
22.
Bowtell J.L., Leese G.P., Smith K., Watt P.W., Nevill A., Rooyackers O., Wagenmakers A.J., Rennie M.J. Modulation of whole body protein metabolism, during and after exercise, by variation of dietary protein. J ApplPhysiol, 85: 1744–1752, 1998.
Abstract/FREE FullText
23.
Brodsky I.G., Balagopal P., Nair K.S. Effects of testosterone replacement on muscle mass and muscle protein synthesis in hypogonadal men – a clinical research center study. J Clin Endocrinol Metab, 81: 3469–3475, 1996.
Abstract
24.
Bylund-Fellenius A.C., Ojamaa K.M., Flaim K.E., Li J.B., Wassner S.J., Jefferson L.S. Protein synthesis versus energy state in contracting muscles of perfused rat hindlimb. Am J Physiol Endocrinol Metab, 246: E297–E305, 1984.
Abstract/FREE Full Text
25.
Carmeli E., Moas M., Lennon S., Powers S.K. High intensity exercise increases expression of matrix metalloproteinases in fast skeletal muscle fibres. ExpPhysiol, 90: 613–619, 2005.
Abstract/FREE FullText
26.
Carraro F., Hartl W.H., Stuart C.A., Layman D.K., Jahoor F., Wolfe R.R. Whole body and plasma protein synthesis in exercise and recovery in human subjects. Am J Physiol Endocrinol Metab, 258: E821–E831, 1990.
Abstract/FREE Full Text
27.
Carraro F., Stuart C.A., Hartl W.H., Rosenblatt J., Wolfe R.R. Effect of exercise and recovery on muscle protein synthesis in human subjects. Am J Physiol Endocrinol Metab, 259: E470–E476, 1990.
Abstract/FREE Full Text
28.
Cheng K.N., Dworzak F., Ford G.C., Rennie M.J., Halliday D. Direct determination of leucine metabolism and protein breakdown in humans using l-[1-13C,15N]-leucine and the forearm model. Eur J ClinInvest, 15: 349–354, 1985.
Medline
29.
Chesley A., MacDougall J.D., Tarnopolsky M.A., Atkinson S.A., Smith K. Changes in human muscle protein synthesis after resistance exercise. J ApplPhysiol, 73: 1383–1388, 1992.
Abstract/FREE FullText
30.
Chinkes D., Klein S., Zhang X.J., Wolfe R.R. Infusion of labeled KIC is more accurate than labeled leucine to determine human muscle protein synthesis. Am J Physiol Endocrinol Metab, 270: E67–E71, 1996.
Abstract/FREE Full Text
31.
Coffey V.G., Hawley J.A. The molecular bases of training adaptation. SportsMed, 37: 737–763, 2007.
CrossRef Medline
32.
Cuthbertson D., Smith K., Babraj J., Leese G., Waddell T., Atherton P., Wackerhage H., Taylor P.M., Rennie M.J. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB J, 19: 422–424, 2005.
Abstract/FREE FullText
33.
Cuthbertson D.J., Babraj J., Smith K., Wilkes E., Fedele M.J., Esser K., Rennie M. Anabolic signaling and protein synthesis in human skeletal muscle after dynamic shortening or lengthening exercise. Am J Physiol Endocrinol Metab,290: E731–E738, 2006.
Abstract/FREE Full Text
34.
Deldicque L., Atherton P., Patel R., Theisen D., Nielens H., Rennie M.J., Francaux M. Decrease in Akt/PKB signalling in human skeletal muscle by resistance exercise. Eur J ApplPhysiol, 104: 57–65, 2008.
CrossRef Medline
35.
Dohm G.L., Tapscott E.B., Barakat H.A., Kasperek G.J. Measurement of in vivo protein synthesis in rats during an exercise bout. BiochemMed, 27: 367–373, 1982.
CrossRef Medline
36.
Dreyer H.C., Drummond M.J., Pennings B., Fujita S., Glynn E.L., Chinkes D.L., Dhanani S., Volpi E., Rasmussen B.B. Leucine-enriched essential amino acid and carbohydrate ingestion following resistance exercise enhances mTOR signaling and protein synthesis in human muscle. Am J Physiol Endocrinol Metab, 294: E392–E400, 2008.
Abstract/FREE Full Text
37.
Dreyer H.C., Fujita S., Cadenas J.G., Chinkes D.L., Volpi E., Rasmussen B.B. Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol, 576: 613–624, 2006.
Abstract/FREE FullText
38.
Drummond M.J., Dreyer H.C., Pennings B., Fry C.S., Dhanani S., Dillon E.L., Sheffield-Moore M., Volpi E., Rasmussen B.B. Skeletal muscle protein anabolic response to resistance exercise and essential amino acids is delayed with aging. J ApplPhysiol, 104: 1452–1461, 2008.
Abstract/FREE FullText
39.
Durham W.J., Miller S.L., Yeckel C.W., Chinkes D.L., Tipton K.D., Rasmussen B.B., Wolfe R.R. Leg glucose and protein metabolism during an acute bout of resistance exercise in humans. J ApplPhysiol, 97: 1379–1386, 2004.
Abstract/FREE FullText
40.
Esmarck B., Andersen J.L., Olsen S., Richter E.A., Mizuno M., Kjaer M. Timing of postexercise protein intake is important for muscle hypertrophy with resistance training in elderly humans. J Physiol, 535: 301–311, 2001.
Abstract/FREE FullText
41.
Forbes G.B. The effect of anabolic steroids on lean body mass: the dose response curve. Metabolism, 34: 571–573, 1985.
CrossRef Medline
42.
Fujii N., Hayashi T., Hirshman M.F., Smith J.T., Habinowski S.A., Kaijser L., Mu J., Ljungqvist O., Birnbaum M.J., Witters L.A., Thorell A., Goodyear L.J. Exercise induces isoform-specific increase in 5′AMP-activated protein kinase activity in human skeletal muscle. BiochemBiophysResCommun, 273: 1150–1155, 2000.
CrossRef
Medline
43.
Fujita S., Dreyer H.C., Drummond M.J., Glynn E.L., Volpi E., Rasmussen B.B. Essential amino acid and carbohydrate ingestion prior to resistance exercise does not enhance post-exercise muscle protein synthesis. J ApplPhysiol. Inpress.
44.
Fujita S., Rasmussen B.B., Bell J.A., Cadenas J.G., Volpi E. Basal muscle intracellular amino acid kinetics in women and men. Am J Physiol Endocrinol Metab, 292: E77–E83, 2007.
Abstract/FREE Full Text
45.
Funai K., Parkington J.D., Carambula S., Fielding R.A. Age-associated decrease in contraction-induced activation of downstream targets of Akt/mTor signaling in skeletal muscle. Am J Physiol Regul Integr Comp Physiol, 290: R1080–R1086, 2006.
Abstract/FREE Full Text
46.
Gautsch T.A., Anthony J.C., Kimball S.R., Paul G.L., Layman D.K., Jefferson L.S. Availability of eIF4E regulates skeletal muscle protein synthesis during recovery from exercise. Am J Physiol Cell Physiol, 274: C406–C414, 1998.
Abstract/FREE Full Text
47.
Glover E.I., Phillips S.M., Oates B.R., Tang J.E., Tarnopolsky M.A., Selby A., Smith K., Rennie M.J. Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. J Physiol, 586: 6049–61, 2008.
Abstract/FREE FullText
48.
Gollnick P.D., Saltin B. Significance of skeletal muscle oxidative enzyme enhancement with endurance training. ClinPhysiol, 2: 1–12, 1982.
Medline
49.
Goodpaster B.H., Chomentowski P., Ward B.K., Rossi A., Glynn N.W., Delmonico M.J., Kritchevsky S.B., Pahor M., Newman A.B. Effects of physical activity on strength and skeletal muscle fat infiltration in older adults: a randomized controlled trial. J ApplPhysiol, 105: 1498–1503, 2008.
Abstract/FREE FullText
50.
Greenhaff P.L., Karagounis L., Peirce N., Simpson E.J., Hazell M., Layfield R., Wackerhage H., Smith K., Atherton P., Selby A., Rennie M.J. Disassociation between the effects of amino acids and insulin on signaling, ubiquitin-ligases and protein turnover in human muscle. Am J Physiol Endocrinol Metab, 295: E595–E604, 2008.
Abstract/FREE Full Text
51.
Halliday D., McKeran R.O. Measurement of muscle protein synthetic rate from serial muscle biopsies and total body protein turnover in man by continuous intravenous infusion of l-(α-15N)lysine. ClinSciMolMed, 49: 581–590, 1975.
Medline
52.
Hardie D.G. AMPK: a key regulator of energy balance in the single cell and the whole organism. Int J Obes (Lond), 32, Suppl4: S7–S12, 2008.
53.
Hartman J.W., Tang J.E., Wilkinson S.B., Tarnopolsky M.A., Lawrence R.L., Fullerton A.V., Phillips S.M. Consumption of fat-free fluid milk after resistance exercise promotes greater lean mass accretion than does consumption of soy or carbohydrate in young, novice, male weightlifters. Am J ClinNutr, 86: 373–381, 2007.
Abstract/FREE FullText
54.
Hasten D.L., Pak-Loduca J., Obert K.A., Yarasheski K.E. Resistance exercise acutely increases MHC and mixed muscle protein synthesis rates in 78–84 and 23–32 yr olds. Am J Physiol Endocrinol Metab, 278: E620–E626, 2000.
Abstract/FREE Full Text
55.
Haus J.M., Miller B.F., Carroll C.C., Weinheimer E.M., Trappe T.A. The effect of strenuous aerobic exercise on skeletal muscle myofibrillar proteolysis in humans. Scand J MedSciSports, 17: 260–266, 2007.
Medline
56.
Henderson G.C., Dhatariya K., Ford G.C., Klaus K.A., Basu R., Rizza R.A., Jensen M.D., Khosla S., O’Brien P., Nair K.S. Higher muscle protein synthesis in women than men across the lifespan, and failure of androgen administration to amend age-related decrements. FASEB J, 23: 631–641, 2009.
Abstract/FREE FullText
57.
Hoppeler H. Exercise-induced ultrastructural changes in skeletal muscle. Int J SportsMed, 7: 187–204, 1986.
Medline
58.
Isidori A.M., Giannetta E., Greco E.A., Gianfrilli D., Bonifacio V., Isidori A., Lenzi A., Fabbri A. Effects of testosterone on body composition, bone metabolism and serum lipid profile in middle-aged men: a meta-analysis. ClinEndocrinol (Oxf), 63: 280–293, 2005.
CrossRef Medline
59.
Jahn L.A., Barrett E.J., Genco M.L., Wei L., Spraggins T.A., Fryburg D.A. Tissue composition affects measures of postabsorptive human skeletal muscle metabolism: comparison across genders. J ClinEndocrinolMetab, 84: 1007–1010, 1999.
Abstract/FREE FullText
60.
Jaleel A., Short K.R., Asmann Y.W., Klaus K.A., Morse D.M., Ford G.C., Nair K.S. In vivo measurement of synthesis rate of individual skeletal muscle mitochondrial proteins. Am J Physiol Endocrinol Metab, 295: E1255–E1268, 2008.
Abstract/FREE Full Text
61.
Karlsson H.K., Nilsson P.A., Nilsson J., Chibalin A.V., Zierath J.R., Blomstrand E. Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am J Physiol Endocrinol Metab, 287: E1–E7, 2004.
Abstract/FREE Full Text
62.
Kim P.L., Staron R.S., Phillips S.M. Fasted-state skeletal muscle protein synthesis after resistance exercise is altered with training. J Physiol, 568: 283–290, 2005.
Abstract/FREE FullText
63.
Kimball S.R., Farrell P.A., Jefferson L.S. Invited Review: Role of insulin in translational control of protein synthesis in skeletal muscle by amino acids or exercise. J ApplPhysiol, 93: 1168–1180, 2002.
Abstract/FREE FullText
64.
Koopman R., Wagenmakers A.J., Manders R.J., Zorenc A.H., Senden J.M., Gorselink M., Keizer H.A., van Loon L.J. Combined ingestion of protein and free leucine with carbohydrate increases postexercise muscle protein synthesis in vivo in male subjects. Am J Physiol Endocrinol Metab, 288: E645–E653, 2005.
Abstract/FREE Full Text
65.
Kostek M.C., Chen Y.W., Cuthbertson D.J., Shi R., Fedele M.J., Esser K.A., Rennie M.J. Gene expression responses over 24 h to lengthening and shortening contractions in human muscle: major changes in CSRP3, MUSTN1, SIX1, and FBXO32. PhysiolGenomics, 31: 42–52, 2007.
Abstract/FREE FullText
66.
Kumar V., Selby A., Rankin D., Patel R., Atherton P., Hildebrandt W., Williams J., Smith K., Seynnes O., Hiscock N., Rennie M.J. Age-related differences in the dose-response of muscle protein synthesis to resistance exercise in young and old men. J Physiol, 587: 211–217, 2009.
Abstract/FREE FullText
67.
Levenhagen D.K., Gresham J.D., Carlson M.G., Maron D.J., Borel M.J., Flakoll P.J. Postexercise nutrient intake timing in humans is critical to recovery of leg glucose and protein homeostasis. Am J Physiol Endocrinol Metab, 280: E982–E993, 2001.
Abstract/FREE Full Text
68.
Louard R.J., Barrett E.J., Gelfand R.A. Effect of infused branched-chain amino acids on muscle and whole-body amino acid metabolism in man. ClinSci (Lond), 79: 457–466, 1990.
Medline
69.
Louard R.J., Barrett E.J., Gelfand R.A. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism, 44: 424–429, 1995.
CrossRef Medline
70.
Louis M., Poortmans J.R., Francaux M., Berre J., Boisseau N., Brassine E., Cuthbertson D.J., Smith K., Babraj J.A., Waddell T., Rennie M.J. No effect of creatine supplementation on human myofibrillar and sarcoplasmic protein synthesis after resistance exercise. Am J Physiol Endocrinol Metab, 285: E1089–E1094, 2003.
Abstract/FREE Full Text
71.
MacDougall J.D., Gibala M.J., Tarnopolsky M.A., MacDonald J.R., Interisano S.A., Yarasheski K.E. The time course for elevated muscle protein synthesis following heavy resistance exercise. Can J ApplPhysiol, 20: 480–486, 1995.
Medline
72.
MacLean D.A., Graham T.E., Saltin B. Branched-chain amino acids augment ammonia metabolism while attenuating protein breakdown during exercise. Am J Physiol Endocrinol Metab, 267: E1010–E1022, 1994.
Abstract/FREE Full Text
73.
MacLean D.A., Graham T.E., Saltin B. Stimulation of muscle ammonia production during exercise following branched-chain amino acid supplementation in humans. J Physiol, 493: 909–922, 1996.
Abstract/FREE FullText
74.
Mascher H., Andersson H., Nilsson P.A., Ekblom B., Blomstrand E. Changes in signalling pathways regulating protein synthesis in human muscle in the recovery period after endurance exercise. ActaPhysiol (Oxf), 191: 67–75, 2007.
CrossRef Medline
75.
Miller B.F., Hansen M., Olesen J.L., Flyvbjerg A., Schwarz P., Babraj J.A., Smith K., Rennie M.J., Kjaer M. No effect of menstrual cycle on myofibrillar and connective tissue protein synthesis in contracting skeletal muscle. Am J Physiol Endocrinol Metab, 290: E163–E168, 2006.
Abstract/FREE Full Text
76.
Miller B.F., Olesen J.L., Hansen M., Dossing S., Crameri R.M., Welling R.J., Langberg H., Flyvbjerg A., Kjaer M., Babraj J.A., Smith K., Rennie M.J. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol, 567: 1021–1033, 2005.
Abstract/FREE FullText
77.
Miller S.L., Tipton K.D., Chinkes D.L., Wolf S.E., Wolfe R.R. Independent and combined effects of amino acids and glucose after resistance exercise. MedSciSportsExerc, 35: 449–455, 2003.
CrossRef Medline
78.
Millward D.J., Jackson A.A. Protein/energy ratios of current diets in developed and developing countries compared with a safe protein/energy ratio: implications for recommended protein and amino acid intakes. PublicHealthNutr, 7: 387–405, 2004.
CrossRef Medline
79.
Moore D.R., Phillips S.M., Babraj J.A., Smith K., Rennie M.J. Myofibrillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening contractions. Am J Physiol Endocrinol Metab, 288: E1153–E1159, 2005.
Abstract/FREE Full Text
80.
Moore D.R., Robinson M.J., Fry J.L., Tang J.E., Glover E.I., Wilkinson S.B., Prior T., Tarnopolsky M.A., Phillips S.M. Ingested protein dose-response of muscle and albumin prtoein synthesis after resistance exercise in young men. Am J ClinNutr, 89: 161–168, 2008.
CrossRef Medline
81.
Nair K.S., Jaleel A., Asmann Y.W., Short K.R., Raghavakaimal S. Proteomic research: potential opportunities for clinical and physiological investigators. Am J Physiol Endocrinol Metab, 286: E863–E874, 2004.
Abstract/FREE Full Text
82.
Parise G., Mihic S., MacLennan D., Yarasheski K.E., Tarnopolsky M.A. Effects of acute creatine monohydrate supplementation on leucine kinetics and mixed-muscle protein synthesis. J ApplPhysiol, 91: 1041–1047, 2001.
Abstract/FREE FullText
83.
Parkington J.D., LeBrasseur N.K., Siebert A.P., Fielding R.A. Contraction-mediated mTOR, p70S6k, and ERK1/2 phosphorylation in aged skeletal muscle. J ApplPhysiol, 97: 243–248, 2004.
Abstract/FREE FullText
84.
Phillips S.M., Parise G., Roy B.D., Tipton K.D., Wolfe R.R., Tamopolsky M.A. Resistance-training-induced adaptations in skeletal muscle protein turnover in the fed state. Can J PhysiolPharmacol, 80: 1045–1053, 2002.
CrossRef
Medline
85.
Phillips S.M., Tipton K.D., Aarsland A., Wolf S.E., Wolfe R.R. Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am J Physiol Endocrinol Metab, 273: E99–E107, 1997.
Abstract/FREE Full Text
86.
Phillips S.M., Tipton K.D., Ferrando A.A., Wolfe R.R. Resistance training reduces the acute exercise-induced increase in muscle protein turnover. Am J Physiol Endocrinol Metab, 276: E118–E124, 1999.
Abstract/FREE Full Text
87.
Pikosky M.A., Gaine P.C., Martin W.F., Grabarz K.C., Ferrando A.A., Wolfe R.R., Rodriguez N.R. Aerobic exercise training increases skeletal muscle protein turnover in healthy adults at rest. J Nutr, 136: 379–383, 2006.
Abstract/FREE FullText
88.
Pilegaard H., Richter E.A. PGC-1alpha: important for exercise performance? J ApplPhysiol, 104: 1264–1265, 2008.
FREE FullText
89.
Pilegaard H., Saltin B., Neufer P.D. Exercise induces transient transcriptional activation of the PGC-1alpha gene in human skeletal muscle. J Physiol, 546: 851–858, 2003.
Abstract/FREE FullText
90.
Rasmussen B.B., Tipton K.D., Miller S.L., Wolf S.E., Wolfe R.R. An oral essential amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J ApplPhysiol, 88: 386–392, 2000.
Abstract/FREE FullText
91.
Raue U., Slivka D., Jemiolo B., Hollon C., Trappe S. Proteolytic gene expression differs at rest and after resistance exercise between young and old women. J Gerontol A Biol Sci Med Sci, 62: 1407–1412, 2007.
Abstract/FREE Full Text
92.
Rennie M.J. An introduction to the use of tracers in nutrition and metabolism.ProcNutrSoc, 58: 935–944, 1999.
Medline
93.
Rennie M.J., Edwards R.H., Davies C.T., Krywawych S., Halliday D., Waterlow J.C., Millward D.J. Protein and amino acid turnover during and after exercise. Biochem Soc Trans, 8: 499–501, 1980.
Medline
94.
Rennie M.J., Edwards R.H., Halliday D., Matthews D.E., Wolman S.L., Millward D.J. Muscle protein synthesis measured by stable isotope techniques in man: the effects of feeding and fasting. ClinSci (Lond), 63: 519–523, 1982.
Medline
95.
Rennie M.J., Phillips S., Smith K. Reliability of results and interpretation of measures of 3-methylhistidine in muscle interstitium as marker of muscle proteolysis. J ApplPhysiol, 105: 1380–1381, 2008.
FREE FullText
96.
Rooyackers O.E., Adey D.B., Ades P.A., Nair K.S. Effect of age on in vivo rates of mitochondrial protein synthesis in human skeletal muscle. ProcNatlAcadSci USA, 93: 15364–15369, 1996.
Abstract/FREE FullText
97.
Rose A.J., Broholm C., Kiillerich K., Finn S.G., Proud C.G., Rider M.H., Richter E.A., Kiens B. Exercise rapidly increases eukaryotic elongation factor 2 phosphorylation in skeletal muscle of men. J Physiol, 569: 223–228, 2005.
Abstract/FREE FullText
98.
Sakamoto K., Arnolds D.E., Ekberg I., Thorell A., Goodyear L.J. Exercise regulates Akt and glycogen synthase kinase-3 activities in human skeletal muscle. BiochemBiophysResCommun, 319: 419–425, 2004.
CrossRef Medline
99.
Sakamoto K., Goodyear L.J. Invited Review: Intracellular signaling in contracting skeletal muscle. J ApplPhysiol, 93: 369–383, 2002.
Abstract/FREE FullText
100.
Sheffield-Moore M., Paddon-Jones D., Sanford A.P., Rosenblatt J.I., Matlock A.G., Cree M.G., Wolfe R.R. Mixed muscle and hepatic derived plasma protein metabolism is differentially regulated in older and younger men following resistance exercise. Am J Physiol Endocrinol Metab, 288: E922–E929, 2005.
Abstract/FREE Full Text
101.
Sheffield-Moore M., Yeckel C.W., Volpi E., Wolf S.E., Morio B., Chinkes D.L., Paddon-Jones D., Wolfe R.R. Postexercise protein metabolism in older and younger men following moderate-intensity aerobic exercise. Am J Physiol Endocrinol Metab, 287: E513–E522, 2004.
Abstract/FREE Full Text
102.
Short K.R., Vittone J.L., Bigelow M.L., Proctor D.N., Nair K.S. Age and aerobic exercise training effects on whole body and muscle protein metabolism. Am J Physiol Endocrinol Metab, 286: E92–E101, 2004.
Abstract/FREE Full Text
103.
Short K.R., Vittone J.L., Bigelow M.L., Proctor D.N., Rizza R.A., Coenen-Schimke J.M., Nair K.S. Impact of aerobic exercise training on age-related changes in insulin sensitivity and muscle oxidative capacity. Diabetes, 52: 1888–1896, 2003.
Abstract/FREE FullText
104.
Smith G., Villareal D., Sinacore D., Shah K., Mittendorfer B. The anabolic response to exercise training is greater in older men than older women. In: APS Intersociety Meeting: The Integrative Biology of Exercise V, September 24–27, 2009, Hilton Head, SC. Bethesda, MD: Am. Physiol. Soc., 2008, p. 17.2.
105.
Smith G.I., Atherton P., Villareal D.T., Frimel T.N., Rankin D., Rennie M.J., Mittendorfer B. Differences in muscle protein synthesis and anabolic signaling in the postabsorptive state and in response to food in 65–80 year old men and women. PLoS ONE3: e1875, 2008.
CrossRef
Medline
106.
Smith K., Barua J.M., Watt P.W., Scrimgeour C.M., Rennie M.J. Flooding with l-[1-13C]leucine stimulates human muscle protein incorporation of continuously infused l-[1-13C]valine. Am J Physiol Endocrinol Metab, 262: E372–E376, 1992.
Abstract/FREE Full Text
107.
Smith K., Rennie M.J. The measurement of tissue protein turnover. BaillieresClinEndocrinolMetab, 10: 469–495, 1996.
CrossRef
Medline
108.
Tang J.E., Manolakos J.J., Kujbida G.W., Lysecki P.J., Moore D.R., Phillips S.M. Minimal whey protein with carbohydrate stimulates muscle protein synthesis following resistance exercise in trained young men. ApplPhysiolNutrMetab, 32: 1132–1138, 2007.
CrossRef
Medline
109.
Tang J.E., Perco J.G., Moore D.R., Wilkinson S.B., Phillips S.M. Resistance training alters the response of fed state mixed muscle protein synthesis in young men. Am J Physiol Regul Integr Comp Physiol, 294: R172–R178, 2008.
Abstract/FREE Full Text
110.
Thomson D.M., Gordon S.E. Diminished overload-induced hypertrophy in aged fast-twitch skeletal muscle is associated with AMPK hyperphosphorylation. J ApplPhysiol, 98: 557–564, 2005.
Abstract/FREE FullText
111.
Tipton K.D., Borsheim E., Wolf S.E., Sanford A.P., Wolfe R.R. Acute response of net muscle protein balance reflects 24-h balance after exercise and amino acid ingestion. Am J Physiol Endocrinol Metab, 284: E76–E89, 2003.
Abstract/FREE Full Text
112.
Tipton K.D., Ferrando A.A., Phillips S.M., Doyle D. Jr., Wolfe R.R. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol Endocrinol Metab, 276: E628–E634, 1999.
Abstract/FREE Full Text
113.
Tipton K.D., Ferrando A.A., Williams B.D., Wolfe R.R. Muscle protein metabolism in female swimmers after a combination of resistance and endurance exercise. J ApplPhysiol, 81: 2034–2038, 1996.
Abstract/FREE FullText
114.
Tipton K.D., Rasmussen B.B., Miller S.L., Wolf S.E., Owens-Stovall S.K., Petrini B.E., Wolfe R.R. Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am J Physiol Endocrinol Metab, 281: E197–E206, 2001.
Abstract/FREE Full Text
115.
Toth M.J., Poehlman E.T., Matthews D.E., Tchernof A., MacCoss M.J. Effects of estradiol and progesterone on body composition, protein synthesis, and lipoprotein lipase in rats. Am J Physiol Endocrinol Metab, 280: E496–E501, 2001.
Abstract/FREE Full Text
116.
Urban R.J., Bodenburg Y.H., Gilkison C., Foxworth J., Coggan A.R., Wolfe R.R., Ferrando A. Testosterone administration to elderly men increases skeletal muscle strength and protein synthesis. Am J Physiol Endocrinol Metab, 269: E820–E826, 1995.
Abstract/FREE Full Text
117.
Volpi E., Ferrando A.A., Yeckel C.W., Tipton K.D., Wolfe R.R. Exogenous amino acids stimulate net muscle protein synthesis in the elderly. J ClinInvest, 101: 2000–2007, 1998.
Medline
118.
Volpi E., Mittendorfer B., Rasmussen B.B., Wolfe R.R. The response of muscle protein anabolism to combined hyperaminoacidemia and glucose-induced hyperinsulinemia is impaired in the elderly. J ClinEndocrinolMetab, 85: 4481–4490, 2000.
Abstract/FREE FullText
119.
Volpi E., Sheffield-Moore M., Rasmussen B.B., Wolfe R.R. Basal muscle amino acid kinetics and protein synthesis in healthy young and older men. JAMA, 286: 1206–1212, 2001.
Abstract/FREE FullText
120.
Wagenmakers A.J. Tracers to investigate protein and amino acid metabolism in human subjects. ProcNutrSoc, 58: 987–1000, 1999.
Medline
121.
Welle S., Thornton C., Jozefowicz R., Statt M. Myofibrillar protein synthesis in young and old men. Am J Physiol Endocrinol Metab, 264: E693–E698, 1993.
Abstract/FREE Full Text
122.
Wilkes E., Selby A., Patel R., Rankin D., Smith K., Rennie M. Blunting of insulin-mediated proteolysis in leg muscle of elderly subjects may contribute to age-related sarcopenia (Abstract). ProcNutrSociety, 67 (OCE5): E153, 2008.
CrossRef
123.
Wilkinson S.B., Phillips S.M., Atherton P.J., Patel R., Yarasheski K.E., Tarnopolsky M.A., Rennie M.J. Differential effects of resistance and endurance exercise in the fed state on signaling molecule phosphorylation and protein synthesis in human muscle. J Physiol, 586: 3701–3717, 2008.
Abstract/FREE FullText
124.
Wilkinson S.B., Tarnopolsky M.A., Macdonald M.J., MacDonald J.R., Armstrong D., Phillips S.M. Consumption of fluid skim milk promotes greater muscle protein accretion after resistance exercise than does consumption of an isonitrogenous and isoenergetic soy-protein beverage. Am J ClinNutr, 85: 1031–1040, 2007.
Abstract/FREE FullText
125.
Williamson D.L., Kubica N., Kimball S.R., Jefferson L.S. Exercise-induced alterations in extracellular signal-regulated kinase 1/2 and mammalian target of rapamycin (mTOR) signalling to regulatory mechanisms of mRNA translation in mouse muscle. J Physiol, 573: 497–510, 2006.
Abstract/FREE FullText
126.
Yang Y., Creer A., Jemiolo B., Trappe S. Time course of myogenic and metabolic gene expression in response to acute exercise in human skeletal muscle. J ApplPhysiol, 98: 1745–1752, 2005.
Abstract/FREE FullText
127.
Yarasheski K.E. Exercise, aging, and muscle protein metabolism. J Gerontol A Biol Sci Med Sci, 58: M918–M922, 2003.
Abstract/FREE FullText
128.
Yarasheski K.E., Campbell J.A., Smith K., Rennie M.J., Holloszy J.O., Bier D.M. Effect of growth hormone and resistance exercise on muscle growth in young men. Am J Physiol Endocrinol Metab, 262: E261–E267, 1992.
Abstract/FREE Full Text
129.
Yarasheski K.E., Pak-Loduca J., Hasten D.L., Obert K.A., Brown M.B., Sinacore D.R. Resistance exercise training increases mixed muscle protein synthesis rate in frail women and men ≥76 yr old. Am J Physiol Endocrinol Metab, 277: E118–E125, 1999.
Abstract/FREE Full Text
130.
Yarasheski K.E., Smith K., Rennie M.J., Bier D.M. Measurement of muscle protein fractional synthetic rate by capillary gas chromatography/combustion isotope ratio mass spectrometry. BiolMassSpectrom, 21: 486–490, 1992.
CrossRef
Medline
131.
Yarasheski K.E., Zachwieja J.J., Bier D.M. Acute effects of resistance exercise on muscle protein synthesis rate in young and elderly men and women. Am J Physiol Endocrinol Metab, 265: E210–E214, 1993.
Abstract/FREE Full Text
132.
Zhang X.J., Chinkes D.L., Wolfe R.R. Measurement of muscle protein fractional synthesis and breakdown rates from a pulse tracer injection. Am J Physiol Endocrinol Metab, 283: E753–E764, 2002.
Abstract/FREE Full Text
Показать еще

Из широкого спектра гормонов особую важность имеют анаболические и катаболические гормоны. Катаболизм – это процесс метаболического распада клеток и тканей, а также разложения сложных структур с выделением энергии в виде тепла или в виде аденозинтрифосфата. Катаболические процессы обеспечивают высвобождение большого количества энергии.
Анаболические процессы противоположны катаболическим. Под анаболическими процессами подразумевают процессы создания клеток и тканей, а также веществ, необходимых для работы организма. Течение регенеративных процессов и анаболизм мышечной ткани во многом зависят от уровня гормона роста, инсулина и тестостерона в плазме крови.
Физическая активность существенно повышает концентрацию множества гормонов в плазме крови и не только непосредственно в момент нагрузки. С начала выполнения упражнения (напр. около максимальной мощности), за первые 4-10 минут концентрация различных гормонов и продуктов метаболизма меняется самопроизвольно. Так с началом упражнения растет концентрация молочной кислоты в крови. А концентрация глюкозы начинает меняться обратно пропорционально концентрации молочной кислоты. При увеличении времени нагрузки в крови растет уровень соматотропина.
Другие исследования продемонстрировали, что у людей преклонного возраста (65-75 лет) после занятий на велотренажере уровень тестостерона увеличивался на 40%. Специалисты геронтологии полагают, что именно сохранение нормальной концентрации тестостерона обеспечивает бодрое, энергичное состояние в преклонные годы и, вероятно, увеличивает продолжительность жизни.
Секрецию гормонов и их попадание в кровь при физических упражнениях можно представить в виде каскада реакций. Физическое напряжение как стресс провоцирует выделение в структурах мозга либеринов, которые, в свою очередь, запускают производство тропинов гипофизом. Через кровь тропины проникают в эндокринные железы, где и осуществляется секреция гормонов.
Катаболизм обусловлен наличием в крови множества факторов, участвующих в высвобождении энергии. Один из этих факторов – кортизол. Этот гормон помогает при стрессах. Однако слишком высокий уровень кортизола нежелателен: начинается расщепление клеток мышц, нарушается доставка в них аминокислот. Совершенно ясно, что в таких условиях при попадании в организм протеинов они не смогут принять участие в анаболизме, а будут либо интенсивно выбрасываться с мочой, либо превращаться печенью в глюкозу. Еще одна отрицательная роль кортизола проявляется в его воздействии на сахаридный метаболизм в период отдыха после упражнения, когда спортсмен желает скорее восстановить силы. Кортизол ингибирует скопление гликогена в мышечной ткани. Увы, кортизол производится в человеческом организме во время тяжелых тренировок. Интенсивные тренировки, высокая физическая нагрузка – это всё стресс. Кортизол выполняет одну из главных ролей при стрессах.
Устранить катаболический эффект кортизола можно с применением анаболических стероидов. Но этот метод – крайне вреден для здоровья. Побочные явления столь опасны, что спортсмену следует найти другие эффективные анаболики, легальные и не вызывающие побочных эффектов. Получение организмом большого количества сахаридов в результате анаболической активности инсулина также благоприятствует быстрому восстановлению. Выяснилось, что и в данном случае эффект достигается ингибированием активности кортизола. Концентрация инсулина обратно пропорциональна концентрации кортизола в крови. Инсулин является полипептидным гормоном и необходим в объединении путей энергоснабжения. Анаболизм инсулина затрагивает мышечную, жировую ткань и печень. Инсулин стимулирует образование гликогена, алифатических кислот и протеинов. Также инсулин ускоряет гликолиз.
Сам механизм анаболизма инсулина состоит в ускорении попадания глюкозы и свободных аминокислот в клетки. Однако процессы образования гликогена, активируемые инсулином, провоцируют уменьшение концентрации глюкозы в крови (основной симптом гипогликемии). Инсулин замедляет катаболизм в организме, в т.ч. разложение гликогена и нейтрального жира. Ускорение анаболизма в организме, то, чего хотят большинство культуристов, возможно и без применения допинг-средств типа анаболических стероидов.
Одним из важнейших агентов, активирующих производство протеина, является прогормон – соматомедин С. Специалисты утверждают, что образование этого вещества стимулируется соматотропином и осуществляется в печени и мышечной ткани. Производство соматомедина С в определенной степени зависит от объёма аминокислот, получаемых организмом. Гормоны с анаболическим эффектом после физических упражнений выполняют еще одну задачу. В результате исследований было выяснено, что при физических нагрузках волокна мышц повреждаются. Под микроскопом на специально подготовленных образцах мышечной ткани можно увидеть частые надрывы и полные разрывы волокон мышц. Факторов столь деструктивного эффекта нагрузки несколько. Первые гипотезы специалистов были связаны с деструктивным эффектом катаболических гормонов. Позже также было обосновано деструктивное воздействие свободных окислителей.
Эндокринная система управляет всеми видами метаболизма и, в зависимости от ситуации, может активировать резервные силы организма. Она же контролирует восстановление после тяжелых физических упражнений. Причем реакции гормональных систем сильно отличаются в соответствии со степенью нагрузки (большой или умеренной мощности).
При нагрузке умеренной мощности и долгой тренировке увеличивается уровень гормона роста и кортизола, падает уровень инсулина и увеличивается уровень трииодтиронина.
Нагрузке большой мощности сопутствует увеличение концентрации гормона роста, кортизола, инсулина и Т3. Гормон роста и кортизол обуславливают развитие специальной работоспособности, и поэтому увеличение их концентрации во время разных тренировочных циклов сопровождается улучшением спортивных показателей спортсмена.
В результате многих исследований специалистов было выяснено, что у профессиональных бегунов на сверхдальние дистанции в спокойном состоянии обнаруживается низкая или нормальная концентрация гормона роста. Однако при марафоновском забеге уровень гормона роста в крови сильно увеличивается, что обеспечивает высокую работоспособность на продолжительный срок. Гормон роста (соматотропин) – гормон, отвечающий за анаболизм в организме (рост, развитие, увеличение веса тела и различных органов). В организме взрослого человека воздействие гормона роста на функции роста в большей степени теряется, а на анаболические функции (образование протеина, сахаридный и жировой обмены) остается. Это и является причиной запрета соматотропного гормона как допинга.
Другим немаловажным гормоном адаптации служит кортизол, который отвечает за сахаридный и протеиновый метаболизм. Кортизол контролирует работоспособность путем катаболического процесса, при котором печень снабжается гликогеном и кетогенными аминокислотами. Вместе с катаболическим процессом (остановка производства протеина в лимфоидной и соединительной тканях) осуществляется сохранение концентрации глюкозы в плазме крови спортсмена на достаточном уровне. Данный гормон также запрещен в качестве допинга. Инсулин управляет концентрацией глюкозы и ее перемещением через мембраны мышечных и других клеток. Уровень инсулина в норме – 5-20 мкед/мл. Нехватка инсулина снижает работоспособность вследствие уменьшения количества глюкозы, доставляемой в клетки.
Выделение инсулина стимулируется при упражнениях большой мощности, что обеспечивает высокую проницаемость клеточных мембран для глюкозы (стимулируется гликолиз). Работоспособность достигается благодаря сахаридному обмену. При умеренной мощности упражнений уровень инсулина падает, что приводит к переходу с сахаридного метаболизма на липидный, что столь востребовано при продолжительной физической активности, когда резервы гликогена частично израсходованы.
Тиреоидные гормоны тироксин и трииодтиронин управляют основным метаболизмом, расходом кислорода и окислительным фосфорилированием. Изменение уровня тиреоидных гормонов определяет предел работоспособности и выносливости человека (возникает дисбаланс между получением кислорода и фосфорилированием, замедляется окислительное фосфорилирование в митохондриях мышечных клеток, замедляется ресинтез аденозинтрифосфата). Обследования бегунов на сверхдальние дистанции продемонстрировали связь между работоспособностью и соотношением гормона роста и кортизола.
Обследование эндокринной системы определенного спортсмена позволяет определить его возможности и готовность выдержать физическую нагрузку с лучшими показателями. Другим существенным аспектом предсказания специальной работоспособности служит выявление способностей коры надпочечников производить кортизол в ответ на раздражение адренокортикотропным гормоном. Повышенное производство кортизола говорит о способности спортсмена работать в оптимальном режиме.
Спортивная работоспособность разных полов существенно зависит от тестостерона. Этот гормон обуславливает агрессию, темперамент и целеустремленность при исполнении задания. Гормональные средства (тестостерон и его вариации, анаболические стероиды, гормон роста, кортикотропин, гонадотропный гормон, эритропоэтин) искусственно увеличивают работоспособность человека, и поэтому считаются допингом и запрещены к употреблению в соревнованиях и на тренировках.
Зачастую употребление препаратов гормонов идет вразрез со здоровым образом жизни и в конечном счете может привести к тяжелым патологиям.
Статья подготовлена главным врачом ГУЗ «ОВФД»
Николаевой И.В.
В статье рассмотрены типы мышечной гипертрофии, влияние на гипертрофию мышц деления клеток-сателлитов, гормонов, гипоксии, механического напряжения, повреждения мышц, метаболического стресса, а также переменных тренировки: интенсивности, объема, типа упражнений, интервала отдыха, работы «до отказа»и скорости выполнения упражнений.
Schoenfeld B. J. The mechanisms of muscle hypertrophy and their application to resistance training //J Strength Cond Res. 2010. V. 24. N.10 P. 2857-2872.
Бред Шёнфилд
Механизмы мышечной гипертрофии и их связь с силовой тренировкой
Аннотация
Те, кто поднимают тяжести, стремятся увеличить мышечную массу тела. Однако не хватает исследований, каким образом максимизировать рост мышц под воздействием физической нагрузки. Бодибилдеры обычно тренируются с умеренными нагрузками и довольно короткими промежутками отдыха, которые вызывают большое количество метаболического стресса. Пауэрлифтеры, наоборот, обычно тренируются с нагрузками высокой интенсивности и длительными периодами отдыха между подходами. Хотя обе группы, как известно, показывают впечатляющую мускулатуру, не ясно, какой метод лучше для гипертрофии мышц. Было показано, что многие факторы опосредуют гипертрофический процесс и что механическое напряжение, повреждение мышц, а также метаболический стресс могут играть определенную роль в вызванной физической нагрузкой гипертрофии мышц. Таким образом, цель данной работы является двоякой: (а) дать широкий обзор литературы, как о механизмах мышечной гипертрофии, так и их применении для осуществления подготовки и (б) сделать выводы из исследований какой протокол тренировки является оптимальным для максимизации роста мышц.
Ключевые слова: развитие мышц, гипертрофия мышц, рост мышцы, напряжение мышцы, повреждение мышцы, метаболический стресс.
Введение
Стремление увеличить мышечную массу тела широко преследуют те, кто поднимает тяжести. Учитывая сильную корреляцию между площадью поперечного сечения мышц и мышечной силой (111), увеличение мышечной массы является одной из главных целей спортсменов, участвующих в скоростно-силовых и силовых видах спорта, таких как футбол, регби, и пауэрлифтинг. Мышечная масса также является жизненно важной для бодибилдинга, где о соперниках судят по количеству и качеству развития мышц. В общем, гипертрофию мышц развивают также рекреационные лифтеры, которые стремятся развить свое телосложение в полной мере. Таким образом, максимизация мышечной массы имеет далеко идущие последствия для различных групп населения, связанных со спортом и здоровьем.
У нетренированных людей на начальных этапах силовой тренировки гипертрофия мышц практически отсутствует и прирост силы возникает за счет нервных влияний (124). Через пару месяцев тренировок, однако, гипертрофия мышц начинает становиться доминирующим фактором, начиная с верхних конечностей и заканчивая нижними (124, 177). На прирост мышечной массы влияют генетические предпосылки, пол, возраст и другие факторы (93). Кроме того, с приобретением опыта тренировок становится все труднее увеличить мышечную массу, поэтому увеличивается важность правильной организации тренировки.
Хотя гипертрофия мышц может быть достигнута с помощью широкого спектра программ силовой тренировки, принцип специфичности подсказывает, что некоторые программы способствуют большей гипертрофии мышц, чем другие (16). Не хватает исследований, свидетельствующих о наиболее эффективных процедурах тренировки. Бодибилдеры обычно тренируются с умеренными нагрузками и дают довольно короткие промежутки отдыха, которые вызывают большое количество метаболического стресса. Пауэрлифтеры, наоборот, обычно тренируются с большими отягощениями и дают длительный отдых между подходами. Хотя обе группы, как известно, показывают впечатляющий прирост мышечной массы, пока не ясно, какой метод лучше всего подходит для максимизации гипертрофического прироста мышечной массы (149). Таким образом, цель данной работы является двоякой: (а) дать широкий обзор литературы, как о механизмах мышечной гипертрофии и их применении к силовой тренировке (б) сделать выводы из исследований и разработать рекомендации по гипертрофии мышц.
Типы гипертрофии мышц
Мышечная гипертрофия отличается от мышечной гиперплазии. При гипертрофии мышц, увеличиваются сократительные элементы, и межклеточный матрикс расширяется для поддержки роста (187). Гиперплазия приводит к увеличению количества мышечных волокон. Гипертрофия сократительных элементов может происходить путем добавления саркомеров либо последовательно или параллельно.
Наиболее часто при гипертрофии, вызванной упражнениями, саркомеры и миофибриллы добавляются параллельно (135, 179). Когда скелетные мышцы подвергают перегрузкам, это вызывает изменения в мышечных волокнах, а также в соответствующем внеклеточном матриксе. Это устанавливает начало цепи миогенных событий что, в конечном итоге, приводит к увеличению размера и количества миофибриллярных сократительных белков: актина и миозина, и общего количества саркомеров, расположенных параллельно. Это, в свою очередь, увеличивает диаметр отдельных мышечных волокон и тем самым приводит к увеличению площади поперечного сечения мышцы (182).
Увеличение количества саркомеров, расположенных вдоль мышечного волокна, связано с маленькой длиной саркомеров (182). Гипертрофия, возникающая при увеличении количества саркомеров в миофибрилле, возникает в том случае, когда мышца вынуждена адаптироваться к новой функциональной длине. Это видно на примере конечностей, которые помещаются в гипс. Иммобилизация сустава приводит к увеличению числа саркомеров в миофибрилле, если мышца растянута и к уменьшению количества саркомеров в миофибрилле, если мышца сокращена (182). Существует ряд доказательств, что определенные типы упражнений могут повлиять на количество саркомеров в миофибриллах. Lynn и Morgan (107) показали, что, когда крысы бежали по беговой дорожке вверх, они имели меньшее количество саркомеров в миофибриллах по сравнению с теми, кто двигался вниз по дорожке. Это говорит о том, что повторные эксцентричные упражнения приводят к увеличению количества саркомеров в миофибриллах, в то время как двигательные действия в концентрическом режиме приводят к последовательному уменьшению количества саркомеров.
Предполагается, что гипертрофия может быть увеличена за счет увеличения различных неконтрактильных элементов и жидкости (108, 205). Эта концепция получила название “саркоплазматической гипертрофии”’ и может привести к большей мышечной массе без сопутствующего увеличения силы (154). Увеличение мышцы за счет саркоплазматической гипертрофии, как считается, связано со специальной тренировкой. Доказано, что мышечная гипертрофия у бодибилдеров отличается от пауэрлифтеров (179). В частности, у бодибилдеров, как правило, больше соединительно-тканного эндомизия, и большее содержание гликогена по сравнению с пауэрлифтерами (109, 177), по-видимому, из-за различий в методологии подготовки. Хотя саркоплазматическая гипертрофия часто описывается как нефункциональная, однако она вызывает отек мышечных волокон, таким образом, может опосредованно влиять на последующее увеличение синтеза белка, которое приводит к большему росту сократительной ткани.
Некоторые исследователи предполагают, что увеличение площади поперечного сечения мышцы может происходить по крайней мере частично из-за увеличения числа волокон (8). Мета-анализ, проведенный Келли (84) показал, что гиперплазия имеет место в мышцах некоторых видов животных в экспериментальных условиях в результате механической перегрузки. Увеличение числа мышечных волокон было наибольшим среди тех групп исследователей, которые изучали птиц, а не млекопитающих. И перегрузки в виде растягиваний давали более значительное увеличение числа волокон, чем упражнения. Однако последующие исследования показали, что такие наблюдения могут быть ошибочными, из-за того, что удлинение волокон считалось увеличением их количества (135). Доказательств того, что гиперплазия имеет место у людей не хватает и, даже, если это имеет место, эффект воздействия на площадь поперечного сечения мышцы минимален (1,108).
Клетки-сателлиты и гипертрофия мышц
Мышцы – это постмитотические ткани. Это означает, что они не являются постоянными клетками, а заменяются в течение жизни. Эффективный способ для клеточного восстановления нужен для того, чтобы предотвращать апоптоз клеток (регулируемый процесс клеточной гибели) и поддерживать массу скелетных мышц. Это осуществляется через динамический баланс между синтезом белков в мышцах и их распадом (69, 182). Мышечная гипертрофия возникает тогда, когда синтез белков превышает их распад.
Гипертрофия служит связующим звеном между активностью клеток-сателлитов, которые находятся между базальной мембраной и сарколеммой (66, 146). Эти «миогенные стволовые клетки» обычно неподвижны, но становятся активными, когда на скелетные мышцы воздействует достаточное количество механических стимулов (187). Однажды пробужденные, клетки-сателлиты пролифелируют (делятся), после чего или сливаются с существующими клетками или взаимодействуют между собой для создания новых мышечных волокон, что приводит к восстановлению и впоследствии гипертрофии новых мышечных волокон (182).
Клетки-сателлиты могут влиять на гипертрофию мышц несколькими способами. Первый, они жертвуют дополнительные ядра мышечным тканям, увеличивая возможность синтеза новых сократительных белков (123). Поскольку отношение количества ядер к объему мышечного волокна (объем мионуклеарного домена) во время гипертрофии мышц остается постоянным, изменяются требования к необходимому количеству внешних источников митотически активных клеток. Клетки-сателлиты сохраняют способность к делению, и тем самым служат как резерв миоядер, используемый для поддержки мышечного роста (15). Это согласуется с концепцией миоядерного домена, которая предполагает, что миоядра регулируют производство иРНК, соответствующее объему саркоплазмы и любые увеличения в размере мышечных волокон должны сопровождаться пропорциональным увеличением количества миоядер. Учитывая, что мышцы включают в себя множество мионуклеарных доменов, гипертрофия может предположительно возникать, как результат либо увеличения количества доменов (через увеличение количества миоядер) либо посредством увеличения размера существующих доменов. Как полагают, в процессе гипертрофии происходят оба процесса, при этом клетки-сателлиты принимают в них активное участие (182).
Более того, клетки-сателлиты сопровождают различные миогенные регуляторные факторы (включая Myf5, MyoD, myogenin и MRF4) которые помогают в восстановлении мышц, регенерации и росте. Эти регуляторные факторы связываются с последовательностью специфических элементов ДНК, представленных в мышечных генах-промоторах, выполняя распределенные роли в миогенезе (148,155).
Миогенные пути
Вызванная упражнениями мышечная гипертрофия связана с большим количеством сигнальных путей, которые под воздействием механической стимуляции передают вниз сигналы, которые сдвигают баланс или в сторону синтеза или в сторону катаболизма белков. Несколько первичных анаболических путей идентифицированы: Akt-mammalian Target of Rapamycin (mTOR), митоген активируемая протеинкиназа (МАРК) и кальций зависимая протеинкиназа.
Akt-mammalian Target of Rapamycin (Akt/mTOR) путь
Akt/mTOR предполагается действует как регулятор роста скелетных мышц (18, 77, 181). Несмотря на то, что специфический молекулярный механизм выяснен не полностью, Akt считается важной узловой молекулярной точкой, которая так же является активатором анаболического синтеза и главным ингибитором катаболических сигналов. Когда он активирован, Akt подает сигналы mTOR, который затем оказывает влияние на различные нижележащие цели, которые содействуют гипертрофии мышечных тканей.
Митоген Активируемый Протеин Киназный (МАПК) путь
Митоген активируемая протеинкиназа считается главным регулятором экспрессии генов, окислительно-восстановительного процесса и метаболизма (88). Специфичная для вызываемой физическими упражнениями гипертрофии скелетных мышц, МАПК связывает стресс с приспособительными ответами мышечных волокон, модуляцией их роста и дифференциации.
С мышечной гипертрофией связаны три различных МАПК сигнальных модуля: экстраклеточная сигнально-регулирующая киназа (ERK ½), p38 МАПК, и c-Jun NH2 – терминал киназа (JNK). Из этих составляющих, JNK показывается как самая отзывчивая к механическим воздействиям и повреждениям мышц и она частично восприимчива к эксцентрическим упражнениям. Вызываемая физическими упражнениями, JNK связана с быстрым ростом в mRNA транскрипционных факторов, которые модулируют клеточное распространение и восстановление ДНК.
Кальций зависимая протеинкиназа
Различные кальций зависимые протеинкиназные пути причастны к регуляции мышечного роста. Кальцинейрин (Cn), и кальций-регулирующая фосфатаза, предположительно являются частью критического регулятора сигнального каскада кальция. Кальцинейрин (Cn) участвует в кальциевом пути и служит связующим звеном между различными гипертрофическими эффекторами, такими как фактор-2 увеличения мышечных волокон, фактор GATA транскрипции, и внутриклеточный фактор активирования Т клеток (118).
Cn-зависимые пути связаны с гипертрофией всех типов мышечных волокон, и их торможение используется для предотвращения роста мышц даже при условии наличия мышечной перегрузки.
Гормоны и Цитокины[1]
Гормоны и цитокины играют неотъемлемую роль в гипертрофической реакции, выступающей в качестве вышестоящих регуляторов анаболических процессов. Повышенная концентрация анаболического гормона увеличивает вероятность рецепторных взаимодействий, способствующих белковому обмену с последующим ростом мышц (31). Многие также участвуют в пролиферации и дифференциации клеток-сателлитов, и возможно облегчают привязку клеток-сателлитов к поврежденным волокнам при восстановлении мышц (182, 187).
Гормональная регуляция гипертрофии – это комплекс с многочисленными гормонами и цитокинами, приводящий к ответной реакции. Гепато-фактор роста, Интерлейкин-5 (IL-5), Интерлейкин-6 (IL-6), фактор роста фибробластов и ингибирующий лейкоз фактор, все это стимулирует анаболизм. Инсулин, как было показано, обладает анаболическими свойствами, с большим воздействием на протеолиз, чем на усиление синтеза белка. Инсулин также, по мнению ученых, вызывает митоз и дифференциацию клеток-сателлитов. Учитывая, что уровень инсулина уменьшается при физической нагрузке, этот аспект тренировочного режима не будет рассматриваться далее.
Различные виды упражнений, как было показано, вызывают острые и в некоторых случаях хронические перестройки гормонального фона, что играет существенную роль в гипертрофии мышц. Существуют три наиболее широко изученных в этом направлении гормона: инсулино-подобный фактор роста (IGF1), тестостерон и гормон роста (GH). Некоторыми исследователями ставится под сомнение острый гормональный ответ на упражнения, обеспечивающий значительные анаболические эффекты. Однако преобладают фундаментальные и косвенные доказательства обратного, а именно огромной важности гормональной сигнализации при занятиях силовыми упражнениями.
Инсулиноподобный фактор роста (IGF-1)
Инсулиноподобный фактор роста часто упоминается, как самый важный анаболический гормон млекопитающих. Это связано с тем, что этот гормон отвечает за основной анаболический эффект организма и реагирует на механическую нагрузку (19, 63).
Конструктивно, IGF-1 – это пептидный гормон, названный так из-за структурного сходства с инсулином. Рецепторы инсулиноподобного фактора роста находятся в активированных клетках-сателлитах, взрослых миофибриллах и Шванновских клетках (15). Во время тренировки мышцы не только производят более системный IGF-1, чем в печени, но также используют циркулирующий IGF-1 (49). Доступность IGF-1 для мышц контролируется с помощью IGF-1-связывающих белков (IGFBPs), которые либо стимулируют, либо тормозят эффекты IGF-1, после привязки к конкретному связывающему белку IGFBP (182).
Определены три различные изоформы IGF-1: системные формы IGF-1Ea и IGF-1Eb и соединяющий IGF-1Ec. Хотя все три формы выражены в мышечной ткани, только IGF-1 Ec активируется путем механического сигнала (63, 199). Из-за его ответа на механическое раздражение, IGF-1Ec еще называют механическим фактором роста (MGF).
Хотя точный механизм действия IGF-1 до сих пор не изучен, принято считать, что механическая стимуляция активирует ген IGF-1, чтобы присоединить MGF, который, в свою очередь вызывает мышечную гипертрофию. В течение дня или около того, MGF полностью присоединяется к системным изоформам IGF-1 (IGF-1Ea и IGF-1Eb) (54, 69). Уровни IGF-1 ,потом остаются повышенными в мышечной ткани в течение некоторого времени после присоединения, с миогенным эффектом, наблюдаемым до 72 часов после тренировки (117). Хотя MGF, как было показано, особенно чувствителен к повреждению мышц, не очень ясно, действительно ли эта изоформа регулирует мембранные повреждения или мембранное повреждение инициирует производство MGF (48).
Инсулиноподобный фактор роста, как было показано, вызывает гипертрофию в аутокринной и паракринной системе (34) и оказывает свое действие несколькими способами. Например, IGF-1 непосредственно стимулирует анаболизм за счет увеличения скорости синтеза белка в дифференцированных миофибриллах (15,63). Кроме того, локальная экспрессия MGF активирует клетки-сателлиты и служит связующим звеном их пролиферации и дифференцировки (69, 200). С другой стороны считается, что IGF-1Ea повышает слияние клеток-сателлитов в мышечных волокнах, способствуя отдачи миоядер и помогает поддерживать объем мионуклеарного домена на постоянном уровне (182).
Инсулиноподобный фактор роста также активирует экспрессию генов L-типа калиевых каналов в результате повышения внутриклеточной концентрации ионов кальция. Это приводит к активации нескольких анаболических кальций-зависимых путей, в том числе кальциневрина и его многочисленных нисходящих сигнальных целей.
Тестостерон
Тестостерон является холестерол-производным гормоном, который оказывает значительное анаболическое действие на мышечную ткань (33, 105). В дополнение к его воздействию на мышцы тестостерон также может взаимодействовать с рецепторами на нейронах и тем самым увеличивать количество освобожденных медиаторов, регенерировать нейроны и увеличивать размеры клеточного тела. В основном тестостерон синтезируется и секретируется клетками Лейдига семенников и через гипоталамо-гипофизарно-гонадную ось в небольших количествах из яичников и надпочечников (22). В крови, большая часть тестостерона связывается либо с альбумином (38%) или со стероидным гормоном, связывающим глобулин (60%). Оставшиеся 2% циркулируют в свободном состоянии. Хотя только несвязанная форма биологически активна и доступна для использования тканями, связанный тестостерон может стать активным, быстро отделившись от альбумина (105). Несвязанный тестостерон связывается с андрогенными рецепторами тканей-мишеней, которые расположены в цитоплазме клеток. Это вызывает конформационные изменения, которые способствуют транспортировке тестостерона в клеточное ядро, где он взаимодействует непосредственно с хромосомной ДНК.
Хотя влияние тестостерона на скелетные мышцы видно и в отсутствие нагрузки, его действие усиливается механическими нагрузками, стимулируя анаболизм за счет увеличения скорости синтеза белка и замедления распада белков (22). Тестостерон также может способствовать синтезу белка, косвенно стимулируя выброс других анаболических гормонов, таких как гормон роста (31). Кроме этого, было выявлено, что он способствует репликации клеток-сателлитов и их активации, в результате чего увеличивается количество миогенных клеток-сателлитов (155). Было выявлено, что приостановление действия тестостерона негативно сказывается на устойчивости к силовой тренировке (100).
Было установлено, что силовые упражнения вызывают повышение содержание рецепторов андрогенов в организме человека (13, 80). У грызунов, модуляция содержания андрогенных рецепторов проявляется в типе волокон определённым образом с увеличением быстро сокращающихся мышц (20). Таким образом, увеличивается потенциал для связывания тестостерона на клеточном уровне, что способствует его поступлению в ткани-мишени.
Силовые упражнения могут иметь ощутимый резкий эффект на выделение тестостерона. Ahtianen et al. (2) установили существенную корреляцию между повышением уровня этого гормона под воздействием тренировки и поперечным сечением мышцы, предположив, что повышение уровня тестостерона в мышцах при тренировках может играть существенную роль в их гипертрофии. Однако срочные ответы лимитированы у женщин и у лиц пожилого возраста, что уменьшает гипертрофический потенциал этих групп населения (61,90, 130).
До сих под не ясен кумулятивный эффект влияния силовых тренировок на содержание тестостерона в мышцах. Некоторые исследования показывают достоверный рост его уровня в мышцах в результате силовой тренировки (60, 93, 163), другие – незначительное увеличение (3,142). В связи с этим необходимы дальнейшие исследования этой проблемы.
Гормон роста
Гормон роста (соматотропный гормон, СТГ) представляет собой полипептидный гормон, который, как считается, обладает как анаболическими, так и катаболическими свойствами. В частности, СТГ действует как агент перераспределения, провоцирующий жировой обмен, приводящий к мобилизации триглицеридов и стимулирующий клеточное поглощение и включение аминокислот в различные белки, в том числе мышцы (187). При отсутствии механической нагрузки СТГ преимущественно активирует иРНК системного IGF-1 (инсулиноподобного фактора роста-1) и опосредованную негепатическую экспрессию генов IGF-1 аутокринным/паракринным образом (63).
Гормон роста выделяется передней долей гипофиза и вводится в действие пульсирующим образом с наибольшими выделениями, не вызываемыми выполнением физических упражнений, происходящими во время сна. Было обнаружено более 100 молекулярных изоформ СТГ; однако, большая часть тренировок с отягощениями сосредоточена исключительно на изоформах 22-кДа, что приводит к ограничению его вывода. Новейшие исследования свидетельствуют о преимущественном выделении нескольких изоформ СТГ с пролонгированным периодом полужизни во время выполнения физических упражнений, что создает возможность для пролонгированного действия на ткани-мишени (131).
В дополнение к воздействию, оказываемому на мышечную ткань, СТГ также принимает участие в регуляции иммунной функции, формирования костей и объема тканевой жидкости. В общей сложности, предполагается, что СТГ активизирует свыше 450 действий в 84 типах клеток (190).
Уровень гормона роста резко повышается после выполнения различных типов физических упражнений (96). Повышение уровня СТГ в связи с выполнением физических упражнений высоко коррелирует с величиной гипертрофии мышечных волокон типа I и II (113). Предполагается, что кратковременное повышение СТГ может приводить к усилению взаимодействия с рецепторами мышечных волокон, что облегчает восстановление волокон и стимулирует гипертрофический ответ (134). Считается, что гормон роста также участвует в вызываемом тренировкой повышении локально экспрессируемого IGF-1 (75). В сочетании с интенсивными физическими упражнениями выделение СТГ связано с заметным повышением экспрессии гена IGF-1 в мышцах таким образом, что большее количество превращается в изоформу MGF (механический фактор роста) (63).
Некоторые исследователи подвергают сомнению существенное гипертрофическое влияние СТГ на мышечную ткань (143). Данная точка зрения базируется на результатах нескольких исследований, в ходе которых не удалось обнаружить значительного увеличения мышечной массы при введении СТГ при выполнении тренировки с отягощениями (101, 201-203). С другой стороны, в данных программах тренировки не воспроизводились большие резкие подъемы СТГ, наблюдаемые после выполнения физических упражнений; учитывая время при котором уровень СТГ был повышен в сочетании с травмой мышц. Таким образом из этих исследований, невозможно сделать выводы относительно того, как СТГ связан с физической нагрузкой. Ответ связан с анаболическими процессами в скелетных мышцах и многое до сих пор не ясно. В связи с этим необходимы дальнейшие исследования, чтобы полностью осветить его роль в развитии мышц.
Клеточная гидратация (отек)
Клеточная гидратация (т.е. клеточный отёк) служит регулятором физиологической функции клеток (65), что используется для моделирования анаболических процессов, то есть увеличения синтеза белка и уменьшения его распада (53,120,165). Хотя физиологическую основу, связывающую отек клеток с анаболическими процессами еще предстоит определить, можно предположить, что увеличение давления на мембрану воспринимается как угроза целостности клетки, что в свою очередь заставляет ее подавать сигналы. Это в итоге приводит к укреплению ее ультраструктуры.
Гидратированные клетки, как было показано, инициировали процесс, который включает активацию протеин-киназных сигнальных путей в мышцах, и, возможно, опосредующих аутокринных эффектов факторов роста в передаче сигнала анаболического ответа на участке мембраны (106). Клеточный отек вызывает растяжение участка мембраны, что может напрямую влиять на транспорт аминокислот посредством интегрин-ассоциированных рецепторов объема. Фосфатдилинозитол- 3-киназы, являются важным компонентом связи модуляции глютамина и альфа-(метил) аминоизомасляной кислоты в транспорте в мышцы, потому что клетки отекают (106). Силовые упражнения, как было показано, взывают изменения водного баланса внутри клетки (156), степень которого зависит от типа и интенсивности упражнения. Клеточный отек достигает максимума при использовании физических упражнений гликолитического типа с накоплением лактата, который вносит основной вклад в осмотические изменения в скелетных мышцах (41, 157). Быстросокращающиеся волокна, особенно чувствительны к осмотическим изменениям, связанными с высокой концентрацией воды в транспортных каналах, называемых аквапорин-4. Аквапорин-4 сильно выражен в сарколемме гликолитических и окислительно-гликолитических волокон, что облегчает приток жидкости в клетку. Учитывая, что быстро сокращающиеся волокна являются наиболее чувствительными к гипертрофии, можно предположить, что клеточная гидратация увеличивает гипертрофический ответ во время тренировки с отягощениями, что в значительной мере опирается на анаэробный гликолиз.
Упражнения, которые вызывают повышение гликогена в мышечных волокнах также увеличивают отек клеток. Учитывая, что гликоген притягивает три грамма воды на каждый грамм гликогена (25), это может влиять на увеличение возможностей для синтеза белка в тех мышечных волокнах, которые обладают большими запасами гликогена.
Гипоксия
Гипоксия, как было показано, способствует мышечной гипертрофии. Эти эффекты видны даже в отсутствии физической нагрузки. Takarada et al. (172) обнаружили, что две ежедневные сессии сосудистой окклюзии тормозят мышечную атрофию в группе пациентов, содержащихся на постельном режиме. Подобные эффекты окклюзии наблюдали Kubota et al. (62, 98), что предотвращало падение мышечной силы и уменьшение площади поперечного сечения во время 2-х недельного периода иммобилизации.
В сочетании с физическими упражнениями, гипоксия, кажется, оказывает дополнительный эффект на гипертрофию мышц. Это было продемонстрировано Takarada et al. (173), которые разделили 24 пожилых женщин, выполняющих сгибание руки в локтевом суставе на три подгруппы. Первая группа женщин выполняла упражнение с низкой интенсивностью (50% от максимума [1РМ]) и имела окклюзию сосудов. Вторая группа женщин выполняла упражнение с низкой интенсивностью, как и первая, но без окклюзии. Третья группа выполняла упражнение с высокой интенсивностью (80% от максимума), но без окклюзии. После 16 недель такой тренировки, первая группа показала значительно большую площадь поперечного сечения локтевого сгибателя по сравнению со второй группой. При этом гипертрофия мышц была такой же, как в третьей группе.
Есть несколько теорий, объясняющих влияние гипоксии на гипертрофию мышц. С одной стороны, гипоксия, как было показано, вызывает повышенное накопление лактата и уменьшает его удаление (173). Это увеличивает отек мышечных волокон, что, как было показано, активирует синтез белка. Кроме того, увеличение лактата приводит к увеличению анаболических гормонов и цитокинов. Takarada et al. (172) отметили 290% возрастание уровня гормона роста после низкоинтенсивной гипоксической тренировки и увеличение концентрации миогенного цитокина IL-6, который оставался повышенным в течение 24 часов.
Другой потенциальный механизм влияния гипоксии на гипертрофию скелетных мышц связан с ее влиянием на активность активных форм кислорода (ROS). Производство активных форм кислорода, как было показано, способствует росту, как гладкой мускулатуры, так и сердечной мышцы (170), и предполагается аналогичное гипертрофическое воздействие на скелетные мышцы (171). Оксид азота (ROS), продуцируемый во время физических упражнений, опосредует пролиферацию клеток-сателлитов, которые, предположительно, приводят к большому росту скелетных мышц (81, 174). Активные формы кислорода, возникающие во время тренировки, активируют передачу сигнала MAPK в скелетных миобластах (83) и таким образом модулируют гипертрофический ответ.
Гипоксия также может способствовать гипертрофическому эффекту посредством реперфузии (гиперемии, т.е., возобновлению притока крови) после ишемического упражнения (173). Реперфузия в поврежденной мышце предположительно влияет на поставку анаболических эндокринных агентов и факторов роста в клетках-сателлитах, тем самым регулируя их пролиферацию и последующий синтез мышечных трубок (187).
Начало гипертрофии, индуцированной Упражнениями
Предполагается, что существуют три основных фактора ответственных за инициацию гипертрофической реакции при выполнении силовых упражнений: это механическое напряжение, мышечное повреждение и метаболический стресс. Ниже приводится краткий обзор каждого из вышеперечисленных факторов.
Механическое напряжение
Механически индуцированное напряжение вызывается генерируемой силой и растяжением, что считается необходимым для роста мышц, а сочетание этих стимулов, вызывает дополнительный эффект (48, 72, 185). Более конкретно, механическая нагрузка увеличивает мышечную массу, в то время как при ее отсутствии результат ведет к мышечной атрофии (47). Этот процесс в значительной степени контролирует скорость синтеза белка, посредством инициализации трансляции (11,87). Считается, что напряжение, связанное с силовыми тренировками, нарушает целостность скелетных мышц, вызывая механо-химическим путем изменение молекулярных и клеточных реакций в миофибриллах и клетках-сателлитах (182). Импульс сигнала проходит через ряд различных процессов, которые включают в себя факторы роста, цитокины, каналы, активируемые растягиванием, и комплексы фокальной адгезии (23,48, 162). Опыт показывает, что последующий процесс регулируется с помощью путей AKT/mTOR, либо посредством прямого взаимодействия или путем модуляции производства фосфатной кислоты. На данный момент, однако, исследование не предоставило четкого понимания того, как эти процессы осуществляются.
Во время эксцентрических сокращений, пассивное мышечное напряжение развивается посредством удлинения цитоскелета мышечного волокна и титина (182). Это повышает возможность развития активного мышечного напряжения, развиваемого в сократительных элементах, увеличивая гипертрофическую реакцию. И амплитуда, и продолжительность возбуждения мышц определяется частотой активации ДЕ, кодирующих сигналы различных путей, в том числе Ca2+ кальмодулина фосфатазы кальцинейрином, CaMKII и CAMKIV, и РКС (26). По этим путям можно определить экспрессию гена, соединение мышечного возбуждения с транскрипцией (182).
Пассивное напряжение дает гипертрофическую реакцию волокон конкретного типа, а именно быстро сокращающихся, но не медленных. Это было продемонстрировано Prado et al. (139), которые обнаружили, что медленно сокращающиеся волокна у кроликов показали низкий уровень содержания титина, зато выявили высокий уровень у быстро сокращающихся волокон. Хотя, механическое напряжение может произвести мышечную гипертрофию, это вряд ли принесет гипертрофическую выгоду в целом (79). На самом деле, тренировки различной мощности и с различной степенью мышечного напряжения, в основном, вызывают лишь адаптацию нервной системы без результирующей гипертрофии (28, 188).
Повреждения мышц
Тренировка может привести к локализованным повреждениям мышечной ткани, которые, при определенных условиях, вызывают гипертрофическую реакцию (38, 69). Повреждение может быть специфическим всего для нескольких макромолекул ткани или привести к большим повреждениям сарколеммы, базальной мембраны и соединительной ткани. Повреждение может индуцировать повреждения сократительной части и цитоскелета (187). Поскольку самые слабые саркомеры могут быть расположены в разных частях миофибрилл, неодинаковое удлинение вызывает сдвиг миофибрилл. Это деформирует мембраны, частично Т-трубочки, что ведет к нарушению гомеостаза кальция и, следовательно, к повреждению от разрыва мембран и /или открытию каналов активируемых посредством растягивания (4). Реакцию на травму мышцы можно сравнить с острой реакцией на воспалительную инфекцию. После того, как повреждение воспринимается организмом, нейтрофилы мигрируют к области поврежденных мышечных волокон, затем удаляются посредством макрофагов и лимфоцитов. Макрофаги удаляют поврежденные части мышечных волокон для поддержания ультраструктуры и вырабатывают цитокины, которые активируют миобласты, макрофаги и лимфоциты. Считается, что это приводит к высвобождению различных факторов роста, которые регулируют пролиферацию клеток-сателлитов и их дифференцировку (182, 187). Высокая концентрация клеток-сателлитов, обеспечивает рост мышц (69, 155). Это приводит к тому, что нервы поврежденного волокна могут стимулировать активность клеток-сателлитов, тем самым способствуя гипертрофии (187).
Метаболический стресс
Многочисленные исследования поддерживают анаболическую роль индуцированного физической нагрузкой метаболического стресса (145, 149, 161) и некоторые полагают, что накопление метаболитов может быть важнее, чем развитие силы в оптимизации гипертрофической реакции при тренировке (153). Хотя метаболический стресс, кажется, не является важным компонентом мышечного роста, большое количество доказательств показывает, что, тем не менее, он может привести к значительному гипертрофическому эффекту, либо первичным, либо вторичным образом. Это можно заметить эмпирическим путем при тренировках умеренной мощности, которые проводились у большого количества бодибилдеров, которые предназначены для повышения метаболического стресса, сохраняя значительное мышечное напряжение. Метаболический стресс проявляется в результате упражнений анаэробного типа, что приводит к последующим накоплениям метаболитов, таких как лактат, ионы водорода, неорганический фосфат, креатин и другие (169, 178). При мышечной ишемии, также был выявлен метаболический стресс, и, возможно, это производит аддитивный гипертрофический эффект при сочетании с гликолитической тренировкой (136, 182). Стресс-индуцированные механизмы теоретически являются посредниками гипертрофической реакции, включают изменения гормональной среды, набухание клеток, производство свободных радикалов, и повышение активности факторов транскрипции, ориентированных на рост (50, 51, 171). Также была выдвинута гипотеза, что повышение кислотности среды, вызванное гликолитической тренировкой может привести к увеличению деградации волокон и большей стимуляции симпатической нервной системы, тем самым способствуя повышению адаптивного гипертрофического ответа (22).
Переменные тренировки и гипертрофия мышц
В соответствии с правилом специфичности, подбор тренировочных переменных имеет большое значение для максимизации гипертрофии мышц, вызванной упражнениями.
Ниже приводится обзор о том, как каждая переменная влияет на гипертрофию мышц относительно физиологических переменных, обсуждавшихся ранее.
Интенсивность
Интенсивность (то есть величина нагрузки), имеет большое влияние на гипертрофию мышц и является, пожалуй, самой важной переменной для стимулирования роста мышц (42). Интенсивность обычно выражают в процентах от массы отягощения, которое спортсмен может поднять один раз, что соответствует количеству повторений, которое может быть выполнено с заданным весом. Повторения классифицируются на три основных диапазона: низкий (1-5), умеренный (6-12) и высокий (15+). Каждый из этих диапазонов будет включать в себя использование различных энергетических систем и напряжения нервно-мышечной системы, по-разному влияя на степень гипертрофии (24, 71). При отсутствии искусственно индуцированной ишемии (то есть тренировки с окклюзией), масса отягощения, меньше, чем 65% от максимума не давала существенной гипертрофии (115). Хотя такая тренировка может вызвать большой метаболический стресс, такое отягощение недостаточно для активирования и утомления больших ДЕ. Вызывает ли низкий или умеренный диапазоны большую гипертрофическую реакцию, был вопрос дебатов. В конечном итоге, пришли к тому, что оба диапазона играют важную роль в увеличении мышц (24). Тем не менее, есть другое мнение, что умеренный диапазон, приблизительно 6-12 повторений, оптимизирует гипертрофическую реакцию (86, 89, 205).
Анаболическое превосходство умеренного диапазона было отнесено к факторам, связанным с метаболическим стрессом. Хотя низкое количество повторений выполняется почти исключительно за счет системы креатинфосфата, а умеренное количество повторения в значительной степени зависит от анаэробного гликолиза (144), это приводит к значительному накоплению метаболитов. Исследования упражнений бодибилдеров, выполняемые несколькими сетами, по 6-12 повторений, показали большое снижение АТФ, креатинфосфата и гликогена, наряду с существенным увеличением лактата в крови, внутримышечного лактата, глюкозы и глюкозы-6-фосфата (37,178). Рост этих метаболитов, как было показано, значительно влияет на анаболический процесс (96). Поэтому возможно, существует максимальный порог гипертрофии, вызванной напряжением, выше которого метаболические факторы становятся более важными, чем дополнительное увеличение нагрузки.
Как было показано, тренировка в умеренном диапазоне с метаболическим накоплением максимизирует высокую анаболическую гормональную реакцию упражнений. Уровень обоих гормонов: тестостерона и GH значительно повышается в программах тренировки, использующих диапазон повторений от 6 до 12 раз по сравнению с теми, кто использует диапазон повторений от 1 до 5 раза (57, 90, 92, 94, 114) , тем самым увеличивая потенциал для последующих клеточных взаимодействий, которые облегчают модернизацию мышечной ткани.
Тренировка в диапазоне от 6 до 12 повторений также максимизирует высокую клеточную гидратацию. Во время этой тренировки, вены, принимающие кровь из работающих мышц сжаты, в то время как артерии по-прежнему поставляют кровь в работающие мышцы, тем самым с%
Похожие записи:
Метаболический стресс. Накопление лактата в мышцах
Описан механизм влияния метаболического стресса (накопления лактата) на гипертрофию мышечных волокон. Показано, что накопление лактата приводит к…
Механическое повреждение мышечных волокон
Описаны механизмы механического повреждения мышечных волокон при силовой тренировке, приводящие к гипертрофии скелетных мышц. Показано, что…
Механическое напряжение (механотрансдукция) в скелетных мышцах
Описаны процессы передачи механического напряжения в скелетных мышцах. Показано, что механическое напряжение, возникающее вследствие сокращения скелетных…
Influence of the KAATSU Training on the Strength Endurance of the Muscles of the Lower Extremities in Qualified Football Players
Изучалось влияние KAATSU-тренинга на силовую выносливость мышц нижних конечностей квалифицированных футболистов. Установлены достоверные изменения в локальной силовой…
Миоглобин скелетных мышц
Дано определение миоглобина и описаны его структура и функции. Приведены данные о концентрации миоглобина в скелетных мышцах…
Упражнение и ограничение кровотока
В обзоре анализируются литературные источники, посвященные проблеме тренировки с ограничением кровотока. Авторы показали, что большое число исследований продемонстрировало…
Отсроченное начало болезненности мышц. Стратегии лечения и факторы эффективности
Описаны симптомы, причины, теории отсроченного начала болезненности мышц (запаздывающих болезненных ощущений, DOMS), а также способы уменьшения этих болей:…
Срочные гормональные ответы у элитных тяжелоатлетов-юниоров
Изучалось изменение концентрации в крови: тестостерона, кортизола, гормона роста, бета-эндорфина и лактата у тяжелоатлетов-юниоров…
Метод «до отказа» для развития силовых способностей человека
В статье рассмотрено применение низко- средне- и высокоинтенсивного метода «до отказа» для развития силы, силовой выносливости и…
Зависимость «сила-длина» мышцы
Описаны: история исследования зависимости «сила-длина мышцы», компоненты мышцы, зависимость «сила-длина» расслабленной (пассивной) и активной мышцы; «сила-длина»…
Саркоплазматическая гипертрофия мышц
Дано определение и описаны механизмы саркоплазматической гипертрофии скелетных мышц. Показано, что этот вид гипертрофии мышц широко…
Виды гипертрофии мышц
В статье дается классификация различных видов гипертрофии скелетных мышц человека на основе ряда классификационных признаков: времени проявления…
В разные периоды жизни человека, соматотропин вырабатывается в разном количестве, например, пик его приходится на период роста в детском и подростковом возрасте, после 25 лет выработка начинается замедляться и постепенно останавливается. Именно с этими процессами связано начало старения организма и ослабление иммунитета.
Если ребенок не получает достаточное количество гормона роста, то это приводит к различного рода задержкам: задержка роста, умственного и полового развития.
У мужчин и женщин гормон роста способствует меньшему накоплению жировых отложений, рост мышечной массы, регулирует углеводный обмен, нормализует выработку инсулина.
Особенно популярен вопрос о том, как повысить гормон роста у мужчин, так как он помогает активнее расти мышечной массе, что особенно важно для спортсменов.
Соматотропин вырабатывается у человека в любое время суток, однако, наиболее активно это происходит во время сна ночью, в момент получения питательных веществ с едой и в период физической активности.
В течение дня наибольшая выработка достигается каждые 3-5 часов и на ее активность влияет множество факторов. Суточный пик обычно приходится на второй-третий час сна человека.
Были проведены независимые исследования, которые доказали, что введение дополнительного гормона роста пожилым людям, существенно повышает их продолжительность жизни и замедляет старение органов.
Причины снижения соматотропина
На выработку соматотропина в организме влияет множество факторов, которые могут быть как генетическими, так и отражать образ жизни человека и факторы окружающей его среды. Основные факторы, которые не увеличивают, а подавляют выработку:
- наличие у человека гипергликемии (большое содержание сахара в крови);
- избыточное количество жирных кислот в крови;
- избыточная выработка надпочечниками стероидных гормонов;
- избыток вещества соматостатина, который вырабатывается в гипоталамусе;
- наличие в организме человека некоторых видов чужеродных бактерий и другое.
Таким образом, на малое количество гормона роста в большей степени влияют сопутствующие заболевания, либо генетические факторы.
Как повысить гормон роста естественным путем
Существует ряд биологических факторов, которые непосредственно влияют на выработку соматотропина
- физическая нагрузка – одно из самых действенных и натуральных способов повышения соматотропина. Сюда относятся не только занятия спортом в тренажерном зале и упражнения с большим весом, но и обычная физическая активность, которая в норме должна присутствовать в повседневной жизни;
- сон – человеку необходимо спать 6-8 часов в сутках, причем лучше всего это делать именно ночью, так как в темное время суток в организме усиливаются многие обменные процессы;
- нормальный уровень эстрогенов, как в женском, так и в мужском организме. Да, в этом плане у женщин, особенно в период созревания, гормона роста вырабатывается на порядок выше, нежели у мужчин;
- невысокое содержание сахара в крови также благоприятно влияет на соматотропный гормон;
- потребление в небольшом количестве некоторых аминокислот, которые являются составляющей частью соматотропина (глутамин, аргинин и другие);
- при нормальном уровне гормона грелина в организме, также будет вырабатываться и достаточное количество гормона роста.
Усиленный синтез может быть связан с неправильной работой щитовидной железы. Например, при гипертиреозе его количество значительно повышается, и данный аспект может служить основанием для проведения обследования щитовидной железы.
Для стимуляции выработки гормона и блокировки негативного действия других веществ, необходимо правильно питаться. Питание должно быть насыщено белками, полезными жирами и медленными углеводами, так сахара в кровь будет выбрасываться меньше, работа инсулина будет достаточной. В рационе должны присутствовать орехи, мясо рыбы, крупы с невысоким гликемическим индексом, яйца, творог и т.п.
Физические нагрузки
Как уже было отмечено, умеренная физическая активность хорошо стимулирует синтез гормона роста. Существует два основных вида такой активности: силовые и аэробные. К силовым относятся любые упражнения, в которых необходимо прикладывать физическую силу и при которых интенсивнее увеличивается мышечная масса, а к аэробным можно отнести бег, все виды ходьбы, лыжи, плавание и т.п. Наибольший успех для повышения гормона роста достигается при силовых нагрузках, однако, они не являются золотым стандартом, для организма лучше всего, когда те и другие виды сочетаются.
Для человека важно каждый день уделять время физической активности: это может быть не быстрая ходьба (желательно проходить в сутки не менее 8000 шагов), заниматься в тренажерном зале с гантелями, на специальных тренажерах или дома с небольшими весами.
Кроме того, что физическая активность помогает увеличить уровень гормона роста, это еще и благоприятно влияет на массу тела и способствует нормализации обменных процессов внутри организма. При физической активности увеличивается углеводный обмен – интенсивнее, что называется, «сгорают жиры» и вес человека уменьшается, а уменьшение веса благоприятно влияет на другие органы и система, также наблюдается снижение сахара в крови.
Как увеличить гормон роста в организме другими способами
Как уже упоминалось выше, для быстрого увеличения сухой мышечной массы, спортсмены прибегают к употреблению специальных веществ или их инъекциям. Метод искусственного введения можно назвать опасным, так как это создает дисбаланс гормональной системы, и могут проявиться побочные эффекты и даже развиться заболевания органов и тканей. Наиболее часто встречающиеся осложнения после приема синтетического гормона роста: увеличение сердца, значительное повышение сахара в крови, развитие опухолей и другое.
Только под присмотром специалиста можно подобрать безопасные препараты, стимулирующие гормон роста, которые не нанесут вред организму, так как будут подобраны индивидуально и назначены в соответствии со всеми нормами и правилами.
К какому врачу обратиться
Гормональная система человека – это полностью стезя врачей-эндокринологов, если какие-либо нарушения происходят в ней, либо необходимо вмешательство в данную систему, то наилучший вариант – это обратиться к специалисту.
Я, Романов Георгий Никитич, квалифицированный специалист, врач-эндокринолог с практикой более 20 лет. Я владею обширными классическими и современными знаниями в области эндокринологии. На моем счету множество благодарных клиентов, с которыми мы смогли нормализовать их ритм жизни.
Сегодня я веду практику не только в клинике, но и провожу онлайн консультации, на которые можно записаться лично у меня любым из представленных способов: ВКонтакте, instagram, WhatsApp, skype, Viber. На онлайн консультации я могу помочь расшифровать результаты инструментальных исследований, скорректировать лечение, ответить на интересующие Вас вопросы. Также я работаю с профессиональными спортсменами, помогаю подобрать необходимые препараты под особенности организма, контролирую процесс изменений, связанный с ними и др.
Выводы

Биохимические маркеры утомления и восстановления после физической нагрузки

В настоящее время появляется потребность оценки степени физической нагрузки или уровня жизнеспособности организма и его элементов, что является одной из ключевых задач профилактики травм и оценки степени тренированности футболистов. Такая оценка позволяет объективно зарегистрировать темп изнашиваемости организма и его изменения при лечебно-профилактических воздействиях. Существуют различные подходы к получению данной оценки, например можно измерять степень отклонения различных структурно-функциональных характеристик организма от нормы и таким образом оценивать степень их утомления и восстановления или износа. Однако, для разных органов и систем организма типичным является разновременное начало, разная степень выраженности и разнонаправленность этих изменений (обычно как результат развития компенсаторных процессов). Зачастую выявляется выраженное индивидуальное и видовое различие этих изменений. При выборе показателей для оценки интенсивности физической нагрузки (ФН) и утомляемости из огромного множества возможных биомаркеров следует учитывать ряд требований, выполнение которых существенно повышает информативность и качество оценки:
1. Показатель обязательно должен значительно изменяться (желательно в несколько раз) в промежутке времени от начала тренировки до периода восстановления (отдыха).
2. Показатель должен быть высоко коррелированным со степенью ФН и тренированностью спортсмена.
3. Межиндивидуальная дисперсия показателя не должна превышать величины изменения его среднего значения.
4. Должна иметь место низкая чувствительность выбранного показателя к болезням (болезни не должны имитировать изменение показателя).
5. Обязательно должно наблюдаться изменение показателя для всех членов популяции.
6. Показатель должен быть индикатором достаточно значимого процесса возрастной физиологии и должен иметь смысловую, морфологическую и функциональную интерпретацию, отражать степень физической тренированности организма или изношенности какой — либо системы.
Кроме этого, при определении биохимического маркера ФН желательно:
· учитывать показатели возраста;
· предусмотреть оценку степени тренированности по системам и органам;
· учитывать апробированные в мировой практике тесты и формулы;
· использовать современные средства информатики.
К настоящему времени, к сожалению, не имеется сравнительного анализа наборов биохимических показателей по каким-либо критериям качества. Пока что не удается однозначно ответить на вопрос, какое же число показателей оптимально для определения степени ФН и утомляемости. Ясно, однако, что увеличение числа показателей более 10-15 мало что дает в отношении точности определения ФН. Небольшое число показателей (3-4) не позволяет дифференцировать типы и профиль ответа организма на ФН.
В различных странах было сделано немало попыток использовать изменение биохимических параметров в качестве маркеров физиологической утомляемости, но все они были неизменно сопряжены с рядом трудностей, связанных с отсутствия четких нормативов. Поскольку различные системы и органы неравномерно реагируют на ФН, основное значение приобретает выбор наиболее информативного, «ведущего» для данного вида тренировки критерия. Очень важна его скоррелированность с другими параметрами биохимического статуса и одинаковость (тождество) состояния признака по завершению процессов утомляемости.
До конца нерешенным остается вопрос о том, какие же показатели максимально пригодны для определения утомляемости у футболистов ввиду их значительной физиологической и индивидуальной вариации. Для ответа на этот вопрос полезно учитывать отношение изменения показателя в течение тренировочного процесса к межиндивидуальному разбросу.
Приказ 337 2001 года (выписка)
3.2. Лабораторные исследования:
3.2.1. Клинический анализ крови;
3.2.2. Клинический анализ мочи;
3.2.3. Клинико — биохимический анализ крови из вены для:
— Определения регуляторов энергетического метаболизма: кортизола, тестостерона, инсулина;
-Оценки тиреоидного статуса: Т3 общий, Т4 общий, ТТГ(тиреотропин);
— Оценки уровня ферментов: АЛТ (аланинаминотрансфераза), ACT (аспартатаминотрансфераза), Щелочная фосфотаза, КФК (креатинфосфокиназа).
— Оценки биохимических показателей: глюкозы, холестерина, триглицеридов, фосфора.
Все перечисленные показатели практически в произвольных сочетаниях используются теми ли иными школами по определению степени утомляемости. Оптимальным, видимо, является набор из наиболее отличающихся тестов, охватывающих различные системы и органы и отражающий:
· возрастную физиологию,
· пределы адаптации и функциональные резервы,
· физическую и нервно-психическую работоспособность,
· характеристики наиболее важных систем.
В практике спорта обычно используется определение активности и содержания;
• энергетических субстратов (АТФ, КрФ, глюкоза, свободные жирные кислоты);
• ферментов энергетического обмена (АТФ-аза, КрФ-киназа, цитохромоксидаза, лактатдегидрогеназа и др.);
• промежуточных и конечных продуктов обмена углеводов, липидов и белков (молочная и пировиноградная кислоты, кетоновые тела, мочевина, креатинин, креатин, мочевая кислота, углекислый газ и др.);
• показателей кислотно-основного состояния крови (рН крови, парциальное давление СО2, резервная щелочность или избыток буферных оснований и др.);
• регуляторов обмена веществ (ферменты, гормоны, витамины, активаторы, ингибиторы);
• минеральных веществ в биохимических жидкостях (бикарбонаты и соли фосфорной кислоты определяют для характеристики буферной емкости крови);
• белка и его фракций в плазме крови.
В настоящем докладе мы ограничимся общим обзором предлагаемых показателей, систематизацией их по классам и возможностью использованием для оценки интенсивности воздействия ФН на различные системы организма. Как показывают исследования, по изменениям субстратов, происходящих в тренированном организме и находящих своё отражение, как в структуре мышц, так и в интегральной форме — в крови, являются отражением окислительных процессов в мышцах. Изучая скорость мобилизации и утилизации энергетических субстратов, при том или ином виде нагрузки в динамике тренировочного процесса, можно составить представления о том, в какой фазе находится формирование основного качества, определяющего выносливость, скоростно-силовые качества, окислительные способности работающих мышц.
Показатели углеводного обмена.
Глюкоза. Изменение ее содержания в крови при мышечной деятельности индивидуально и зависит от уровня тренированности организма, мощности и продолжительности физических упражнений. Кратковременные физические нагрузки субмаксимальной интенсивности могут вызывать повышение содержания глюкозы в крови за счет усиленной мобилизации гликогена печени. Длительные физические нагрузки приводят к снижению содержания глюкозы в крови. У нетренированных лиц это снижение более выражено, чем у тренированных. Повышенное содержание глюкозы в крови свидетельствует об интенсивном распаде гликогена печени либо относительно малом использовании глюкозы тканями, а пониженное ее содержание — об исчерпании запасов гликогена печени либо интенсивном использовании глюкозы тканями организма.
По изменению содержания глюкозы в крови судят о скорости аэробного окисления ее в тканях организма при мышечной деятельности и интенсивности мобилизации гликогена печени. Этот показатель обмена углеводов редко используется самостоятельно в спортивной диагностике, так как уровень глюкозы в крови зависит не только от воздействия физических нагрузок на организм, но и от эмоционального состояния человека, гуморальных механизмов регуляции, питания и других факторов.
Появление глюкозы в моче при физических нагрузках свидетельствует об интенсивной мобилизации гликогена печени. Постоянное наличие глюкозы в моче является диагностическим тестом заболевания сахарным диабетом.
Органические кислоты. Этот анализ позволяет обнаруживать метаболические нарушения, связываемые с генерализованной болью и утомляемостью, причинами возникновения которых считают реакцию на токсическую нагрузку, дисбаланс питательных веществ, пищеварительную дисфункцию и другие факторы. Этот анализ позволяет получить важную клиническую информацию о: органических кислотах, которые точно отражают углеводный метаболизм, функцию митохондрий и бета-окисление жирных кислот; дисфункции митохондрий, которая может лежать в основе хронических симптомов фибромиалгии, утомляемости, недомоганий, гипотонии (ослабления мышечного тонуса), нарушения кислотно-основного баланса, низкой переносимости физических нагрузок, боли в мышцах и суставах, а также головной боли. Нормальное здоровье и самочувствие зависят от здорового функционирования клеток. В каждой клетке имеется митохондрия, работающая как «электростанция». Основная функция митохондрии — эффективно производить требуемую для жизни энергию. Профиль клеточной энергии измеряет специально подобранные группы органических кислот. Эти метаболиты в основном отражают углеводный метаболизм, функционирование митохондрий и окисление жирных кислот, которое происходит в процессе дыхания клетки. Измеряемые в ходе данного анализа органические кислоты являются основными компонентами и промежуточными элементами метаболических путей преобразования энергии, связанных с циклом Кребса и производством аденозинтрифосфата — основного источника энергии клеток. Этот профиль может оказаться особенно полезным для пациентов с хроническим недомоганием, фибромиалгией, утомляемостью, гипотонией (ослаблением мышечного тонуса), нарушением кислотно-щелочного баланса, плохой переносимостью физических нагрузок, болями в мышцах или суставах, а также головной болью. Органические кислоты играют главенствующую роль в выработке энергии для мышечной ткани. Поэтому дефекты митохондрий связаны с множеством нервно-мышечных нарушений. Накопление лактата, естественного для анаэробного гликолиза вещества, в плазме свидетельствует об истощении окислительного метаболического потенциала вследствие возрастания энергетических потребностей. Гликолитический механизм ресинтеза АТФ в скелетных мышцах заканчивается образованием молочной кислоты, которая затем поступает в кровь. Выход ее в кровь после прекращения физической нагрузки происходит постепенно, достигая максимума на 3—7-й минуте после окончания ФН. Содержание молочной кислоты в крови существенно возрастает при выполнении интенсивной физической работы. При этом накопление ее в крови совпадает с усиленным образованием в мышцах. Значительные концентрации молочной кислоты в крови после выполнения максимальной работы свидетельствуют о более высоком уровне тренированности при хорошем спортивном результате или о большей метаболической емкости гликолиза, большей устойчивости его ферментов к смещению рН в кислую сторону. Таким образом, изменение концентрации молочной кислоты в крови после выполнения определенной физической нагрузки связано с состоянием тренированности спортсмена. По изменению ее содержания в крови определяют анаэробные гликолитические возможности организма, что важно при отборе спортсменов, развитии их двигательных качеств, контроле тренировочных нагрузок и хода процессов восстановления организма.
Показатели липидного обмена.
Свободные жирные кислоты. Являясь структурными компонентами липидов, уровень свободных жирных кислот в крови отражает скорость липолиза триглицеридов в печени и жировых депо. В норме содержание их в крови составляет 0,1—0,4 ммоль • л»1 и увеличивается при длительных физических нагрузках.
По изменению содержания СЖК в крови контролируют степень подключения липидов к процессам энергообеспечения мышечной деятельности, а также экономичность энергетических систем или степень сопряжения между липидным и углеводным обменом. Высокая степень сопряжения этих механизмов энергообеспечения при выполнении аэробных нагрузок является показателем высокого уровня функциональной подготовки спортсмена.
Кетоновые тела. Образуются они в печени из ацетил-КоА при усиленном окислении жирных кислот в тканях организма. Кетоновые тела из печени поступают в кровь и доставляются к тканям, в которых большая часть используется как энергетический субстрат, а меньшая выводится из организма. Уровень кетоновых тел в крови отражает скорость окисления жиров. При накоплении в крови (кетонемия) они могут появиться в моче, тогда как в норме в моче кетоновые тела не выявляются. Появление их в моче (кетонурия) у здоровых людей наблюдается при голодании, исключении углеводов из рациона питания, а также при выполнении физических нагрузок большой мощности или длительности.
По увеличению содержания кетоновых тел в крови и появлению их в моче определяют переход энергообразования с углеводных источников на липидные при мышечной активности. Более раннее подключение липидных источников указывает на экономичность аэробных механизмов энергообеспечения мышечной деятельности, что взаимосвязано с ростом тренированности организма.
Холестерин. Это представитель стероидных липидов, не участвующий в процессах энергообразования в организме. Однако, систематические физические нагрузки могут привести к его снижению в крови. Можно выделить три типа изменения (повышение, снижение и не изменяющееся) содержание общего холестерина после мышечного усилия. Характер изменений холестерина зависит от его исходного уровня: при более высоком содержании общего холестерина отмечается его снижение в ответ на нагрузку, при относительно низком, наоборот, происходит его увеличение. У спортсменов имеет место увеличение содержания холестерина как в покое, так и после физической нагрузки.
Фосфолипиды. Содержание фосфолипидов отражает выраженность нарушений липидного обмена связанного с дистрофией печени. Повышение их уровня в крови наблюдается при диабете, заболеваниях почек, гипофункции щитовидной железы и других нарушениях обмена, понижение — при жировой дистрофии печени. Поскольку длительные физические нагрузки сопровождаются жировой дистрофией печени, в спортивной практике иногда используют контроль содержания триглицеридов и фосфолипидов в крови.
Продукты перекисного окисления липидов (ПОЛ). При интенсивных физических нагрузках усиливаются процессы перекисного окисления липидов и в крови накапливаются продукты этих процессов, что является одним из факторов, лимитирующих физическую работоспособность. Две составляющие этого механизма: уровень перекисных процессов в скелетной мышце и вовлечение лейкоцитов в процесс повреждения. ФН вызывает усиление перекисных процессов в скелетных мышцах при снижении активности основного фермента антиоксидантной защиты – супероксиддисмутазы, что приводит к повреждению целостности мембран миоцитов. Результатом повреждения клеточной мембраны является изменение ее проницаемости и выход в кровь как цитоплазматических (миоглобин, аспартатаминотрансфераза), так и структурных (тропомиозин) белков скелетной мышцы. Повреждение ткани при гипоксии и вследствие развития процесса перекисного окисления при восстановлении кровотока (реперфузия) стимулирует привлечение в очаг повреждения лейкоцитов которые в следствие активации выделяют большое количество активных форм кислорода (ОМГ-тест) тем самым разрушая здоровые ткани. Через одни сутки после интенсивной физической нагрузки активность гранулоцитов крови выше контрольного значения примерно в 7 раз и на этом уровне сохраняется в течение последующих 3 суток, затем начинает снижаться, превышая, однако, контрольный уровень и через 7 суток восстановления.
Биохимический контроль реакции организма на физическую нагрузку, оценка специальной подготовленности спортсмена, выявления глубины биодеструктивных процессов при развитии стресс-синдрома должены включать определение содержания продуктов перекисного окисления в крови: малонового диальдегида, диеновых конъюгатов, а также активность ферментов глутатионпероксидазы, глутатионредуктазы и каталазы, супероксиддисмутазы. Перекисное повреждение белковых веществ приводит к их деградации и образованию токсических фрагментов, в том числе, молекул средней массы (МСМ), которые принято считать маркерами эндогенной интоксикации в том числе у спортсменов после интенсивной ФН.
Показатели белкового обмена
Гемоглобин. Основным белком эритроцитов крови является гемоглобин, который выполняет кислородтранспортную функцию. Он содержит железо, связывающее кислород воздуха. При мышечной деятельности резко повышается потребность организма в кислороде, что удовлетворяется более полным извлечением его из крови, увеличением скорости кровотока, а также постепенным увеличением количества гемоглобина в крови за счет изменения общей массы крови. С ростом уровня тренированности спортсменов в видах спорта на выносливость концентрация гемоглобина в крови возрастает. Увеличение содержания гемоглобина в крови отражает адаптацию организма к физическим нагрузкам в гипоксических условиях. Однако при интенсивных тренировках, происходит разрушение эритроцитов крови и снижение концентрации гемоглобина, что рассматривается как железодефицитная «спортивная анемия». В таком случае следует изменить программу тренировок, а в рационе питания увеличить содержание белковой пищи, железа и витаминов группы В.
По содержанию гемоглобина в крови можно судить об аэробных возможностях организма, эффективности аэробных тренировочных занятий, состоянии здоровья спортсмена. Гематокрит — это доля (%) от общего объема крови, которую составляют эритроциты. Гематокрит отражает соотношение эритроцитов и плазмы крови и при адаптации к физической нагрузке имеет исключительно важное значение. Определение его позволяет оценить состояние кровообращения в микроциркуляторном русле и определить факторы, затрудняющие доставку кислорода в ткани. Гематокрит при ФН возрастает в результате чего увеличивается способность крови транспортировать кислород к тканям. Однако это имеет и отрицательную сторону — приводит к повышению вязкости крови, что затрудняет кровоток и ускоряет время свертывания крови. Повышение уровня гемоглобина в крови обусловлено уменьшением плазмы крови в результате трансфузии жидкости из кровяного русла в ткани и выходом эритроцитов из депо.
Ферритин. Самый информативный индикатор запасов железа в организме, основная форма депонированного железа. В физиологических условиях метаболизма железа ферритин играет важную роль в поддержании железа в растворимой, нетоксичной и биологически полезной форме. Во время физической нагрузки снижение уровня ферритина свидетельствует о мобилизации железа для синтеза гемоглобина, выраженное снижение – о наличии скрытой железодифицитной анемии. Повышенный уровень сывороточного ферритина отражает не только количество железа в организме, но и является проявлением острофазного ответа на воспалительный процесс. Тем не менее, если у пациента действительно имеется дефицит железа, острофазное повышение его уровня не бывает значительным.
Трансферин. Плазменный белок, гликопротеин — основной переносчик железа. Синтез трансферрина осуществляется в печени и зависит от функционального состояния печени, от потребности в железе и резервов железа в организме. Трансферрин участвует в транспорте железа от места его всасывания (тонкая кишка) до места его использования или хранения (костный мозг, печень, селезенка). При снижении концентрации железа синтез трансферррина возрастает. Снижение процента насыщения трансферрина железом (следствие снижения концентрации железа и роста концентрации трансферрина) указывает на анемию, обусловленную недостатком поступления железа. Длительная интенсивная ФН может привести к увеличению содержания этого транспортного белка в крови. У нетренированных спортсменов ФН может вызвать снижение его уровня.
Миоглобин. В саркоплазме скелетных и сердечной мышц находится высокоспециализированный белок, выполняющий функцию транспорта кислорода подобно гемоглобину. Под влиянием физических нагрузок, при патологических состояниях организма он может выходить из мышц в кровь, что приводит к повышению его содержания в крови и появлению в моче (миоглобинурия). Количество миоглобина в крови зависит от объема выполненной физической нагрузки, а также от степени тренированности спортсмена. Поэтому данный показатель может быть использован для диагностики функционального состояния работающих скелетных мышц.
Актин. Содержание актина в скелетных мышцах в качестве структурного и сократительного белка существенно увеличивается в процессе тренировки. По его содержанию в мышцах можно было бы контролировать развитие скоростно-силовых качеств спортсмена при тренировке, однако определение его содержания в мышцах связано с большими методическими затруднениями. Тем не менее, после выполненных физических нагрузок отмечается появление актина в крови, что свидетельствует о разрушении либо обновлении миофибриллярных структур скелетных мышц.
Белки свертывающей системы крови. «Возраст человека — есть возраст его сосудов» (Демокрит) и данной точки зрения придерживаются большинство современных исследователей. Поэтому весьма актуальным является вопрос стандартизации гемостазиологических критериев утомляемости и оценки степени ФН по оценке эффективности микроциркуляции в организме. Гетерохронность процесса утомления и восстановления подразумевает неравномерность темпов утомляемости отдельных систем человека. Система гемостаза является в филогенетическом смысле наиболее древней и отражает генерализованные изменения, происходящие на уровне целостного организма. Она является наиболее мобильной системой и высокочувствительна к любым нарушениям во внутренней среде организма. Для изучения микроциркуляции и гемостазиограммы определяют уровень фибриногена (ФГ), число тромбоцитов (Тг), активированное парциальное тромбопластиновое время (АПТВ), фибринолитическую активность (ФА), концентрацию растворимых фибринмономерных комплексов (РФМК), уровень антитромбина III (ATIII).
Общий белок. Он определяет физико — химические свойства крови- плотность, вязкость, онкотическое давление. Белки плазмы являются основными траспортными белкамим. Альбумины и глобулины. Это низкомолекулярные основные белки плазмы крови. Они выполняют разнообразные функции .в организме: входят в состав иммунной системы, защищают организм от инфекций, участвуют в поддержании рН крови, транспортируют различные органические и неорганические вещества, используются для построения других веществ. Количественное соотношение их в сыворотке крови в норме относительно постоянно и отражает состояние здоровья человека. Соотношение этих белков изменяется при утомлении, многих заболеваниях и может использоваться в спортивной медицине как диагностический показатель состояния здоровья.
Альбумины — самая однородная фракция белков плазмы. Основная их функция заключается в поддержании онкотического давления. Кроме того большая поверхность молекул альбумина играет существенную роль в переносе жирных кислот, билирубина, солей желчных кислот. Альбумины частично связывают значительную часть ионов кальция. После выполнения физической нагрузки концентрация белка в сыворотке крови, взятой натощак не изменяется. Альфа-глобулины — фракция белков, включающая гликопротеиды. Основная функция — перенос углеводородов, так же транспортные белки для гормонов, витаминов и микроэлементов. Осуществляют транспорт липидов (триглицеридов, фосфолипидов, холестерина. После выполнения нагрузки спортсменами концентрация альфа-глобулинов в крови, взятой натощак снижается по сравнению с уровнем покоя. Бета-глобулины — фракция белков крови участвующая в транспорте фосфолипидов, холестерина, стероидных гормонов, катионов, осуществляет перенос железа кровью. После выполнения спортсменами ФН концентрация бета-глобулинов в крови заметно увеличивается. Гамма-глобулины. В эту фракцию входят различные антитела. Основная функция иммуноглобулинов – защитная. Содержание гамма-глобулинов в сыворотке крови после физической нагрузки уменьшается.
Аммиак. Гипоперфузия скелетных мышц при ФН приводит к клеточной гипоксии, что наряду с другими факторами обусловливает симптомы утомляемости. Мышечная утомляемость — неспособность мышц поддерживать мышечное сокращение заданной интенсивности — связана с избытком аммиака, который усиливает анаэробный гликолиз, блокируя выход молочной кислоты. Повышение уровня аммиака и ацидоз лежат в основе метаболических нарушений при мышечной утомляемости. Причиной последней являются нарушения митохондриального метаболизма, усиление катаболизма белковых структур. Накопление аммиака стимулирует гликолиз путем блокирования аэробного использования пирувата и повторного запуска глюконеогенеза, что приводит к избыточному образованию лактата. Для указанного процесса, представляющего порочный круг, используется термин «метаболическая смерть». Накопление молочной кислоты и ацидоз приводят к гликолизу и «параличу» энергетических процессов. Ион аммония, влияя на метаболизм, стимулирует гиперпноэ, что усугубляет утомление. Снижение сократительной способности мышц сопровождается повышением уровня аммиака в крови и клетке. Усиленный ацидоз и чрезмерно высокий уровень аммиака не позволяют сохранять структуру клетки. Следствием этого является повреждение миофибрилл. В действительности имеет место усиленный катаболизм мышечных белков, затрагивающий скелетную мускулатуру. Это может быть измерено по выделению с мочой 3-метил-гистидина, специфического метаболита мышечных белков. В результате перетренировки возникает истощение резервов глюкозы и липидов, связанное с экстремальным кислотно-основным состоянием. Усиленный ацидоз и чрезмерно высокий уровень аммиака не позволяют сохранять структуру клетки. Гипераммониемия является признаком нарушения метаболизма в мышце и связана с состоянием утомления.
Мочевина. При усиленном распаде тканевых белков, избыточном поступлении в организм аминокислот в печени в процессе связывания токсического для организма человека аммиака (МН3) синтезируется нетоксическое азотсодержащее вещество — мочевина. Из печени мочевина поступает в кровь и выводится с мочой. Концентрация мочевины в норме в крови каждого взрослого человека индивидуальна. Она может увеличиваться при значительном поступлении белков с пищей, при нарушении выделительной функции почек, а также после выполнения длительной физической работы за счет усиления катаболизма белков. В практике спорта этот показатель широко используется при оценке переносимости спортсменом тренировочных и соревновательных физических нагрузок, хода тренировочных занятий и процессов восстановления организма. Для получения объективной информации концентрацию мочевины определяют на следующий день после тренировки утром натощак. Если выполненная физическая нагрузка адекватна функциональным возможностям организма и произошло относительно быстрое восстановление метаболизма, то содержание мочевины в крови утром натощак возвращается к норме. Связано это с уравновешиванием скорости синтеза и распада белков в тканях организма, что свидетельствует о его восстановлении. Если содержание мочевины на следующее утро остается выше нормы, то это свидетельствует о недовосстановлении организма либо развитии его утомления.
Обнаружение белка в моче. У здорового человека белок в моче отсутствует. Появление его (протеинурия) отмечается при заболевании почек (нефрозы), поражении мочевых путей, а также при избыточном поступлении белков с пищей или после мышечной деятельности анаэробной направленности. Это связано с нарушением проницаемости клеточных мембран почек из-за закисления среды организма и выхода белков плазмы в мочу. По наличию определенной концентрации белка в моче после выполнения физической работы судят о ее мощности. Так, при работе в зоне большой мощности она составляет 0,5 %, при работе в зоне субмаксимальной мощности может достигать 1,5 %.
Креатинин. Это вещество образуется в мышцах в процессе распада креатинфосфата. Суточное выделение его с мочой относительно постоянно для данного человека и зависит от мышечной массы тела. По содержанию креатинина в моче можно косвенно оценить скорость креатинфосфокиназной реакции, а также содержание мышечной массы тела. По количеству креатинина, выделяемого с мочой, определяют содержание тощей мышечной массы тела согласно следующей формуле:
тощая масса тела = 0,0291 х креатинин мочи (мг • сут~1) + 7,38.
Креатин. Креатин — это вещество, которое синтезируется в печени, поджелудочной железе и почках из аминокислот аргинина, глицина и метионина. Образуется из фосфокреатина ферментом креатинкиназой. Наличие такого энергетического запаса сохраняет уровень АТФ/АДФ в тех клетках, где необходимы высокие концентрации АТФ. Фосфокреатинкиназная система работает в клетке как внутриклеточная система передача энергии от тех мест, где энергия запасается в виде АТФ (митохондрия и реакции гликолиза в цитоплазме) к тем местам, где требуется энергия (миофибриллы в случае мышечного сокращения). Особенно большое количество креатина содержится в мышечной ткани, где он играет важную роль в процессах энергетического обмена. Тяжелый, высокоинтенсивный тренинг приводит к дефициту фосфоркреатина. Именно этим объясняется физическое утомление, которое нарастает от упражнения к упражнению и достигает пика к концу тренировки. Обнаружение его в моче может использоваться как тест для выявления перетренировки и патологических изменений в мышцах. Увеличение концентрации креатина в эритроцитах является специфическим признаком гипоксии любого происхождения и свидетельствует об увеличении числа молодых клеток, т.е. о стимуляции эритропоэза (в молодых эритроцитах его содержание в 6-8 раз превышает таковое в старых).
Аминокислоты. Анализ аминокислот (мочи и плазмы крови) является незаменимым средством оценки достаточности и степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических нарушений при утомляемости после ФН. Жизнь без аминокислот невозможна. В свободной форме или в связанном виде как пептиды они играют важную роль в таких процессах, как нейротрансмиттерная функция, регуляция рН, метаболизм холестерина, контроль боли, детоксикация и контроль воспалительных процессов. Аминокислоты являются строительными блоками всех гормонов и структурных тканей организма. Поскольку все эти соединения получаются или строятся из аминокислот, то оценка поступления «незаменимых» аминокислот с пищей, их достаточности, правильности баланса между ними и активностью ферментов, которые превращают их в гормоны, имеет основополагающее значение для выяснения исходной причины многих хронических нарушений. Анализ аминокислот, позволяет получить информацию о широком спектре нарушений обмена веществ и питания, включая белковые отклонения, хроническую усталость.
Показатели кислотно-основного состояния (КОС) организма. В процессе интенсивной мышечной деятельности в мышцах образуется большое количество молочной и пировиноградной кислот, которые диффундируют в кровь и могут вызывать метаболический ацидоз организма, что приводит к утомлению мышц и сопровождается болями в мышцах, головокружением, тошнотой. Такие метаболические изменения связаны с истощением буферных резервов организма. Поскольку состояние буферных систем организма имеет важное значение в проявлении высокой физической работоспособности, в спортивной диагностике используются показатели КОС — рН крови, ВЕ избыток оснований, или щелочной резерв, рСО2 — парциальное давление углекислого газа, ВВ — буферные основания цельной крови. Показатели КОС отражают не только изменения в буферных системах крови, но и состояние дыхательной и выделительной систем организма в том числе после ФН. Существует корреляционная зависимость между динамикой содержания лактата в крови и изменением рН крови. По изменению показателей КОС при мышечной деятельности можно контролировать реакцию организма на физическую нагрузку. Наиболее информативным показателем КОС является величина ВЕ — щелочной резерв, который увеличивается с повышением квалификации спортсменов, особенно специализирующихся в скоростно-силовых видах спорта.
Активная реакция мочи (рН) находится в прямой зависимости от кислотно-основного состояния организма. При метаболическом ацидозе кислотность мочи увеличивается до рН 5, а при метаболическом алкалозе снижается до рН 7.
Регуляторы обмена веществ.
Ферменты. Особый интерес в спортивной диагностике представляют тканевые ферменты, которые при различных функциональных состояниях организма поступают в кровь из скелетных мышц и других тканей. Такие ферменты называются клеточными, или индикаторными. К ним относятся альдолаза, каталаза, лактатдегидрогеназа, креатинкиназа. Повышение в крови индикаторных ферментов или их отдельных изоформ связано с нарушением проницаемости клеточных мембран тканей и может использоваться при биохимическом контроле за функциональным состоянием спортсмена. Результатом повреждения клеточной мембраны является выход в кровь цитоплазматических (миоглобин, аспартатаминотрансфераза) и структурных (тропомиозин) белков скелетной мышцы. Диагностика микроповреждений мышечной ткани (ММТ) базируется на измерении активности в плазме крови саркоплазматических ферментов (креатинкиназы лактатдегидрогеназы). Повышение их активности в плазме крови отражает значительное изменение проницаемости мембранных структур миоцита, вплоть до его полного разрушения. Данный факт отражает адаптацию организма спортсмена к ФН высокой интенсивности. При постановке диагноза микроповреждения используется комбинация из биологических и клинических параметров — например, активность ЛДГ и КФК в плазме, концентрация миоглобина и малондиальдегида, уровень лейкоцитов, а также физиологические параметры мышцы.
Появление в крови ферментов процессов биологического окисления веществ альдолазы (фермент гликолиза) и каталазы (фермент, осуществляющий восстановление перекисей водорода) после физических нагрузок является показателем неадекватности физической нагрузки, развития утомления, а скорость их исчезновения свидетельствует о скорости восстановления организма. Если физическая нагрузка вызывает значительный выход ферментов в кровь из тканей и они долго сохраняются в ней в период отдыха, это свидетельствует о невысоком уровне тренированности спортсмена, а, возможно, и о предпатологическом состоянии организма.
Гормоны. К показателям функциональной активности организма можно отнести: особенности метаболизма в целом, активность ряда ферментов, количественная секреция многих гормонов. Поэтому важно исследовать взаимосвязь этих показателей с ФН. Неоспоримо влияние мышечной нагрузки на состояние внутренней среды организма. В крови могут определяться более 20 различных гормонов, регулирующих разные звенья обмена веществ. Величина изменения содержания гормонов в крови зависит от мощности и длительности выполняемых нагрузок, а также от степени тренированности спортсмена. При работе одинаковой мощности у более тренированных спортсменов наблюдаются менее значительные изменения этих показателей в крови. Кроме того, по изменению содержания гормонов в крови можно судить об адаптации организма к физическим нагрузкам, интенсивности регулируемых ими метаболических процессов, развитии процессов утомления, применении анаболических стероидов и других гормонов.
Физическая нагрузка сама по себе значительно увеличивает уровень многих гормонов в крови и не только во время выполнения самого упражнения. После начала выполнения непрерывного упражнения, например, субмаксимальной мощности, в течение первых 3-10 минут в крови уровень многих метаболитов и гормонов изменяется совершенно непредсказуемо. Этот период «врабатывания» вызывает некоторую десинхронизацию в уровне регуляторных факторов. Однако некоторые закономерности таких изменений все же существуют. Освобождение гормонов в кровоток при физической нагрузке представляет собой набор каскадных реакций. Упрощенная схема этого процесса может выглядеть примерно так: физическая нагрузка — гипоталамус, гипофиз — высвобождение тропных гормонов и эндорфинов — железы внутренней секреции — высвобождение гормонов — клетки и ткани организма.
Профиль гормонов служит важным средством выявления скрытых биохимических нарушений, лежащих в основе хронической усталости. Изучение уровня кортизола в крови целесообразно для оценки мобилизационных резервов организма. Он рассматривается как основной «гормон стресса», и увеличение его концентрации в крови является ответной реакцией организма на физические, физиологические и психологические нагрузки. Избыточные количества кортизола могут негативно влиять на костную и мышечную ткань, сердечно-сосудистую функцию, иммунную защиту, функцию щитовидной железы, контроль массы тела, сон, регуляцию уровня глюкозы и ускорять процесс старения. Высокий уровень кортизола после тренировки характеризуется недовосстановлением организма спортсменов после предшествующей нагрузки.
В спортивной медицине для выявления утомления обычно определяют содержание гормонов симпато-адреналовой системы (адреналина, норадреналин, серотонин) в крови и моче. Эти гормоны отвечают за степень напряжения адаптационных изменений в организме. При неадекватных функциональному состоянию организма физических нагрузках наблюдается снижение уровня не только гормонов, но и предшественников их синтеза (дофамин) в моче, что связано с исчерпанием биосинтетических резервов эндокринных желез и указывает на перенапряжение регуляторных функций организма контролирующих адаптационные процессы.
Гормон роста (соматотропный гормон), инсулинподобный фактор роста (Соматомедин С). Основные физиологические эффекты гормона роста: ускорение роста тканей тела — специфическое действие; усиление синтеза белков и повышение проницаемости мембран клеток для аминокислот; ускорение расщепление глюкозы и окисление жиров. Его эффекты проявляются в облегчении утилизации глюкозы тканями, активации в них синтеза белка и жира, повышения транспорта аминокислот через клеточную мембрану. Эти эффекты характерны для кратковременного действия соматотропина. Интенсивная ФН приводит к снижению концентрации гормона в сыворотке крови, взятой натощак. При увеличении продолжительности ФН в кровотоке концентрация соматотропина увеличивается.
Паратгормон и кальцитонин принимают участие в регуляции содержания кальция и фосфатов. Паратгормон осуществляет действие, активируя аденилатциклазу и стимулируя образование цАМФ внутри клетки. Основное назначение инсулина — повышает потребление глюкозы тканями, вследствие чего понижается содержание сахара в крови. Он влияет на все виды обмена веществ, стимулирует транспорт веществ через клеточные мембраны, тормозит липолиз и активирует липогенез. Снижение концентрации инсулина в крови под влиянием мышечной работы, становится значительным уже через 15-20 минут после физической нагрузки. Причина изменения уровня инсулина в крови во время работы заключается в угнетении его секреции, что обуславливает увеличение выработки глюкозы. Концентрация гормона в крови зависит от скорости окисления глюкозы и от уровня других гормонов участвующих в регуляции содержания. После выполнения физической нагрузки спортсменами концентрация гормона в крови, взятой натощак, снижается.
Паратгормон и кальцитонин необходимы для обеспечения работоспособности, и при мышечной работе имеет место повышение уровня кальцитонина и паратгормона в крови. Наиболее значительно различалось содержание кальцитонина в плазме крови. Занятия спортом оказали значительное влияние на исследуемые вещества. Скорее всего это связано с адаптацией спортсменов к высокому уровню двигательной активности.
Тестостерон. Тестостерон оказывает анаболические эффекты на мышечную ткань, способствует созреванию костной ткани, стимулирует образование кожного сала железами кожи, участвует в регуляции синтеза липопротеидов печенью, модулирует синтез b-эндорфинов («гормонов радости»), инсулина. У мужчин обеспечивает формирование половой системы по мужскому типу, развитие мужских вторичных половых признаков в пубертатном периоде, активирует половое влечение, сперматогенез и потенцию, отвечает за психофизиологические особенности полового поведения.
Спортивным врачам очень хорошо известно, что в нашем современном промышленном обществе существуют две крайности: люди, которые с чрезмерным энтузиазмом устремляются в спорт и в свое свободное время настолько же нацелены на достижение результатов, как и на работе; и люди, которые занимаются спортом слишком мало. Обе крайности отрицательно сказываются на уровне тестостерона. Изнуряющие физические нагрузки (например, марафон) понижают уровень тестостерона почти в той же степени, что и отсутствие физической активности. В наше время проблема заключается в перегрузках, возникающих в результате интенсивных спортивных тренировок, что, как представляется, влечет за собой значительное снижение уровня тестостерона в крови.
Максимальная физическая нагрузка приводит к увеличению концентрации в крови адренокортикотропного гормона, соматотропного гормона, кортизола и трийодтиронина и снижению содержания инсулина. При длительной ФН концентрации кортизола и индекса тестостерон/кортизол снижается.
Витамины. Выявление витаминов в моче входит в диагностический комплекс характеристики состояния здоровья спортсменов, их физической работоспособности. В практике спорта чаще всего выявляют обеспеченность организма водорастворимыми витаминами, особенно витамином С. В моче витамины появляются при достаточном обеспечении ими организма. Данные многочисленных исследований свидетельствуют о недостаточной обеспеченности многих спортсменов витаминами, поэтому контроль их содержания в организме позволит своевременно скорректировать рацион питания или назначить дополнительную витаминизацию путем приема специальных поливитаминных комплексов.
Минеральные вещества. В мышцах образуется неорганический фосфат в виде фосфорной кислоты (Н3Р04) при реакциях перефосфорилирования в креатинфосфокиназном механизме синтеза АТФ и других процессах. По изменению его концентрации в крови можно судить о мощности креатинфосфокиназного механизма энергообеспечения у спортсменов, а также об уровне тренированности, так как прирост неорганического фосфата в крови спортсменов высокой квалификации при выполнении анаэробной физической работы больше, чем в крови менее квалифицированных спортсменов.
Железо. Основные функции железа
1. транспорт электронов (цитохромы, железосеропротеиды);
2. транспорт и депонирование кислорода (миоглобин, гемоглобин);
3. участие в формировании активных центров окислительно-восстановительных ферментов (оксидазы, гидроксилазы, СОД);
4. активация перекисного окисления, предварительно подготовленного ионами меди;
5. транспорт и депонирование железа (трансферрин, ферритин, гемосидерин, сидерохромы, лактоферрин);
6. участие в синтезе ДНК, делении клеток;
7. участие в синтезе простагландинов, тромбоксанов, лейкотриенов и коллагена;
8. участие в метаболизме гормонов мозгового вещества надпочечников;
9. участие в метаболизме альдегидов, ксантина;
10. участие в катаболизме ароматических аминокислот, пероксидов;
11. лекарственная детоксикация
При дефиците Fe отмечается гипохромная анемия, миоглобиндефицитная кардиопатия и атония скелетных мышц, воспалительные и атрофические изменения слизистой рта, носа, эзофагопатия, хронический гастродуоденит а также иммунодефицитные состояния. Избыток Fe, в первую очередь, может оказывать токсическое влияние на печень, селезенку, головной мозг, усиливать воспалительные процессы в организме человека. Хроническая алкогольная интоксикация может приводить к накоплению Fe в организме.
Калий — важнейший внутриклеточный элемент-электролит и активатор функций ряда ферментов. Калий особенно необходим для «питания» клеток организма, деятельности мышц, в том числе миокарда, поддержания водно-солевого баланса организма, работы нейроэндокринной системы. Это — основной элемент в каждой живой клетке. Внутриклеточный калий находится в постоянном равновесии с малым количеством того, который остается снаружи клетки. Это соотношение обеспечивает прохождение электрических нервных импульсов, контролирует сокращения мышцы, обеспечивает стабильность артериального давления. Калий улучшает снабжение мозга кислородом. Как эмоциональный, так и физический стресс могут также привести к дефициту калия. Калий, натрий и хлор теряются с потом, поэтому у спортсменов может возникать потребность восполнения этих элементов специальными напитками и препаратами. Злоупотребление алкоголем ведет к потере калия
Основные функции калия
1. регулирует внутриклеточный обмен, обмен воды и солей;
2. поддерживает осмотическое давление и кислотно-щелочное состояние организма;
3. нормализует деятельность мышц;
4. участвует в проведении нервных импульсов к мышцам;
5. способствует выведению из организма воды и натрия;
6. активирует ряд ферментов и участвует в важнейших метаболических процессах (энергообразование, синтез гликогена, белков, гликопротеинов);
7. участвует в регуляции процесса выделения инсулина клетками поджелудочной железы;
8. поддерживает чувствительность гладкомышечных клеток к сосудосуживающему действию ангиотензина.
Причины дефицита калия у спортсменов – обильное потоотделение, клинические симптомы – слабость и утомление, физическое истощение, переутомление
Кальций — это макроэлемент, играющий важную роль в функционировании мышечной ткани, миокарда, нервной системы, кожи и, особенно, костной ткани при его дефиците. Кальций имеет крайне важное значение для здоровья человека, он управляет многочисленными процессами жизнедеятельности всех основных систем организма. Са преимущественно находится в костях, обеспечивая опорную функцию и защитную роль скелета для внутренних органов. 1 % Са в ионизированной форме циркулирует в крови и межклеточной жидкости, участвуя в регуляции нервно-мышечной проводимости, сосудистого тонуса, продукции гормонов, проницаемости капилляров, в обеспечении репродуктивной функции, свертываемости крови, препятствуя депонированию в организме токсинов, тяжелых металлов и радиоактивных элементов
Хром. При недостаточности хрома в организме у спортсменов нарушаются процессы высшей нервной деятельности (появление беспокойства, утомляемости, бессонницы, головных болей).
Цинк — Он управляет сокращаемостью мышц, необходим для синтеза белка (печенью), пищеварительных ферментов и инсулина (поджелудочной железой), очищения организма.
Магний. Магний, наряду с калием, является основным внутриклеточным элементом — активизирует ферменты, регулирующие углеводный обмен, стимулирует образование белков, регулирует хранение и высвобождение энергии в АТФ, снижает возбуждение в нервных клетках, расслабляет сердечную мышцу. У спортсменов снижение уровня магния в крови является следствием перетренировки и утомления. Недостаток предрасполагает к развитию заболеваний сердечно-сосудистой системы, гипертонической болезни, уролитиаза, судорог.
Биохимический контроль развития систем энергообеспечения организма при мышечной деятельности.
Спортивный результат в определенной степени лимитируется уровнем развития механизмов энергообеспечения организма. Поэтому в практике спорта проводится контроль мощности, емкости и эффективности анаэробных и аэробных механизмов энергообразования в процессе тренировки.
Для оценки мощности и емкости креатинфосфокиназного механизма энергообразования можно использовать показатели количества креатинфосфата и активности креатинфосфокиназы в крови. В тренированном организме эти показатели значительно выше, что свидетельствует о повышении возможностей креатинфосфокиназного (алактатного) механизма энергообразования. Степень подклю-чения креатинфосфокиназного механизма при выполнении физических нагрузок можно оценить по увеличению в крови содержания продуктов обмена КрФ в мышцах (креатина, креатинина и неорганического фосфата) и изменению их содержания в моче
Для характеристики гликолитического механизма энергообразования часто используют величину максимального накопления лактата в артериальной крови при максимальных физических нагрузках, а также значение рН крови и показатели КОС, содержание глюкозы в крови, активность ферментов лактатдегидрогеназы, фосфорилазы. О повышении возможностей гликолитического (лактатного) энергообразования у спортсменов свидетельствует более поздний выход на максимальное количество лактата в крови при предельных физических нагрузках, а также более высокий его уровень. Увеличение емкости гликолиза сопровождается увеличением запасов гликогена в скелетных мышцах, особенно в быстрых волокнах, а также повышением активности гликолитических ферментов.
Для оценки мощности аэробного механизма энергообразования чаще всего используются уровень максимального потребления кислорода (МПК или ИЭ2тах) и показатель кислородтранспортной системы крови – концентрация гемоглобина. Эффективность аэробного механизма энергообразования зависит от скорости утилизации кислорода митохондриями, что связано прежде всего с активностью и количеством ферментов окислительного фосфорилирования, количеством митохондрий, а также от доли жиров при энергообразовании. Под влиянием интенсивной тренировки аэробной направленности увеличивается эффективность аэробного механизма за счет увеличения скорости окисления жиров и увеличения их роли в энергообеспечении работы. При однократных и систематических ФН с аэробной направленностью метаболических процессов наблюдается усиление липидного метаболизма как жировой ткани, так и скелетных мышц. Повышение интенсивности аэробных ФН приводит к увеличению мобилизации внутримышечных триглицеридов и утилизации жирных кислот в работающих мышцах за счет активизации процессов их транспорта.
Биохимический контроль за уровнем тренированности, утомления и восстановления организма футболиста.
Контроль за процессами утомления и восстановления, которые являются неотъемлемыми компонентами спортивной деятельности, необходим для оценки переносимости физической нагрузки и выявления перетренированности, достаточности времени отдыха после физических нагрузок, эффективности средств повышения работоспособности. Сроки восстановления после тяжёлых тренировок не являются строго детерминированными и зависят от характера нагрузки и степени истощения систем организма под её воздействием.
Уровень тренированности оценивается по изменению концентрации лактата в крови при выполнении стандартной либо предельной физической нагрузки для данного контингента спортсменов. О более высоком уровне тренированности свидетельствуют меньшее накопление лактата (по сравнению с нетренированными) при выполнении стандартной нагрузки, что связано с увеличением доли аэробных механизмов в энергообеспечении этой работы; меньшее увеличение содержания лактата в крови при возрастании мощности работы, увеличение скорости утилирации лактата в период восстановления после ФН.
С увеличением уровня тренированности спортсменов увеличивается общая масса крови, что приводит к увеличению концентрации гемоглобина до 160—180 г • л»1 — у мужчин и до 130—150 г • л»1 — у женщин, увеличению скорости утилизации лактата в период восстановления после физических нагрузок.
Утомление, вызванное физическими нагрузками максимальной и субмаксимальной мощности, связано с истощением запасов энергетических субстратов (АТФ, КрФ, гликогена) в тканях, обеспечивающих этот вид работы, и накоплением продуктов их обмена в крови (молочной кислоты, креатина, неорганических фосфатов), поэтому и контролируется по этим показателям. При выполнении продолжительной напряженной работы развитие утомления может выявляться по длительному повышению уровня мочевины в крови после окончания работы, по изменению компонентов иммунной системы крови, а также по снижению содержания гормонов в крови и моче.
Для ранней диагностики перетренированности, скрытой фазы утомления используется контроль за функциональной активностью иммунной системы. Для этого определяют количество и функциональную активность клеток Т- и В-лимфоцитов: Т-лимфоциты обеспечивают процессы клеточного иммунитета и регулируют функцию В-лимфоцитов; В-лимфоциты отвечают за процессы гуморального иммунитета, их функциональная активность определяется по количеству иммуноглобулинов в сыворотке крови.
При подключении иммунологического контроля за функциональным состоянием спортсмена необходимо знать его исходный иммунологический статус с последующим контролем в различные периоды тренировочного цикла. Такой контроль позволит предотвратить срыв адаптационных механизмов, исчерпание иммунной системы и развитие инфекционных заболеваний спортсменов высокой квалификации в периоды тренировки и подготовки к ответственным соревнованиям (особенно при резкой смене климатических зон).
Восстановление организма связано с возобновлением количества израсходованных во время работы энергетических субстратов и других веществ. Их восстановление, а также скорость обменных процессов происходят не одновременно. Знание времени восстановления в организме различных энергетических субстратов играет большую роль в правильном построении тренировочного процесса. Восстановление организма оценивается по изменению количества тех метаболитов углеводного, липидного и белкового обменов в крови или моче, которые существенно изменяются под влиянием тренировочных нагрузок. Из всех показателей углеводного обмена чаще всего исследуется скорость утилизации во время отдыха молочной кислоты, а также липидного обмена — нарастание содержания жирных кислот и кетоновых тел в крови, которые в период отдыха являются главным субстратом аэробного окисления, о чем свидетельствует снижение дыхательного коэффициента. Однако наиболее информативным показателем восстановления организма после мышечной работы является продукт белкового обмена — мочевина. При мышечной деятельности усиливается катаболизм тканевых белков, способствующий повышению уровня мочевины в крови, поэтому нормализация ее содержания в крови свидетельствует о восстановлении синтеза белка в мышцах, а следовательно, и восстановлении организма.
Оценка повреждения мышечной ткани. Скелетные мышцы обеспечивают любую двигательную активность организма. Выполнение данной функции вызывает значительные биохимические и морфологические изменения в ткани скелетных мышц, и чем интенсивнее двигательная активность, тем большие изменения обнаруживаются. Систематические нагрузки способствуют закреплению ряда возникших биохимических изменений, что определяет развитие состояния тренированности скелетных мышц, которое обеспечивает выполнение более высоких ФН. Вместе с тем и тренированные мышцы повреждаются при выполнении ФН, хотя порог повреждения в этом случае выше по сравнению с нетренированными мышцами.
Начальная, инициирующая фаза повреждения — механическая, за которой следует вторичное метаболическое или биохимическое повреждение, достигающее максимума на 1-3-й дни после повреждающего сокращения, что хорошо совпадает с динамикой развития дегенеративного процесса. Повреждения структуры мышц при продолжительных или напряженных ФН сопровождаются появлением усталости. В случае пролонгированных ФН в качестве фактора повреждения мышцы отмечаются гипоксические условия, реперфузия, образование свободных радикалов и повышение лизосомальной активности. Принятым биохимическим показателем повреждения мышц является появление в крови мышечных белков (миоглобин, креатинкиназа — КК, лактатдегидрогеназа, аспартатаминотрансфераза — АсАТ), так и структурных (тропомиозин, миозин) белков мышечной ткани. Обнаружение в крови белков скелетных мышц является доказательством повреждения мышечной ткани при ФН. Механизм повреждения скелетных мышц при ФН включает ряд процессов:
1) Нарушения гомеостаза Са2+, сопровождающиеся повышением внутриклеточной концентрации Са2+, что приводит к активации калпаинов (нелизосомальные цистеиновые протеазы), которые играют важную роль в запуске расщепления белков скелетных мышц, воспалительных изменениях и процессе регенерации;
2) Усиление окислительных процессов, в том числе процесса перекисного окисления липидов (ПОЛ), что приводит к повышению проницаемости мембран миоцитов;
3) Асептическая воспалительная реакция, протекающая с участием лейкоцитов и активацией циклооксигеназы-2;
4) физический разрыв сарколеммы.
В роли одного из важных факторов, инициирующего каскад биохимических реакций, определяющих повреждение мышцы, рассматривают механический стресс. Значение данного фактора в повреждении скелетных мышц подчеркивает уникальность этой ткани, структура которой предназначена для выполнения сократительной функции. Мышцы здорового человека не подвергаются ишемии – приток крови в них достаточен. Вместе с тем высоко интенсивные ФН вызывают сильную метаболичесткую гипоксию мышц, последствия которой после прекращения ФН сходны с реперфузией при ишемии. В развитии повреждения важным оказывается не столько ишемия, сколько последующая реперфузия, поэтому основными маркерами повреждения являются высокий уровень активных форм кислорода (АФК) — инициаторов ПОЛ и воспалительных лейкоцитов — нейтрофилов. В основе реализации этого механизма лежит как локальное усиление свободно-радикальных процессов, так и накопление воспалительных лейкоцитов. Наряду с активацией ПОЛ выявляется снижение активности супероксиддисмутазы – одного из ключевых ферментов антиоксидантной защиты. Наличие достоверных коррелятивных связей между активностью в крови ряда ферментов скелетных мышц (КК, лактатдегидрогеназа) и концентрацией малонового диальдегида — продукта ПОЛ — у футболистов являясь важным фактором модификации клеточных мембран, вызывает изменение их физико-химических свойств, проницаемости, что и определяет выход в циркуляцию мышечных белков. Уже в процессе нагрузки, протекающей в условиях гипоксии, в мышцах развивается комплекс «повреждающих» метаболических реакций. Увеличивается концентрация внутриклеточного Ca2+, что ведет к активации Ca2+ -зависимых протеиназ — калпаинов; вследствие нарушения энергетического обмена истощаются запасы макроэргов в мышечном волокне; развивается ацидоз в связи с продукцией большого количества лактата. По завершении нагрузки в мышцах включаются реакции повреждения следующего эшелона, связанные с активацией окислительных процессов и лейкоцитарной инфильтрацией. Наиболее информативными маркерами мышечного повреждения являются уровень активности КК и концентрация миоглобина в плазме/сыворотке крови.
Повреждения, возникающие в скелетных мышцах при выполнении ФН высокой интенсивности и длительности, могут быть уменьшены с помощью адекватной фармакологической поддержки, а также соответствующей физиотерапевтической подготовки мышц к выполнению нагрузки. Ускорения восстановления повреждений можно добиться также, применяя фармакологическую поддержку, наряду с известными физиотерапевтическими мероприятиями. Учитывая сведения о механизмах повреждения скелетных мышц при выполнении ФН высокой интенсивности, с целью заблаговременной фармакологической поддержки скелетных мышц можно использовать различные комплексные препараты антиоксидантов и возможно определенные нестероидные противовоспалительные препараты. Как те, так и другие применяются спортсменами, однако на наш взгляд очень важно определить тактику применения препаратов, основываясь на ясном понимании процессов, происходящих в мышцах при ФН и в период реституции. С этих позиций наиболее разумно поддержку с использованием антиоксидантов начинать хотя бы за несколько дней до соревнований и не прекращать в процессе соревнований. Противовоспалительные препараты следует использовать, по-видимому, перед нагрузкой, а возможно и сразу после нее. Использование противовоспалительных препаратов может помочь подавить воспалительный процесс, в частности тот его этап, который связан с формированием локального структурно-метаболического фона, определяющего приток лейкоцитов.
Биохимические маркеры перенапряжения и тренированности.
Перенапряжение мышечной ткани — одна из наиболее частых проблем, с которыми сталкиваются спортсмены при выполнении физической нагрузки высокой интенсивности. На сегодняшний день молекулярная диагностика этого феномена, в основном, базируется на измерении активности в плазме крови различных саркоплазматических ферментов (креатинкиназы (КФК) и лактатдегидрогеназы (ЛДГ)). В норме эти ферменты проникают за пределы клеточной мембраны в незначительных количествах, и повышение их активности в плазме крови отражает значительное изменение проницаемости мембранных структур миоцита, вплоть до его полного разрушения. У спортсменов активность КФК и ЛДГ значительно превосходит таковую у обычных людей. Данный факт отражает адаптацию организма спортсмена к ФН высокой интенсивности. Если у нетренированного человека при повреждении скелетной мускулатуры уровни КФК и ЛДГ растут на порядок, то у спортсменов они, зачастую, остаются неизменными. При перенапряжении мышечной ткани лучше использовать комбинацию из биологических и клинических параметров — например, активность ЛДГ и КФК в плазме, концентрация миоглобина и малондиальдегида, уровень лейкоцитов, а также физиологические параметры мышцы. Высокая активность КФК и высокий уровень малондиальдегида в сыворотке крови хорошо отражают перенапряжение мышечной ткани.
Оценка функционального состояния организма и готовности к повышенным нагрузкам.
При оценке адекватности физических нагрузок в период интенсивных занятий спортом стоит задача поиска объективных маркёров состояния мышечной ткани и др. систем организма. Мы предлагаем в качестве таких критериев использовать биохимические показатели работы основных органов: В первую очередь обращаем внимание на состояние мышечной системы и сердца:
— общая КФК, как правило, повышается при интенсивных занятиях (к повышению уровня фермента приводит недостаточность кровоснабжения мышц). Однако необходимо следить за тем, чтобы это повышение было умеренным. Кроме этого, за повышением общего уровня КФК за счет напряжения скелетной мускулатуры, можно пропустить начало разрушения сердечной мышцы – обязательно проверяем миокардиальную фракцию КФК — МВ.
— ЛДГ и АСТ – саркоплазматические ферменты помогут оценить состояние сердечной мышцы и скелетной мускулатуры.
— Миоглобин обеспечивает транспорт и хранение кислорода в поперечно-полосатой мускулатуре. При повреждении мышц происходит высвобождение миоглобина в сыворотку крови и появление его в моче. Концентрация его в сыворотке пропорциональна мышечной массе, поэтому у мужчин базовый уровень миоглобина выше (как правило). Определение миоглобина может использоваться для определения уровня подготовки атлета – выход в сыворотку миоглобина задерживается у тренированных спортсменов и увеличен у потерявших спортивную форму. Значительное увеличение концентрации миоглобина наблюдается при деструкции клеток скелетной мускулатуры и при перенапряжении мышц.
— При выявлении повышенных уровней КФК-МВ или значительном скачке концентрации миоглобина на фоне тренировок необходимо срочно назначить тест на Тропонин (количественный) для исключения развития инфаркта миокарда. Корме этого, мы предлагаем для диагностики хронической сердечной недостаточности определять уровень BNP (натрий-уретический гормон, вырабатываемый сердечной мышцей).
— Исследовать электролитный баланс (Na, K, Cl, Ca++, Mg).
— Интенсивная работа скелетных мышц (особенно в начале занятий у нетренированных лиц или после длительного перерыва) сопровождается накоплением молочной кислоты (лактата) в мышцах. Повышение кислотности за счет молочной кислоты (лактоацидоз) может происходить из-за тканевой гипоксии и проявлять себя в виде мышечных болей. Следовательно, необходим контроль за уровнем лактата и кислотно-основным равновесием (газы крови);
— Повышение потребления кислорода мышцами отражается на интенсивности синтеза и распада эритроцитов. Чтобы оценить состояние эритропоэза и контролировать гемолиз необходим мониторинг уровня гемоглобина и гематокрита, а также гаптоглобина и билирубина (прямого и общего) – показателей повышенного гемолиза. Если обнаруживаются какие-либо сдвиги в этих показателях – назначается исследование обмена железа, витамина В12 и фолатов (чтобы проверить, хватает ли организму витаминов и микроэлементов для поддержания интенсивного уровня эритропоэза.
Виды и организация биохимического контроля у футболистов.
Определение биохимических показателей обмена веществ позволяет решать следующие задачи
— комплексного обследования: контроль за функциональным состоянием организма спортсмена, которое отражает эффективность и рациональность выполняемой индивидуальной тренировочной программы, —
— наблюдение за адаптационными изменениями основных энергетических систем и функциональной перестройкой организма в процессе тренировки,
— диагностика предпатологических и патологических изменений метаболизма спортсменов.
Биохимический контроль позволяет также решать такие частные задачи, как выявление реакции организма на физические нагрузки, оценка уровня тренированности, адекватности применения фармакологических и других восстанавливающих средств, роли энергетических метаболических систем в мышечной деятельности, воздействия климатических факторов и др. В связи с этим в практике спорта используется биохимический контроль на различных этапах подготовки спортсменов.
В годичном тренировочном цикле подготовки квалифицированных футболистов выделяют разные виды биохимического контроля:
• текущие обследования (ТО), проводимые повседневно в соответствии с планом подготовки;
• этапные комплексные обследования (ЭКО), проводимые 3—4 раза
в год;
• углубленные комплексные обследования (УКО), проводимые 2 раза
в год;
• обследование соревновательной деятельности (ОСД).
На основании текущих обследований определяют функциональное состояние спортсмена — одно из основных показателей тренированности, оценивают уровень срочного и отставленного тренировочного эффекта физических нагрузок, проводят коррекцию физических нагрузок в ходе тренировок.
В процессе этапных и углубленных комплексных обследований футболистов с помощью биохимических показателей можно оценить кумулятивный тренировочный эффект, причем биохимический контроль дает тренеру, педагогу или врачу быструю и достаточно объективную информацию о росте тренированности и функциональных системах организма, а также других адаптационных изменениях.
При организации и проведении биохимического обследования особое внимание уделяется выбору тестирующих биохимических показателей: они должны быть надежными либо воспроизводимыми, повторяющимися при многократном контрольном обследовании, информативными, отражающими сущность изучаемого процесса, а также валидными либо взаимосвязанными со спортивными результатами.
В каждом конкретном случае определяются разные тестирующие биохимические показатели обмена веществ, поскольку в процессе мышечной деятельности по-разному изменяются отдельные звенья метаболизма. Первостепенное значение приобретают показатели тех звеньев обмена веществ, которые являются основными в обеспечении спортивной работоспособности в данном виде спорта.
Немаловажное значение в биохимическом обследовании имеют используемые методы определения показателей метаболизма, их точность и достоверность. В настоящее время в практике спорта широко применяются лабораторные методы определения многих (около 60) различных биохимических показателей в плазме крови. Одни и те же биохимические методы и показатели могут быть использованы для решения различных задач. Так, например, определение содержания лактата в крови используется при оценке уровня тренированности, направленности и эффективности применяемого упражнения, а также при отборе лиц для занятий отдельными видами спорта.
В зависимости от решаемых задач изменяются условия проведения биохимических исследований. Поскольку многие биохимические показатели у тренированного и не тренированного организма в состоянии относительного покоя существенно не различаются, для выявления их особенностей проводят обследование в состоянии покоя утром натощак (физиологическая норма), в динамике физической нагрузки либо сразу после нее, а также в разные периоды восстановления.
При выборе биохимических показателей следует учитывать, что реакция организма человека на физическую нагрузку может зависеть от факторов, непосредственно не связанных с уровнем тренированности, в частности от вида тренировки, квалификации спортсмена, а также от окружающей обстановки, температуры среды, времени суток и др. Более низкая работоспособность наблюдается при повышенной температуре среды, а также в утреннее и вечернее время. К тестированию, как и к занятиям, спортом, особенно с максимальными нагрузками, должны допускаться только полностью здоровые футболисты, поэтому врачебный осмотр должен предшествовать другим видам контроля. Контрольное биохимическое тестирование проводится утром натощак после относительного отдыха в течение суток. При этом должны соблюдаться примерно одинаковые условия внешней среды, которые влияют на результаты тестирования.
Для оценки влияния физической нагрузки биохимические исследования проводятся спустя 3-7 минут после тренировки, когда наступают наибольшие изменения в крови. Изменение биохимических показателей под воздействием физических нагрузок зависит от степени тренированности, объема выполненных нагрузок, их интенсивности и анаэробной или аэробной направленности, а также от пола и возраста обследуемых. После стандартной физической нагрузки значительные биохимические сдвиги обнаруживаются у менее тренированных людей, а после максимальных — у высокотренированных. При этом после выполнения специфических для спортсменов нагрузок в условиях соревнования или в виде прикидок в тренированном организме возможны значительные биохимические изменения, которые не характерны для нетренированных людей.
Спектр биохимических маркеров по видам обследования футболистов.
Углубленное медицинское обследование.
Скриннинг, позволяющий «отфильтровать» группу спортсменов, нуждающихся в дообследовании (готовность к сезону):
• ОАК (RBC, HGB, HCT, MCV, MCH, MCHC, RDW + ретикулоциты, PLT)
• ОАМ (рН, плотность, кетоны, соли, белок, глюкоза)
• Коагулограмма (Фг, Пр, Ат111, ТВ. АЧТВ, РКМФ, Д-димер, ФА)
• БАК (мочевина, мочевая кислота, холестерин, липиды, глюкоза, АСТ, АЛТ, креатинин, КФК, КФК MB, ЩФ, ЛДГ, магний, кальций, фосфор, калий, натрий, железо, ферритин, амилаза, белок, альбумин, глобулин и фракции, аминокислоты, СМП, Тропонин –Т, BNP)
• Гормоны (кортизол, тестостерон, инсулин, С-пептид, адреналин, эритропоэтин, гормон роста , Соматомедин С, паратгормон, кальцитонин, ТТГ, св. Т4)
• Инфекции (TORCH, ЗППП)
• Наркотики
• Микроэлементы (цинк, хром, селен)
Этапное медицинское обследование.
• ОАК, ОАМ, БАК
• Коагулогрумма (оценка микроциркуляции)
• Антиоксидантный статус (малоновый диальдегид, супероксиддисмутаза)
• Диагностика анемий (железо, ферритин, трансферин, ОЖСС, Витамин В12, фолиевая кислота)
Контрольное медицинское обследование.
(по усмотрению врача и в зависимости от физической нагрузки и состояния футболиста)
• Гемоглобин, эритроциты
• Мочевина, креатинин, аммиак, молочная кислота
Оценка состояния организма и готовности к повышенным нагрузкам
(обследование футболиста перед заключением контракта)
• ОАК (RBC, HGB, HCT, MCV, MCH, MCHC, RDW + ретикулоциты, PLT)
• Коагулограмма (Фг, Пр, Ат111, ТВ. АЧТВ, РКМФ, Д-димер, ФА)
• БАК (мочевина, мочевая кислота, холестерин, липиды, глюкоза, АСТ, АЛТ, креатинин, КФК, КФК MB, ЩФ, ЛДГ, магний, кальций, фосфор, калий, натрий, железо, ферритин, амилаза, белок, альбумин, глобулин и фракции, аминокислоты, СМП, Тропонин –Т, BNP)
• Гормоны (кортизол, тестостерон, инсулин, С-пептид, адреналин, эритропоэтин, гормон роста , Соматомедин С, паратгормон, кальцитонин, ТТГ, св. Т4)
• Инфекции (TORCH, ЗППП)
• Наркотики
• Микроэлементы (цинк, хром, селен)
• Паразитологические обследования
• Пищевая непереносимость.
• Аллергия
• Микроэлементы
• КФК, ЛДГ, АСТ (умеренное повышение – результат недостаточности кровоснабжения мышц и перенапряжение скелетной мускулатуры при интенсивных занятиях, резкое повышение – недостаточная тренированность)
• КФК – МВ (повышение при поражении сердечной мышцы)
• Миоглобин (концентрация в крови пропорциональна мышечной массе. Отражает уровень подготовки атлета – выход в сыворотку миоглобина задерживается у тренированных спортсменов и увеличен у потерявших спортивную форму. Количество миоглобина в крови зависит от объема выполненной физической нагрузки, а также от степени тренированности спортсмена.)
• Тропонин (диагностика инфаркта миокарда)
• BNP (повышается при хронической сердечной недостаточности)
• (Na, K, Cl, Ca++, Mg) (нарушение водно-электролитного баланса, передачи нервного импульса, мышечного сокращения)
• Лактат и КОС (газы крови) (интенсивная работа скелетных мышц (особенно в начале занятий у нетренированных лиц или после длительного перерыва) сопровождается накоплением молочной кислоты и ацидозом)
• Гемоглобин и гематокрит (интенсивность эритропоэза и аэробного окисления)
• Гаптоглобин и билирубин (интенсивность гемолиза эритроцитов)
• ОАМ (рН, плотность, кетоны, соли, белок, глюкоза)
Спектр биохимических маркеров, позволяющих оценить влияние ФН на организм футболиста.
Маркеры контролирующие объем ФН
• ОАК (гемоглобин, гематокрит, эритроциты, лейкоциты)
• Биохимические показатели (мочевина, аммиак, холестерин, триглицериды, КФК, ферритин, железо, магний, калий, белок)
• Гормоны (кортизол, адреналин, дофамин, АКТГ, СТГ, Т3, инсулин, тестостерон) (повышение адренокортикотропного гормона, соматотропного гормона, кортизола, тестостерона и трийодтиронина, снижение содержания инсулина. При длительной ФН концентрации кортизола и индекса тестостерон/кортизол снижается).
• ОАМ (по наличию определенной концентрации белка в моче после выполнения физической работы судят о ее мощности. Так, при работе в зоне большой мощности она составляет 0,5 %, при работе в зоне субмаксимальной мощности может достигать 1,5 %).
Маркеры, контролирующие интенсивность ФН.
• ОАК (гемоглобин, гематокрит, эритроциты, ретикулоциты)
• Биохимические показатели (мочевина, аммиак, молочная кислота, мочевая кислота, холестерин, триглицериды, КФК, ЛДГ, АСТ, миоглобин, ферритин, трансферин, железо, магний, калий, общий белок и белковые фракции, СМП), КОС
• Гормоны (кортизол, тестостерон, Т/К, норадреналин, дофамин, эритропоэтин)
• ОАМ (рН, плотность, белок, кетоны)
• БАМ (креатин, креатинин в моче, кетоновые тела)
Маркеры перенапряжения и тренированности.
О более высоком уровне тренированности свидетельствуют
• Меньшее накопление лактата (по сравнению с нетренированными) при выполнении стандартной нагрузки, что связано с увеличением доли аэробных механизмов в энергообеспечении этой работы.
• Меньшее увеличение содержания лактата в крови при возрастании мощности работы.
• Увеличение скорости утилирации лактата в период восстановления после ФН.
• С увеличением уровня тренированности спортсменов увеличивается общая масса крови, что приводит к увеличению концентрации гемоглобина до 160—180 г • л»1 — у мужчин и до 130—150 г • л»1 — у женщин.
• Уровень саркоплазматических ферментов (КФК) и (ЛДГ) (повышение активности отражает значительное изменение проницаемости мембранных структур миоцита и адаптацию организма к ФН высокой интенсивности. Если у нетренированного человека при повреждении скелетной мускулатуры уровни КФК и ЛДГ растут на порядок, то у спортсменов они, часто остаются неизменными).
• Концентрация миоглобина и малондиальдегида (величина повышения активности КФК, миоглобина и уровня малондиальдегида отражают степень перенапряжение и деструкции мышечной ткани )
• БАМ (обнаружение креатина и 3-метил-гистидина, специфического метаболита мышечных белков, используется как тест для выявления перетренировки и патологических изменений в мышцах,)
• Магний, калий в крови (сниженная концентрация обнаружена у людей после неадекватной ФН и является следствием перетренировки и утомления – потеря с потом!!!)
• Хром (при недостаточности хрома в организме у футболистов нарушаются процессы высшей нервной деятельности, появляется беспокойство, утомляемость, бессонница, головные боли).
Маркеры утомления.
Мышечная утомляемость — неспособность мышц поддерживать мышечное сокращение заданной интенсивности — связана с избытком аммиака, лактата, креатинфосфата, недостатком белка
• Коэффициент восстановления:
— углеводного обмена (скорость утилизации молочной кислоты во время отдыха),
— липидного обмена (нарастание содержания жирных кислот и кетоновых тел в крови, которые в период отдыха являются главным субстратом аэробного окисления),
— белкового обмена (скорость нормализации мочевины при оценке переносимости спортсменом тренировочных и соревновательных физических нагрузок, хода тренировочных занятий и процессов восстановления организма). Если содержание мочевины на следующее утро остается выше нормы, то это свидетельствует о недовосстановлении организма либо развитии его утомления).
• Коэффициент микроциркуляции (КМ)=7,546Фг-0,039Tr -0,381АПТВ+0,234ФА+0,321РФМК-0,664ATIII+101,064 (должен равняться календарному возрасту)
• Определение содержания продуктов перекисного окисления в крови малонового диальдегида, диеновых конъюгатов. Биохимический контроль реакции организма на физическую нагрузку, оценка специальной подготов-ленности спортсмена, выявления глубины биодеструктивных процессов при развитии стресс-синдрома
• активность ферментов глутатионпероксидазы, глутатионредуктазы и каталазы, супероксиддисмутазы.
• Определение молекул средней массы (МСМ) (перекисное повреждение белковых веществ приводит к их деградации и образованию токсических фрагментов молекул средней массы, которые принято считать маркерами эндогенной интоксикации у спортсменов после интенсивной ФН. На ранних стадиях утомления уровень СМП возрастает по сравнению с нормой в среднем на 20-30 %, на средней стадии — на 100-200 %, поздних — на 300-400 %. )
• Коэффициент эндогенной интоксикации = СМП/ЭКА* 1000 (эффективная концентрация альбумина)
• ОМГ- тест (привлечение в очаг повреждения лейкоцитов которые в следствие активации выделяют большое количество активных форм кислорода тем самым разрушая здоровые ткани. Через одни сутки после интенсивной физической нагрузки активность гранулоцитов крови выше контрольного значения примерно в 7 раз и на этом уровне сохраняется в течение последующих 3 суток, затем начинает снижаться, превышая, однако, контрольный уровень и через 7 суток восстановления)
Маркеры повреждения мышечной ткани.
• Уровень саркоплазматических ферментов (КФК) и (ЛДГ)
• Миоглобин, тропонин, BNP
• Определение содержания продуктов перекисного окисления в крови малонового диальдегида, диеновых конъюгатов
• Активность ферментов глутатионпероксидазы, глутатионредуктазы и каталазы, супероксиддисмутазы
• Уровень активных форм кислорода (ОМГ- тест)
• БАМ (обнаружение креатина и 3-метил-гистидина)
Маркеры восстановления организма после ФН.
Восстановление организма связано с возобновлением количества израсходованных во время работы энергетических субстратов и других веществ. Уровень биохимических маркеров изучается на 1, 3, 7 день после интенсивной физической нагрузки.
• Уровень глюкозы.
• Уровень инсулина, кортизола.
• Скорость восстановления уровня молочной кислоты (лактата)
• Скорость восстановления уровня ферментов ЛДГ, КФК,
• Скорость восстановления уровня мочевины,
• Нарастание содержания свободных жирных кислот
• Снижение уровня малонового диальдегида, диеновых конъюгатов
• Общего белка и белковых фракций
• Восстановление до исходного уровня измененных показателй.
Кандидат медицинских наук, доцент
Б. А. Никулин.


ТЕЛЕФОНЫ ДЛЯ СПРАВОК
+7 499 967-8698
+7 965 237-0310
- TOP 50 АНАЛИЗОВ

Забор анализов на дому или в офисе
- Щитовидная железа (скрининг)
- Заболевания почек
- Вакцинация против гепатита B