Стерилизации
подвергаются питательные среды,
лабораторная посуда, инструменты,
растворы и т. д. Можно условно выделить
термическую и холодную стерилизацию.
К методам
термической стерилизации (стерилизации
высокой температурой) относят:
прокаливание и обжигание в пламени
спиртовки; кипячение; сухожаровую
(горячим паром) стерилизацию; пастеризацию;
стерилизацию насыщенным паром под
давлением (автоклавирование); дробную
стерилизацию (тиндализацию);.
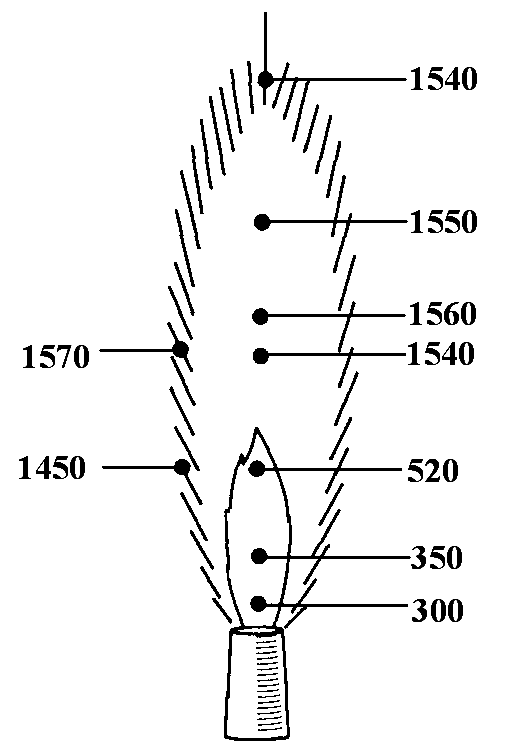
Прокаливание
и обжигание в пламени
– наиболее быстрые и доступные методы
стерилизации. При прокаливании необходимо
помнить, что наивысшая температура
развивается в верхней и периферической
частях пламени (до 1 560 °С), поэтому не
следует опускать петлю непосредственно
к горелке (рисунок 1.1). При прокаливании
происходит сгорание микроорганизмов
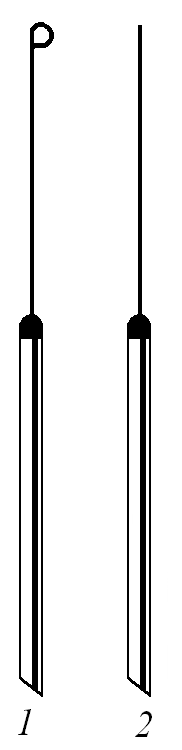
и их спор. Такими методами стерилизуют
бактериологические петли, иглы (рисунок
1.2), шпатели, пинцеты, предметные и
покровные стекла, фарфоровые ступки и
другие инструменты.
При
обжигании
бактериологической петли (или иглы)
проволоку
прокаливают докрасна в пламени горелки
и одновременно обжигают примыкающую к
петле часть держателя, которая будет
вводиться внутрь сосуда, содержащего
микроорганизмы. При прокаливании петлю
держат в пламени почти вертикально,
чтобы вся проволока была равномерна
раскалена. Сразу же после стерилизации
петлю (иглу) вводят в сосуд с микроорганизмами.
|
|
1 |
|
Рисунок 1.1 –
температуры (°С)
участках пламени |
Рисунок 1.2 –
Бактериологическая
и бактериологическая |
Кипячение
– простейший
способ стерилизации. Кипячением в
дистиллированной воде стерилизуют
мембранные фильтры. Режим стерилизации
для мембранных фильтров – 30–60 мин с
момента энергичного закипания воды.
Металлические инструменты, мелкие
стеклянные детали лучше всего кипятить
в стерилизаторах. В микробиологической
практике таким способом стерилизации
пользуются редко, поскольку продолжительное
кипячение может повредить обрабатываемый
материал, а сокращение времени кипячения
может не обеспечить стерильности.
Дробная
стерилизация (тиндализация или
стерилизация текучим паром)
используется для стерилизации питательных
сред и растворов, которые изменяют
свойства при применении температур
выше 100 °С. К таким объектам относятся
витамины, некоторые среды, углеводы,
молоко и т.д. Метод разработан в 1877 году
Дж. Тиндалем. Согласно этому методу,
жидкость доводят до 100 °С и продолжают
выдерживать при этой температуре 10 мин.
За это время все вегетативные клетки
погибают, жизнеспособными остаются
только споры. Затем жидкость охлаждают
до температуры, оптимальной для
прорастания спор (30 °С) и через несколько
часов снова пропускают пар. Двух–трех
подобных циклов обычно бывает достаточно
для уничтожения всех имеющихся спор.
При тиндализации резервуар с кипящей
водой расположен в нижней части аппарата,
над ним расположена сетка с устанавливаемыми
стерилизуемыми растворами.
Сухожаровая
стерилизация или стерилизация сухим
горячим воздухом
проводится
в сушильных шкафах. Режим стерилизации:
160–170 °С на протяжении 2 часов. При этом
предполагается, что погибают как клетки,
так и споры. Таким способом стерилизуют
стеклянную посуду, инструменты и др.,
завернутые в бумагу или закрытые
ватно-марлевыми пробками для сохранения
стерильности после стерилизации (таблица
1.1). Таким способом можно стерилизовать
минеральные и растительные масла, жиры,
вазелин, воск.
Таблица 1.1 – Условия
стерилизации стеклянной посуды сухим
жаром (горячим воздухом)
|
Температура, °С |
Время, мин |
|
140 |
180 |
|
150 |
150 |
|
160 |
120 |
|
170 |
60 |
Пастеризация
заключается
в однократном прогреве материала при
температурах ниже 100 °С и направлена на
уничтожение вегетативных клеток. Этот
метод широко используется в пищевой
промышленности для обработки продуктов,
которые теряют вкусовую и пищевую
ценность при кипячении: молока, ягодных
и фруктовых сиропов, соков, пива и т. д.
В микробиологической практике
пастеризацией пользуются для получения
накопительных культур спорообразующих
бактерий. В лабораторных условиях
пастеризацию проводят либо на водяной
бане либо в ультратермостате при
следующих режимах: 60–70 °С в течение
15–30 мин; 80 °С в течение 10–15 мин.
Стерилизация
насыщенным паром под давлением или
автоклавирование
– один из наиболее эффективных методов
стерилизации, так как стерилизуемый
объект подвергается одновременному
воздействию как высокой температуры,
так и повышенному давлению пара. Погибают
как вегетативные клетки, так и споры
микроорганизмов. Процесс проводится в
специальных приборах – автоклавах,
закрывающихся герметично. Основные
используемые режимы стерилизации
следующие: 15–30 мин при избыточном
давлении 0,5 атм (температура достигает
110–112 °С); 15–45 мин при избыточном давлении
1,0 атм (температура достигает 121 °С);
10–30 мин при избыточном давлении 1,5 атм
(температура достигает 126 °С). Таким
способом стерилизуют питательные среды,
растворы, посуду, инструменты, фильтры
и т. д.
При
холодной стерилизации
используют химические вещества или
проводят воздействие на объект факторами
физической природы. Химические методы
подавления жизнедеятельности
микроорганизмов предполагают использование
дезинфектантов и антисептиков, имеющих
неспецифический эффект, либо использование
антибиотиков и синтетических антимикробных
препаратов с избирательным противомикробным
действием. Дезинфицирующие вещества
классифицируются по группам: кислоты,
щелочи, галогены, тяжелые металлы,
четвертичные аммониевые основания,
фенольные соединения, альдегиды, кетоны,
спирты, амины и перекиси. Устойчивость
микроорганизмов к их действию может
существенно меняться в зависимости от
таких факторов как концентрация активного
компонента, длительность контакта, рН,
температура, влажность, присутствие
органического вещества. Химические
средства неспецифического действия
используются для обработки помещений,
оборудования, различных предметов.
Например, спирты используются в
концентрации 60–70 % и эффективны в
отношении вегетативных клеток. Фенолы
и их производные применяются для
дезинфекции помещений.
Среди используемых
летучих стерилизующих веществ можно
назвать окись этилена, окись пропилена,
озон, метилбромид, формальдегид. Указанные
вещества могут быть использованы для
стерилизации пластмассовых центрифужных
пробирок, пластмассовых чашек Петри,
оптических инструментов, сыворотки
крови и др.
Стерилизация
фильтрованием
используется для веществ, которые не
выдерживают термической обработки
(растворов белков, аминокислот, углеводов,
витаминов, углеводородов, антибиотиков,
сыворотки). Способ заключается в
пропускании жидкостей и газов через
специальные мелкопористые фильтры,
диаметр пор которых не превышает
0,45–0,20 мкм. Для пропускания раствора
через фильтр требуется вакуум или
давление.
Существуют два
основных типа
фильтров
– глубинные
и мембранные.
Глубинные состоят из волокнистых или
гранулированных материалов, которые
спрессованы, свиты или связаны в лабиринт
проточных каналов. Частицы задерживаются
в них в результате адсорбции и механического
захвата в матриксе фильтра. Мембранные
фильтры имеют непрерывную структуру и
захват ими частиц определяется размером
пор. Фильтры содержат различные природные
(коалин, асбест, целлюлоза) или
синтетические (производные целлюлозы)
материалы. Различают фильтры: мембранные,
получаемые на основе нитроцеллюлозы;
асбестовые или фильтры Зейтца, получаемые
на основе смеси асбеста и целлюлозы;
фарфоровые или свечи Шамберлана,
получаемые из смеси кварцевого песка
и коалина, сплавленные между собой;
стеклянные, полученные из стекла
«Пирекс».
Перед употреблением
фильтрующее устройство должно быть
простерилизовано. Стерилизуют либо
длительным кипячением либо автоклавированием.
Прибор собирают в асептических условиях
непосредственно перед работой. Фильтры
Зейтца автоклавируют в собранном виде,
предварительно завернув в бумагу.
Стерилизация
с использованием облучения
пригодна для термолабильных материалов.
Ультрафиолетовые (УФ) лучи (250–270 нм)
используются для стерилизации центрифужных
пробирок, наконечников для пипеток и
т.д. Время облучения определяется
мощностью лампы, временем воздействия,
видовым составом микроорганизмов
загрязненного материала. Вегетативные
формы более чувствительны к облучению,
чем споры, которые в 3–10 раз более
устойчивы. От УФ-облучения микроорганизмы
могут быть защищены органическими
веществами, пылью или другими защитными
оболочками.
Недостатком при
использовании данного метода стерилизации
является низкая проникающая способность
УФ-лучей.
Рентгеновское
и -облучение
также эффективно для стерилизации
пластмасс, пищевых продуктов, но требует
строгого соблюдения правил безопасности.
Наиболее чувствительны к -облучению
вегетативные клетки бактерий, затем
идут плесневые грибы, дрожжи, бактериальные
споры и вирусы. В большинстве случаев
для надежного уничтожения микроорганизмов
достаточно дозы облучения 2,5 Мрад.
-облучение
используется для стерилизации больничных
принадлежностей, антибиотиков, витаминов,
гормонов, стероидов, пластмассового
разового оборудования, шовного и
перевязочного материала.
Необходим контроль
остаточной радиации изделий. Основные
преимущества лучевой стерилизации:
возможность обработки термолабильных
материалов, стерилизации объектов в
упакованном виде, включение стерилизации
в непрерывный производственный процесс.
Следует отметить,
что все большее распространение получают
посуда и инструменты одноразового
использования.
Соседние файлы в папке Скорина
- #
- #
- #
- #
- #
- #
Стерилизация — это обеспложивание, т. е. полное освобождение объектов внешней среды от микроорганизмов.
Стерилизацию проводят различными способами: физическими (воздействие высокой температуры, ультрафиолетовых лучей, использование бактериальных фильтров); химическими (использование различных антисептиков для консервирования питательных сред); биологическими (применение антибиотиков).
Целесообразность использования того или иного способов стерилизации обусловлена особенностями материала, подлежащего стерилизации, его физическими и химическими свойствами.
В лабораторной практике обычно применяют физические способы стерилизации.
Прокаливание в пламени горелки или спиртовки (фламбирование) — способ стерилизации, при котором происходит полное обеспложивание объекта, гак как погибают не только вегетативные клетки, но и споры микроорганизмов. Обычно прокаливают бактериологические петли, шпатели, предметные и покровные стекла, мелкие инструменты.
Стерилизацию сухим жаром проводят в сушильных шкафах (стерилизаторах), представляющих собой термостат с электрическим обогревом, в котором автоматически на заданием уровне может поддерживаться высокая температура. Этим способом стерилизуют лабораторную посуду, предварительно тщательно вымытую, высушенную и плотно завернутую в бумагу.
Стерильность сухим паром при 160-165 °С обеспечивается не менее чем за 90 мин, при 180 °С — не менее чем за 30 мин.
Жидкости (питательные среды, физиологический раствор и др.), предметы из резины и синтетических материалов стерилизовать сухим жаром нельзя, так как жидкости выкипают и выливаются, а резина и синтетические материалы разрушаются. Питательные среды и другие жидкости стерилизуют нагревом в парах воды.
Стерилизация паром может проводиться паром под давлением и текучим паром. Чаще применяют первый способ.
Стерилизацию паром под давлением производят в автоклаве. Способ основан на воздействии на стерилизуемые материалы насыщенного водяного пара под давлением, выше атмосферного. В результате такой обработки погибают вегетативные и споровые формы микроорганизмов.
Автоклав представляет собой двухстенный массивный котел, снаружи обшитый металлическим кожухом, с герметически закрывающейся крышкой, которая плотно прижимается к котлу откидывающимися болтами с барашками. За счет кипения воды и герметизации в автоклаве создается повышенное давление, позволяющее поднять температуру выше 100 °С.
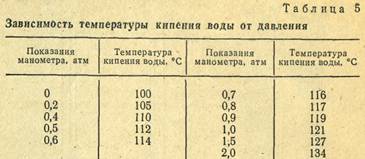
Каждому значению избыточного давления чистого водяного пара, которое фиксируется манометром, устанавливаемым на автоклаве, соответствует определенная температура кипения воды (табл. 5).
В автоклавах обрабатывают питательные среды, физиологический раствор, воду, лабораторные приборы и мелкое оборудование, имеющее резиновые детали, и др.
Температура и длительность автоклавирования питательных сред определяются их составом. Например, простые среды (мясопептонный агар, мясопептонный бульон) стерилизуют 20 мин при 120 °С. Однако при этой температуре нельзя стерилизовать среды, содержащие нативные белки, углеводы и другие легко изменяющиеся от нагревания вещества. Среды, имеющие углеводы, стерилизуют в автоклаве при температуре 112°С в течение 10-15 мин или дробно при 100 °С в кипятильнике Коха.
Различные жидкости, приборы, имеющие резиновые шланги, пробки, бактериологические фильтры и т. д. стерилизуют 20 мин при температуре 120 °С.
В автоклавах обезвреживают также инфицированный материал. Чашки и пробирки, содержащие культуры микробов, помещают в специальные металлические ведра или баки с отверстиями в крышке для проникновения пара и стерилизуют в автоклаве при температуре 120 °С в течение часа. Таким же образом стерилизуют инструменты после работы с бактериями, образующими споры.
К работе с автоклавом допускаются специально подготовленные люди, которые должны строго и точно выполнять правила, указанные в инструкции, прилагаемой к аппарату.
Различные питательные среды и другие материалы для заготовки впрок разливают в пробирки, колбы и закрывают ватными пробками. После обработки в автоклаве они хранятся длительное время, не подвергаясь порче, и используются по мере надобности.
В лабораторной практике для получения эффекта стерильности при температуре, не превышающей 100 °С, иногда пользуются кипятильником Коха. Это металлический цилиндрический сосуд, на дно которого наливается вода; над водой, на решете, помещают стерилизуемые предметы. При кипячении воды все предметы оказываются в атмосфере пара (при температуре 100 °С), вытекающего через неплотно закрывающуюся крышку, отчего и возникло выражение «стерилизация текучим паром».
Однократное прогревание текучим паром в течение часа не приводит к гибели споровых микробов. Достичь этого можно, прибегнув к двукратному повторному нагреванию, которое проводят с интервалом 24 ч по часу. Это так называемая дробная стерилизация.
Учитывая, что температура может существенно влиять на развитие психрофилов, мезофилов, термофилов, при выращивании каждой группы следует создавать необходимые температурные условия; их поддерживают в термостатах — лабораторных шкафах с двойными стенками, теплонагревательным элементом и терморегулятором.
Стерилизация кипячением. Кипячение является наиболее простым и легкодоступным способом стерилизации, пригодным для устранения вегетативной формы микробов. Для уничтожения спороносной микрофлоры оно неприемлемо.
Стерилизацию кипячением проводят в стерилизаторе. В него наливают холодную дистиллированную воду, так как водопроводная вода образует накипь. Стеклянные предметы погружают в холодную, металлические предметы – в горячую воду с добавлением соды. Стерилизуемые предметы кипятят на слабом огне. По окончании кипячения воду сливают, инструменты берут стерильным пинцетом, который кипятят вместе с остальными предметами.
Стерилизация прокаливанием. Бактериологические петли, сделанные из платиновой или нихромовой проволоки, стерилизуют в пламени спиртовой или газовой горелки. Такой способ стерилизации получил название прокаливания или фламбирования.
Петлю в горизонтальном положении вносят в нижнюю, наиболее холодную часть пламени, чтобы не произошло разбрызгивания находящегося на ней сжигаемого инфицированного материала. После того как он сгорит, петлю переводят в вертикальное положение, накаливают докрасна вначале нижнюю, а затем верхнюю часть проволоки и прожигают петле-держатель. Прокаливание в целом занимает 5–7 с.
Стерилизацию сухим жаром проводят в так называемых воздушных стерилизаторах – ВС (прежнее название – сухожаровая печь или печь Пастера).
Современная промышленность выпускает несколько модификаций ВС, основным различием которых является принцип устройства периодического и непрерывного действия. По форме они могут быть горизонтальными, вертикальными, круглыми, стационарными и переносными. Тем не менее каждый ВС состоит из корпуса, в котором расположены нагревательные элементы, стерилизационной (рабочей) камеры с решетчатыми полками для размещения на них стерилизуемых объектов.
Заданную температуру в рабочей камере поддерживают с помощью специальных терморегуляторов с пультом управления, который регулирует режим обработки изделий в зависимости от заданной температуры: 180 °С – 60 мин; 160 °С – 150 мин, после чего нагревательные элементы автоматически отключаются.
Упакованные соответствующим образом подлежащие стерилизации изделия загружают так, чтобы они лежали поперек пазов полок, не перекрывая продувочные окна и решетки вентиляции. Объемные изделия кладут на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха.
Правильная загрузка стерилизуемого материала в том количестве, которое допускает свободную подачу воздуха к нему, обеспечивает равномерное распределение горячего воздуха во всем объеме камеры.
Преимущества сухожарового метода стерилизации заключаются в том, что при его применении не наблюдается коррозии металлов и инструментов, не повреждаются стеклянные поверхности, равномерно нагреваются все объекты.
К недостаткам метода относится продолжительность цикла стерилизации, составляющая 2–4 ч в зависимости от объема стерилизационной камеры, количества стерилизуемых объектов и заданной температуры.
Стерилизация паром под давлением (автоклавирование). Наиболее часто используемым методом стерилизации является стерилизация паром под давлением в паровом стерилизаторе (автоклав).
При паровом методе стерилизации стерилизующим средством является насыщенный пар с давлением в стерилизационной камере 0,5–2,1 кгс/см2 и соответствующей температурой 110-135 °С.
Паровой стерилизатор состоит из двух котлов, вставленных друг в друга, конуса и герметически закрывающейся крышки. В зависимости от конструкции различают паровые стерилизаторы со встроенным или внешним парогенератором.
Из множества отечественных паровых стерилизаторов наиболее широко распространены в лабораториях страны вертикальные электрические автоклавы ВК-75 и ГК-100, выпускаемые Тюменским заводом медицинского оборудования. Поскольку они являются приборами повышенной опасности, их установка и эксплуатация должны строго подчиняться правилам техники безопасности, обеспечиваться регулярным техническим обслуживанием с ежегодной проверкой и клеймением манометра.
При работе с паровым стерилизатором очень большое значение имеет строгое соблюдение правил эксплуатации аппарата, имеющихся в паспорте прибора. Поэтому к работе на паровых стерилизаторах допускаются только лица, прошедшие специальное обучение, выдержавшие испытания перед квалификационной комиссией и получившие соответствующее удостоверение на право работы с паровым стерилизатором определенного образца.
Принципы этих правил являются общими для всех моделей паровых стерилизаторов, различия заключаются только в технике их исполнения, поэтому они могут быть освещены в нескольких основных положениях.
- Стерилизационную камеру парового стерилизатора загружают стерилизуемым материалом.
- Водопаровое пространство (между котлами) заполняют водой до отметки на водомерной трубке.
- Плотно закрывают крышку стерилизатора.
Для удаления воздуха из стерилизационной камеры используют различные приемы. В некоторых современных паровых стерилизаторах для этой цели предусмотрены вакуумные насосы, создающие высокий вакуум (вакуумные автоклавы).
Если паровой стерилизатор не имеет специального устройства для снижения давления, то, как в старых конструкциях, в начале работы воздух вытесняют, устанавливая автоклав на режим «текучего пара» (с открытым выпускным краном). При закипании воды из выпускного воздушного крана начинает выходить вытесняемый паром воздух, вначале отдельными порциями, затем непрерывной струей, что означает полное вытеснение из стерилизационной камеры воздуха. После этого кран закрывают, и в котле начинается постепенное повышение давления.
- • Началом стерилизации считается тот момент, когда стрелка манометра показывает заданное давление. После этого интенсивность подогрева уменьшается, для того чтобы давление в паровом стерилизаторе оставалось в течение нужного времени на одном уровне (табл. 4.4).
Таблица 4.4. Соотношение показаний манометра и температуры кипения воды
|
Показания манометра, кгс/см2 |
Температура кипения воды, °С |
Показания манометра, кгс/см2 |
Температура кипения воды, °С |
|
0 |
100 |
0,7 |
116 |
|
0,2 |
105 |
0,8 |
117 |
|
0,4 |
110 |
1 |
121 |
|
0,5 |
112 |
1,5 |
127 |
|
0,6 |
114 |
2 |
134 |
- По окончании срока стерилизации прекращают подогревание и продолжают наблюдать за стрелкой манометра, пока стрелка не упадет до нуля.
- Открывают пароотводный кран для выхода остатков пара и воды.
- После снижения давления в стерилизационной камере до нуля, открывают крышку стерилизатора и приступают к разгрузке стерилизационной камеры.
Температура и продолжительность стерилизации определяются качеством стерилизуемого материала и свойствами тех микроорганизмов, которыми он заражен (табл. 4.5).
Таблица 4.5. Режимы стерилизации, наиболее часто употребляемые в лабораторной практике
|
Объект |
Давление (кгс/см2) |
Температура (°С) |
Время (мин) |
Нормативный документ |
|
Изделия из коррозиестойкого металла, стекла, текстильных материалов, резины |
2±0,2 |
132 |
20±2 |
ОСТ 42-21-2-85 |
|
Изделия из резины, латекса и отдельных полимерных материалов |
1,1±0,2 |
120 |
45±3 |
ОСТ 42-21-2-85 |
|
Бактериальные культуры неспорообразующих бактерий I–II групп опасности |
1,5±0,2 |
126 |
60 |
СП 1.2.011-94 |
|
То же для спорообразующих бактерий |
2,0 |
132 |
90 |
СП 1.2.011-94 |
|
Питательные среды, растворы |
0,5-1,1 |
110–120 |
15-30 |
В соответствии с рецептами сред и растворов |
Примечание. Таблица из книги: Медицинские лабораторные технологии/Справочник. – СПб.: Интермедика, 2002.
Контроль температуры в стерилизационных камерах паровых и воздушных стерилизаторов осуществляется большей частью с помощью порошкообразных химических веществ – индикаторов, имеющих определенную температуру плавления (табл. 4.6). Запаянные ампулы с порошками, смешанными с небольшим количеством краски, помещаются в камеру со стерилизуемым материалом. Количество тестов и схемы расположения зависят от формы и размеров стерилизационной камеры.
Таблица 4.6. Показатели температуры плавления порошков-индикаторов
|
Химическое вещество – индикатор |
Температура, °С |
Примечание |
|
Бензонафтол |
110 |
На 100 г порошка-индикатора прибавляют 0,01 г сафранина, 0,005 г фуксина или метиленового синего |
|
Антипирин |
115 |
|
|
Серный цвет |
115 |
|
|
Резорцин чистый |
116 |
|
|
Бензойная кислота |
121 |
При достижении в камере определенной температуры порошки плавятся, образуя сплавы, окрашенные в цвет добавленной краски.
Недостаток химических тестов состоит в том, что цвет индикатора появляется даже при кратковременном воздействии температуры плавления на соответствующий химический индикатор.
Научно-производственной фирмой «ВИНАР» (Россия) создана комплексная система контроля критических параметров паровой (время, температура, насыщенный пар) и воздушной (время, температура) стерилизации, как в камере стерилизатора, так и внутри стерилизуемых упаковок и изделий.
Основой системы являются химические индикаторы. Они наносятся на прямоугольную полоску бумаги и представляют собой две цветные метки – индикаторную и эталон сравнения. Цвет индикаторной метки необратимо меняется при соблюдении требуемых условий стерилизации, приобретая темно-фиолетовый цвет (паровая стерилизация) или коричневый цвет (воздушная стерилизация) (рис. 4.1, а, б – см. вклейку).
Стерилизация текучим паром производится в текучепаровом аппарате Коха или в паровом стерилизаторе при незавинченной крышке и открытом выпускном кране.
Аппарат Коха представляет собой металлический полый цилиндр с двойным дном. Пространство между верхней и нижней пластинками дна заполняют на 2/3 водой (для спуска оставшейся после стерилизации воды имеется кран). Крышка аппарата имеет вмонтированный в центре термометр и несколько небольших отверстий для выхода пара.
Стерилизуемый материал загружают в камеру аппарата неплотно, чтобы обеспечить наибольшую возможность контакта с паром.
Началом стерилизации считается время закипания воды и поступления пара в стерилизационную камеру.
В текучепаровом аппарате стерилизуют главным образом питательные среды, свойства которых изменяются при температуре выше 100 °С. Стерилизацию текучим паром следует проводить повторно, так как однократное прогревание при 100 °С не обеспечивает полного обеспложивания стерилизуемого объекта.
Такой метод стерилизации получил название дробной стерилизации: обработку стерилизуемого материала текучим паром проводят по 30 мин ежедневно в течение 3 дней.
В промежутках между стерилизациями материал выдерживают при комнатной температуре для прорастания спор в вегетативные формы, которые погибают при последующих прогреваниях.
Тиндализация – дробная стерилизация с применением температуры ниже 100 °С, предложена Тиндалем.
Прогревание стерилизуемого материала производят в водяной бане, снабженной терморегулятором, по часу, при 60–65 °С в течение 5 дней или при 70–80 °С в течение 3 дней. В промежутках между прогреваниями обрабатываемый материал выдерживают при 25–37 °С для прорастания спор в вегетативные формы, которые погибают, при последующих прогреваниях.
В микробиологических лабораториях тиндализацией пользуются для обеспложивания питательных сред, свойства которых изменяются под действием высокой температуры, например жидкостей, содержащих в своем составе белок.
Механическая фильтрация с помощью бактериальных фильтров. Мембранные ультрафильтры из органического вещества нитроклетчатки представляют собой диски белого цвета диаметром 35 мм и толщиной 0,1 мм.
Бактериальные фильтры различаются между собой величиной пор и обозначаются порядковым номером (табл. 4.7).
Таблица 4.7. Бактериальные фильтры
|
Номер фильтра |
Средний диаметр пор, мкм |
|
1 |
0,3 |
|
2 |
0,5 |
|
3 |
0,7 |
|
4 |
0,9 |
|
5 |
1,2 |
Непосредственно перед употреблением мембранные фильтры стерилизуют кипячением. Фильтры помещают в дистиллированную воду, подогретую до температуры 50–60 °С, чтобы предупредить их скручивание, кипятят на слабом огне в течение 30 мин, меняя 2–3 раза воду. Простерилизованные фильтры осторожно, чтобы избежать их повреждения, вынимают из стерилизатора фламбированным и остуженным пинцетом с гладкими кончиками.
Мембранные фильтры используют для фильтрации жидкостей в специальном фильтровальном приборе (Зейтца или Рублевской водопроводной станции). Каждый из указанных выше приборов состоит из двух частей: верхней части, имеющей форму цилиндра или воронки, и нижней – опорной части аппарата, с так называемым фильтровальным столиком из металлической сетки или керамической пластинки, на которые помещают мембранный фильтр (рис. 4.2).
Рис. 4.2. Прибор Зейтца с воронкой.
Опорная часть аппарата имеет форму воронки, суживающаяся часть которой укрепляется в резиновой пробке горлышка колбы Бунзена.
В рабочем состоянии верхнюю часть прибора фиксируют на нижней с помощью винтов (в приборе Зейтца) или специального металлического кольца с двумя пазами, надетого на шейку воронки (в приборе Рублевской водопроводной станции).
Перед началом фильтрации места соединения разных частей установки для создания герметичности заливают парафином. Отводную трубку колбы присоединяют толстостенной резиновой трубкой к водоструйному, масляному или велосипедному насосу. После этого в цилиндр или воронку аппарата наливают фильтруемую жидкость и включают в действие насос, создающий вакуум в колбе Бунзена.
В результате образующейся разности давлений фильтруемая жидкость проходит через поры фильтра в приемник. Микробы остаются на поверхности фильтра.
Стерилизация — это уничтожение в материалах, продуктах, 
Стерилизация сухим теплом
Часто применяется в лабораторной практике. Для этого используются суховоздушные термостаты или сушильные шкафы. Высокие температуры гораздо эффективнее убивают живые клетки микроорганизмов, чем низкие температуры. Многие бактерии способны пережить обработку даже жидким кислородом при температуре -252 °С.
Обработка сухим теплом менее эффективна, чем влажным. Для полного уничтожения микроорганизмов в условиях влажного тепла нужно выдержать материал около 30 минут при +110-130 °С, а в суховоздушном шкафу — 45 минут при +180 °С.
Сухим теплом стерилизуют лабораторную стеклянную посуду (колбы, пипетки, пробирки, чашки Петри и пр.) при +160-200 °С. Чем ниже температура, тем дольше длится стерилизация: от 2 часов при +160 °С до 15 минут при +200 °С.
Стерилизация влажным теплом
Процедуру проводят в аппаратах Коха, похожих на бытовую пароварку. Вода кипит в нижнем отделении и пар стерилизует материалы, помещенные в верхнее отделение. Такой стерилизации обычно подвергают микробиологические среды, которые нельзя нагревать выше +100 °С.
Часто применяют дробную стерилизацию: выдерживают обрабатываемый раствор в течение часа при температуре около +70 °С, потом снижают температуру до оптимального для микроорганизмов уровня на сутки и опять нагревают, уничтожая все проросшие клетки. Так повторяют три-четыре раза.
Кипячение
Кипячением стерилизуют медицинские металлические инструменты, шприцы, резиновые перчатки, пинцеты, резиновые груши и т.п. Время процедуры отсчитывают от того момента, когда закипела вода.
Металлические инструменты кипятят в слабом (двухпроцентном) растворе гидрокарбоната натрия, который не оказывает на металл коррозионного действия.
Облучение

Пастеризация
Применяется для обработки продуктов питания и некоторых лабораторных образцов. Она подразумевает уничтожение многих живых микроорганизмов, грибковых спор при температуре не более 80 °С, в течение 10 минут или менее. При этом вкусовые качества продуктов не изменяются. Кроме этого, сохраняются некоторые виды полезных бактерий.
Прокаливание в пламени
Этим методом стерилизуют микробиологические петли и иглы, концы пинцетов, сверла для пробок и т. п., иногда стеклянные принадлежности. Прокаливание производится в пламени газовой горелки. Более технологичный способ — прокаливание при температуре до +850 °С в электрическом стерилизаторе. В этом случае удается избежать загрязнения инструментов продуктами горения пламени.
Фильтрование
Для стерилизации питательных сред или жидкостей, 
Химическая стерилизация
Для химической дезинфекции применяются самые разнообразные вещества:
- этиловый и изопропиловый спирты;
- соединения хлора (гипохлорит натрия, хлорамины) и йода;
- соединения тяжелых металлов, например, ртути, серебра;
- производные фенола;
- микробоцидные (убивающие микробы) газы, к которым относят пары формальдегида, пропиолактона, оксид этилена.
Химическая стерилизация используется в лабораториях для оперативной обработки, а также в тех случаях, когда невозможно использовать другие методы.
УТВЕРЖДАЮ
Руководитель Департамента
госсанэпиднадзора
Минздрава России
А.А.МОНИСОВ
30 декабря 1998 г.
N МУ-287-113
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКЕ И СТЕРИЛИЗАЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
Методические указания разработаны:
Научно — исследовательским институтом дезинфектологии Минздрава России
Пермским областным центром ГСЭН
Пермским городским центром ГСЭН
Пермской городской дезинфекционной станцией
Архангельским государственным медицинским институтом
| Авторы: | И.М.Абрамова, | Л.Г.Пантелеева, | Л.С.Федорова, |
| Н.В.Рамкова, | Г.Н.Мельникова, | Р.Л.Гутерман, | |
| Т.Н.Юшманова, | Т.М.Лебедева, | С.С.Николаева, | |
| В.В.Семериков, | В.Н.Северюхин, | И.С.Шарипова, | |
| Е.А.Каликова |
Методические указания предназначены для специалистов лечебно — профилактических учреждений (ЛПУ), работников дезинфекционной и санитарно — эпидемиологической служб.
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Дезинфекция, предстерилизационная очистка и стерилизация изделий медицинского назначения (далее изделия) направлена на профилактику внутрибольничных инфекций у пациентов и персонала лечебно — профилактических учреждений (ЛПУ).
1.2. Дезинфекцию изделий проводят с целью уничтожения патогенных и условно — патогенных микроорганизмов — вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), бактерий (включая микобактерии туберкулеза), грибов на изделиях медицинского назначения, а также в их каналах и полостях.
Дезинфекции подлежат все изделия после применения их у пациента. После дезинфекции изделия применяют по назначению или (при наличии показаний) подвергают предстерилизационной очистке и стерилизации.
1.3. Стерилизацию изделий проводят с целью умерщвления на изделиях или в изделиях микроорганизмов всех видов, в том числе споровых форм микроорганизмов. Стерилизации подлежат все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью в организме пациента или вводимой в него, инъекционными препаратами, а также изделия, которые в процессе эксплуатации контактируют со слизистой оболочкой и могут вызвать ее повреждение.
1.4. Изделия многократного применения, подлежащие стерилизации, перед стерилизацией подвергают предстерилизационной очистке.
Предстерилизационную очистку проводят с целью удаления с изделий белковых, жировых и механических загрязнений, а также остатков лекарственных препаратов.
1.5. В качестве средств дезинфекции, предстерилизационной очистки и стерилизации используют только разрешенные в установленном порядке в Российской Федерации физические и химические средства.
1.6. При выборе средств следует учитывать рекомендации изготовителей изделий, касающиеся воздействия конкретных средств (из числа разрешенных в нашей стране для данной цели) на материалы этих изделий.
При проведении дезинфекции, предстерилизационной очистки и стерилизации допускается использование только того оборудования (установки, моечные машины, стерилизаторы и др.), которое разрешено в установленном порядке к промышленному выпуску и применению (в случае импортного оборудования — разрешенного к применению) в Российской Федерации.
1.7. Емкости с растворами дезинфицирующих, моющих и стерилизующих средств должны быть снабжены крышками, иметь четкие надписи с указанием названия средства, его концентрации, назначения, даты приготовления (для готовых к применению средств, разрешенных для многократного использования, указывают дату начала использования средства).
1.8. Рекомендации по дезинфекции, предстерилизационной очистке и стерилизации сложных по конструкции изделий (эндоскопы, медицинские инструменты к гибким эндоскопам и др.), а также дополнительные сведения, касающиеся различных аспектов указанных видов обработки изделий, более подробно изложены в ряде официальных инструктивно — методических документов, указанных в приложении 1.
1.9. Перечень дезинфекционных средств и методических документов по их применению приведен в приложении 2.
2. ДЕЗИНФЕКЦИЯ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
2.1. Дезинфекцию изделий осуществляют физическим (кипячение, водяной насыщенный пар под избыточным давлением, сухой горячий воздух) и химическим (использование растворов химических средств) методами. Выбор метода дезинфекции зависит от особенностей изделия и его назначения.
2.2. Физический метод дезинфекции надежен, экологически чист и безопасен для персонала, поэтому в тех случаях, когда позволяют условия (оборудование, номенклатура изделий и т.д.) при проведении дезинфекции изделий предпочтение следует отдать этому методу.
2.3. Дезинфекцию с использованием физического метода выполняют: способом кипячения в дистиллированной воде или в воде с добавлением натрия двууглекислого (сода пищевая); паровым методом (в паровом стерилизаторе — автоклаве) и воздушным методом (в воздушном стерилизаторе).
2.3.1. Дезинфекции способом кипячения подвергают изделия из стекла, металлов, термостойких полимерных материалов и резин. Перед кипячением изделия очищают от органических загрязнений, промывая водопроводной водой с соблюдением мер противоэпидемической защиты. Отсчет времени дезинфекционной выдержки начинают с момента закипания воды.
2.3.2. Паровым методом дезинфицируют изделия из стекла, металлов, резин, латекса, термостойких полимерных материалов. Предварительная очистка изделий не требуется. Их складывают в стерилизационные коробки и помещают в паровой стерилизатор. Дезинфекция осуществляется воздействием водяного насыщенного пара под избыточным давлением.
2.3.3. Дезинфекцию воздушным методом изделий из стекла, металлов, силиконовой резины проводят без упаковки в воздушных стерилизаторах. Этим методом можно дезинфицировать только изделия, незагрязненные органическими веществами. Режимы дезинфекции физическим методом представлены в таблице 2.1.
Таблица 2.1.
Дезинфекция физическими методами
| Метод дезинфекции | Дезинфицирующий агент | Режимы дезинфекции | Применяемость | Условия проведения дезинфекции | Применяемое оборудование | |||
| Температура, град. С | Время выдержки, мин | |||||||
| Номинальное значение | Предельное отклонение | Номинальное значение | Предельное отклонение | |||||
| Кипячение | Дистиллированная вода | 99 | +/- 1 | 30 | +5 | Для изделий из стекла, металлов, термостойких полимерных материалов, резин, латекса | Полное погружение изделий в воду | Кипятильник дезинфекционный |
| Дистиллированная вода с натрием двууглекислым 2% (пищевая сода) | 15 | |||||||
| Паровой | Водяной насыщенный пар под избыточным давлением Р=0,05 МПа (0,5 кгс/кв. см) | 110 | +/- 2 | 20 | Для изделий из стекла, металлов, термостойких полимерных материалов, резин, латекса | В стерилизационных коробках | Паровой стерилизатор; камеры дезинфекционные | |
| Воздушный | Сухой горячий воздух | 120 | +/- 3 | 45 | Для изделий из стекла, металлов, силиконовой резины | Без упаковки (в лотках) | Воздушный стерилизатор |
2.4. Дезинфекцию с использованием химических средств проводят способом погружения изделий в раствор в специальных емкостях из стекла, пластмасс или покрытых эмалью без повреждений. Наиболее удобно применение специальных контейнеров, в которых изделия размещают на специальных перфорированньк решетках. Разъемные изделия дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором.
Для изделий и их частей, не соприкасающихся непосредственно с пациентом, может быть использован способ двукратного протирания салфеткой из бязи или марли, смоченной в растворе дезинфицирующего средства. Способом протирания не рекомендуется применять средства, содержащие альдегиды (Глутарал, Глутарал-Н, Сайдекс, Гигасепт ФФ, Бианол, Формалин и др.), а также Дезоксон-1 и Дезоксон-4 во избежание побочного токсического эффекта.
2.5. Для дезинфекции изделий разрешены к применению дезинфицирующие средства отечественного и зарубежного производства из следующих основных химических групп соединений: катионных поверхностно — активных веществ (ПАВ), окислителей, хлорсодержащих средств, средств на основе перекиси водорода, спиртов, альдегидов.
2.6. Более щадящим действием по отношению к материалам, из которых изготавливаются медицинские изделия, обладают альдегидсодержащие средства: Глутарал, Глутарал-Н, Бианол, Аламинол, Сайдекс, Гигасепт ФФ, Лизоформин 3000, Дезоформ, Альдазан 2000, Секусепт — форте, Септодор — Форте и др. Эти средства рекомендованы для изделий из стекла, металлов, резин, пластмасс, в том числе термолабильных.
Недостатком многих средств из этой группы является их способность фиксировать органические загрязнения на поверхности и в каналах изделий. Во избежание этого изделия необходимо сначала отмыть от загрязнений с соблюдением противоэпидемических мер, а затем дезинфицировать, о чем есть сведения в Методических указаниях по применению конкретных средств.
2.7. Применение спирта этилового синтетического ректификованного рекомендовано только для дезинфекции инструментов из металлов. Для дезинфекции изделий не только из металлов, но и других материалов разрешены к применению средства на основе спиртов и катионных ПАВ: Гибитан, Велтосепт.
Средства, содержащие спирты, также обладают свойством фиксировать загрязнения органического происхождения, что обуславливает необходимость предварительного отмыва загрязненных изделий перед дезинфекцией с соблюдением противоэпидемических мер.
2.8. Хлорсодержащие средства (хлорамин Б или ХБ, ДП-2, Пресепт, Клорсепт и др.), а также большинство средств на основе перекиси водорода (перекись водорода с 0,5% моющего средства, Пероксимед, ПВК и др.) предназначены для дезинфекции изделий из коррозионностойких металлов, а также других материалов — резин, пластмасс, стекла.
Для дезинфекции изделий медицинского назначения допускается применение перекиси водорода медицинской и технической (марки А и Б).
2.9. Дезинфицирующие средства с моющим действием, такие как Пероксимед, нейтральные анолиты, Лизетол АФ, Септодор — Форте, Виркон и др. могут быть использованы для дезинфекции изделий медицинского назначения и предстерилизационной очистки в едином процессе обработки.
2.10. Дезинфекцию изделий химическим методом осуществляют одним из средств по режимам, представленным в табл.2.2.
Таблица 2.2.
Дезинфекция химическим методом
| Название дезинфицирующего средства и фирмы — производителя | Вид инфекции | Режимы дезинфекции | Применение | |
| Концентрация раствора, %<*> | Время выдержки, мин | |||
| 1 | 2 | 3 | 4 | 5 |
| Аламинол (Россия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
8,0 1,0 3,0 3,0 3,0 |
60 60 90 90 60 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе стоматологических инструментов |
| Бианол (Россия) |
вирусные, бактериальные, туберкулез, кандидозы, дерматофитии |
1,5<**> | 30<**> | Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов и инструментов к ним |
| Глутарал (Россия), Глутарал-Н (Россия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
Без разведения | 15 15 90 90 90 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Сайдекс («Джонсон энд Джонсон Медикал Лтд», США) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
Без разведения | 15 15 90 30 90 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Стераниос 20% концентрированный («Аниос», Франция) | вирусные, бактериальные, туберкулез, дерматофитии |
1,0 <**> | 15 <**> | Для изделий из стекла (кроме микропипеток), металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| То же | 1,0 | 30 | Для микропипеток | |
| Формалин (по формальдегиду) |
вирусные бактериальные туберкулез дерматофитии |
4,0 3,0 10,0 10,0 |
60 30 60 60 |
Для изделий из стекла, металлов, пластмасс, резин |
| Гигасепт ФФ («Шюльке и Майр», Германия) |
вирусные, бактериальные, туберкулез, дерматофитии |
10,0<**> | 60<**> | Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Септодор — форте («Хэппи Дэй-М», Россия; «Дорвет Лтд», Израиль) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,4 0,1 0,4 0,2 0,4 |
60 60 90 60 90 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Лизоформин 3000 («Лизоформ Д-р Ганс Роземанн ГмбХ», Берлин/Германия) |
вирусные, бактериальные, туберкулез, кандидозы, дерматофитии |
0,75 <**> | 60 <**> | Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Альдазан 2000 («Лизоформ Д-р Ганс Роземанн ГмбХ», Берлин/Германия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
6,0 3,0 3,0 3,0 3,0 |
60 60 60 60 60 |
Для изделий из стекла, металлов, пластмасс, резин |
| Дезоформ («Лизоформ Д-р Ганс Роземанн ГмбХ», Берлин/Германия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
1,0 1,0 1,0 1,0 1,0 |
60 90 90 120 120 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Корзолин и Д («Боде Хеми ГмбХ и Ко», Германия) |
вирусные бактериальные туберкулез кандидозы |
10,0 3,0 3,0 3,0 |
15 60 60 60 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Секусепт — форте («Хенкель Эколаб АБ», Финляндия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
5,0 1,5 5,0 3,0 3,0 |
30 60 30 30 30 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| КолдСпор («Метрекс Ресерч Корпорейшн», США) |
вирусные, бактериальные, туберкулез, кандидозы, дерматофитии |
10,0<**> | 10<**> | Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Деконекс 50 ФФ («Борер Хеми АГ», Швейцария) |
вирусные бактериальные туберкулез кандидозы |
2,0 1,0 1,5 1,5 |
30 30 120 90 |
Для изделий из стекла, металлов, пластмасс, резин |
| Хелипур Х плюс («Б.Браун Мельзунген АГ», Германия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
3,0 1,5 2,5 1,5 1,5 |
120 60 90 20 120 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Антисептика комби инструментен — дезинфекцион («Научно — производственное объединение Антисептика», Германия) |
вирусные, бактериальные, туберкулез, кандидозы, дерматофитии |
2,0 <**> | 60 <**> | Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Альдесол («Плива», Хорватия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
12,0 2,0 3,0 3,0 3,0 |
30 30 60 30 120 |
Для изделий из стекла, металлов, пластмасс, резин |
| Дюльбак растворимый («Петтенс — Франс — Химия», Франция) |
вирусные бактериальные туберкулез кандидозы |
Без разведения | 15 15 90 15 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Лизетол АФ («Шюльке и Майр», Германия) |
вирусные бактериальные туберкулез дерматофитии |
4,0 2,0 2,0 2,0 |
15 30 60 60 |
Для изделий из стекла, металлов, пластмасс, резин |
| Хлоргексидина глюконат (Гибитан) (спиртовой раствор) («Польфа», Польша) («Ай-Си-Ай», Англия) |
вирусные бактериальные (кроме туберкулеза) |
0,5 0,5 |
30 15 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов, инструментов к ним |
| Велтосепт (Россия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
Без разведения | 15 15 30 15 15 |
Для изделий из стекла, металлов, полимерных материалов, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Спирт этиловый (Россия) |
вирусные бактериальные кандидозы |
70,0 70,0 70,0 |
30 15 30 |
Для изделий из металлов |
| Дюльбак ДТБ/Л (Дюльбак Макси) («ПФХ Петтенс Химия», Франция) |
вирусные, бактериальные (кроме туберкулеза) |
2,0 <**> | 15 <**> | Для изделий из стекла, металлов, пластмасс, резин |
| Пливасепт 5% глюконат без ПАВ («Плива», Хорватия) |
вирусные, бактериальные, туберкулез, кандидозы, дерматофитии |
0,5 водноспиртовой раствор | 30 | Для изделий из стекла, металлов, пластмасс, резин |
| Велтолен (Россия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
2,5 1,0 5,0 2,5 2,5 |
60 60 60 60 60 |
Для изделий из стекла, металлов, полимерных материалов, резин, в том числе эндоскопов, инструментов к ним, стоматологических инструментов |
| Дезэффект (Санифект-128) («Ликва-Тех. Индастриез Инк»., США) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
3:128 3:128 3:128 3:128 3:128 |
60 30 60 60 120 |
Для изделий из стекла, металлов, пластмасс, резин, в том числе эндоскопов и инструментов к ним |
| Перекись водорода (Россия) |
вирусные бактериальные туберкулез дерматофитии |
4,0 3,0 3,0 3,0 |
90 80 180 180 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| Перекись водорода с 0,5% моющего средства («Прогресс», «Астра» «Айна», «Лотос», «Маричка», Россия) |
вирусные бактериальные туберкулез дерматофитии |
4,0 3,0 3,0 3,0 |
90 80 180 180 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| Пероксимед (Россия) |
вирусные бактериальные туберкулез дерматофитии |
3,0 3,0 3,0 3,0 |
60 30 120 180 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| ПВК (Россия) |
вирусные бактериальные (кроме туберкулеза) |
3,0 0,5 |
60 30 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| Виркон («КРКА», Словения) |
вирусные, бактериальные (кроме туберкулеза) | 2,0 <**> | 10 <**> | Для изделий из стекла, коррозионностойких металлов, пластмасс, резин (кроме эндоскопов) |
| вирусные, бактериальные (кроме туберкулеза) | 2,0 <**> | 30 <**> | Эндоскопы | |
| Секусепт пульвер («Хенкель Эколаб АБ», Финляндия) |
вирусные бактериальные (кроме туберкулеза) кандидозы дерматофитии |
2,0 2,0 2,0 |
120 60 60 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| Виркон («Натуран», Польша) |
вирусные, бактериальные, (кроме туберкулеза) | 2,0 <**> | 10 <**> | Для изделий из коррозионностойких металлов |
| вирусные, бактериальные (кроме туберкулеза) | 2,0 <**> | 30 <**> | Для изделий из стекла, полимерных материалов | |
| Дезоксон-1, Дезоксон-4 (Россия) |
вирусные бактериальные туберкулез |
0,5 0,1 0,5 |
60 15 60 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| ДП-2 (Россия) |
вирусные бактериальные туберкулез |
0,5 0,1 0,5 |
60 60 60 |
Для изделий из стекла, коррозионностойких металлов, пластмасс, резин |
| Клорсепт («Медентек Лтд», Ирландия) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,1 0,1 0,3 0,2 0,2 |
60 60 60 60 60 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов (резин, пластмасс) |
| Жавелион («ETC Линоссиер», Франция) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,1 0,1 0,2 0,2 0,2 |
60 60 60 60 60 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов |
| Пюржавель («Гидрохим», Франция) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,1 0,1 0,2 0,2 0,2 |
60 60 60 60 60 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов |
| Деохлор («ПФХ Петтенс Химия», Франция) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,1 0,1 0,2 0,2 0,2 |
15 15 60 15 15 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов |
| Пресепт («Джонсон и Джонсон Медикал», США) |
вирусные бактериальные туберкулез кандидозы дерматофитии |
0,056 0,056 0,28 0,112 0,163 |
90 90 45 30 30 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов |
| Хлорамин (Россия) |
вирусные бактериальные туберкулез дерматофитии |
3,0 1,0 5,0 5,0 |
60 30 240 240 |
Для изделий из стекла, коррозионностойких металлов, полимерных материалов |
| Гипохлорит натрия, получаемый электрохимическим методом | вирусные бактериальные (кроме туберкулеза) дерматофитии |
0,5 0,25 0,3 |
60 15 60 |
Для изделий из стекла, пластмасс (ПВХ), силиконовой резины |
| Анолиты | вирусные бактериальные туберкулез кандидозы дерматофитии |
0,02-0,05 0,02-0,05 0,02-0,06 0,02-0,06 0,02-0,06 |
30-180 30-180 30-300 60-240 30-240 |
Для изделий из стекла, пластмасс (ПВХ), силиконовой резины |
| Деконекс денталь ББ («Борер Хеми АГ», Швейцария) |
вирусные, бактериальные (кроме туберкулеза) | Без разведения | 30 | Для вращающихся стоматологических инструментов |
| Гротанат Борербад («Шюльке и Майр», Германия) |
вирусные бактериальные туберкулез кандидозы |
Без разведения | 30 | Для вращающихся стоматологических инструментов |
| ИД 220 («Дюрр Денталь Орохим», Германия) |
вирусные бактериальные туберкулез кандидозы |
Без разведения | 30 | Для вращающихся стоматологических инструментов |
| ИД 212 («Дюрр Денталь Орохим», Германия) |
вирусные бактериальные туберкулез кандидозы |
4,0 2,0 4,0 2,0 |
60 60 60 60 |
Для изделий из резин, металлов, стекла, пластмасс, стоматологических инструментов |
| Шюльке и Майр — МАТИК («Шюльке и Майр», Германия) |
вирусные, бактериальные, туберкулез, кандидозы | 2,0 <**> | 2 <**> | Отсасывающие стоматологические системы |
| Оротол Ультра («Дюрр Денталь Орохим», Германия) |
вирусные, бактериальные, туберкулез, кандидозы | 1,0 <**> | 2 <**> | Отсасывающие стоматологические системы |
| вирусные, бактериальные, туберкулез, кандидозы | 1,0 <**> | 180 <**> | Слюноотсосы |
Примечания:
<*> Концентрации рабочих растворов средств Глутарал, Глутарал-Н, формалин, хлоргексидина глюконат (Гибитан), спирт этиловый, Пливасепт 5% глюконат без ПАВ, Пливасепт 5% концентрат с ПАВ перекись водорода, перекись водорода с моющим средством, Пероксимед, ПВК, Дезоксон-1 и Дезоксон-4, Клорсепт, Жавелион, Пюржавель, Деохлор, Пресепт, гипохлорит натрия, анолиты приведены по ДВ, остальных средств — по препарату.
<**> Указанный режим эффективен для дезинфекции изделий при всех перечисленных инфекциях.
2.10.1. Режимы дезинфекции химическим методом даны в пяти вариантах: 1-я строка — при вирусных гепатитах, ВИЧ-инфекции, энтеровирусных, ротавирусных инфекциях; 2-я строка — следует применять для предупреждения гнойных заболеваний, кишечных и капельных инфекций бактериальной этиологии, острых респираторных вирусных инфекций (грипп, аденовирусные заболевания и др.); 3- я строка — при туберкулезе; 4-я строка — при кандидозах; 5-я строка — при дерматофитиях. В случаях, когда в таблице приведен один вариант (средства КолдСпор, Деконекс денталь ББ и др.) он распространяется на все виды возбудителей.
2.10.2. При отсутствии обоснованных показаний к проведению дезинфекции по режимам для инфекций бактериальной этиологии (исключая туберкулез), дезинфекцию проводят по режимам для вирусных инфекций.
2.10.3. Прочерки в графах «концентрация раствора» и «время выдержки» означают, что применение дезинфицирующего средства не рекомендовано.
2.10.4. Для дезинфекции эндоскопов могут быть использованы следующие дезинфицирующие средства: Бианол, Глутарал, Глутарал-Н, Сайдекс, Гигасепт ФФ, Септодор-форте, Велтолен, Велтосепт и др. Подробно методика проведения дезинфекции эндоскопов изложена в Методических указаниях по применению конкретных средств (приложение 1).
2.11. По окончании дезинфекционной выдержки изделия промывают проточной питьевой водой. Оставшиеся загрязнения тщательно отмывают с помощью механических средств (ерши, щетки, салфетки марлевые или бязевые и др.).
2.12. После дезинфекции изделия используют по назначению или (при наличии показаний) подвергают дальнейшей предстерилизационной очистке и стерилизации.
2.13. Дезинфекция изделий медицинского назначения в стоматологии.
2.13.1. Изделия медицинского назначения, применяемые в стоматологии, отличаются разнообразием по конструкции, по составу входящих в них материалов, по назначению и поэтому требуют тщательного выбора метода и средства дезинфекции.
2.13.2. Стоматологические изделия, выдерживающие воздействие высоких температур, дезинфицируют кипячением или воздействием сухого горячего воздуха.
2.13.3. Для дезинфекции стоматологических инструментов рекомендованы средства на основе альдегидов, спиртов, катионных ПАВ, содержащих, кроме действующих веществ, анионные и неионогенные ПАВ, ингибиторы коррозии и другие компоненты (Аламинол, Деконекс Денталь ББ, Гротанат Борербад, ИД 220, ИД 212, Сайдекс, Дезэффект (Санифект-128), Велтолен, Велтосепт и др.).
По окончании дезинфекционной выдержки изделия промывают проточной питьевой водой (см. п.2.11).
2.13.4. Средства Шюльке и Майр-Матик и Оротол Ультра применяют для дезинфекции стоматологических отсасывающих систем. Подробные сведения об использовании этих средств имеются в Методических указаниях по их применению.
2.13.5. Дезинфекцию стоматологических оттисков осуществляют после их предварительного промывания водой с соблюдением мер противоэпидемической защиты. Во время промывания оттисков следует избегать разбрызгивания смывных вод.
2.13.6. Дезинфекцию оттисков проводят способом погружения в раствор дезинфицирующего средства. Выбор дезинфицирующего средства обусловлен видом оттискного материала. Набор дезинфицирующих средств для обеззараживания оттисков из силиконовых материалов шире, чем для оттисков из альгинатных материалов.
2.13.7. Режимы дезинфекции оттисков представлены в таблице 2.3., они обеспечивают обеззараживание их от вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), бактерий, грибов рода Кандида.
2.13.8. После дезинфекции оттиски промывают водой для удаления остатков дезинфицирующего средства.
2.14. Контроль качества дезинфекции изделий медицинского назначения проводят в соответствии с изложенным в приложении 3.
Таблица 2.3.
Режимы дезинфекции стоматологических оттисков
| Дезинфицирующее средство | Режимы дезинфекции | Применение | |
| Концентрация раствора,% | Время выдержки, мин | ||
| Глутарал (Россия) | Без разведения | 10 | Оттиски альгинатные (кальцинат, стомальгин, упин) и силиконовые (сиэласт — 03, 05, 69, дентафлекс) |
| Глутарал Н (Россия) | Без разведения | 10 | Оттиски альгинатные (кальцинат, стомальгин, упин) и силиконовые (сиэласт — 03, 05, 69, дентафлекс) |
| Сайдекс («Джонсон энд Джонсон Медикал Лтд», США) | Без разведения | 10 | Оттиски альгинатные (кальцинат, стомальгин, упин) и силиконовые (сиэласт — 03, 05, 69, дентафлекс) |
| Перекись водорода (Россия) | 4,0 | 15 | Оттиски силиконовые |
| Дезоксон-1 (Россия) | 0,1 | 10 | Оттиски силиконовые |
| Дезоксон-4 (Россия) | 0,1 | 10 | Оттиски силиконовые |
| Гипохлорит натрия, получаемый электрохимическим методом | 0,5 | 20 | Оттиски силиконовые |
| МД-520 («Дюрр-Денталь Орохим», Германия) | Без разведения | 10 | Оттиски альгинатные, силиконовые, из полиэфирной смолы, гидроколлоида; зубопротезные заготовки из металлов, керамики, пластмасс и др. материалов, коррозионностойкие артикуляторы |
Примечание. Концентрация дезинфицирующих растворов приведена по действующему веществу
3. ПРЕДСТЕРИЛИЗАЦИОННАЯ ОЧИСТКА
3.1. Предстерилизационную очистку изделий медицинского назначения осуществляют после их дезинфекции и последующего отмывания остатков дезинфицирующих средств проточной питьевой водой (п. 2.11.).
Предстерилизационную очистку лигатурного шовного материала (нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные) в ЛПУ не проводят.
3.2. Для предстерилизационной очистки используют средства, указанные в табл. 3.1., в том числе электрохимически активированные растворы (католиты, анолиты), вырабатываемые в диафрагменных электрохимических установках, разрешенных к промышленному выпуску в установленном порядке.
Раствор, содержащий перекись водорода и моющее средство (Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс), готовят в условиях ЛПУ, применяя перекись водорода медицинскую или техническую (марки А и Б). Для снижения коррозионного действия моющих растворов, содержащих перекись водорода с моющим средством Лотос или Лотос — автомат, целесообразно использовать ингибитор коррозии — 0,14% олеата натрия.
3.3. Предстерилизационную очистку проводят ручным или механизированным (с помощью специального оборудования) способом.
Предстерилизационную очистку ручным способом осуществляют в соответствии с табл. 3.2. и 3.3., используя емкости из пластмасс, стекла или покрытых эмалью (без повреждений).
Методика проведения предстерилизационной очистки механизированным способом должна соответствовать инструкции по эксплуатации, прилагаемой к конкретному оборудованию.
3.4. При наличии у средства, наряду с моющими, также и антимикробных свойств (в том числе обязательно в отношении возбудителей парентеральных вирусных гепатитов и ВИЧ-инфекции) предстерилизационная очистка изделий на этапе замачивания или кипячения в растворе может быть совмещена с их дезинфекцией в соответствии с табл. 3.4.
3.5. Разъемные изделия подвергают предстерилизационной очистке в разобранном виде.
При замачивании или кипячении в моющем растворе изделия полностью погружают в раствор моющего средства, заполняя им каналы и полости изделий.
Мойку изделий осуществляют с помощью ерша, ватно-марлевых тампонов, тканевых салфеток; каналы изделий промывают с помощью шприца. Использование ерша при очистке резиновых изделий не допускается.
3.6. Для предстерилизационной очистки растворы средств Биолот, Биолот-1, Лизетол АФ, Бланизол, Пероксимед, Септодор, Векс — Сайд, а также средство Гротанат Борербад, католиты и анолиты используют однократно; растворы средств Луч, Зифа, Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) — двукратно.
Растворы остальных средств допускается применять до загрязнения (появление первых признаков изменения внешнего вида), но не более чем в течение времени, указанного в методическом документе по применению конкретного средства.
При применении растворов, содержащих перекись водорода с моющим средством, растворов моющих средств Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс, а также натрия двууглекислого неизмененный раствор можно использовать до шести раз в течение рабочей смены.
3.7. Сушку изделий из натурального латекса проводят в соответствии с режимом, указанным в инструкциях по применению этих изделий.
Сушку изделий, имеющих оптические детали, проводят путем протирания чистой тканевой салфеткой и просушиванием при комнатной температуре.
3.8. Контроль качества предстерилизационной очистки изделий проводят в соответствии с изложенным в приложении 4.
Таблица 3.1.
Средства предстерилизационной очистки
| Наименование средства | Концентрация рабочего раствора,%<*> | Способ очистки | Вид изделий |
| 1 | 2 | 3 | 4 |
| Биолот, Биолот-1 (Россия) | 0,15 | Механизированный (ротационный метод) | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты, эндоскопы, инструменты к гибким эндоскопам |
| 0,3 | Механизированный (струйный метод, использование ультразвука, ершевание) | ||
| 0,5 | Ручной | ||
| Аламинол («НИОПИК», Россия) | 5,0 или 8,0 | Ручной | Изделия из стекла, резин, пластмасс, металлов (исключая углеродистую сталь), в т.ч. стоматологические инструменты |
| Деконекс 50 ФФ («Борер Хеми АГ», Швейцария; | 1,5 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты |
| Лизетол АФ («Шюльке и Майр ГмбХ», Германия) | 2,0 | Ручной | Изделия из стекла, резин, пластмасс, металлов |
| 4,0 | |||
| 5,0 | |||
| Велтолен («ВЕЛТ», Россия) | 1,0; 1,5 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты, эндоскопы, инструменты к гибким эндоскопам |
| 1,0 | Механизированный (использование ультразвука) | Вращающиеся стоматологические инструменты | |
| Дезэффект (Санифект-128) («Ликва-Тех. Индастриез Инк.», США) | 2,3; 3,8 (3:128; 5:128) |
Ручной | Изделия из стекла, резин, пластмасс, металлов |
| Деконекс денталь ББ («Борер Хеми АГ», Швейцария) | Применяют без разведения | Ручной и механизированный (использование ультразвука) | Вращающиеся стоматологические инструменты |
| Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) («ПФХ Петгенс — Химия», Франция) | 2,0 | Ручной | Изделия из стекла, резин, пластмасс, металлов |
| ИД 212 («Дюрр Денталь — Орохим», Германия) | 2,0 | Ручной | Хирургические и стоматологические (включая вращающиеся) инструменты простой конфигурации |
| 4,0 | Хирургические и стоматологические инструменты, имеющие замковые части | ||
| Септабик («Абик», Израиль) | 0,15; 0,2 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты, эндоскопы, инструменты к гибким эндоскопам |
| Септодор («Дорвет Лтд.», Израиль) | 0,2; 0,3 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты, эндоскопы, инструменты к гибким эндоскопам |
| Септодор — Форте («Дорвет Лтд.», Израиль) | 0,4 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты (включая вращающиеся), эндоскопы, инструменты к гибким эндоскопам |
| Раствор, содержащий: — перекись водорода и — моющее средство (Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс) |
0,5 0,5 |
Механизированный (струйный метод, использование ультразвука, ершевание) и ручной | Изделия из стекла, резин, пластмасс, коррозионностойких металлов |
| Пероксимед (Россия) | 3,0 | Ручной | Изделия из стекла, резин, пластмасс, коррозионно-тойких металлов |
| 5,0 | Механизированный (использование ультразвука) | ||
| Виркон («КРКА», Словения) | 1,0 | Механизированный (обработка в установке КРОНТ-УДЭ-1) | Гибкие эндоскопы |
| 2,0 | Ручной | Изделия из стекла, резин, пластмасс, металлов (кроме гибких эндоскопов) | |
| Лотос, Астра, Прогресс | 0,5 | Механизированный (использование ультразвука) | Изделия из стекла, резин, пластмасс, металлов |
| 1,5 | Ручной (с применением кипячения) | ||
| Лотос — автомат, Айна, Маричка | 1,5 | Ручной (с применением кипячения) | Изделия из стекла, резин, пластмасс, металлов |
| ЗИФА (АООТ «Сода», Россия) | 0,5 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты |
| ЛУЧ (АООТ «Сода», Россия) | 0,5 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. стоматологические инструменты |
| Натрий двууглекислый (пищевая сода) | 2,0 | Ручной (с применением кипячения) | Изделия из стекла, резин, пластмасс, металлов |
| 3,0 | Ручной | ||
| Бланизол («Лизоформ Д-р Ханс Роземанн ГмбХ», Германия) | 1,0 | Ручной | Изделия из стекла, резин, пластмасс, металлов, в т.ч. эндоскопы |
| Анолиты <**> (Россия) | 0,01; 0,02; 0,03; 0,05 |
Ручной | Изделия из стекла, резин, пластмасс, коррозионностойких металлов (сплавы титана) |
| Католиты <**> (Россия) | Применяют без разведения | Ручной | Изделия из стекла, резин, пластмасс, металлов |
| Векс — Сайд («Вексфорд Лэбз., Инк.», США) | 0,4 (1:256) |
Ручной | Хирургические инструменты |
| Гротанат Борербад («Шюльке и Майр», Германия) | Применяют без разведения | Ручной и механизированный (использование ультразвука) | Вращающиеся стоматологические инструменты |
Примечания:
<*> Концентрация перекиси водорода, растворов средства Пероксимед, а также анолитов приведена по действующему веществу, остальных средств — по препарату; концентрация средств Дезэффект (Санифект-128) и Векс — Сайд дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<**> Электрохимически активированные растворы с рН от 5,5 до 8,4 в зависимости от типа анолита («нейтральный анолит», «нейтральный анолит АНК»), вырабатываемые в установках СТЭЛ-МТ-1, СТЭЛ-4Н-60-01, СТЭЛ-4Н-60-02, СТЭЛ-10Н-120-01; применяют без разведения. Конкретные концентрации анолита приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
<***> Электрохимически активированные растворы с рН от 9,0 до 12,0, вырабатываемые в установках ЭХА-30, СТЭЛ-10АК-120-01, СТЭЛ-МТ-2, УМЭМ; применяют без разведения.
Таблица 3.2.
Предстерилизационная очистка ручным способом с применением замачивания в моющем растворе
| Этапы при проведении очистки | Режим очистки | ||
| Концентрация рабочего раствора,% <1> | Температура рабочего раствора, град. С | Время выдержки /обработки, мин | |
| 1 | 2 | 3 | 4 |
| Замачивание в моющем растворе при полном погружении изделия при применении средства: — Биолот, Биолот-1 |
0,5 | 40 <2> | 15 |
| — Аламинол | 5,0 или 8,0 <3> |
Не менее 18 |
60 |
| — Деконекс 50 ФФ | 1,5 | То же | 30 и 60 <4> |
| — Лизетол АФ | 2,0 4,0 5,0 |
-«- -«- -«- |
60 30 15 |
| — Велтолен | 1,0; 1,5 | -«- | 15 |
| — Дезэффект (Санифект-128) | 2,3 (3:128) 3,8 (5:128) |
50 <2> То же |
60 30 |
| — Деконекс денталь ББ | Применяют без разведения | Не менее 18 | 30 |
| — Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) | 2,0 | То же | 30 |
| — ИД 212 | 2,0 4,0 |
-«- -«- |
60 30 |
| — Септабик | 0,15 0,20 |
-«- -«- |
30 20 |
| — Септодор | 0,2 0,2 0,3 |
45 <2> Не менее 18 То же |
15 30 15 |
| — Септодор — Форте <5> | 0,4 | -«- | 60 |
| — раствор, содержащий перекись водорода и моющее средство (Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс) |
0,5 0,5 |
50 <2> | 15 |
| — Пероксимед | 0,5 3,0 |
То же Не менее 18 |
15 30 |
| — Виркон <6> | 2,0 | То же | 10 |
| — ЛУЧ, ЗИФА | 0,5 | 50 <2> | 15 |
| — натрий двууглекислый (пищевая сода) | 3,0 | Не менее 18 | 15 |
| — Бланизол | 1,0 | То же | 15 |
| — анолиты | 0,01-0,05 | -«- | 20-30 <7> |
| — католиты | Не нормируется | -«- | 15-45 <7> |
| — Векс — Сайд | 0,4 (1:256) | -«- | 30 |
| — Гротанат Борербад | Применяют без разведения | -«- | 30 |
| Мойка каждого изделия в том же растворе, в котором проводили замачивание, при помощи ерша, ватно — марлевого тампона или тканевой салфетки, каналов — с помощью шприца | Концентрация каждого конкретного средства указана выше | Не нормируется | 0,5 или 1,0 <8> |
| Ополаскивание проточной питьевой водой после применения средства: — Гротанат Борербад |
Не нормируется | 0,5 | |
| — Велтолен, Септабик, ИД 212 | То же | 1,0 | |
| — Деконекс денталь ББ | -«- | 2,0 | |
| — Аламинол, Биолот, Биолот-1, Виркон, ЗИФА, ЛУЧ, Дезэффект (Санифект-128), Септодор | -«- | 3,0 | |
| — Бланизол, Векс — Сайд, Пероксимед, Маричка, Прогресс, натрий двууглекислый, Деконекс 50 ФФ | -«- | 5,0 | |
| — католиты и анолиты | -«- | 1,0; 3,0 или 5,0 <7> | |
| — Септодор — Форте | Не нормируется | 3,0 или 5,0 <5> | |
| — Лотос, Лотос — автомат, Астра, Айна, Лизетол АФ, Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) | То же | 10,0 | |
| Ополаскивание дистиллированной водой | -«- | 0,5 | |
| Сушка горячим воздухом | 85 град. С | До полного исчезновения влаги |
Примечания: <1> Концентрация перекиси водорода, растворов средства Пероксимед, а также анолитов приведена по действующему веществу, остальных средств — по препарату; концентрация средств Дезэффект (Санифект-128) и Векс — Сайд дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<2> Температура раствора в процессе мойки не поддерживается.
<3> Используемая концентрация рабочего раствора средства Аламинол зависит от конструктивных особенностей изделий и указана в методических указаниях по применению средства.
<4> Время выдержки зависит от особенностей обрабатываемых изделий и указано в методических указаниях по применению данного средства.
<5> При применении средства Септодор — Форте замачивание изделий проводят после предварительной их очистки от видимых загрязнений в этом же растворе.
<6> При применении средства Виркон замачивание изделий в его 2% рабочем растворе проводят после предварительной очистки изделий от видимых загрязнений в 0,5% растворе этого средства.
<7> Время выдержки приведено в методических указаниях по применению католитов и анолитов, вырабатываемых конкретными установками.
<8> В течение 1 мин осуществляют мойку изделий средствами Векс — Сайд и Септодор — Форте, также мойку сложных изделий, имеющих каналы или замковые части, средствами Бланизол Велтолен, Виркон, Пероксимед, Септабик, Септодор, ИД 212, Деконекс 50 ФФ; во всех остальных случаях мойку каждого изделия осуществляют в течение 0,5 мин.
Таблица 3.3.
Предстерилизационная очистка ручным способом с применением кипячения
| Процессы при проведении очистки | Режим очистки | |
| Температура, град. С | Время выдержки/ обработки, мин | |
| Кипячение при применении средства: — Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс (1,5% раствор); — натрий двууглекислый (2% раствор). |
99 +/- 1 | 15,0 |
| Мойка каждого изделия в процессе ополаскивания проточной питьевой водой с помощью ерша, ватно — марлевых тампонов или тканевых салфеток, каналов — с помощью шприца. | Не нормируется | 0,5 |
| Ополаскивание проточной питьевой водой после применения средства: — Прогресс, Маричка, натрий двууглекислый; — Лотос, Лотос — автомат, Астра, Айна |
Не нормируется | 5,0 10,0 |
| Ополаскивание дистиллированной водой | Не нормируется | 0,5 |
| Сушка горячим воздухом | 85 +/- 3 | До полного исчезновения влаги |
Таблица 3.4.
Дезинфекция и предстерилизационная очистка, совмещенные в одном процессе
| Название средства, фирма, страна | Инфекции | Концентрация рабочего раствора, % <1> | Температура рабочего раствора, град. С | Время обработки (мин) на этапе | Вид изделий | ||
| Замачивания | Мойки в том же растворе, в котором осуществляли замачивание <2> | Ополаскивания проточной питьевой водой | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Аламинол («НИОПИК», Россия) |
Вирусные
Бактериальные |
5,0 или 8,0 <3> 5,0 5,0 5,0 5,0 |
Не менее 18 |
60
то же |
0,5-1,0
то же |
3,0
то же |
Изделия из стекла, резин, пластмасс, металлов (исключая углеродистую сталь), в т.ч. стоматологические инструменты |
| Лизетол АФ («Шюльке и Майр ГмбХ», Германия) |
Вирусные Бактериальные Туберкулез Дерматофитии |
4,0 2,0 4,0 2,0 4,0 2,0 4,0 |
Не менее 18 |
30 60 30 60 30 60 30 |
0,5 то же -«- -«- -«- -«- -«- |
10 то же -«- -«- -«- -«- -«- |
Изделия из металлов, стекла, пластмасс, резин |
| Велтолен, («ВЕЛТ», Россия) |
Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
2,5 1,0 5,0 2,5 2,5 |
Не менее 18 |
60 то же -«- -«- -«- |
0,5-1,0 то же -«- -«- -«- |
1,0 то же -«- -«- -«- |
Изделия из металлов, стекла, пластмасс, резин, в т.ч. стоматологические инструменты, эндоскопы и инструменты к ним <4> |
| Дезэффект (Санифект-128) («Ликва-Тех Индастриез Инк.», США) |
Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
3:128 то же -«- -«- -«- |
50 <5> | 60 то же -«- -«- -«- |
0,5-1,0 то же -«- -«- -«- |
3,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, металлов (кроме инструментов, имеющих замковые части) |
| Деконекс денталь ББ («Борер Хеми АГ», Швейцария) |
Вирусные Бактериальные (кроме туберкулеза) Кандидозы |
Готовое к приме- нению |
Не менее 18 |
30 то же -«- |
0,5 то же -«- |
2,0 то же -«- |
Вращающиеся стоматологические инструменты |
| Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) («ПФХ» Петтенс — Химия», Франция) |
Вирусные Бактериальные (кроме туберкулеза) Дерматофитии Кандидозы |
2,0 1,0 3,0 |
Не менее 18 |
45 15 60 |
0,5 то же -«- |
10 то же -«- |
Изделия из металлов, стекла, пластмасс, резин, в т.ч. эндоскопы, инструменты к гибким эндоскопам<4>, стоматологические инструменты |
| ИД 212 («Дюрр Денталь — Орохим»,Германия) |
Вирусные Бактериальные Туберкулез Кандидозы |
4,0 2,0 2,0 4,0 |
Не менее 18 |
30-60 то же -«- -«- |
0,5-1,0 то же -«- -«- |
1,0 то же -«- -«- |
Стоматологические инструменты (включая вращающиеся) |
| Септабик («Абик», Израиль) |
Вирусные
Бактериальные |
1,0
1,0 |
Не менее
18 |
60 или 120<6> то же 60 то же -«- |
0,5-1,0
то же |
3,0
то же |
Изделия из металлов, стекла, пластмасс, резин, в т.ч. эндоскопы, инструменты к гибким эндоскопам<4>, стоматологические инструменты |
| Септодор — Форте <7> («Дорвет Лтд», Израиль) | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
0,4 то же -«- -«- -«- |
Не менее 18 |
60 то же 90 60 90 |
1,0 то же -«- -«- -«- |
3,0-5,0 то же -«- -«- -«- |
Изделия из металлов, стекла, пластмасс, резин, в т.ч. эндоскопы, инструменты к гибким эндоскопам<4>, стоматологические инструменты (включая вращающиеся) |
| Пероксимед (Россия) | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
3,0 3,0 3,0 5,0 5,0 |
Не менее 18 | 60 30 120 90 90 |
0,5-1,0 то же -«- -«- -«- |
5,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, коррозионностойких металлов |
| Виркон<8> («КРКА», Словения) | Вирусные Бактериальные (кроме туберкулеза) |
2,0 то же |
Не менее 18 | 10 то же |
0,5-1,0 то же |
3,0 то же |
Изделия из металлов, стекла, пластмасс, резин (кроме гибких эндоскопов) |
| Вирусные Бактериальные (кроме туберкулеза) |
1,0 то же |
Не менее 18 | 10 то же |
Не требуется |
2,0 то же |
Гибкие эндоскопы (обработка в установке КРОНТ-УДЭ-1) | |
| Лотос, Лотос — автомат, Астра, Айна | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
1,5 то же -«- -«- -«- |
Кипячение 99 +/- 1 |
30 то же -«- -«- -«- |
0,5 то же -«- -«- -«- |
10,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, металлов |
| Маричка, Прогресс | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
1,5 то же -«- -«- -«- |
Кипячение 99 +/- 1 |
30 то же -«- -«- -«- |
0,5 то же -«- -«- -«- |
5,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, металлов |
| Натрий двууглекислый (пищевая сода) | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
2,0 то же -«- -«- -«- |
Кипячение 99 +/- 1 |
15 то же -«- -«- -«- |
0,5 то же -«- -«- -«- |
5,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, металлов |
| Анолиты <9> | Вирусные Бактериальные Туберкулез Кандидозы Дерматофитии |
0,02-0,05 0,02-0,05 0,02-0,06 0,02-0,06 0,02-0,06 |
Не менее 18 | 30-180 30-180 30-300 60-240 30-240 |
0,5 то же -«- -«- |
1,0-3,0 то же -«- -«- -«- |
Изделия из стекла, пластмасс, резин, коррозионностойких металлов (сплавы титана) |
| Гротанат Борербад («Шюльке и Майр ГмбХ», Германия) | Вирусные Бактериальные Туберкулез Кандидозы |
Готовое к применению | Не менее 18 | 30 то же -«- -«- |
0,5 то же -«- -«- |
0,5 то же -«- -«- |
Вращающиеся стоматологические инструменты |
Примечания:
<1> Концентрация растворов средства Пероксимед, а также анолитов приведена по действующему веществу, остальных средств — по препарату; концентрация средств Дезэффект (Санифект-128) и Векс — Сайд дополнительно выражена соотношением долей концентрата средства и добавляемой воды.
<2> Мойку каждого изделия осуществляют с помощью ерша, ватно — марлевого тампона или тканевой салфетки; каналы изделий промывают с помощью шприца. В течение 1 мин осуществляют мойку сложных изделий, имеющих каналы или замковые части, средствами Бланизол, Векс — Сайд, Велтолен, Виркон, Пероксимед, Септабик, Септодор, Септодор — Форте; во всех остальных случаях мойку каждого изделия осуществляют в течение 0,5 мин. При применении растворов моющих средств (Лотос, Лотос — автомат, Астра, Айна, Маричка, Прогресс), а также натрия двууглекислого мойку изделий после кипячения осуществляют в процессе их ополаскивания проточной питьевой водой.
<3> Используемая концентрация рабочего раствора средства Аламинол зависит от конструктивных особенностей изделий.
<4> Время обработки эндоскопов и медицинских инструментов к гибким эндоскопам на этапах мойки в растворах средств и ополаскивания проточной питьевой водой указано в методических указаниях по применению конкретного средства.
<5> При применении средства Дезэффект (Санифект-128) температуру раствора в процессе мойки не поддерживают.
<6> Время замачивания 120 мин указано для изделий из резин.
<7> При применении средства Септодор-Форте замачивание изделий проводят после предварительной их очистки от видимых загрязнений в этом же растворе.
<8> При применении средства Виркон замачивание изделий в его 2% рабочем растворе проводят после предварительной очистки изделий от видимых загрязнений в 0,5% растворе этого же средства.
<9> Электрохимически активированные растворы с рН от 5,5 до 8,4 в зависимости от типа анолита («нейтральный анолит», «нейтральный анолит АНК»), вырабатываемые в установках СТЭЛ-МТ-1, СТЭЛ-4Н-60-01, СТЭЛ-4Н-60-02, СТЭЛ-10Н-120-01; применяют без разведения. Конкретные концентрации анолитов и время выдержки приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
4. СТЕРИЛИЗАЦИЯ
4.1. Стерилизацию изделий медицинского назначения проводят с целью умерщвления на них всех патогенных и непатогенных микроорганизмов, в том числе их споровых форм.
4.2. Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами, указанными в табл. 4.1., 4.3. — 4.6. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий.
При стерилизации паровым, воздушным и газовым методами изделия, как правило, стерилизуют упакованными в стерилизационные упаковочные материалы; при паровом методе, кроме того, используют стерилизационные коробки без фильтров и с фильтрами (табл. 4.1, 4.3, 4.5).
Могут быть использованы только упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению (в случае импортных материалов — разрешенные к применению) в Российской Федерации.
При воздушном методе, а также в отдельных случаях при паровом и газовом методах, допускается стерилизация инструментов в неупакованном виде (в открытых лотках).
4.3. Паровой метод стерилизации.
4.3.1. При паровом методе стерилизации стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/кв. см) — 0,21 МПа (2,1 кгс/кв. см) температурой 110-135 град. С; стерилизацию осуществляют в паровых стерилизаторах (автоклавах).
4.3.2. Паровым методом стерилизуют общие хирургические и специальные инструменты, детали приборов и аппаратов из коррозионностойких металлов, стекла, шприцы с пометкой 200 град. С, хирургическое белье, перевязочный и шовный материал, изделия из резин (перчатки, трубки, катетеры, зонды и т.д.), латекса, отдельных видов пластмасс (табл. 4.1.).
4.3.3. Стерилизационные коробки (биксы) не являются упаковкой для хранения простерилизованных изделий, но если эти изделия хранятся в коробках в течение времени, указанного в табл. 4.1., допускается использовать такие изделия по назначению.
4.3.4. Хирургическое белье, перевязочный материал укладывают в стерилизационные коробки параллельно движению пара. Норма загрузки стерилизационных коробок хирургическим бельем и перевязочным материалом представлена в табл. 4.2.
Таблица 4.1.
Стерилизация паровым методом (водяной насыщенный пар под избыточным давлением)
| Режим стерилизации | Вид изделий, рекомендуемых к стерилизации данным методом | Вид упаковочного материала | ||||||
| Давление пара в стерилизационной камере, МПа (кгс/кв. см) |
Температура стерилизации, град. С |
Время стерилизационной выдержки, мин | ||||||
| при ручном и полуавтомагическом управлении, не менее<*> |
при автоматическом управлении | |||||||
| номинальное значение | предельное отклонение | номинальное значение | предельное отклонение | |||||
| номинальное значение | предельное отклонение | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 0,21 (2,1) |
+/- 0,01 (+/- 0,1) |
134 | +/- 1 | 5<**> | 5<**> | +1 | Изделия из коррозионностойких металлов, стекла, изделия из текстильных материалов, резин | Стерилизационная коробка с фильтром или без фильтра, двойная мягкая упаковка из бязи, пергамент, бумага мешочная непропитанная, бумага мешочная влагопрочная, бумага упако вочная высокопрочная, бумага крепированная, стерилизационные упаковочные материалы фирмы «Випак Медикал» (Финляндия) и корпорации «Рексам» (Великобритания) <***> |
| 0,20 (2,0) |
+/- 0,02 (+/- 0,2) |
132 | +/- 2 | 20 | 20 | +2 | Изделия из коррозионностойких металлов, стекла, изделия из текстильных материалов, резин, лигатурный шовный материал | |
| 0,14 (1,4) |
+/- 0,01 (+/- 0,1) |
126 | +/- 1 | 10<**> | 10<**> | +1 | Изделия из коррозионностойких металлов, стекла, изделия из текстильных материалов, резин | |
| 0,11 (1,1) |
+0,02 (+0,2) |
120 | +2 | 45 | 45 | +3 | Изделия из резин, латекса, отдельных видов пластмасс (полиэтилен высокой плотности, ПВХ-пластикаты), лигатурный шовный материал | Стерилизационная коробка с фильтром или без фильтра, двойная мягкая упаковка из бязи, пергамент, бумага мешочная непропитанная, бумага мешочная влагопрочная, бумага упаковочная высокопрочная, бумага крепированная, стерилизационные упаковочные материалы фирмы «Випак Медикал» (Финляндия) и корпорации «Рексам» (Великобритания)<***> |
| 0,11 (1,1) |
+/- 0,01 (+/- 0,1) |
121 | +/- 1 | 20<**> | 20<**> | +2 | ||
| 0,05 (0,5) |
+0,02 (+0,2) |
110 | +2 | 180 | 180 | +5 | Изделия из резин, отдельных видов пластмасс (полиэтилен высокой плотности, ПВХ-пластикаты) |
Примечания:
<*> Время стерилизационной выдержки, соответствующее значению температуры стерилизации с учетом предельных отклонений температуры в загруженной стерилизационной камере, указано в паспорте на конкретную модель стерилизатора.
<**> Приведено время стерилизационной выдержки, которое рекомендовано в паровых стерилизаторах нового поколения с предельным отклонением температуры в стерилизационной камере +/- 1 от номинального значения.
<***> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации паровым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм.
Срок сохранения стерильности изделий, простерилизованных в стерилизационной коробке без фильтра, в двойной мягкой упаковке — 3 суток, в пергаменте, бумаге мешочной непропитанной, бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром — 20 суток.
Кратность использования пергамента, бумаги мешочной непропитанной, бумаги мешочной влагопрочной и бумаги крепированной — 2 раза, бумаги упаковочной высокопрочной — 3 раза.
Таблица 4.2.
Нормы загрузки стерилизационных коробок изделиями медицинского назначения (загрузка изделий одного наименования)
| Стерилизуемый объект | Единица измерения | Тип стерилизационной коробки | ||||||
| КСК-3 КФ-3 |
КСК-6 КФ-6 |
КСК-9 КФ-9 |
КСК-12 КФ-12 |
КСК-18 КФ-18 |
КСПФ- 12 | КСПФ- 16 | ||
| Бинт | г | 150 | 300 | 450 | 600 | 900 | 600 | 800 |
| Вата | г | 65 | 130 | 195 | 260 | 390 | 260 | 350 |
| Полотенце | шт. | 1 | 3 | 5 | 7 | 10 | 7 | 9 |
| Халат | шт. | — | 1 | 2 | 3 | 5 | 3 | 4 |
| Простыня | шт. | — | 1 | 2 | 3 | 5 | 3 | 4 |
| Хирургические шапочки | шт. | 10 | 20 | 30 | 40 | 60 | 40 | 51 |
| Хирургические перчатки | пара | — | — | 45<*> | 60<*> | 90<*> | 60<*> | 80<*> |
| Трубки дренажные, катетеры, зонды | кг | 0,5 | 1,0 | 1,5 | 2,0 | 3,0 | 2,0 | 2,7 |
Примечание:
<*> 1 пара хирургических перчаток весит 20 г; приведена норма загрузки для паровых стерилизаторов с вакуумным способом удаления воздуха из стерилизационной камеры; норма загрузки для паровых стерилизаторов, не имеющих вакуумирования, должна быть снижена в 3 раза.
4.3.5. Резиновые перчатки перед стерилизацией пересыпают внутри и снаружи тальком для предохранения их от склеивания. Между перчатками прокладывают марлю или бумагу, каждую пару перчаток заворачивают отдельно в марлю или бумагу и в таком виде помещают в стерилизационную коробку или в другую упаковку. В целях уменьшения неблагоприятного воздействия пара резиновые перчатки, как и другие изделия из резин, стерилизуют при температуре 120-122 град. С.
4.3.6. Паровым методом стерилизуют лигатурный шовный материал: нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные (далее — лигатурный шовный материал).
Лигатурный шовный материал готовят к стерилизации в виде косичек, мотков, наматывая на катушки, стеклянные палочки и т.д.
Подготовленный лигатурный шовный материал заворачивают в два слоя упаковочного материала (при размещении в стерилизационной коробке — в один слой упаковочного материала) в количестве, рассчитанном на одну операцию. На упаковке отмечают вид шовного материала и его номер.
Нити хирургические капроновые крученые стерилизуют паром только при температуре 120-122 град. С; лигатурный шовный материал других перечисленных видов допускается стерилизовать, кроме того, при температуре 130-134 град. С.
Лигатурный шовный материал хранят в той же упаковке, в которой он был простерилизован, в специальных шкафах для стерильных изделий. Неиспользованный стерильный лигатурный шовный материал в случае нарушения условий или истечения срока хранения может быть повторно (еще лишь один раз) простерилизован паровым методом при температуре 120-122 град. С.
4.4. Воздушный метод стерилизации.
4.4.1. При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 160 град. С и 180 град. С; стерилизацию осуществляют в воздушных стерилизаторах.
4.4.2. Воздушным методом стерилизуют хирургические, гинекологические, стоматологические инструменты, детали приборов и аппаратов, в том числе изготовленные из коррозионнонестойких металлов, шприцы с пометкой 200 град. С, инъекционные иглы, изделия из силиконовой резины (табл. 4.3).
Таблица 4.3.
Стерилизация воздушным методом (сухой горячий воздух)
| Режим стерилизации | Вид изделий, рекомендуемых к стерилизации данным методом | Вид упаковочного материала | |||
| Температура стерилизации, град. С | Время стерлизационной выдержки, мин | ||||
| номинальное значение | предельное отклонение | номинальное значение | предельное отклонение | ||
| 200 | +/- 3 | 30<*> | +3 | Изделия из металлов, стекла и резин на основе силиконового каучука | Бумага мешочная влагопрочная, бумага упаковочная высокопрочная, бумага крепированная, стерилизационные упаковочные материалы фирмы «Випак Медикал» (Финляндия) и корпорации «Рексам» (Великобритания) |
| 180 | +/- 2 10 | 60 | +5 | ||
| 180 | +/- 3 | 45<*> и 60<*> | +5 | ||
| 160 | +/- 2 10 | 150 | +5 | ||
| 160 | +/- 3 | 150<*> | +5 | ||
| <**> или без упаковки (в открытых лотках) |
Примечания:
<*> Приведено время стерилизационной выдержки для воздушных стерилизаторов нового поколения с предельными отклонениями температуры в стерилизационной камере + 3 град. С от номинального значения (время указано в паспорте на конкретную модель стерилизатора).
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации воздушным методом, а также сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок.
Срок сохранения стерильности изделий, простерилизованных в бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной — 20 суток. Кратность использования бумаги мешочной влагопрочной, бумаги крепированной — 2 раза, бумаги упаковочной высокопрочной — 3 раза.
Изделия, простерилизованные без упаковки, помещают на «стерильный стол» и используют в течение одной рабочей смены.
4.4.3. Перед стерилизацией воздушным методом изделия после предстерилизационной очистки обязательно высушивают в сушильном шкафу при температуре 85 град. С до исчезновения видимой влаги.
4.4.4. Качество стерилизации воздушным методом зависит от равномерности распределения горячего воздуха в стерилизационной камере, что достигается правильной загрузкой стерилизатора. Изделия загружают в таком количестве, которое допускает свободную подачу воздуха к стерилизуемому изделию.
4.4.5. Стерилизуемые изделия, равномерно распределяя, укладывают горизонтально поперек пазов кассет (полок); не допускается перекрывать продувочные окна и решетки вентиляции. Объемные изделия следует класть на верхнюю металлическую решетку, чтобы они не препятствовали потоку горячего воздуха. При загрузке необходимо следить за тем, чтобы стерилизуемые изделия не попадали в зону вращения крыльчатки. Загрузку и выгрузку изделий проводят при температуре в стерилизационной камере 40-50 град. С.
4.4.6. Изделия стерилизуют завернутыми в стерилизационные упаковочные материалы. Шприцы стерилизуют в разобранном виде.
Во время стерилизации металлических инструментов без упаковки их располагают так, чтобы они не касались друг друга.
4.5. Стерилизация в среде нагретых стеклянных шариков.
4.5.1. В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные, дрильборы, а также рабочие части гладилок, экскаваторов, зондов и др.). Изделия стерилизуют в неупакованном виде по режимам, указанным в инструкции по эксплуатации конкретного стерилизатора, разрешенного для применения.
После стерилизации инструменты используют сразу по назначению.
4.6. Стерилизация растворами химических средств.
4.6.1. Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку изделия нельзя простерилизовать в упаковке, а по окончании стерилизации их необходимо промыть стерильной жидкостью (питьевая вода, 0,9% раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению простерилизованных изделий микроорганизмами.
Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть в тех случаях, когда особенности материалов изделий не позволяют использовать другие официально рекомендуемые методы стерилизации. Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходим хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия.
4.6.2. Для стерилизации растворами химических средств используют средства, указанные в табл. 4.4., в том числе электрохимически активированные растворы, вырабатываемые в диафрагменных электрохимических установках типа «СТЭЛ», а также вырабатываемые другими установками, разрешенными к выпуску, согласно инструктивно — методическим документам, утвержденным в установленном порядке в Российской Федерации.
4.6.3. При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений).
4.6.4. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна составлять не менее 20 град. С для альдегидсодержащих средств и не менее 18 град. С — для остальных средств.
4.6.5. Стерилизацию проводят при полном погружении изделий в раствор, свободно их раскладывая. При большой длине изделия его укладывают по спирали. Разъемные изделия стерилизуют в разобранном виде. Каналы и полости заполняют раствором.
4.6.6. Во избежание разбавления рабочих растворов, используемых для стерилизации, погружаемые в них изделия должны быть сухими.
4.6.7. После стерилизации все манипуляции проводят, строго соблюдая правила асептики. Изделия извлекают из раствора с помощью стерильных пинцетов (корнцангов), удаляют раствор из каналов и полостей, а затем промывают в стерильной жидкости, налитой в стерильные емкости, согласно рекомендациям методического документа по применению конкретного средства. При каждом переносе из одной емкости в другую освобождение каналов и полостей и их заполнение свежей жидкостью осуществляют с помощью стерильного шприца, пипетки или иного приспособления.
4.6.8. Промытые стерильные изделия после удаления остатков жидкости из каналов и полостей используют сразу по назначению или помещают (с помощью стерильных пинцетов, корнцангов) на хранение в стерильную стерилизационную коробку, выложенную стерильной простыней, на срок не более 3 суток.
4.7. Стерилизация газовым методом.
4.7.1. Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте, а также озон.
4.7.2. Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 18 град. С), при температуре 35 град. С и 55 град. С (табл. 4.5), парами раствора формальдегида в этиловом спирте при температуре 80град. С (табл.4.6). Эндоскопы и медицинские инструменты к гибким эндоскопам стерилизуют согласно режимам, изложенным в соответствующих методических документах (см. приложение 1).
4.7.3. Стерилизацию газовым методом осуществляют в стационарных газовых стерилизаторах, разрешенных к применению в установленном порядке, а также в портативных аппаратах (микроанаэростаты объемом 2,0 куб. дм и 2,7 куб. дм).
Для поддержания температуры стерилизации (35, 55 град. С) в портативных аппаратах их помещают в термостат или водяную баню.
4.7.4. Перед газовой стерилизацией изделия после предстерилизационной очистки вытирают чистой салфеткой либо подсушивают при комнатной температуре или температуре 35 град. С до исчезновения видимой влаги. Удаление влаги из каналов полимерных (резиновые, пластмассовые) катетеров, трубок проводят с использованием централизованного вакуума, при его отсутствии — с помощью водоструйного насоса, подсоединенного к водопроводному крану.
Таблица 4.4.
Стерилизация растворами химических средств
| Стерилизующее средство | Режим стерилизации | Вид изделий, рекомендуемых к стерилизации данным методом | Условия проведения стерилизации | ||||
| Температура, град. С | Концентрация рабочего раствора, % <1> | Время стерилизационной выдержки, мин | |||||
| номинальное значение | предельное отклонение | номинальное значение | предельное отклонение | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Перекись водорода (Россия) <2> | Не менее 18 50 <3> |
—
+/- 2 |
6,0
6,0 |
360
180 |
+/- 5
+/- 5 |
Изделия из полимерных материалов (резины, пластмассы), стекла, коррозионностойких металлов | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
| Дезоксон-1, Дезоксон-4 (Россия) | Не менее 18 | — | 1,0 | 45 | +5 | Изделия из полимерных материалов (резины на основе силиконового каучука, пластмассы) стекла, коррозионностойких металлов | |
| Первомур (Россия) |
Не менее 18 |
— | 4,8 | 15 | +5 | Лигатурный шовный материал (нити хирургические шелковые крученые, нити хирургические капроновые крученые, шнуры хирургические полиэфирные) | |
| Бианол («НИОПИК», Россия) |
21 | +/- 1 | 20,0 | 600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |
| Лизоформин 3000 («Лизоформ Д-р Ханс Роземанн ГмбХ», Берлин/ Германия) | 40
50 |
+/- 1
+/- 1 |
8,0
8,0 |
60
60 |
+5
+5 |
Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
| КолдСпор («Метрекс Ресерч Корпорейшн», США) | 21 | +/- 1 | 20,0 | 540 | +5 | То же | |
| Глутарал, Глутарал-Н (Россия) | 21 | +/- 1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | |
| 600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |||||
| Сайдекс («Джонсон энд Джонсон Медикал Лтд.», Великобритания) | 21 | +/- 1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | |
| 600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |||||
| Стераниос 20% концентрированный («Аниос», Франция) | 21 | +/- 1 | 2,0 | 300 | +5 | Эндоскопы, изделия из стекла, пластмасс, инструменты простой конфигурации из металлов | |
| 360 | +5 | Медицинские инструменты к гибким эндоскопам, изделия из резин, инструменты из металлов, имеющие замковые части, вращающиеся стоматологические инструменты | |||||
| Дюльбак растворимый («Петтенс — Франс — Химия», Франция) | 20 | +1 | Применяют без разведения | 240 | +5 | Инструменты из металлов | Полное погружение изделий в раствор (с заполнением каналов и полостей) на время стерилизационной выдержки |
| 360 | +5 | Изделия из полимерных материалов (резины, пластмассы), в т.ч. гибкие эндоскопы, инструменты к ним | |||||
| Гигасепт ФФ («Шюльке и Майр» Германия) | 21 | +/- 1 | 10,0 | 600 | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, металлов, в т.ч. эндоскопы и инструменты к ним | |
| Анолиты (Россия) <4> | Не менее 18 | — | 0,02-0,05 <4> | 15- 300 <4> | +5 | Изделия из полимерных материалов (резины, пластмассы), стекла, сплавов титана (последние — кроме стерилизации «кислыми анолитами») |
Примечания:
<1> Концентрация растворов средств Бианол, Лизоформин 3000, КолдСпор, Гигасепт ФФ приведена по препарату, средства Первомур — по суммарному содержанию 30-33% перекиси водорода и 100% муравьиной кислоты, растворов остальных средств — по действующему веществу.
<2> Допускается использование только медицинской перекиси водорода.
<3> Температура раствора в момент погружения в него изделий; в процессе стерилизации указанную температуру не поддерживают.
<4> Электрохимически активированные растворы с рН от 2,0 до 8,4 в зависимости от типа анолита («кислый анолит», «нейтральный анолит», «нейтральный анолит АНК»), вырабатываемые в установках ЭХА-30, СТЭЛ-МТ-1, СТЭЛ-МТ-2, СТЭЛ-4Н-60-01, СТЭЛ-4Н-60-02, СТЭЛ-1ОАК-120-01, СТЭЛ-1ОН-120-01. Анолиты используют без разведения. Конкретные режимы стерилизации приведены в методических указаниях по применению растворов, вырабатываемых конкретными установками.
Таблица 4.5.
Стерилизация газовым методом (смесь ОБ и окись этилена)
| Стерилизующее средство | Режим стерилизации | |||||||||
| Доза газа, мг/куб. дм | Парциальное давление | Рабочая температура в стерилизационной камере, град. С | Относительная влажность,% | Время стерилизационной выдержки, мин | Вид изделий, рекомендуемых к стерилизации данным методом <*> | Вид упаковки или стерилизационного упаковочного материала | ||||
| МПа (кгс/кв. см) | MM рт. ст. | номинальное значение | предельное отклонение | номинальное значение | предельное отклонение | |||||
| Смесь ОБ (окись этилена с бромистым метилом в соотношении 1:2,5 по весу соответственно) | 2000 | 0,065 (0,65) |
490 | 35 | +/-5 | Не менее 80 | 240 | +/-5 | Оптика, кардиостимуляторы | Упаковка из двух слоев полиэтиленовой пленки толщиной 0,06-0,2 мм, пергамент, бумага мешочная непропитанная, бумага мешочная влагопрочная, бумага упаковочная высокопрочная, бумага крепированная, стерилизационные упаковочные материалы фирмы «Випак Медикал» (Финляндия) и корпорации «Рексам» (Великобритания)<**> |
| 2000 | 0,065 (0,65) |
490 | 55 | +/-5 | 240 | +/-5 | Изделия из полимерных материалов (резины, пластмассы) стекла, металлов | |||
| 2000 | 0,065 (0,65) |
490 | 55 | +/-5 | 360 | +/-5 | Пластмассовые магазины к сшивающим аппаратам | |||
| 2000 | 0,065 (0.65) |
490 | Не менее 18 | — | 960 | +/-5 | Изделия из полимерных материалов (резины, пластмассы) стекла, металлов | |||
| Окись этилена | 1000 | 0,055 (0,55) |
412 | Не менее 18 | — | 960 | +/-5 | Изделия из полимерных материалов (резины, пластмассы) стекла, металлов |
Примечания:
<*> Изделия, простерилизованные смесью ОБ или окисью этилена, применяют после их выдержки в вентилируемом помещении (при скорости движения воздуха 20 см/с) в течение:
— 1 суток — для изделий из стекла, металла;
— 5-13 суток — для изделий из полимерных материалов (резин, пластмасс), имеющих кратковременный контакт (до 30 мин); конкретные сроки проветривания должны быть указаны в ТУ на конкретные изделия;
— 14 суток — для всех изделий, имеющих длительный контакт (свыше 30 мин) со слизистыми оболочками, тканями, кровью;
— 21 суток — для изделий из полимерных материалов, имеющих длительный контакт (свыше 30 мин), используемых для детей.
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации газовым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм. Срок сохранения стерильности изделий, простерилизованных в упаковке из полиэтиленовой пленки — 5 лет, в пергаменте или бумаге — 20 суток.
4.7.5. Изделия после подсушивания упаковывают в разобранном виде в пакеты из рекомендованных упаковочных материалов, затем помещают их в стационарный или в портативный аппараты и закрывают крышкой, которую прижимают зажимом.
4.7.6. При стерилизации смесью ОБ и окисью этилена из портативного аппарата удаляют воздух до давления 0,9 кгс/кв. см по показанию вакуумметра. Дозирование газов осуществляют по парциальному давлению непосредственно из баллона через штуцер микроанаэростата.
4.7.7. Методика стерилизации изделий медицинского назначения парами раствора формальдегида в этиловом спирте и способ приготовления этого раствора изложены в методических рекомендациях по обработке эндоскопов и медицинских инструментов к гибким эндоскопам (см. приложение 1).
4.7.8. При использовании портативного аппарата после окончания стерилизационной выдержки его открывают в вытяжном шкафу и выдерживают 5 часов.
4.7.9. Озоном, вырабатываемым в «Стерилизаторе озоновом СО-01-С.-Пб.», стерилизуют инструменты простой конфигурации из коррозионностойких сталей и сплавов, применяемые в хирургии и стоматологии (скальпели, пинцеты, зеркала цельнометаллические, гладилки, зонды, шпатели, боры стоматологические твердосплавные), в неупакованном виде в соответствии с методическим документом по применению данного средства (см. приложение 1).
После стерилизации инструменты используют по назначению сразу (без дополнительного проветривания).
4.8. Стерилизация аппаратов экстракорпорального (искусственного) кровообращения.
Таблица 4.6.
Стерилизация газовым методом (пары раствора формальдегида в этиловом спирте)
| Стерилизующее средство | Режим стерилизации | Вид изделий, рекомендуемых к стерилизации данным методом <*> | Вид упаковки или стерилизационного упаковочного материала | |||||
| Температура стерилизации, град. С | Доза формальдегида, мг/ куб.дм | Количество раствора формальдегида в этиловом спирте, мг/куб. дм | Время стерилизационной выдержки, мин | |||||
| номинальное значение | предельное отклонение | номинальное значение | предельное отклонение | |||||
| Пары 40% раствора формальдегида в этиловом спирте | 80 | +/- 5 | 150 | 375 | 180 | +/- 5 | Изделия из полимерных материалов (резины, пластмассы) | Упаковка из двух слоев полиэтиленовой пленки толщиной 0,06-0,2 мм, пергамента, бумаги мешочной непропитанной, бумаги мешочной влагопрочной, бумаги упаковочной высокопрочной, бумаги крепированной; стерилизационные упаковочные материалы фирмы «Випак Медикал» (Финляндия) и корпорации «Рексам» (Великобритания)<**> |
| 120 | +/- 5 | Изделия из металлов и стекла |
Примечания:
<*> После стерилизации парами раствора формальдегида в этиловом спирте дегазация изделий из полимерных материалов, металлов и стекла не требуется, за исключением изделий из резин и пластмасс, контактирующих с кровью, для которых требуется дегазация при комнатных условиях в течение двух суток.
<**> Конкретные виды зарубежных упаковочных материалов однократного применения, рекомендованные для стерилизации газовым методом, а также соответствующие сроки сохранения в них стерильности изделий указаны в методических документах по применению упаковок данных фирм. Срок сохранения стерильности изделий, простерилизованных в упаковке из полиэтиленовой пленки — 5 лет, в пергаменте или бумаге — 20 суток.
4.8.1. Аппараты искусственного кровообращения стерилизуют в разобранном и в собранном виде. Подготовка аппарата к стерилизации предусматривает все этапы предстерилизационной очистки (табл. 3.2).
4.8.2. Отдельные блоки и детали аппарата (оксигенераторы, резервуар для донорской крови, резервный сосуд, артериальные канюли, венозные катетеры, тройник, ловушки, трубки из полимерных материалов и т.д.) стерилизуют паровым методом при температуре 120-122 град. С.
Трубки из полимерных материалов при стерилизации приобретают молочный цвет, исчезающий после подсушивания в сушильном шкафу при температуре 60-80 град. С в течение 10 часов. Сборку аппарата осуществляют в асептических условиях.
4.8.3. Стерилизацию аппаратов экстракорпорального кровообращения в собранном виде проводят газовым методом окисью этилена согласно методическому документу по стерилизации аппаратов искусственного кровообращения (см. приложение 1).
4.9. Контроль стерилизации.
4.9.1. Контроль стерилизации предусматривает проверку параметров режимов стерилизации и оценку ее эффективности. Более подробно вопросы контроля стерилизации изложены в ряде официальных инструктивно — методических документов, указанных в приложении 1.
4.9.2. Контроль параметров режимов стерилизации проводят физическим (с помощью контрольно — измерительных приборов: термометров, мановакуумметров и др.) и химическим (с использованием химических индикаторов) методами.
4.9.3. Контроль работы паровых и воздушных стерилизаторов проводят с учетом сведений, приведенных в приложении 5.
4.9.4. Эффективность стерилизации оценивают на основании результатов бактериологических исследований, проводимых при применении биотестов (приложение 5) и контроле стерильности изделий, подвергнутых стерилизации (приложение 6).
5. МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С ДЕЗИНФИЦИРУЮЩИМИ, МОЮЩИМИ И СТЕРИЛИЗУЮЩИМИ СРЕДСТВАМИ
5.1. К работе со средствами не допускаются лица моложе 18 лет, страдающие аллергическими заболеваниями, беременные женщины и кормящие матери.
5.2. Приготовление рабочих растворов средств, дезинфекцию, предстерилизационную очистку и стерилизацию изделий медицинского назначения проводят в специальном помещении с естественной или искусственной (приточновытяжной) вентиляцией.
5.3. Емкости с рабочими растворами в процессе обработки должны быть плотно закрыты крышками. Все работы со средствами необходимо выполнять с защитой кожи рук резиновыми перчатками.
5.4. Если в Методических указаниях по применению средства имеются рекомендации по защите органов дыхания респираторами (РУ-60М или РПГ-67), следует неукоснительно их соблюдать.
5.5. После окончания работ со средствами помещение необходимо проветрить.
5.6. Хранить средства следует в отдельном помещении, в прохладном месте, закрытыми в шкафу отдельно от лекарственных препаратов, в местах, недоступных детям.
Приложение 1
ПЕРЕЧЕНЬ
ИНСТРУКТИВНО — МЕТОДИЧЕСКИХ ДОКУМЕНТОВ, ОТРАЖАЮЩИХ ВОПРОСЫ ДЕЗИНФЕКЦИИ, ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ И СТЕРИЛИЗАЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы».
2. Приказ Минздрава СССР от 12 июля 1989 г. N 408 «О мерах по снижению заболеваемости вирусными гепатитами в стране».
3. Приказ Минздрава России от 16 июня 1997 г. N 184 «Об утверждении Методических указаний по очистке, дезинфекции и стерилизации эндоскопов и инструментов к ним, используемых в лечебно — профилактических учреждениях».
4. Методические указания по классификации очагов туберкулезной инфекции, проведению и контролю качества дезинфекционных мероприятий при туберкулезе (N 10-8/39 от 04.05.79 г.).
5. Методические рекомендации по дезинфекции, предстерилизационной очистке и стерилизации медицинских инструментов к гибким эндоскопам (N 28-6/3 от 09.02.88 г.).
6. Методические рекомендации по очистке, дезинфекции и стерилизации эндоскопов (N 15-6/33 от 17.07.90 г.).
7. Методические рекомендации по стерилизации лигатурного шовного материала в лечебно — профилактических учреждениях (N 15-6/34 от 19.07.90 г.).
8. Методические указания по контролю работы паровых и воздушных стерилизаторов (N 15/6-5 от 28.02.1991 г.).
9. Методические указания по применению озона, вырабатываемого в стерилизаторе озоновом СО-01-С.-Пб., для стерилизации медицинских инструментов (N МУ-135-113 от 31.07.97 г.).
10. Методические рекомендации по стерилизации аппаратов искусственного кровообращения газообразной окисью этилена (N 1-13-73 от 26.03.72 г.).
11. Методические указания по применению медицинских упаковочных материалов корпорации «РЕКСАМ» (Великобритания) (N МУ-204-113 от 29.12.97 г.).
12. Методические указания по применению медицинских упаковочных материалов «СТЕРИКИНГ» фирмы «Випак Медикал» (Финляндия) (N МУ-157-113 от 10.08.98 г.).
13. Инструкция по применению индикаторов стерилизации одноразового применения ИС-120, ИС-132, ИС-160, ИС-180 (N 154.004.98ИП от 18.02.98 г.).
Приложение 2
ПЕРЕЧЕНЬ
ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ И МЕТОДИЧЕСКИХ ДОКУМЕНТОВ ПО ИХ ПРИМЕНЕНИЮ
| Наименование средства | Наименование регламентирующего документа | N и дата утверждения |
| 1 | 2 | 3 |
| Аламинол | Методические указания по применению для дезинфекции и предстерилизационной очистки средства «Аламинол» ГНЦ РФ «НИОПИК» (Россия) | N МУ-98-113 от 04.07.98. |
| Альдазан-2000 | Методические указания по применению для дезинфекции изделий медицинского назначения средства «Альдазан-2000», фирмы «Лизоформ Дезинфекшн АГ», Швейцария, производимого фирмой «Лизоформ Д-р Ганс Роземанн ГмбХ» Берлин, Германия | N 01-19/5-11 от 14.02.94. |
| Альдесол | Методические указания по применению для целей дезинфекции средства «Альдесол» компании Плива (Хорватия) | N МУ-24-113 от 05.03.97. |
| Анолиты кислые | Методические указания по применению электрохимически активированных растворов натрия хлорида (анолит, католит), вырабатываемых в устройстве ЭХА-30, для целей дезинфекции, предстерилизационной очистки и стерилизации | N 15-6/22 от 18.09.91. |
| Методические указания по применению электрохимически активированных растворов натрия хлорида (анолит, католит), вырабатываемых в установке СТЭЛ-10АК-120-01, для целей дезинфекции, предстерилизационной очистки и стерилизации | N 01-19/48-11 от 10.08.93. | |
| Методические указания по применению электрохимически активированных растворов натрия хлорида (анолит, католит), вырабатываемых в установке СТЭЛ-МТ-2, для целей дезинфекции, предстерилизационной очистки и стерилизации | N 01-19/59-11 от 01.11.93. | |
| Анолиты нейтральные | Методические указания по применению электрохимически активированного раствора хлорида натрия (нейтральный анолит), вырабатываемого в установке СТЭЛ-МТ-1, для целей дезинфекции, предстерилизационной очистки и стерилизации | N 01-19/15-11 от 16.09.92. |
| Методические указания по применению электрохимически активированных растворов натрия хлорида, вырабатываемых на установке УМЭМ, для целей дезинфекции и предстерилизационной очистки | N 01-19/57-11 от 23.09.93. | |
| Анолиты нейтральные | Методические указания по применению электрохимически активированного раствора натрия хлорида (нейтральный анолит), вырабатываемого в установке СТЭЛ-4Н-60-01, для целей дезинфекции, предстерилизационной очистки и стерилизации | N 01-19/49-11 от 10.08.93. |
| Методические указания по применению нейтрального анолита, вырабатываемого в установке СТЭЛ-4Н-60-02, для целей дезинфекци предстерилизационной очистки и стерилизации | N 01-19/137-12 от 02.10.96. | |
| Анолит нейтральный АНК | Методические указания по применению нейтрального анолита АНК, вырабатываемого в установке СТЭЛ-10Н-120-01, для целей дезинфекции, предстерилизационной очистки и стерилизации | N МУ-17-12 от 14.02.97. |
| Антисептика комби инструментен — дезинфекцион | Методические указания по применению для дезинфекции изделий медицинского назначения средства «Антисептика комби инструментен — дезинфекцион» фирмы «Научно — производственное объединение Антисептика», Германия | N МУ-132-113 от 31.07.97. |
| Бианол | Методические указания по применению для целей дезинфекции и стерилизации средства Бианол | N МУ-39-113 от 13.05.97. |
| Биолот | Методические указания по предстерилизационной очистке изделий медицинского назначения | N 28-6/13 от 08.06.82. |
| Биолот-1 | Методические указания по применению средства Биолот-1 для предстерилизационной очистки изделий медицинского назначения | N 01-19/40-11 от 25.11.92. |
| Бланизол | Методические указания по применению для предстерилизационной очистки изделий медицинского назначения средства Бланизол фирмы «Лизоформ Дезинфекшн АГ» (Швейцария), производимого фирмой «Лизоформ Д-р Ханс Роземанн ГмбХ» (Германия) | N 01-19/113-11 от 05.12.95. |
| Векс — Сайд | Методические указания по применению для целей дезинфекции и предстерилизационной очистки средства «Векс — Сайд» фирмы «Вексфорд Лэбз., Инк.», США | N МУ-151-113 от 21.11.97. |
| Велтолен | Методические указания по применению средства «Велтолен» (ЗАО «ВЕЛТ», Россия) для целей дезинфекции и предстерилизационной очистки | N МУ-231-113 от 29.10.98. |
| Велтосепт | Методические указания по применению в качестве кожного антисептика и для целей дезинфекции средства «Велтосепт», производства ЗАО «Велт» (Россия, Оренбург) | N МУ-147-113 от 19.11.97. |
| Виркон | Методические указания по применению для целей дезинфекции и предстерилизационной очистки средства Виркон фирмы КРКА (Словения) (переработанные и дополненные в части обработки изделий медицинского назначения) | N 01-19/47-11 от 28.03.96 |
| Методические указания по применению средства «Виркон» фирмы «Натуран» (Польша) для целей дезинфекции | N МУ-259-113 от 23.11.98. | |
| Гибитан | Методические указания по применению гибитана для дезинфекции | N 28-6/4 от 26.08.81. |
| Гигасепт ФФ | Методические указания по применению препарата Гигасепт ФФ для дезинфекции и стерилизации изделий медицинского назначения (фирма Шульке и Майер, Германия) | N 11-114/4057 от 31.08.92. |
| Гипохлорит натрия | Методические указания по применению раствора гипохлорита натрия, получаемого в электрохимической установке ЭЛМА-1, для дезинфекции в лечебно — профилактических учреждениях | N 15-6/5 от 15.02.89. |
| Методические указания по применению гипохлорита натрия, вырабатываемого в установках Санер-5-30, Санер-4-120, Санер-5-240, Санер-5-400, для дезинфекции в лечебно — профилактических учреждениях | N 01-19/61-11 от 09.11.93. | |
| Методические указания по применению раствора гипохлорита натрия, получаемого на установке «КРОНТ-УМЭМ-ЭКО», для дезинфекции в лечебно — профилактических учреждениях | N 01-19/62-11 от 09.11.93. | |
| Методические указания но применению раствора гипохлорита натрия, получаемого в электрохимической установке «Эффект», для дезинфекции в лечебно — профилактических учреждениях | N 01-19/72-11 от 01.12.93. | |
| Применение продуктов электролиза раствора хлористого натрия для дезинфекции в лечебно — профилактических учреждениях | N 28-6/25 от 31.07.86. | |
| Методические указания по применению средства «Гипохлорит натрия ГГ-400», вырабатываемого в установке УЭХД-60-1,6/1,8-01 «ГИПОФЛО», для дезинфекции в лечебно — профилактических учреждениях | N МУ-136-113 от 31.07.97. | |
| Глутарал | Методические указания по применению препарата «Глутарал» для дезинфекции и стерилизации изделий медицинского назначения | N 11-16/03-02 от 22.06.93. |
| Глутарал-Н | Методические указания по применению для дезинфекции и стерилизации изделий медицинского назначения средства Глутарал-Н | N 01-19/90-11 от 03.06.96. |
| Гротанат Борербад | Методические указания по применению для дезинфекции и предстерилизационной очистки вращающихся стоматологических инструментов средства Гротанат Борербад фирмы «Шюльке и Майр ГмбХ» (Германия) | N 01-19/103-12 от 31.07.96 |
| Дезэффект | Методические указания по применению для целей дезинфекции и предстерилизационной очистки средства «ДЕЗЭФФЕКТ» (фирма «Ликва-Тех Индастриез Инк.», США) | N МУ-70-113 от 20.05.98 |
| Дезоксон-1 | Методические рекомендации по применению Дезоксона-1 для дезинфекции и стерилизации | N 28-15/6 от 24.12.80. |
| Дезоксон-4 | Методические рекомендации по применению Дезоксона-4 для целей дезинфекции и стерилизации | N 11-114/3323-1 от 29.06.92. |
| Дезоформ | Методические указания по применению для дезинфекции изделий медицинского назначения средства Дезоформ фирмы «Лизоформ Дезинфекцион АГ, Швейцария», производимого фирмой «Лизоформ Д-р Ганс Роземанн ГмбХ», Берлин/ Германия» | N 01-19/4-11 от 14.02.94. |
| Деконекс денталь ББ | Методические указания по применению для дезинфекции и предстерилизационной очистки стоматологических инструментов средства Деконекс денталь ББ фирмы «Борер Хеми АГ» (Швейцария) | N 01-19/83-11 от 02.11.95. |
| Деконекс 50 ФФ | Методические указания по применению средства Деконекс 50 ФФ (фирма «Борер Хеми АГ», Швейцария) для целей дезинфекции и предстерилизационной очистки | N МУ-198-113 от 17.08.98. |
| Деохлор | Методические указания по применению средства Деохлор/таблетки (фирма «Петтенс-Франс-Химия», Франция) для целей дезинфекции | N 01-19/84-11 от 23.05.96. |
| ДП2 | Методические указания по применению препарата ДП-2 для дезинфекции | N 28-6/22 от 20.07.83. |
| Дюльбак растворимый | Методические указания по применению средства Дюльбак растворимый для целей дезинфекции и стерилизации (фирма «Петтенс-Франс-Химия», Франция) | N МУ-35-113 от 29.04.97. |
| Дюльбак ДТБ/Л (ДЮЛЬБАК МАКСИ) | Методические указания по применению средства Дюльбак ДТБ/Л (Дюльбак Макси) для целей дезинфекции и предстерилизационной очистки изделий медицинского назначения и дезинфекции предметов ухода за больными (фирма «ПФХ Петтенс-Химия», Франция) | N МУ-59-113 от 13.04.98. |
| Жавелион | Методические указания по применению для дезинфекции средства Жавелион (Новелти хлор) фирмы «ETC ЛИНОССИЕР» (Франция) | N 01-12/202 от 06.11.96. |
| ЗИФА | Методические указания по применению для предстерилизационной очистки изделий медицинского назначения моющего средства ЗИФА» АООТ «Сода» (Россия) | N МУ-60-113 от 21.05.97. |
| ИД 212 | Методические указания по применению для дезинфекции и предстерилизационной очистки стоматологических инструментов средства «ИД 212» фирмы «Дюрр Денталь — Орохим» (Германия) | N МУ-206-113 от 29.12.97. |
| ИД 220 | Методические указания по применению для дезинфекции стоматологических вращающихся инструментов средства ИД 220 фирмы «Дюрр Денталь — Орохим» (Германия) | N МУ-165-113 от 15.12.97. |
| Католиты | См. наименование документов по средству «Анолиты кислые» | |
| Методические указания по применению электрохимически активированных растворов натрия хлорида (нейтральный анолит и католит), вырабатываемых на установке УМЭМ для целей дезинфекции и предстерилизационной очистки | N 01-19/57-11 от 23.09.93 г. | |
| Клорсепт | Методические указания по применению для дезинфекции средства Клорсепт (таблетки и гранулы) фирмы «Медентек Лтд» (Ирландия) | N 01-19/93-12 от 31.07.96. |
| КолдСпор | Методические указания по применению для дезинфекции и стерилизации изделий медицинского назначения средства КолдСпор фирмы «Метрекс Ресерч Корпорейшн», США | N 01-19/213-12 от 05.12.96. |
| Корзолин иД | Методические указания по применению для дезинфекции изделий медицинского назначения средства «Корзолин иД» фирмы «БОДЕ Хеми ГмбХ и Ко», Германия | N МУ-46-113 от 21.05.97. |
| Лизетол АФ | Методические указания по применению препарата Лизетол АФ для дезинфекции и предстерилизационной очистки изделий медицинского назначения (фирма Шульке и Майер, Германия) | N 11-114/4056 от 31.08.92. |
| Лизоформин 3000 | Методические указания по применению для целей дезинфекции средства Лизоформин З000 фирмы «Лизоформ Дезинфекцион АГ, Швейцария», производимого фирмой «Лизоформ Д-р Ганс Роземанн ГмбХ», Берлин/Германия | N 01-19/6-11 от 14.02.94. |
| Лизоформин 3000 | Методические указания по применению для стерилизации изделий медицинского назначения средства Лизоформин 3000 фирмы «Лизоформ Дезинфекцион АГ, Швейцария», производимого фирмой «Лизоформ Д-р Ганс Роземанн ГмбХ, Берлин/Германия» | N 01-19/73-11 от 29.12.94. |
| ЛУЧ | Методические указания по применению для предстерилизационной очистки изделий медицинского назначения моющего средства «ЛУЧ» АООТ «Сода» (Россия) | N МУ-59-113 от 21.05.97. |
| МД-520 | Методические указания по применению для дезинфекции средства МД-520 фирмы «Дюрр Дентадь-Орохим» (Германия) | N 01-19/94-12 от 31.07.96. |
| Натрий двууглекислый | ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы.» | |
| Озон | Методические указания по применению озона, вырабатываемого в стерилизаторе озоновом СО-01-С.-Пб., для стерилизации медицинских инструментов | N МУ-135-113 от 31.07.97. |
| Оротол Ультра | Методические указания по применению средства Оротол Ультра фирмы «Дюрр Денталь — Орохим» (Германия) для дезинфекции | N 01-19/209-12 от 06.11.96. |
| ПВК | Методические указания по применению для дезинфекции средства ПВК | N 01-19/114-11 от 15.12.95. |
| Первомур | Методические рекомендации по стерилизации лигатурного шовного материала в лечебно — профилактических учреждениях | N 15-6/34 от 19.07.90. |
| Перекись водорода | ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы.» | |
| Перекись водорода с моющими средствами | Инструкция по использованию перекиси водорода с моющими средствами для целей дезинфекции. | N 858-70 от 29.08.70. |
| ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы.» | ||
| Методические рекомендации по применению ингибиторов коррозии в процессе предстерилизационной очистки изделий медицинского назначения из металла | N 28-6/16 от 30.04.86. | |
| Пероксимед | Методические указания по применению средства Пероксимед для целей дезинфекции и предстерилизационной очистки | N 01-19/43-11 от 22.03.96. |
| Пливасепт 5% глюконат без ПАВ | Методические указания по применению для целей дезинфекции и в качестве кожного антисептика средства Пливасепт 5% глюконат без ПАВ компании ПЛИВА (Хорватия) | N 01-19/212-12 от 06.11.96. |
| Пливасепт 5% концентрат с ПАВ | Методические указания по применению для целей дезинфекции и в качестве кожного антисептика средства Пливасепт 5% концентра с ПАВ компании ПЛИВА (Хорватия) | N 01-19/211-12 от 06.11.96. |
| Пресепт | Методические указания по применению средства Пресепт для целей дезинфекции (фирма «Джонсон и Джонсон Медикал», США) | N МУ-94-113 от 01.07.97. |
| Пюржавель | Методические указания по применению для целей дезинфекции средства Пюржавель (Пастиль жавель эффервессант) фирмы «Гидрохим», Франция | N МУ-4-12 от 21.01.97. |
| Сайдекс | Методические указания по применению для дезинфекции и стерилизации изделий медицинского назначения средства «САЙДЕКС» фирмы «Джонсон энд Джонсон Медикал Лтд.», Великобритания | N МУ-1-113 от 28.01.98. |
| Санифект-128 | Методические указания по применению для целей дезинфекции и предстерилизационной очистки средства «Санифект-128» (фирма «Ликва-Тех Индастриез Инк., США) | N МУ-219-113 от 30.12.97. |
| Септабик | Методические указания по применению для предстерилизационной очистки изделий медицинского назначения средства «Септабик» фирмы «Абик» (Израиль) |
N МУ-47-113 от 21.05.97. |
| Септодор | Методические указания по применению для предстерилизационной очистки изделий медицинского назначения средства СЕПТОДОР фирмы «Дорвет Лтд», Израиль (дополненные в части предстерилизационной очистки эндоскопов и инструментов к ним) |
N МУ-20-113 от 18.03.97 |
| Септодор — Форте | Методические указания по применению для дезинфекции и предстерилизационной очистки средства «Септодор — Форте» фирмы «Дорвет Лтд.» (Израиль) | N МУ-115-113 от 16.06.98. |
| Секусепт — пульвер | Методические указания по применению для дезинфекции средства Секусепт — пульвер (фирма «Хенкель — Эколаб АБ», Финляндия) | N 01-19/27-11 от 02.03.95. |
| Секусепт — форте | Методические указания по применению для дезинфекции изделий медицинского назначения (включая гибкие эндоскопы) средства Секусепт — форте (фирма «Хенкель Эколаб АБ», Финляндия) | N 01-19/25-11 от 02.03.95. |
| Спирт этиловый | Методические указания по применению спирта этилового синтетического ректификованного для дезинфекции изделий медицинского назначения из металла | N 01-19/41-11 от 09.07.93. |
| Стераниос 20% концентрированый | Методические указания по применению для дезинфекции и стерилизации изделий медицинского назначения средства «Стераниос 20% концентрированный» фирмы «Аниос», Франция | N МУ-99-113 от 04.07.98. |
| Формалин | ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства и режимы.» | |
| Хелипур X плюс | Методические указания по применению для дезинфекции изделий медицинского назначения средства Хелипур Х плюс фирмы «Б. Браун Мельзунген АГ», (Германия) | N 01-19/24-11 от 05.03.96. |
| Хлорамин | Методические указания по применению средства «Хлорамин Б» производства ОАО «Уфахимпром» (Россия) для целей дезинфекции | N МУ-252-113 от 23.11.98. |
| Шюльке и Майр — МАТИК | Методические указания по применению для дезинфекции отсасывающих установок, применяемых в стоматологии, средства «Шюльке и Майр — Матик» фирмы «Шюльке и Майр ГмбХ» (Германия) | N 01-19/109-12 от 31.07.96. |
Приложение 3
КОНТРОЛЬ КАЧЕСТВА ДЕЗИНФЕКЦИИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. О качестве дезинфекции судят по отсутствию на изделиях медицинского назначения после ее проведения золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Контролю подлежит 1% от одновременно обработанных изделий одного наименования (но не менее 3 единиц).
2. Контроль качества дезинфекции осуществляют методом смывов. Взятие смывов производят с поверхностей изделий медицинского назначения до проведения дезинфекции и после нее. Взятие смывов производят стерильными марлевыми салфетками размером 5х5 см, простерилизованными в бумажных пакетах или чашках Петри.
3. Перед взятием смывов в стерильные широкогорлые пробирки со стеклянными бусами стерильной пипеткой разливают по 10 мл стерильной водопроводной воды или нейтрализатора, соответствующего применяемому дезинфицирующему средству: для группы окислителей (хлор, йод, перекись содержащие средства) — 0,5-1% раствор тиосульфата натрия; для катионных ПАВ — 0,5% раствор сульфонола; для альдегид- и фенолсодержащих средств — вода; для композиционных средств — универсальный нейтрализатор, содержащий твин-80 — 3%, сапонин — 3%, гистидин — 0,1%, цистеин — 0,1%. Салфетку захватывают стерильным пинцетом, увлажняют стерильной питьевой водой из пробирки и протирают ею поверхность обрабатываемого изделия. После этого салфетку помещают в пробирку с водой и затем встряхивают в течение 5 мин, избегая увлажнения пробки.
4. У изделий, имеющих функциональные каналы, рабочий конец изделия опускают в пробирку со стерильной питьевой водой или нейтрализатором и с помощью стерильного шприца или пипетки 1-2 раза промывают канал этим раствором.
5. Смывы по 0,1 мл наносят на поверхность желточно — солевого, кровяного агара и на среду Эндо. Посевы выдерживают в термостате при температуре 37 град. С. Результаты учитывают через 48 часов.
6. При наличии роста микроорганизмов на агаре идентификацию выделенных микроорганизмов проводят в соответствии с действующими методическими документами. Дезинфекцию считают эффективной при отсутствии роста микроорганизмов, указанных в п.1.
Приложение 4
КОНТРОЛЬ КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОЧИСТКИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. Контроль качества предстерилизационной очистки проводят центры Государственного санитарно — эпидемиологического надзора и дезинфекционные станции не реже 1 раза в квартал.
Самоконтроль в ЛПУ проводят: в централизованных стерилизационных (ЦС) ежедневно, в отделениях — не реже 1 раза в неделю; организует и контролирует его старшая медицинская сестра (акушерка) ЦС (отделения).
2. Контролю подлежит: в ЦС — 1% от каждого наименования изделий, обработанных за смену, в отделениях — 1% одновременно обработанных изделий каждого наименования, но не менее 3 единиц.
3. Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.
4. Методика приготовления реактивов для постановки проб.
4.1. Азопирамовая проба.
4.1.1. Приготовление исходного раствора.
Для приготовления 1 л (куб. дм) исходного раствора азопирама отвешивают 100 г амидопирина и 1,0-1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (куб. дм) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения исходного раствора азопирама составляет 2 месяца при температуре 4 град. С (в холодильнике); при комнатной температуре (20+/-2 град. С) — не более 1 месяца. Умеренное пожелтение исходного раствора в процессе хранения без выпадения осадка не снижает рабочих свойств раствора.
4.1.2. Приготовление реактива азопирам.
Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода. Реактив азопирам можно хранить не более 2 часов. При более длительном стоянии может появиться розовое спонтанное окрашивание реактива. При температуре выше +25 град. С раствор розовеет быстрее, поэтому его необходимо использовать в течение 30-40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов.
В случае необходимости пригодность реактива азопирам проверяют следующим образом: 2-3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению; если окрашивание в течение 1 мин не появляется, реактивом пользоваться не следует.
4.2. Амидопириновая проба.
Готовят 5% спиртовой раствор амидопирина на 95% этиловом спирте. Данный раствор должен храниться во флаконе с притертой пробкой в холодильнике; срок годности раствора — 1 месяц.
Готовят 30% раствор уксусной кислоты и 3% раствор перекиси водорода на дистиллированной воде.
Смешивают равные количества 5% спиртового раствора амидопирина, 30% раствора уксусной кислоты и 3% раствора перекиси водорода. Реактив готовят перед применением.
4.3. Фенолфталеиновая проба.
Готовят 1% спиртовой раствор фенолфталеина на 95% этиловом спирте; раствор хранят во флаконе с притертой пробкой в холодильнике в течение месяца.
5. Методика постановки проб.
Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или наносят 2-3 капли реактива на изделие с помощью пипетки.
В шприцы вносят 3-4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь; реактив оставляют в шприце на 1 мин, а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3-4 капли на марлевую салфетку.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделий на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от величины изделия.
6. Учет результатов постановки проб.
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее, чем через 1 мин, появляется вначале фиолетовое, затем быстро в течение нескольких секунд переходящее в розово — сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств пероксидаз растительного происхождения (растительных остатков), окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.), а также ржавчины (окислов и солей железа) и кислот. При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово — сиреневый цвет.
При положительной амидопириновой пробе о наличии на изделиях остаточных количеств крови свидетельствует немедленное или не позже чем через 1 мин после контакта реактива с кровью, появление сине — фиолетового окрашивания различной интенсивности.
При постановке азопирамовой и амидопириновой проб окрашивание реактивов, наступившее позже чем через 1 мин после постановки пробы, не учитывается.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива.
В случае положительной пробы на кровь или .на остаточные количества щелочных компонентов моющих средств, всю группу контролируемых изделий, от которой отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в журнале по форме N 366/у (таблица П.4.1.).
Таблица П.4.1.
Код формы по ОКУД
Код учреждения по ОКПО
| Министерство здравоохранения РФ Наименование учреждения |
Медицинская документация. Форма N 366/у. Утверждена Минздравом СССР 04.10.80. пр. N 1030 |
ЖУРНАЛ
УЧЕТА КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОБРАБОТКИ
Начат «___» ____________ 199___ г. Окончен «___» _____________ 199__ г.
| Дата | Способ обработки | Применяемое средство | Результаты выборочного химического контроля обработанных изделий | Фамилия лица, проводившего контроль | |||
| Наименование изделий | Количество (штук) | Из них загрязненных | |||||
| кровью | моющими средствами | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Приложение 5
КОНТРОЛЬ РАБОТЫ ПАРОВЫХ И ВОЗДУШНЫХ СТЕРИЛИЗАТОРОВ
Методы и средства контроля работы паровых и воздушных стерилизаторов представлены в таблице П.5.1.
Проверку температурного режима осуществляют с помощью максимальных термометров, которые помещают в контрольные точки стерилизаторов в соответствии с табл. П.5.2. (паровые стерилизаторы) и табл. П.5.3 (воздушные стерилизаторы). Предельные отклонения температуры в различных точках стерилизационной камеры от номинальных значений температур стерилизации должны соответствовать показателям, приведенным в табл. 4.1. (паровые стерилизаторы) и табл. 4.2. (воздушные стерилизаторы) данных методических указаний.
Для контроля температуры используют также химические индикаторы (индикаторы типа ИС, химические тесты), которые помещают в контрольные точки, указанные выше.
Индикаторы типа ИС представляют собой полоску бумаги с нанесенным на нее индикаторным слоем и предназначены для оперативного визуального контроля совокупности параметров (температура, время) режимов работы паровых и воздушных стерилизаторов.
Химические тесты представляют собой стеклянные трубки, содержащие химические соединения или их смеси с красителями и предназначены для контроля достижения заданной температуры по вменению агрегатного состояния и/или цвета химических соединений, наблюдаемому после окончания стерилизации.
Медицинский персонал, использующий средства физического и химического контроля, регистрирует результаты контроля в журнале по форме N 257/у (табл. П.5.4.).
Бактериологический контроль работы стерилизационной аппаратуры осуществляют с помощью биотестов на основании гибели спор термоустойчивых микроорганизмов. Биотесты представляют собой дозированное количество спор тест — культуры (табл. П.5.1) на носителе (или в нем), помещенном в упаковку, которая предназначена для сохранения целостности носителя со спорами и предупреждения вторичного обсеменения после стерилизации. В качестве носителей используют инсулиновые флаконы чашечки из алюминиевой фольги (для паровых и воздушных стерилизаторов), а также диски из фильтровальной бумаги (для воздушных стерилизаторов). Упакованные биотесты помещают в те же контрольные точки стерилизационной камеры, что и средства физического и химического контроля.
Основанием для заключения об эффективной работе стерилизационной аппаратуры является отсутствие роста тест — культуры при бактериологических исследованиях всех биотестов в сочетания с удовлетворительными результатами физического и химического контроля.
Таблица П.5.1.
Контроль работы паровых и воздушных стерилизаторов
| Контролируемый показатель | Метод контроля | Средство контроля работы стерилизаторов | |||||||
| паровых при режиме стерилизации | воздушных при режиме стерилизации | ||||||||
| 110+/-1 град.С 180 мин |
120+/-2 град. С 45 мин |
121+/-1 град. С 20 мин |
126+/-1 град. С 10 мин |
132+/-2 град. С 20 мин |
134+/-1 град. С 5 мин |
+2 160 -10 град. C 150 мин |
160+/-3 град. С 150 мин |
+2 180 -10 град. С 60 мин |
180+/-3 град. С 60 мин |
| Температура, время | Химический | Химические индикаторы<*> | |||||||
| — | ИС-120 (НПФ «ВИНАР», НПФ «АНВ») |
— | — | ИС-132 (НПФ «ВИНАР», НПФ «АНВ») |
— | — | ИС-160 (НПФ «ВИНАР», НПФ «АНВ») |
— | ИС-180 (НПФ «ВИНАР», НПФ «АНВ») |
| Температура | Химический | Химический тест с антипирином или резорцином | Химический тест с кислотой бензойной | Химический тест с бензамидом или сукцинимидом | Химический тест с никотинамидом или мочевиной, или Д(+)-маннозой | Химический тест с левомицетином | Химический тест с кислотой винной или гидрохиноном, или тиомочевиной | ||
| Температура | Физический | Термометр ртутный стеклянный максимальный с диапазоном измерения от 0 до 150 град. С (ТП-7) | Термометр ртутный стеклянный максимальный с диапазоном измерения от 0 до 200 град. С (ТП-25); термометр ртутный стеклянный лабораторный с диапазоном измерения от 0 до 200 град. С |
||||||
| Давление в стерилизационной камере | Физический | Мановакуумметр с диапазоном измерения от 0,1 до 0,5 МПа | |||||||
| Эффективность воздействия на споры тест — культуры в биотесте | Бактериологический | Биологические индикаторы | |||||||
| Биотест со спорами тест — культуры Bacillus stearotermophilus ВКМ В-718 | Биотест со спорами тест — культуры Bacillus licheniformis шт. G ВКМ В-1711 D |
Примечания: <*> Изменение цвета химических индикаторов после цикла стерилизации не является свидетельством достижения стерильности изделий.
Знак <-> обозначает, что данный показатель не контролируется или данное средство контроля не используется для этого режима.
Таблица П.5.2
Расположение контрольных точек в паровых стерилизаторах
| Объем стерилизационной камеры, куб. дм | Число контрольных точек | Расположение контрольных точек | |
| Описание | Схема <*> | ||
| До 100 включительно | 5 | Для стерилизаторов круглых вертикальных: т. 1 — в верхней части камеры; т. 2 — в нижней части камеры; т. 3-5 — в центре стерилизационных коробок или внутри стерилизуемых упаковок, размещенных на разных уровнях Для стерилизаторов круглых горизонтальных: |
|
| Свыше 100 до 750 включительно | 11 | Для стерилизаторов круглых горизонтальных и стерилизаторов прямоугольных: т. 1 — у загрузочной двери; т. 2 — у противоположной стенки; т. 3-11 — в центре стерилизационных коробок или внутри стерилизуемых упаковок |
|
| Свыше 750 | 13 | Для стерилизаторов прямоугольных: т. 1 — у загрузочной двери; т. 2 — у противоположной стенки (разгрузочной двери); т. 3-13 — в центре стерилизационных коробок или внутри стерилизуемых упаковок, размещенных на разных уровнях |
<*> Схемы не приводятся.
Примечание: контрольные точки 1 и 2 находятся в стерилизационной камере вне стерилизуемых изделий
Таблица П.5.3.
Расположение контрольных точек в воздушных стерилизаторах
| Объем стерилизационной камеры, куб. дм | Число контрольных точек | Расположение контрольных точек | |
| Описание | Схема <*> | ||
| До 80 включительно | 5 | т. 1 — в центре стерилизационной камеры т. 3 и 4 — в нижней части стерилизационной камеры: справа (т. 3) и слева (т. 4) на одинаковом удалении от двери и задней стенки, т. 2 и 5 — в нижней части камеры: справа (т.2)и слева(т. 5) у двери |
|
| Свыше 80 однокамерные | 15 | т. 1-3 — в центре стрерилизационной камеры на трех уровнях сверху вниз, т. 4-15 — по углам на трех уровнях (т. 4-7 — низ, т. 8-11 — середина, т. 12-15 — верх), размещая против часовой стрелки |
|
| Свыше 80 двукамерные | 30 (по 15 в каждой камере) | Аналогичным образом (как в однокамерных стерилизаторах) для каждой стерилизационной камеры | См. схему для однокамерных стерилизаторов с объемом стерилизационной камеры свыше 80 куб. дм |
<*> Схемы не приводятся.
Примечание: контрольные тесты помещают на расстоянии не менее 5 см от стенок стерилизационной камеры.
Таблица П.5.4.
Код формы по ОКУД
Код учреждения по ОКПО
Медицинская документация. Форма N 257/у.
Утверждена Минздравом СССР 04.10.80. пр. N 1030
ЖУРНАЛ
РАБОТЫ СТЕРИЛИЗАТОРОВ ВОЗДУШНОГО, ПАРОВОГО (АВТОКЛАВА)
Начат «___» __________ 199__ г. Окончен «___» __________ 199__ г.
| Дата | Марка, N стерилизатора воздушного, парового | Стерилизуемые изделия | Упаковка | Время стерилизации (мин.) | Режим | Тест — контроль | Подпись | |||||
| наименование | количество | начало | конец | давление | температура | биологический | термический | химический | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
Приложение 6
КОНТРОЛЬ СТЕРИЛЬНОСТИ ИЗДЕЛИЙ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ
1. Требования к помещению для посева на стерильность.
1.1. Контроль стерильности изделий, простерилизованных в ЛПУ, проводят в специально оборудованных помещениях, соблюдая асептические условия, исключающие возможность вторичной контаминации изделий микроорганизмами.
Посев исследуемого материала желательно проводить в настольных боксах с ламинарным потоком воздуха.
При их отсутствии контроль стерильности проводят в боксированных помещениях (бокс с предбоксником). Общая площадь бокса должна быть не менее 3 кв. м.
1.2. В боксированном помещении стены должны быть окрашены масляной краской или выложены кафельной плиткой, не должны иметь выступов, карнизов, щелей, трещин; пол в боксе и рабочий стол должны быть покрыты линолиумом или другим гладким легко моющимся и устойчивым к действию дезинфицирующих средств материалом; стенки и ножки стола должны быть покрашены масляной краской.
1.3. Боксы оборудуют приточно — вытяжной вентиляцией (с преобладанием притока над вытяжкой) с подачей в них стерильного воздуха через бактериальные фильтры.
1.4. В боксе и предбокснике устанавливают бактерицидные облучатели в соответствии с нормами, предусмотренными действующими инструктивно — методическими документами (Руководство Р.3.1.683-98 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха и поверхностей в помещениях», утв. Минздравом России 19.01.98 г.).
2. Подготовка бокса, инструментов и персонала к работе.
2.1. Перед проведением работы поверхности в помещениях бокса и предбоксника (стены, пол, оборудование и др.), а также внутренние поверхности настольного бокса протирают 3% раствором перекиси водорода с 0,5% моющего средства. В случае обнаружения в воздухе грибов или споровых форм микроорганизмов обработку проводят 6% раствором перекиси водорода с 0,5% моющего средства или 6% раствором средства Пероксимед, или 2% раствором средства ПВК (концентрации приведены по ДВ).
Через 45-60 минут после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
2.2. При проведении работы в настольном боксе в нем включают вентиляцию на время, достаточное для обеспечения полного обмена воздуха, а затем помещают необходимый для работы материал.
2.3. В боксе и предбокснике перед работой включают бактерицидные облучатели. Длительность облучения определяют в соответствии с документом, упомянутом в п. 1.4.
2.4. Вспомогательные инструменты и лабораторную посуду, используемые в работе, а также спецодежду, предварительно стерилизуют. В процессе работы вспомогательные инструменты 2-3 раза заменяют аналогичным стерильным комплектом.
Внутреннюю поверхность настольного бокса обрабатывают так же, как и помещение бокса. Через 45-60 минут после обработки в бокс вносят все необходимые для работы материалы и инструменты, кроме образцов изделий.
2.5. Перед входом в бокс работники лаборатории тщательно моют руки теплой водой с мылом, вытирают их стерильным полотенцем (салфеткой), надевают в предбокснике бахилы, стерильные халаты, 4-слойные маски, шапочки и стерильные перчатки.
2.6. В процессе работы в боксе проверяют обсемененность воздуха. Для этого на рабочий стол ставят 2 чашки с питательным агаром, открывая их на 15 мин, затем чашки помещают в термостат при температуре 32 град. С на 48 часов.
Допускается рост не более трех колоний неспорообразующих сапрофитов на чашке. В случае роста более 3 колоний дополнительно проводят обработку бокса 6% раствором перекиси водорода с 0,5% моющего средства или 6% раствором средства Пероксимед, или раствором средства ПВК.
3. Правила отбора проб.
3.1. В стационарах, имеющих централизованные стерилизационные, контролю на стерильность подлежит не менее 1% от числа одновременно простерилизованных изделий одного наименования.
3.2. В стационарах, не имеющих централизованных стерилизационных и осуществляющих стерилизацию в отделениях, контролю на стерильность подлежат не менее двух одновременно простерилизованных изделий одного наименования.
3.3. Отбор проб на стерильность проводят лаборант центра Госсанэпиднадзора, дезинфекционной станции или медицинская сестра под руководством сотрудника бактериологической лаборатории.
3.4. При стерилизации изделий в упакованном виде (централизованная и децентрализованная стерилизация) все изделия, подлежащие контролю, направляют в бактериологическую лабораторию в упаковке, в которой осуществляли их стерилизацию. Перед доставкой в лабораторию стерильные изделия в упаковке дополнительно заворачивают в стерильную простыню или помещают в наволочку.
При стерилизации изделий в неупакованном виде в отделении отбор проб проводят в стерильные емкости, соблюдая правила асептики.
После проведения контроля стерильности все изделия, за исключением перевязочных материалов, подлежат обязательному возврату для последующего использования.
4. Методика и техника посева на стерильность.
4.1. Посевы на стерильность проводит бактериолог с помощью лаборанта.
4.2. Перед посевом исследуемый материал вносят в предбоксник, предварительно сняв наружную мягкую упаковку. В предбокснике с помощью стерильного пинцета (корнцанга) стерилизационные коробки, пакеты протирают снаружи стерильной салфеткой (ватным тампоном), смоченной 6% раствором перекиси водорода, перекладывают на стерильный лоток и оставляют на 30 мин, затем переносят в бокс. При поступлении изделий, упакованных в два слоя бумаги, пергамента, ткани, первый слой снимают в предбокснике и изделия во внутренней упаковке переносят в бокс.
4.3. В боксе с помощью стерильного пинцета изделия извлекают из стерилизационной коробки, пакета или другой упаковки.
4.4. Контроль стерильности проводят путем прямого посева (погружения) изделий целиком (при их небольших размерах) или в виде отдельных деталей (разъемные изделия) и фрагментов (отрезанные стерильными ножницами кусочки шовного, перевязочного материала и т.п.) в питательные среды. Объем питательной среды в пробирке (колбе, флаконе) должен быть достаточным для полного погружения изделия (деталей или фрагментов изделия).
При проверке стерильности более крупных изделий проводят отбор проб методом смывов с различных участков поверхности изделий: с помощью стерильного пинцета (корнцанга) каждый участок тщательно протирают марлевой салфеткой (размер салфетки 5 х 5 см), увлажненной стерильной питьевой водой или стерильным 0,9% раствором хлорида натрия, или раствором нейтрализатора (при стерилизации раствором химического средства). Каждую салфетку помещают в отдельную пробирку с питательной средой.
У изделий, имеющих функциональные каналы, рабочий конец опускают в пробирку с питательной средой и с помощью стерильного шприца или пипетки 1-2 раза промывают канал этой средой.
4.5. При контроле стерильности проводят посев на тиогликолевую среду (сухая питательная среда для контроля стерильности НИИВС им. И.И.Мечникова) и среду Сабуро. Состав сред и способ их приготовления приведен в приложении N 1 к приказу Минздрава СССР от 31 июля 1978 г. N 720 «Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничной инфекцией» (тиогликолевую среду из сухой питательной среды готовят способом, указанным на этикетке).
При контроле изделий каждого наименования обязателен одновременный посев на обе указанные питательные среды.
На пробирках, колбах и флаконах с посевами делают надписи с указанием даты посева, N загрузки, N образца.
4.6. Посевы в тиогликолевую среду выдерживают в термостате при температуре 32 град. С, посевы в среду Сабуро — при температуре 20-22 град. С в течение 14 суток при контроле изделий, простерилизованных растворами химических средств и газовым методом, в течение 7 суток — простерилизованных термическими (паровой, воздушный) методами.
4.7. При отсутствии роста микроорганизмов во всех пробирках (колбах, флаконах) делают заключение о стерильности изделий.
Как проводится стерилизация?
Стерилизации подлежат все инструменты многократного использования, которые контактируют с кожей и слизистыми оболочками клиента и могут их травмировать, а также изделия, непосредственно контактирующие с кровью.
Исходя из этого утверждения, стерилизационной обработке подлежат:
- Хирургический инструментарий;
- Стоматологический инструментарий;
- Маникюрный инструментарий;
- Инструменты для тату, перманентного макияжа и пирсинга;
- Косметологические инструменты.
Кроме того, в медицинских учреждениях обработке подвергаются белье, перевязочные материалы, медицинские тапочки и перчатки, дренажные трубки, зонды и пр.
Добиться полной стерильности инструментов можно лишь путем проведения последовательной обработки, включающей дезинфекцию, предстерилизационную очистку (ПСО) и стерилизацию. Каждый из этих этапов выполняет свою функцию. Нельзя приступать сразу же к стерилизации, игнорируя предварительное проведение дезинфекции и ПСО. Такой подход лишь помешает качественному проведению обеззараживания инструментов. А это чревато заражением инфекциями, как клиентов, так и сотрудников.
Методы стерилизации
Существует несколько методов. При выборе метода необходимо учитывать материал, из которого изготовлено изделие/инструмент, количество обрабатываемых изделий, финансовые возможности учреждения и прочие факторы.
Различают такие методы стерилизации изделий и инструментов:
- Физический;
- Химический;
- Газовый.
Каждый из методов обладает своими преимуществами и недостатками.
Особенности физических методов стерилизации
Физические методы, по сути, представляют собой обработку инструментов высокой температурой. К этой категории относят паровую, воздушную и гласперленовую стерилизацию. Проведение физической стерилизации требует использования определенного оборудования. В целом, это наиболее часто используемый метод обработки, который помогает добиться качественного обеззараживания инструментов.
Суть паровой стерилизации заключается в обработке инструментария водяным паром, подаваемым под высоким давлением. Для этого используют паровые стерилизаторы — автоклавы. Это достаточно громоздкое и дорогое оборудование, которое могут себе позволить большие учреждения, например, больницы. Температурный режим в автоклавах варьирует в пределах 110-135°С, время обработки — всего лишь 5-20 минут. Это самый эффективный и быстрый метод стерилизации.
Воздушный метод обработки это не что иное, как обработка инструментов сухим горячим воздухом. Стоит отметить, что воздушные стерилизаторы (они же сухожаровые шкафы) меньше в размере и дешевле автоклавов. Поэтому большинство салонов красоты и студий ногтевого сервиса практикуют этот вид дезинфекции. Впрочем, у воздушного метода есть и свои относительные недостатки. Так, для стерилизации сухим воздухом требуются еще большие значения температуры — 160-180°С, а время стерилизации увеличивается до 30-150 минут.
Особенность проведения гласперленовой стерилизации заключается в использовании аппарата, заполненного кварцевыми шариками. При включении аппарата шарики нагреваются до 180-240°С, благодаря чему происходит оббезараживание. Гласперленовые стерилизаторы имеют небольшие размеры, а поэтому подходят для обеззараживания только мелких инструментов. Этот метод обладает существенными недостатками. Во-первых, в аппарат невозможно погрузить большой инструмент целиком, а значит, его обработка будет неполной. Во-вторых, не существует методов контроля работы гласперленовых стерилизаторов. Учитывая эти нюансы, контролирующие органы не рекомендуют использовать этот вид стерилизации в профессиональной деятельности.
Особенности химического метода стерилизации
Химический метод — обеззараживание инструментов и изделий различными химическими средствами. Этот метод особенно ценен для обработки изделий, изготовленных из термолабильных материалов (к примеру, из стекла, пластмасс или резины). В частности его применяют для стерилизации эндоскопов. Еще одним преимуществом метода можно назвать его дешевизну. Однако химический метод стерилизации достаточно трудоемкий, что можно расценивать как недостаток.
Для проведения стерилизации используют контейнер, который наполняют раствором химического средства. В наполненную емкость полностью погружают использованные инструменты, при этом они не должны лежать плотно друг к другу. Время экспозиции зависит от используемого химического средства и может составлять от 60 до 600 минут. По завершению обработки инструменты вынимают стерильными пинцетами и промывают в стерильной воде. Обработанные изделия хранят в стерильных контейнерах не более трех дней.
Особенности газового метода
Газовый метод в РФ нельзя назвать популярным. Обработка в газовых стерилизаторах производится при температурах до 80°С и с использованием газов: оксида этилена, озона, паров раствора формальдегида. Одной из причин непопулярности газовой стерилизации можно назвать дороговизну самого стерилизационного оборудования.
Газовую стерилизацию, главным образом, проводят для обработки термолабильных изделий из резины и пластмассы, инструментов с зеркальной поверхностью, оптических эндоскопов, кардиостимуляторов. Но стоит отметить и тот факт, что обработка газом требует значительного времени экспозиции. Так, время стерилизационной выдержки при обработке парами формальдегида составляет 120-180 минут, озоном — 240-960 минут. Еще одним недостатком метода является токсичность газов.
Контроль качества стерилизации
От соблюдения методики проведения стерилизации и исправности оборудования зависит качество обеззараживания инструментов. Оценить качество проведения позволяют методы контроля.
Проведение физического метода контроля невозможно без использования приборов, фиксирующих показатели температуры, давления и времени. Например, соответствие температурного режима нормам оценивают с помощью максимальных термометров, которые помещают в стерилизатор вместе с обрабатываемыми инструментами.
Химический метод контроля базируется на использовании специально разработанных химических полосок с индикаторами. Тест-полоски укладывают в стерилизаторе в определенных точках. После проведения стерилизационной обработки осматривают тест-полоски, которые при правильном проведении стерилизации меняют цвет. Если же тест-полоски не изменили цвет — значит, инструменты остались нестерильными.
Биологический метод контроля представляет собой использование биотестов. Это флаконы, обсемененные тест-микроорганизмами, которые во время проверки размещают в стерилизаторе. Далее биотесты подвергаются бактериологическому исследованию. Если на исследуемых образцах отсутствует рост культур — это говорит в пользу эффективного проведения стерилизации.
Контроль качества — это один из основных моментов, на который обращают внимание контролирующие органы. Стоит отметить, что руководителям медицинских учреждений и салонов красоты стоит внедрить эти методы контроля в свою будничную практику. Это позволит выявить и устранить возможные ошибки при проведении стерилизации, а также гарантировать клиентам стопроцентную стерильность используемых инструментов.
Вернуться к списку публикаций
1. Введение
В настоящее время в деятельности микробиологических (бактериологических) лабораторий происходят большие изменения, ориентированные на совершенствование качества результатов анализов. Эти изменения связаны с необходимостью более взвешенного подхода при назначении антимикробной терапии. В связи с этим необходимо пересмотреть и изменить взаимоотношения между ами-клиницистами и бактериологической лабораторией. К сожалению, большинство ей-клиницистов считают, что они не участвуют в диагностическом лабораторном процессе и, поэтому, не оказывают влияния на качество обследования пациентов и результатов, получаемых в лаборатории. Вместе с тем, если рассматривать диагностический лабораторный процесс, частью которого является бактериологическое исследование, то целый комплекс процедур (подготовка пациента к исследованиям, метод взятия проб биоматериала, их правильная и своевременная доставка в лабораторию), могут оказывать существенное влияние на качество результатов анализов, и целиком находятся в компетенции ей-клиницистов и среднего медицинского персонала.
Поэтому данные практические рекомендации предназначены, в первую очередь, для специалистов, принимающих участие в отборе проб биологического материала для бактериологических исследований.
2. Термины и определения
Патогенный биологический агент (ПБА) — патогенные для человека микроорганизмы, включая генно-инженерно-модифицированные, яды и токсины биологического происхождения, а также любые объекты и материалы, включая полевой, клинический, секционный, подозрительные на содержание перечисленных агентов.
Биологический материал — любые типы проб биологического происхождения (имеющие непосредственное отношение к организму человека), полученные прижизненно или при вскрытии, а также материал, полученный при контроле санитарно-гигиенического состояния внешней среды.
Проба биологического материала или просто проба — разными способами отобранный биологический материал, качество и количество которого позволяет использовать его для микробиологического исследования.
Контейнер — емкость, специально предназначенная для отбора и безопасной транспортировки биологического материала, герметично закрывающаяся.
Транспортная система (ТС) — это комплект, состоящий из пластиковой пробирки, заполненной транспортной средой, и аппликатора с тампоном.
Зонд-тампон, тубсер (тупфер) — средство взятия пробы биологического материала, состоящее из тампонодержателя, изготовленного из дерева, пластика или металла и накрученного на него тампона из волокнистого материала, может быть упакован индивидуально в бумажно-пластиковую упаковку, либо в пробирку
Целлюлозная пробка — это промышленно изготовленная газопроницаемая пробка, используемая вместо ватно-марлевых пробок ручного производства.
Стерильная одноразовая пробирка (емкость) — пробирка (емкость) из пластика или стекла стерилизованная промышленно или в лаборатории с герметичной или газопроницаемой пробкой.
Вакуумная пробирка (система) — представляет собой максимально безопасную закрытую систему для взятия проб венозной крови. Состоит из одноразовой стерильной пробирки, в которой создано дозированное разряжение (вакуум), герметично укупоренная пробкой из силиконовой резины.
Мазок — биологический материал (жидкий или полужидкий), нанесенный тонким равномерным слоем на предметное стекло, предназначенный для микроскопического исследования.
3. Область применения и обоснование необходимости систематизации преаналитического этапа микробиологических исследований
3.1. Область применения
Данные практические рекомендации определяют основные требования к организации преаналитического этапа бактериологических исследований. Они регламентируют: порядок составления направления; требования к подготовке пациента к бактериологическим исследованиям; использование посуды и приспособлений для сбора и транспортировки материала; порядок проведения процедуры сбора отдельных видов патогенного биологического материала.
Рекомендации предназначены для применения в медицинских организациях, направляющих пробы биологического материала на бактериологические исследования.
3.2. Обоснование необходимости систематизации преаналитического этапа микробиологических исследований
Клиническая микробиология, частью которой являются бактериологические исследования, как раздел медицинской микробиологии, решает две основные задачи: этиологическая диагностика инфекционного процесса и выбор рациональных средств этиотропной терапии. Обе задачи взаимосвязаны, без решения первой, как правило, невозможно достоверное решение второй. Диагностический процесс складывается из четырех основных этапов: 1) формулировка задачи и выбор метода исследования; 2) определение исследуемого материала и тактики отбора пробы, хранения и транспортировки в лабораторию; 3) проведение исследований; 4) анализ и интерпретация полученных результатов. Процесс проведения лабораторных исследований, в свою очередь, включает три самостоятельных этапа: 1) преаналитический; 2) аналитический; 3) постаналитический. Если провести корреляцию между этими процессами, то первые два этапа диагностического процесса (формулировка задачи и выбор метода исследования и взятия пробы материала, его хранение и транспортировка) в сущности и есть «преаналитический» этап бактериологических исследований и от того как он организован зависит достоверность результата исследования. По действующим нормативным документам, регламентирующим работу бактериологических лабораторий, специалисты-бактериологи не принимают в нем непосредственного участия, так как не имеют права контактировать с пациентами. Осуществляют преаналитический этап специалисты-клиницисты, начиная с формулировки задачи, выбора метода исследования и взятия пробы исследуемого материала, его хранения и доставки в лабораторию. Строгое соблюдение правил проведения преаналитического этапа клиницистами, даст возможность бактериологам продемонстрировать свое умение при выявлении этиологического фактора инфекционного процесса.
Получение качественных и достоверных результатов лабораторных анализов пациента — это единый процесс, начиная от составления заявки на анализы, взятия проб биоматериала, его доставки, в лабораторию для проведения исследований, получением и использованием результатов для оказания пациенту качественной медицинской помощи. Но, особое внимание необходимо уделять преаналитическому этапу, именно потому, что медицинский персонал, осуществляющий сбор и транспортировку биоматериала для бактериологических исследований не всегда понимает важность этого процесса для получения качественного и достоверного конечного результата. Преаналитический этап бактериологического исследования проводится вне лаборатории и включает в себя: прием а и назначение пациенту необходимых лабораторных исследований; составление направления на бактериологическое исследование; получение пациентом инструкций а/медицинской сестры об особенностях подготовки к сдаче анализов или сбору биологического материала; взятие проб биологического материала у пациента; доставка биоматериала в лабораторию.
Все эти процедуры полностью находится в компетенции а-клинициста и медицинской сестры. Появление даже незначительных ошибок на преаналитическом этапе неизбежно приводит к искажению качества окончательных результатов лабораторных исследований. Как бы хорошо в дальнейшем лаборатория не выполняла исследования, ошибки на преаналитическом этапе не позволят получить достоверные результаты.
Наиболее частыми причинами неправильного результата лабораторных исследований являются ошибки, допущенные на преаналитическом этапе: неправильное взятие пробы биологического материала и нарушения условий и сроков ее транспортировки. Ошибки, допущенные на преаналитическом этапе исследования чреваты потерей времени и средств на проведение повторных исследований, а их более серьезным следствием может стать неправильный диагноз.
Основные причины ошибок:
— отсутствие стандартов качества выполнения процедур преаналитического этапа;
— редкое использование для взятия и транспортировки биоматериала одноразовых специализированных приспособлений;
— неправильное использование специализированных приспособлений для взятия и транспортировки биоматериала;
— неумение медицинского персонала «работать» со специализированными приспособлениями для взятия и транспортировки биоматериала.
Поэтому для обеспечения качественного выполнения процедур преаналитического этапа в каждой медицинской организации необходимо разработать внутренний стандарт преаналитического этапа. Кроме этого, необходимо внедрение передовых технологий — использование одноразовых приспособлений для взятия и транспортировки проб биологического материала. Примеры таких приспособлений представлены в различных разделах данных практических рекомендаций.
4. Общие положения преаналитического этапа
4.1 Нормативные документы, регламентирующие преаналитический этап
— Методические указания по применению микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораторий лечебно-профилактических учреждений; Приложение 1 к Приказу Министерства здравоохранения СССР от 22.04.85 № 535
— Инструкция по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебно-профилактических учреждений. Утверждена Минздравом СССР 17.01.91;
— «О развитии и совершенствовании лабораторий клинической микробиологии (бактериологии) лечебно-профилактических учреждений»; утвержден приказом Минздрава России от 19.01.95 №8; Документ с изменениями, внесенными приказом Минздрава России от 25.1297 №380.
— МУК 4.2.1887-04 Лабораторная диагностика менингококковой инфекции и гнойных бактериальных менингитов;
— МУ 4.2.2039-05 Техника сбора и транспортировки биоматериалов в микробиологические лаборатории;
— МУК 4.2.3222-14. 4.2. Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика малярии и бабезиозов. Методические указания.
4.2. Направление на исследование
Основным инструментом обмена информацией между специалистом-клиницистом и бактериологической лабораторией является направление. Именно клиницист определяет успех бактериологического исследования, давая процессу правильный вектор. Основываясь на знаниях этиологии и патогенеза инфекционного процесса, он формулирует цели и задачи исследования и излагает их в направлении. Стандартные направления на бактериологические исследования, регламентированные нормативными документами, не существуют. В данных практических рекомендациях мы предлагаем унифицированный вариант направления и рекомендуем его к использованию в медицинских организациях, независимо от профиля.
4.3. Общие требования к процедуре сбора биологического материала
Перед сбором пробы, особенно при применении инвазивных методов, учитывается вероятность риска для пациента и пользы, а также значимость данного вида биоматериала для целей объективизации клинического диагноза и оценки проводимых или планируемых лечебных мероприятий. Кроме того, необходимо учитывать соответствие назначения исследования стандартам оказания медицинской помощи для данной патологии.
Необходимые условия для процедуры сбора пробы биоматериала ПБА:
- До начала антибактериальной терапии, при отсутствии такой возможности — непосредственно перед повторным введением (приемом) препаратов;
- В количестве (масса, объем), необходимом для выполнения анализа, т.к. недостаточное для исследования количество биоматериала приводит к получению ложных результатов, а избыточное усложняет проведение исследования.
- С минимальным загрязнением пробы бактериями нормобиоты, т.к. их наличие приводит к ошибочной трактовке результатов, полученных из проб нестерильных биотопов организма, например, при исследовании мокроты, проб из носа, глотки (зева), гениталий и др.;
- Взятие проб биологического материала должны проводить специально обученные медицинские работники, желательно и;
- В случае самостоятельного сбора биоматериала пациентами им должна выдаваться памятка с пошаговой инструкцией по сбору;
- Для взятия и транспортировки проб используют стерильные инструменты, пробирки или контейнеры, предназначенные для этих целей. Использование нестерильных пробирок для транспортировки допускается только для проведения серологических исследований;
Возможные проблемы:
- Сбор материала производит не или не обученный медицинский работник;
- Неправильная подготовка пациента;
- Медицинский персонал не соблюдает меры индивидуальной защиты (инфицирование персонала, контаминация материала);
- Забор материала проводят после начала антимикробной терапии.
4.3.1. Приспособления для сбора ПБА, не содержащие питательной среды
Главным образом, они используются для взятия, сохранения и транспортировки материала в ограниченные сроки (до 2 ч) на небольшие расстояния.
1.Стерильные зонды-тампоны без пробирки предназначены для взятия образцов биологического материала, не предназначенного для последующей транспортировки. Их используют:
а) для подготовки (очистки) места взятия пробы — извлечь стерильный зонд из упаковки, снять с его помощью избыточное отделяемое, утилизировать использованный зонд в специальную емкость для отходов с биологическими загрязнениями;
б) для получения материала на цитологическое или бактериологическое исследование — извлечь стерильный зонд из упаковки, взять «мазок» из исследуемого эпитопа, нанести материал тонким слоем на предметное стекло, в зависимости от предполагаемого метода окрашивания высушить препарат или фиксировать с использованием аэрозольных фиксаторов, утилизировать использованный зонд в специальную емкость для отходов с биологическими загрязнениями;
в) при прямом посеве пробы биоматериала на плотные питательные среды, разлитые в чашки Петри — извлечь стерильный зонд из упаковки, опустить зонд-тампон в пробу и нанести материал на плотную питательную среду штриховкой, утилизировать использованный зонд в специальную емкость для отходов с биологическими загрязнениями;
г) для взятия биологических проб для дальнейшего бактериологического исследования (не желательно!) — извлечь стерильный зонд из упаковки, отобрать пробу и поместить зонд-тампон в стерильную емкость пустую или со средой;
2.Стерильные зонды-тампоны в ударопрочной ПП-пробирке (тубсеры) предназначены для взятия образцов биологического материала и последующей безопасной транспортировки в лабораторию для анализа.
Применение этих изделий, как стандартных закрытых систем, не требует использования дополнительных нестандартных, смонтированных вручную средств предохранения взятого материала от посторонней контаминации, высыхания и других неблагоприятных факторов. Они полностью готовы к использованию для безопасного взятия биологических проб со слизистых, раневых, операционных и иных поверхностей с целью дальнейшего бактериологического исследования при условии кратковременной (не более 2 ч) транспортировки от места взятия пробы до лаборатории.
Работа с ними очень проста:
— стерильный зонд-тампон извлекают из пробирки;
— отбирают на него необходимое количество биоматериала;
— аккуратно помещают в пробирку, не касаясь ее стенок;
— отобранную пробу немедленно доставляют в лабораторию.
Каждая пробирка снабжена этикеткой, которая играет роль контроля первого вскрытия тубсера. На ней предусмотрено место для внесения сведений о пациенте, дате и времени отбора пробы, номере истории болезни, подписи а, отобравшего материал, наименовании образца и названии медицинской организации.
3. Стерильные контейнеры разнообразной формы универсального назначения
4.Стерильные контейнеры разнообразной формы специального назначения: контейнеры для вакуумного сбора ПБА; контейнеры для сбора мочи; контейнеры для сбора кала.
4.3.2. Приспособления для сбора ПБА, содержащие транспортные среды — транспортные системы
Значительное повышение качества бактериологических исследований на преаналитическом этапе достигается за счет использования специализированных транспортных систем, которые позволяют создать оптимальные для каждого вида микроорганизмов условия существования во время их транспортировки в бактериологическую лабораторию. Это позволяет сохранить изъятое из организма человека или объекта внешней среды количество микроорганизмов, что значительно облегчает получение качественного результата бактериологического исследования и, особенно, интерпретации его результатов. Широкий выбор транспортных сред дает возможность подбирать наиболее правильную систему в зависимости от задач и условий использования одного образца. Все существующие транспортные системы делятся на системы с жидкой средой и системы с агаризованной средой.
4.3.2.1. Транспортные системы с жидкой средой
Биологический образец полностью диспергирован в транспортной жидкой среде. Перемешивание (взбалтывание) транспортной системы обеспечивает создание однородной суспензии (образец равномерно распределяется во всем объеме транспортной среды), которая может быть разделена на аликвоты и использована сразу для несколько лабораторно-диагностических исследований (молекулярных, культурных окраске по Граму и микроскопировании). Кроме того, благодаря жидким транспортным средам любой клинический образец становится жидким, а жидкий образец можно обрабатывать автоматически. Таким образом, возможность преобразовать собранной пробы клинического материала для микробиологического анализа в жидкую форму — революционный подход к стандартизации и автоматизации преаналитического этапа бактериологической диагностики.
Транспортные системы с жидкой питательной средой могут быть универсальными и специализированными.
Универсальные транспортные системы
Используется для сбора биоматериала из различных локусов организма. Состав жидкой питательной среды может быть разный, в зависимости от места локализации и вида микроорганизма. Более подробно эта информация представлена в разделе «Правила сбора и транспортировки отельных видов патогенного биологического материала».
Состав транспортной системы:
— полипропиленовая пробирка 12×80 мм с завинчивающейся крышкой;
— универсальная транспортная среда 1 мл;
— зонд-тампон для взятия материала.
Правила работы с транспортной системой, содержащей жидкую питательную среду:
1) вскрыть упаковку в том месте, где указано «Открывать здесь»;
2) достать тампон-аппликатор и произвести забор клинического образца;
3) асептически открутить крышку с пробирки;
4) поместить аппликатор в пробирку, отломить его верхнюю часть в точке перелома, отмеченной цветной меткой. Оставшуюся в руке часть аппликатора утилизировать в контейнер для сбора медицинских отходов;
5) закрыть пробирку завинчивающей пробкой, зафиксировав аппликатор под крышкой;
6) промаркировать пробирку, указав Ф.И.О. пациента дату, время взятия образца и др.
При сборе образца оператор не должен касаться аппликатора ниже точки перелома, отмеченной цветной меткой, во избежание контаминации взятого образца.
Специализированные транспортные системы
Используются для определенного вида биологического материала. Подробная информация о них содержится в разделе «Правила сбора и транспортировки отельных видов патогенного биологического материала».
4.3.2.2. Транспортные системы с агаризованной средой
Полностью готовы к использованию для безопасного взятия биологических проб со слизистых, раневых, операционных и иных поверхностей. Обеспечивают длительное сохранение жизнеспособности микроорганизмов, в том числе прихотливых. Широкое распространение получили три вида питательных сред, используемых в транспортных системах:
- Среда Стюарта представляет собой полужидкий, бедный питательными веществами субстрат для сохранения и транспортировки широкого спектра патогенных микроорганизмов (Neisseria gonorrhoeae, Haemophilus influenzae, Corynebacterium diphteriae, Trichomonas vaginalis, Streptococcus spp., Salmonella spp., Shigella spp. и др.). Наиболее требовательные микроорганизмы сохраняются в данной среде более суток, прочие — до нескольких дней. Наличие в среде тиогликолата подавляет ферментативную активность бактерий, а отсутствие азота предотвращает их размножение.
- Транспортная среда КериБлейр представляет собой модификацию базовой транспортной среды Стюарта, предназначенную специально для фекальных образцов. Глицерофосфат, являющийся метаболитом некоторых энтеробактерий (Escherichia coli, Klebsiella pneumoniae, и др.), заменен неорганическим фосфатом, удален метиленовый синий и рН среды увеличена до 8,4. Среда позволяет сохранять большинство патогенных микроорганизмов, включая требовательные, такие как Neisseria spp., Haemophilus spp., Streptococcus spp. Campylobacter spp. Данная среда является стандартной для транспортировки анаэробов микроаэрофилов.
- Транспортная среда Эймса представляет собой очередную модификацию базовой транспортной среды Стюарта, в которой глицерофосфат заменен неорганическим фосфатом, поскольку глицерофосфат является метаболитом некоторых энтеробактерий (Escherichia coli, Klebsiella pneumoniae и др.) и может поддерживать рост некоторых грамотрицательных микроорганизмов. Метиленовый синий заменен на активированный уголь (фармацевтического качества). В среду добавлены кальций и магний для поддержания проницаемости бактериальных клеток. Эта среда способна более 3 дней поддерживать такие микроорганизмы, как Neisseria spp., Haemophilus spp., Corynebacteria, Streptococci, Enterobacteriaceae, Campylobacter spp. и др., однако наилучшие результаты дает культивирование в течение первых 24 ч.
Состав транспортной системы:
— Стерильная круглодонная пробирка с пробкой, изготовленная из ударопрочного полипропилена, пригодного для использования в пищевых целях, содержащая транспортную среду.
— Зонд-тампон, состоящий из деревянного или пластикового тампонодержателя (оси), тампона с защитной пробкой, надежно закупоривающей пробирку.
— Этикетка, скрепляющая пробку с пробиркой. На этикете имеется место для указания ФИО пациента, даты и времени взятия пробы, номера пробы, данных о е, характере образца и названии медицинского учреждения. Также на этикетке нанесен срок годности, номер партии, описание продукта и название предприятия-изготовителя среды, а также указания по использованию.
— Упаковка с указанием номера партии, срока годности, кода и описания продукта и указаниями по использованию.
Правила работы с транспортной системой, содержащей агаризованную среду:
1) вскрыть стерильную упаковку;
2) извлечь зонд-тампон.
3) отобрать на него необходимое количество биоматериала;
4) аккуратно вскрыть пробирку с транспортной средой;
5) поместить зонд-тампон в пробирку, не касаясь ее стенок;
6) промаркировать пробирку, указав Ф.И.О. пациента, дату и время взятия образца.
Пробу в пробирке с транспортной средой хранят при комнатной температуре (исключая термочувствительные микроорганизмы) до 72 ч, хотя оптимальным сроком до пересева материала считают 48 ч.
4.4. Общие требования к транспортировке патогенного биологического материала
4.4.1. Без использования транспортных систем, содержащих среду
Все пробы отправляют в микробиологическую лабораторию немедленно после получения: максимальное время доставки 1,5—2 ч. Выполнения этого требования ОБЯЗАТЕЛЬНО!
Это необходимо для: — сохранения жизнеспособности и возможности выделения микроорганизмов, требующих особых условий культивирования (Haemophylus и др.); — предотвращения избыточного роста быстрорастущих микроорганизмов; — поддержания соотношения исходных концентраций изолятов при наличии в пробе микробных ассоциаций; — сокращения времени контакта пробы с некоторыми антисептиками, используемыми местно, которые могут обладать антибактериальной активностью; — объективизации клинического диагноза инфекционно-воспалительного заболевания и оценки результатов терапии.
В противном случае результат бактериологического исследования сводится к нулю. Задача специалистов-бактериологов при приеме патогенного биологического материала тщательно отслеживать соблюдение временного интервала от момента забора материала до доставки в лабораторию. В случае нарушения данного требования необходимо отказывать в приеме, мотивируя отказ невозможностью качественного проведения исследования.
Условия транспортировки проб биологического материала для аэробов: 1) время — не больше 2 ч; 2) температура — от 25 до 37°; 3) отсутствие контаминации другими микроорганизмами.
Условия транспортировки патогенного биологического материала для анаэробов: 1) время — не больше 2 ч; 2) температурный режим оптимальный для микроорганизмов; 3) отсутствие контаминации другими микроорганизмами; 4) использование специальных герметично закрытых флаконов, заполненных инертным газом, в которые проба вносится путем прокола крышки иглой шприца или в одноразовом шприце, из которого удален воздух, а кончик шприца закрыт либо стерильной резиновой пробкой, либо иглой, с надетым на нее штатным защитным колпачком. Все образцы должны иметь четкую маркировку, обеспечивающие их безошибочную идентификацию.
4.4.2. С использованием транспортных систем, содержащих среду:
1) время — 24—48—72 ч, в зависимости от транспортной системы; 2) температурный режим оптимальный для микроорганизмов; 3) отсутствие контаминации другими микроорганизмами; 4) отсутствие необходимости создавать специальные условия для анаэробов. Все образцы должны иметь четкую маркировку, обеспечивающие их безошибочную идентификацию.
4.5. Правила биологической безопасности на преаналитическом этапе бактериологического исследования
К работе по взятию и транспортировке биологического материала допускается медицинский персонал, прошедший специальный инструктаж по технике и мерам безопасности. При взятии биологического материала должны использоваться средства индивидуальной защиты: медицинские халаты, шапочки, сменная обувь, резиновые (латексные, виниловые) перчатки, при необходимости — дополнительно марлевые маски (респираторы), очки, клеенчатые фартуки. Работать с исследуемым материалом следует в резиновых (латексных, виниловых) перчатках, все повреждения кожи на руках должны быть закрыты лейкопластырем или напальчником. Следует избегать уколов и порезов. В случае загрязнения кожных покровов кровью или другими биологическими жидкостями следует немедленно обработать их в течение 2 мин тампоном, обильно смоченным 70% спиртом, вымыть под проточной водой с мылом и вытереть индивидуальным тампоном. При загрязнении перчаток кровью их протирают тампоном, смоченным 3% раствором хлорамина, 6% раствором перекиси водорода. При подозрении на попадание крови на слизистые оболочки, их немедленно обрабатывают струей воды, 1% раствором протаргола; рот и горло прополаскивают 70% спиртом или 1% раствором борной кислоты или 0,05% раствором перманганата калия. Для транспортировки образцов следует использовать преимущественно пластиковую одноразовую тару, герметично закрытую пластмассовыми, резиновыми пробками или завинчивающимися крышками. Запрещается использовать стеклянную посуду со сколами, трещинами и т.п. При транспортировке сосудов, закрытых целлюлозными (ватными) пробками, следует исключить их увлажнение. Транспортировка биоматериала осуществляется в специальных закрытых переносках (укладках), желательно — термостатированных, выдерживающих дезинфекцию.
Сопроводительная документация помещается в предназначенный для нее карман переноски (укладки), а в случае его отсутствия — кладется в переноску в отдельном полиэтиленовом пакете. При хранении биологического материала в холодильнике каждый образец упаковывается в отдельный полиэтиленовый пакет. Выделяется отдельный холодильник, хранение в котором пищевых продуктов и лекарственных препаратов не допустимо.
5. Правила сбора и транспортировки отдельных видов биологического материала
5.1. Кровь
При бактериологическом исследовании крови существует две серьезные проблемы, влияющие на качество проведения самого исследования. Эти проблемы возникают на преаналитическом этапе:
- Правильный отбор контингента пациентов для проведения исследований. Бактериологический посев крови, в последнее время, является часто назначаемым исследованием, хотя перечень показаний для него крайне ограничен.
Показания к проведению исследования: клиническая картина сепсиса; лихорадочные состояния неустановленной этиологии; пневмонии; подозрение на инфекционные заболевания (брюшной тиф и паратифы, сальмонеллезы, бруцеллез, возвратный тиф, лептоспирозы, малярия, эпидемический менингит, пневмококковые/стафилококковые/стрептококковые инфекции, сибирская язва, туляремия, чума и др.).
Перечисленные показания связаны с тяжелым лихорадочным синдромом, возникающим из-за циркуляции бактериальных возбудителей в крови, и относятся к тяжелым состояниям, характерным для пациентов реанимационных отделений и отделений интенсивной терапии. Часто и назначают бактериологическое исследование крови на стерильность амбулаторным пациентам, которые не имеют показаний к проведению этого исследования.
- Несоблюдение правил взятия крови. Анализ результатов исследования крови свидетельствует о том, что практически в 70% случаев выделяются микроорганизмы, живущие на поверхности кожных покровов, что свидетельствует о контаминации, возникшей в результате несоблюдения требований при заборе.
В связи с этим, для проведения данного вида исследования клиницисты должны целенаправленно отбирать пациентов и строго соблюдать правила сбора и транспортировки проб крови. Пробы для определения наличия в крови биологических агентов получают венепункцией периферических вен (чаще вены локтевого сгиба), артерий или из пятки у новорожденных. Сбор пробы из постоянного внутривенного или внутриартериального катетеров допускается только в случаях подозрения на наличие катетер-ассоциированной инфекции или отсутствия возможности ее получения венепункцией.
Необходимое оснащение: вакуумные системы для взятия венозной крови. В случае их отсутствия: шприцы одноразовые 20-граммовые (для детей 10-граммовые) с иглами для венопункции; флаконы с питательными средами: среда для аэробов и факультативных анаэробов + среда для облигатных анаэрбов (например, двойная среда + среда СКС) или универсальная среда для аэробов и анаэробов. Предпочтительно использовать промышленно произведенные среды, разрешенные к применению в России. При использовании изготовленной в лаборатории среды СКС в качестве индикатора анаэробиоза в нее добавляют резазурин, который краснеет в присутствии кислорода. В случае покраснения более 20% верхней части столбика среду регенерируют прогреванием в течение 20 мин в кипящей водяной бане. Регенерацию можно провести лишь однократно. При отсутствии резазурина среду регенерируют перед посевом в обязательном порядке. Оптимальным средством отбора пробы венозной крови являются вакуумные двухфазные флаконы для автоматического посева крови; 70° этиловый спирт; — 2 или 5% настойка йода; венозный жгут; резиновые (латексные, виниловые) перчатки; спиртовка (для флаконов со средами, изготовленными в лаборатории). В крупных стационарах, как правило используют Анализаторы гемокультур для детекции микробного роста в пробах крови и других образцах, которые являются необходимым оборудованием в диагностике инфекций кровотока и септических состояний, когда важен каждый час. Их отличает высокая производительность, высокий процент высеваемости бактерий в первые 24 ч, а также наличие дополнительного флакона для выделения грибов.
Взятие исследуемого материала:
Сбор проб крови для посева производят 2 человека у постели пациента или в процедурной. Один человек работает с пациентом, другой работает с инструментарием для взятия крови.
Для получения пробы необходимо выполнить следующее: 1) участок кожи над выбранным для пункции сосудом продезинфицировать (обработать кожу тампоном, смоченным 70° этиловым спиртом, затем другим тампоном, смоченным 1—2% раствором йода или другим дезинфектантом, разрешенным к применению для этих целей в установленном порядке); 2) подождать, пока высохнет обработанный участок. Не допускается пальпировать сосуд после обработки кожи перед введением иглы; 3) параллельно с дезинфекцией участка кожи для пунктирования обработать пробки флаконов 70° этиловым спиртом (раствор йода не допускается использовать для обработки пробок при работе с флаконами для автоматических анализаторов). Количество независимо отбираемых проб крови и время их взятия определяет лечащий (табл. 1). Как правило, должны исследоваться не менее 2—3 проб крови, каждая из которых взята путем отдельной венепункции. Это необходимо для дифференциации истинной бактериемии от случайной контаминации крови при венепункции. Вероятность загрязнения вследствие случайного прокола сальной или потовой железы составляет 3%.
У больных, получающих антибактериальные препараты, пробы необходимо собирать непосредственно перед введением (приемом) следующей дозы препарата. При наличии лихорадки оптимальным является взятие крови на фоне повышения температуры тела (но не на пике температуры!). Сразу после взятия кровь засевают на питательные среды. Соотношение крови и среды должно быть 1/10—1/60 для устранения бактерицидного действия крови путем ее разведения.
Техника посева зависит от вида используемых питательных сред.
Среды лабораторного приготовления, расфасованных во флаконы с целлюлозными (ватными) пробками: 1) снять иглу со шприца; 2) над пламенем спиртовки открыть флакон; 3) внести половину крови из шприца во флакон; 4) обжечь горлышко и пробку флакона в пламени спиртовки; 5) закрыть флакон пробкой; 6) осторожно, чтобы не замочить пробку, перемешать содержимое флакона круговыми движениями; 7) вторую порцию крови из шприца внести во второй флакон, повторяя указанные операции.
Флаконы со средами промышленного производства во флаконах с резиновыми либо пластиковыми пробками: 1) при наличии на флаконах защитных колпачков их удалить (отогнуть), не открывая при этом пробки; 2) пробки флаконов обработать 70° этиловым спиртом (использование йодной настойки определяется рекомендациями производителя сред); 3) кровь в равных объемах внести в «аэробную» и «анаэробную» питательные среды, проколов при этом пробки флаконов. Если предполагается проведение бактериоскопического исследования, дополнительно готовят препарат «толстая капля» и мазок.
Приготовление мазка: 1) каплю крови диаметром 2—3 мм нанести на обезжиренное предметное стекло вблизи от торца; 2) перед каплей крови под углом 45° поставить одноразовый пластиковый шпатель для растяжки мазков или стекло со шлифованным краем и плавным движением равномерно распределить материал по поверхности.
Приготовление препарата «толстая капля»: 1) на предметное стекло наносят 2 капли крови диаметром 5 мм, кровь распределяют в равномерные диски диаметром 1,0—1,5 см с помощью угла чистого стекла или в прямоугольники с помощью скарификатора, которым прокалывали кожу; 2) между каплями делают мазок в виде полоски для маркировки препарата отдельного пациента, при массовых обследованиях делают две полоски: на одной полоске указывается Ф.И.О., дата взятия крови, на другой — название ЛПУ (код), где проводилось обследование; — на предметном стекле готовят мазок крови более толстый, чем требуемый для исследования на малярию; — сразу после приготовления мазка, пока он не высох, наносят кровь из капилляра или влажной поверхностью мазка прикасаются к выступившей капле крови; 3) приготовленный препарат помещают на горизонтальную поверхность, капля крови распределяется по влажному мазку, величина капель зависит от количества крови и ее реологических свойств (вязкость). Толщина толстой капли должна быть такой, чтобы через нее после высыхания просматривался газетный текст. Слишком толстая капля может оторваться от стекла при высушивании; такой препарат не пригоден для исследования. Маркировка препарата производится на мазке крови между каплями. Толщина капли должна позволять видеть через нее газетный шрифт. Препараты высушить («толстая капля» сохнет 2—3 ч) и доставить в лабораторию в специальном планшете для хранения и транспортировки стекол с соблюдением необходимой осторожности.
Посевы крови немедленно доставить в лабораторию, оберегая от охлаждения.
Как уже было сказано выше посев крови необходимо производить в специальные флаконы сразу после забора у пациента, так как для бактериологического исследования нельзя транспортировать нативную кровь. Выбор флаконов определяется методом самого исследования. Оно может быть ручным и автоматизированным.
Флаконы для ручного метода могут быть приготовлены как в самой бактериологической лаборатории, так и закуплены промышленного производства. Для автоматизированного метода исследования используются флаконы только промышленного производства, предназначенные для работы на определенном бактериологическом автоматическом анализаторе.
Флаконы для ручного метода исследования промышленного производства
Следует помнить, что все среды, не зависимо от производителя выпускаются в двух объемах: для взрослых и детей. Использовать их можно в четком соответствии с инструкцией
Однофазная система Signal для определения стерильности крови
Система Signal — состоит из двух частей — флакона с жидкой питательной средой специального состава и индикатора роста (камера, устанавливаемая на флакон после посева).
Правила работы с системой Signal
- Перед переносом образца крови осмотреть бутыль с бульоном, не использовать его, если визуально обнаружены любые признаки повреждения или контаминации.
- Подготовить бутыль для посева перед переносом крови. Снять зеленый пластиковый колпачок и продезинфицировать открытую часть резиновой пробки.
- С соблюдением стерильности добавить максимальное количество крови 10 мл через центральное кольцо резиновой пробки. (Частичный вакуум в бутыли позволяет принять 12 мл крови.)
- Тщательно перемешать кровь и бульон в бутыли.
- Указать Ф.И.О. и данные пациента на этикетке бутыли.
- Немедленно отправить бутыль с посевом крови в лабораторию. Если лаборатория закрыта или нет возможности организовать немедленную транспортировку, бутыль следует инкубировать при ±1°C, выполнив описанные ниже лабораторные процедуры при первой возможности (в течение 24 ч).
5.2. Ликвор
Показания к проведению исследования: подозрение на нейроинфекцию. При подозрении на гнойный менингит в обязательном порядке в лабораторию направляют:
1) ликвор для первичного посева, бактериоскопии и серологических исследований в количестве не менее 1,0 мл;
2) ликвор в 0,1% полужидком агаре (среда «обогащения»).
Необходимое оснащение: игла для люмбальной пункции; мандрены; анестетик; 70° этиловый спирт; настойка йода (2% или 5%) или другой антисептик, разрешенный к применению; перевязочный материал; стерильные пластиковые пробирки (лучше центрифужные с завинчивающимися крышками); шоколадный полужидкий агар (0,1%) (желательно);
Взятие исследуемого материала: ликвор получают путем люмбальной пункции, реже — при пункции боковых желудочков мозга. Желательно взять материал сразу при поступлении больного в стационар, до начала лечения. Взятие ликвора — сложная ебная манипуляция. Пункция и взятие материала проводятся с соблюдением всех правил асептики, персонал работает в масках: 1) больной укладывается в положение на боку, головной конец кровати максимально опущен, голова прижата к груди, ноги — к животу, спина максимально согнута; 2) определяются необходимые для выбора места пункции анатомические ориентиры. Пункцию проводят между поясничными позвонками L3-L4, L4-L5 или пояснично-крестцовыми L5-S1, у детей L1-L2; 3) Обрабатывают область пункции сначала раствором антисептика, затем 70° спиртом; 4) пальпируют рукой в стерильных перчатках точку пункции и вводят раствор анестетика; 5) проводят пункцию иглой со вставленным мандреном до ощущения «провала»; 6) извлекают мандрен; 7) первую порцию ликвора берут в отдельную пробирку для проведения общего ликворологического исследования; 
Согласно МУК 4.2.1887-04 ликвор после пункции распределяют следующим образом: а) 1,0 мл направляют в клиническую лабораторию для проведения общего ликворологического и цитологического исследования; б) 0,2 мл направляют для постановки полимеразной цепной реакции; в) 1,0 мл направляют для первичного бактериологического посева, бактериоскопии и серологических исследований; г) для бактериологического и бактериоскопического исследований отбирают вторая порция ликвора, либо самую мутную из всех в стерильную, желательно центрифужную пробирку с завинчивающейся крышкой; д) 0,5 мл засевают в чашку с «шоколадным» агаром непосредственно у постели больного. Посев термостатируют при 37 °C до доставки в лабораторию; е) 0,5 мл засевают в 5,0 мл 0,1% полужидкого питательного агара непосредственно у постели больного и далее хранят при +37 °C в условиях термостата до доставки в лабораторию; ж) касаться руками краев канюли, иглы, пробирки, класть пробку — нельзя; з) доставлять материал в бактериологическую лабораторию лучше в термстатированной переноске (сумке) на грелке при +37—38 °C. При отсутствии возможности немедленно доставить материал в лабораторию, его помещают в транспортную систему со средой Эймс (с углем или без него) и хранят в термостате до 48 ч. Доставка материала в транспортной системе должна производиться также с обеспечением мер поддержания температуры +37 °C. При получении материала пункцией боковых желудочков мозга, ликвор из шприца, предварительно сняв иглу, вносят в стерильную пробирку над пламенем спиртовки, обжигают горлышко стеклянной пробирки и пробку в пламени спиртовки.
5.3. Моча
Показания к проведению исследования: подозрение на воспалительные заболевания почек и мочевого пузыря. Диагностика инфекционных заболеваний: брюшного тифа (с конца 2-й недели заболевания), лептоспироза. Острая задержка мочи.
Для диагностики инфекции мочевых путей имеет значение количественный критерий бактериурии. Содержание бактерий в моче зависит от многих факторов, в том числе от вида микроорганизма, сроков транспортировки и температурой хранения собранного образца. В идеале собранная моча должна быть немедленно транспортирована в лабораторию (максимальное сохранение бактерий в пробе).
Сбор мочи: мочу на микробиологическое исследование можно собирать несколькими способами: 1) взятие средней порции мочи; 2) взятие мочи катетером; 3) сбор мочи путем надлобковой пункции; 4) сбор пробы с использованием цистоскопа.
Сбор средней порции мочи.
Необходимое оснащение: стерильный широкогорлый контейнер; теплая вода; мыло; стерильные марлевые салфетки; стерильный ватный тампон (для женщин).
Этот материал можно использовать для создания «памятки пациента». Не допускается собирать мочу с постельного белья или из мочеприемника! Не допускается использовать пробу из суточной мочи для микробиологического исследования!
Взятие исследуемого материала: 1) в стерильный контейнер собирают среднюю порцию свободно выпущенной мочи в количестве 3—5 мл. Перед взятием материала больной должен совершить тщательный туалет наружных половых органов. Так как сбор материала пациенты проводят самостоятельно, необходимо проинформировать их о правилах. Для этого предлагаем варианты информации, которую пациенту необходимо выдавать на руки.
Для мужчин: 1) тщательно вымыть руки; 2) тщательно вымыть половой орган теплой водой с мылом и высушить стерильной салфеткой; 3) обнажить головку полового члена (если не было обрезания) и выпустить небольшую порцию мочи; 4) прервать мочеиспускание и выпустить порцию мочи в контейнер; 5) закрыть контейнер и передать в лабораторию.
Для женщин: 1) тщательно вымыть руки; 2) вымыть половые органы, используя стерильные марлевые салфетки и теплую мыльную воду, в направлении спереди назад; 3) промыть половые органы еще раз теплой водой и вытереть стерильной салфеткой. Отверстие влагалища желательно закрыть стерильным тампоном; 4) на протяжении всей процедуры держать половые губы раздвинутыми; 5) помочиться, отбросив первую порцию мочи; 6) собрать порцию мочи в стерильный контейнер; 5) закрыть контейнер и передать в лабораторию.
Для лиц, собирающих мочу маленьких детей: 1) дать ребенку попить воды или другой жидкости, пригодной для питья; 2) вымыть руки с мылом, сполоснуть водой, высушить;
У девочек: промыть отверстие мочеиспускательного канала, промежность и область заднего прохода теплой мыльной водой или жидким мылом, сполоснуть теплой водой, высушить стерильной марлевой салфеткой. Держать наружные половые губы на расстоянии друг от друга в процессе мочеиспускания. Собрать среднюю порцию мочи (10—15 мл) в стерильный контейнер с завинчивающейся крышкой. Закрыть контейнер и передать в лабораторию.
У мальчиков: промыть пенис и оттянутую крайнюю плоть, область заднего прохода вымыть теплой водой с мылом и сполоснуть теплой водой, высушить стерильной марлевой салфеткой. При мочеиспускании держать крайнюю плоть оттянутой (для предотвращения контаминации мочи) Собрать среднюю порцию мочи (10—15 мл) в стерильный контейнер с завинчивающейся крышкой. Закрыть контейнер и передать в лабораторию.
Сбор мочи катетером: сбор пробы катетером у женщин допускается только в крайнем случае! Катетером мочу собирают в следующих случаях: 1) при отсутствии возможности получения мочи естественным путем; 2) при широкой вариабельности результатов, полученных при сборе средней порции мочи; 3) при необходимости дифференциации очага инфекции: мочевой пузырь или почки.
Необходимое оснащение: стерильный широкогорлый контейнер; теплая вода; мыло; стерильные марлевые салфетки (для женщин); стерильный катетер; резиновые перчатки.
Сбор материала проводит только медицинский персонал.
Взятие исследуемого материала: 1) перед катетеризацией, если мочевой пузырь заполнен, пациент должен его частично освободить; 2) необходимо провести туалет наружных половых органов теплой водой с мылом и высушить их стерильными марлевыми салфетками, после чего ввести катетер в мочевой пузырь; 3) из катетера первые 15—30 мл мочи собрать в специальную посуду для утилизации, после чего заполнить на 1/3—1/2 стерильный одноразовый контейнер с завинчивающейся крышкой, в котором моча будет доставлена в лабораторию; 4) для уточнения локализации инфекции мочевой пузырь опорожнить катетером, промыть раствором антисептика (50 мл раствора, содержащего 40 мг неомицина и 20 мг полимиксина) и через 10 минут забрать пробы мочи. При инфекциях мочевого пузыря моча остается стерильной.
Сбор мочи путем надлобковой пункции: наиболее достоверные результаты могут быть получены при надлобковой пункции мочевого пузыря, но эта процедура сопряжена с опасностью для пациента и проводится только по клиническим показаниям.
Необходимое оснащение: стерильный широкогорлый контейнер, — 70° этиловый спирт, 1—2% раствор йода; игла для пункции; резиновые перчатки.
Процедура проводится с соблюдением правил асептики. Моча, вытекающая из иглы, собирается в стерильный контейнер и доставляется в лабораторию.
Сбор мочи цистоскопом — билатеральная катетеризация мочеточника: проводят для определения очага инфекции в мочевыводящих путях.
Необходимое оснащение: стерильный широкогорлый контейнер; цистоскоп.
Взятие исследуемого материала: 1) перед проведением цистоскопии пациент должен освободить мочевой пузырь; 2) обработать наружные половые органы, области промежности и заднего прохода, как указано ранее; 3) ввести цистоскоп в мочевой пузырь и собирать 5—10 мл мочи в специальный стерильный одноразовый контейнер или стерильную стеклянную посуду; 4) промаркировать контейнер или посуду символом КМП (катетерная моча пузыря); 5) оросить пузырь не бактериостатическим физиологическим (официнальным) раствором; 6) собрать истекающую жидкость, держа концы обоих катетеров над открытым стерильным одноразовым контейнером или специальными стерильными стеклянными емкостями; 7) промаркировать емкости символом «ПЖП» (промывная жидкость пузыря); 
Транспортировка мочи для микробиологических исследований: вне зависимости от способа получения мочи, она должна быть доставлена в лабораторию в течение 2 ч, если не используются специальные транспортные системы, содержащие питательные среды. Следует помнить, что в зависимости от химического состава мочи, бактерии в ней могут при хранении как отмирать, так и размножаться. Пролонгация срока хранения пробы мочи может крайне затруднить клиническую интерпретацию результата. Для транспортировки мочи на микробиологические исследования существует несколько приспособлений:
I. УроТампон Copan UriSwab
Специальное транспортировочное устройство с полиуретановой губкой, предназначенное для транспортировки мочи в лабораторию, не содержащее питательной среды.
Процедура сбора и транспортировки мочи с помощью системы UriSwab — Уро-Тампон
(материал любезно предоставлен компанией Danies): С пробирки Уро-Тампона открутить крышку, аппликатор с тампоном извлечь из пробирки. После этого возможны два варианта:
- Если моча уже собрана в широкогорлый контейнер, то Уро-Тампон используется только для транспортировки. Для этого тампон-губку следует погрузить в контейнер с мочой (не менее 10 с), до видимого глазом насыщения губки, чтобы гарантировать оптимальное поглощение мочи тампоном. Как только губка тампона напитается мочой, аппликатор с тампоном нужно вынуть из контейнера и поместить обратно в пробирку. Завинтить крышку на пробирке.
- Если моча еще не собрана, то Уро-Тампон используют как для транспортировки, так и для сбора мочи. Пациент мочится на губку тампона, погружает ее обратно в пробирку и закручивает крышку. Пробирка или контейнер должны быть промаркированы, указав Ф.И.О. пациента дату, время взятия образца.
- Контейнер доставить в лабораторию.
II. Дипслайды
Дипслайды — устройства для бактериологического анализа мочи, сочетающие в себе транспортировку и первичный посев, обеспечивающие выделение, идентификацию и количественный учет бактерий в моче. Устройство предназначено для использования ами-клиницистами и работниками бактериологических лабораторий с целью ускоренной диагностики инфекций мочевыводящих путей. При его использовании отпадает необходимость транспортировать в бактериологическую лабораторию саму пробу, так как первичный посев мочи производит персонал отделения, в котором находится пациент.
Устройство представляет собой пластиковую подложку, покрытую с обеих сторон слоем питательной среды (хромогенный агар и Мак-Конки агар). Подложка вмонтирована в завинчивающуюся крышку прозрачной пластиковой пробирки. К краю подложки прикреплено пластиковое кольцо с зубцами (по три с каждой стороны).
Концы зубцов погружают в контейнер с образцом мочи приблизительно до половины их длины. При помещении подложки в исходную пробирку кольцо с зубцами застревает в отверстии пробирки, осуществляя штриховой посев на поверхности питательных сред. В серии полосок штрихов бактериальная концентрация уменьшается, что обеспечивает рост изолированных колоний даже при высокой концентрации бактерий в пробе.
Правила работы с устройством Дипстрик
Установить Дипстрик вертикально на ровной поверхности. Одной рукой удерживая пробирку, другой рукой отвинтить крышку и быстрым движением вытащить подложку.
Расположив лопатку строго вертикально, погрузить зубцы на несколько секунд в контейнер с пробой мочи приблизительно до половины их длины.
Вставить зубцы лопатки в отверстие пробирки Дипстрика.
Шлепком ладони или ударом пальца с усилием втолкнуть лопатку в пробирку и ввернуть крышку.
Отправить засеянный Дипстрик с прикрепленным к нему направлением на анализ в лабораторию для инкубации и дальнейшего исследования. Если немедленная отправка засеянного Дистрикта в лабораторию невозможна, допускается хранение Дипстрика в закрытом состоянии при комнатной температуре и в защищенном от прямых солнечных лучей месте не более 48 ч или транспортировка при температуре +2…+8 °C в течение 24 ч.
5.4. Отделяемое мочеполовых органов мужчин и женщин
5.4.1. Материал из уретры
Показания к проведению исследования: острые и хронические заболевания уретры, половых органов, бесплодие.
Необходимое оснащение: теплая вода; стерильный физиологический раствор; приспособления для сбора и транспортировки ПБА (стерильные зонды-тампоны с волокнистой головкой индивидуально упакованные или тубсеры или транспортная система с агаризованной средой Эймса с активированным углем); стерильная пластиковая пастеровская пипетка (возможные замены: стерильная стеклянная пипетка с грушей и стерильная пробирка «Эппендорф»); 2 предметных стекла; стерильная ушная воронка; 70° этиловый спирт; резиновые перчатки.
Взятие исследуемого материала: перед сбором материала необходимо обмыть половые органы теплой водой или изотоническим раствором с помощью ватного тампона, затем удалить свободно стекающие выделения.
Для микроскопического исследования:
1) Материал получают при помощи разных инструментов: стерильные одноразовые зонды-тампоны с волокнистой головкой; стерильные одноразовые бактериологические петли; желобоватые зонды; маленькие ложки Фолькмана; при обильном отделяемом материал собирают с помощью стеклянной палочки или края шлифованного по периметру стекла. 2) Сразу готовят мазки на предметных стеклах; 3) В лабораторию должны быть направлены минимум 2 мазка от одного пациента. При скудном отделяемом пациенту предлагают до исследования не мочиться в течение 4—8 ч, а затем массируют уретру, стараясь выдавить собравшийся в глубине секрет.
Для бактериологического исследования:
1) В мочеиспускательный канал вводят стерильную ушную воронку, через которую собирают отделяемое. 2) Материал забирают с помощью стерильного зонда-тампона в пробирке (тубсера) или стерильной одноразовой бактериологической петли. Для бактериологического исследования на наличие гонококков — необходимо использовать транспортную систему со средой Эймс с активированным углем. В этом случае материал может быть доставлен в лабораторию в течение 48 ч. Не допускается его охлаждение до температуры ниже 30 °С.
При подозрении на трихомонадную инфекцию наиболее эффективно исследовать смывы из уретры, получаемые с помощью стерильной одноразовой пастеровской пипетки или стеклянной трубки, снабженной резиновой грушей. Для этого в полиэтиленовую стерильную пастеровскую пипетку с замкнутым резервуаром набирают 0,5—1,0 мл стерильного, теплого раствора Рингера; носик пипетки вставляют в наружное отверстие уретры, раствор несколько раз вдувают в канал и засасывают в трубку; затем материал переносят в стерильную пробирку Эппендорф и используют для приготовления препаратов или культурального исследования (можно таким же образом использовать стерильную стеклянную трубку или стеклянную пипетку с надетым на нее резиновым баллончиком).
5.4.2. Материал из половых органов у мужчин
А. Язва полового члена
Показания к проведению исследования: изъязвления на коже и слизистой полового члена, за исключением подозрения на твердый шанкр.
Необходимое оснащение: стерильный физиологический раствор; стерильный ватный тампон; стерильная марлевая салфетка; одноразовый шприц на 1 мл.
Взятие исследуемого материала: 1) очистить поверхность язвы с помощью смоченного физиологическим раствором стерильного тампона; 2) стерильной марлевой салфеткой обтереть поверхность язвы до появления тканевой жидкости (следует избегать появления крови первую порцию); 3) руками в перчатках сдавить язву у основания до появления прозрачной или слегка опалесцирующей тканевой жидкости; 4) аспирировать тканевую жидкость одноразовым шприцом с иглой; 5) закрыть иглу защитным колпачком и направить в лабораторию как можно быстрее.
Б. Материал из простаты
Непосредственное взятие материала из простаты возможно лишь при хирургической операции, что, как правило, не приемлемо. Поэтому для диагностики бактериальных простатитов и выявления их этиологии, как правило, наиболее адекватным считается метод E. Meares и T. Stamey (1968). Поэтапный сбор первой и второй порций мочи, затем получение секрета простаты путем массажа и затем третьей порции мочи.
Показания к проведению исследования: хронические простатиты.
Необходимое оснащение: стерильные широкогорлые контейнеры (банки) с завинчивающейся крышкой; предметное стекло; теплая вода; мыло; стерильные марлевые салфетки; резиновые перчатки.
Взятие исследуемого материала: 1) провести тщательный туалет наружных половых органов с помощью теплой воды, мыла и стерильных марлевых салфеток; 2) больному предлагают помочиться в стерильный контейнер в объеме 10—20 мл мочи; 3) контейнер пометить, как проба №1; 4) больной мочится в другой стерильный контейнер в объеме 10—20 мл мочи, полностью не опорожняя мочевого пузыря; 5) контейнер пометить, как проба №2; 6) в стерильной перчатке произвести пальцевой массаж простаты через прямую кишку (-уролог); 7) собрать образовавшийся эякулят в стерильный одноразовый контейнер с завинчивающейся крышкой; 
5.4.3. Отделяемое женских половых органов
Минимальная схема обследования женщины должна включать бактериоскопическое исследование мазков из трех биотопов: уретра (диагностика ЗППП), задний свод влагалища (оценка состояния влагалищного биоценоза, диагностика вагинозов и вагинитов) и цервикальный канал (диагностика ЗППП). Если три мазка направляют в лабораторию на одном стекле, они должны быть четко промаркированы, например, «С», «V», «U». При необходимости, дополнительно отбираются пробы для бактериологического исследования и ПЦР. Наиболее часто объектом микробиологического исследования является материал из влагалища и цервикального канала. Другие виды материала исследуют редко, поэтому ограничимся изложением общих принципов их получения. Из вульвы и преддверия влагалища материал забирают зондом-тампоном. При воспалении бартолиниевых желез проводят их пункцию. Материал из матки можно получить с помощью специального инструмента — шприца аспиратора. После прохождения зондом цервикального канала в полости матки раскрывают наружную оболочку зонда и набирают в шприц содержимое матки. Взятие для исследования материала из придатков матки проводят во время оперативного вмешательства.
А. Материал из влагалища
Состояние влагалищной микрофлоры может быть оценено с помощью трех методов: бактериоскопического, бактериологического полуколичественного и бактериологического количественного Количественный бактериологический метод, безусловно, является наиболее информативным. В этом случае материал забирают специальной калиброванной стерильной одноразовой бактериологической петлей и сразу засевается на питательные среды или материал берут с помощью заранее взвешенного тампона. В лаборатории тампон взвешивают повторно, определяя тем самым количество отобранного влагалищного отделяемого. Так как количественный метод используется, как правило, только при проведении научных исследований, в настоящем пособии его подробное описание не приводится.
Показания к проведению исследования: диагностика вагинитов и вагинозов. Обследование супруги при уретритах у мужа.
Необходимое оснащение: одноразовое стерильное гинекологическое зеркало; стерильные одноразовые зонды-тампоны на пластиковой оси: один — в стерильной пробирке (тубсер), второй — индивидуально упакованный или уретральные зонды или специальные щеточки — (cervix brush, cytobrush и vola brush); 2 предметных стекла; система с транспортной средой Эймс или Стюарт (желательно).
Взятие исследуемого материала: материал для анализа получают только до проведения мануального исследования! 1) зеркало и подъемник ввести во влагалище; 2) убрать избыток выделений и слизи с помощью стерильной салфетки; 3) материал собрать с заднего свода или с патологически измененных участков двумя стерильными зондами-тампонами; 4) первый тампон поместить обратно в стерильную пробирку и возможно быстро доставить в лабораторию для проведения бактериологического исследования; 5) второй тампон использовать для приготовления мазка: материал нанести на 2 предметных стекла, если одновременно планируется исследование материала из цервикального канала и/или уретры, все 2—3 мазка можно сделать на одном стекле (в лабораторию в этом случае доставляются два стекла, на каждом из них мазки из всех обследуемых биотопов). Мазки маркировать, высушить на воздухе и, поместив в специальные планшеты для транспортировки стекол, или в чашки Петри, доставить в лабораторию.
Исследование на гонорею: 1) материал собрать зондом-тампоном из транспортной системы (предпочтительно — среда Эймс с активированным углем); 2) материал доставить в лабораторию максимум в течение 24 ч; 3) не допускается его охлаждение до температуры ниже +30 °С.
Исследование на уреаплазмы и микоплазмы: 1) материал собрать зондом-тампоном (ложкой Фолькмана, специальным зондом); 2) сразу же погрузить в специальную питательную среду для микоплазма и уреаплазм; 3) в течение 2 ч материал доставить в лабораторию. Допускается увеличение сроков транспортировки до 48 ч при температуре +4— +8 °С, при использовании специальных питательных сред.
Исследование на трихомонады: 1) для сбора материала используют сухой стерильный тампон; 2) сразу после взятия материал погрузить в пробирку (флакон) с транспортной средой для трихомонад (раствор Рингера); 3) материал доставить в лабораторию возможно быстро без охлаждения.
Б. Материал из цервикального канала
Показания к проведению исследования: диагностика цервицитов и заболеваний, передающихся половым путем.
Необходимое оснащение: одноразовое стерильное гинекологическое зеркало; стерильные одноразовые зонды; тампоны на пластиковой оси: один — в стерильной пробирке (тубсер), второй — индивидуально упакованный или — специальные щеточки; (cervix brush, cytobrush и vola brush); система с транспортной средой Эймс или Стюарт (желательно).
Взятие исследуемого материала: 1) обнажить шейку матки с помощью зеркал и убрать избыток выделений и слизи стерильной марлевой салфеткой или ватным шариком, смоченным стерильным физиологическим раствором или дистиллированной водой; высушивают салфеткой; 2) стерильный зонд-тампон транспортной системы аккуратно ввести в цервикальный канал на глубину 1,0—1,5 см, и вращать 10 с; 3) извлечь, не касаясь стенок влагалища, и сразу же погрузить в транспортную среду. При проведении исследований на хламидии, микоплазмы/уреаплазмы и вирусы материал лучше забирать с помощью специальных цитощеток (зондов). Порядок дальнейших действий зависит от выбранного метода исследования:
Культуральный метод — материал переносят в питательную среду. Можно использовать как единую питательную среду для микоплазм и уреаплазм, так и отдельные среды для каждого микроорганизма. В течение 2 ч материал должен быть доставлен в лабораторию. Допускается увеличение сроков транспортировки до 48 ч при температуре +4—+8 °С.
ПЦР — материал помещают в микропробирку с лизирующим буфером, физиологическим раствором и т.п. (выдает лаборатория). Зонд несколько раз вращают в пробирке для снятия материала. Вопрос, можно ли обломить зонд и оставить его в пробирке, следует уточнить непосредственно в лаборатории, выполняющей исследования;
РИФ (ПИФ) — сразу после взятия материала приготавливаются мазки на предметном стекле. Лучше использовать специальные стекла «с лунками», которые обычно входят в состав диагностических наборов.
5.5. Отделяемое дыхательных путей
5.5.1. Мазок со слизистых передних отделов полости носа
Показания к проведению исследования: диагностика стафилококкового бактерионосительства.
Необходимое оснащение: стерильный зонд-тампон из вискозы на пластиковой оси в пластиковой пробирке (тубсер) или транспортная система.
Взятие исследуемого материала: 1) материал собрать одним тампоном из двух носовых ходов, поместить обратно в тубсер или транспортную систему; 2) доставить в лабораторию: в тубсере в течении 2 ч, в транспортной системе — максимально до 48 ч. Можно использовать стерильный зонд-тампон в индивидуальной упаковке и стерильную емкость (пробирку) для транспортировки в лабораторию (не более 2 ч с момента взятия пробы).
5.5.2. Слизь из носоглотки и носа
Показания к проведению исследования: подозрение на дифтерию.
Необходимое оснащение: Стерильный зонд-тампон из вискозы на пластиковой оси в пластиковой пробирке (тубсер) или транспортная система — 2 штуки. Тампон должен иметь форму «капли», а не «веретена» и находясь в пробирке не касаться дна и стенок; шпатель.
Взятие исследуемого материала: при антибиотикотерапии исследование проводят не ранее чем через 3 дня после отмены препарата! 1) Материал собрать натощак или через 3—4 ч после еды; 2) с миндалин: шпателем надавливать на корень языка, в этот момент небная занавеска приподнимается, тампон завести за мягкое небо и 2—3 раза провести по миндалинам с одной и с другой стороны. При извлечении тампон не должен касаться зубов, слизистой щек, языка и язычка; 3) из двух носовых ходов забрать пробу одним тампоном; если есть налеты, материал забирают с границы пораженных и здоровых тканей, слегка нажимая на них тампоном; 4) доставить в лабораторию: в тубсере в течении 2 ч, в транспортной системе — максимально до 48 ч. В холодное время года пробы при транспортировке следует оберегать от охлаждения.
5.5.3. Слизь с задней стенки глотки
Показания к проведению исследования: подозрение на менингококковую инфекцию, коклюш.
Необходимое оснащение: транспортные системы со средой Эймс (с углем или без него) или стерильные «заднеглоточные» зонды-тампоны индивидуально упакованные; шпатель.
Взятие исследуемого материала: для диагностики менингококковой инфекции забирают слизь с задней стенки глотки натощак или через 3—4 ч после еды; 1) шпателем надавить на корень языка, в этот момент небная занавеска приподнимается, тампон завести за мягкое небо и 2—3 раза провести по задней стенке носоглотки; 2) при извлечении тампон не должен касаться зубов, слизистой щек, языка и язычка; 3) доставить в лабораторию: в тубсере в течении 2 ч, в транспортной системе — максимально до 48 ч. В холодное время года пробы при транспортировке следует оберегать от охлаждения.
5.5.4. Аспират из придаточных пазух
Показания к проведению исследования: диагностика синуситов.
Необходимое оснащение: набор инструментов для проведения пункции пазухи; стерильный шприц 10 мл; транспортная система со средой Эймс или стерильная пробирка.
Взятие исследуемого материала: 1) с соблюдением правил асептики пропунктировать пазуху; 2) аспирированную жидкость из шприца перелить в транспортную среду типа среды Эймса, при отсутствии транспортной среды материал вносят в стерильную пробирку. В этом случае он должен быть доставлен в лабораторию немедленно; 3) доставить в лабораторию: в тубсере в течение 2 ч, в транспортной системе — максимально до 48 ч.
В холодное время года пробы при транспортировке следует оберегать от охлаждения.
5.5.5. Мокрота
Показания к проведению исследования: воспалительные заболевания нижних отделов дыхательных путей, сопровождающиеся отделением мокроты; при подозрении на пневмонию в первые 3 дня заболевания целесообразно исследовать кровь.
Необходимое оснащение: стерильный широкогорлый контейнер.
Взятие исследуемого материала:
Предпочтительным является исследование утренней порции мокроты.
- Перед сбором мокроты больному предлагают почистить зубы и прополоскать рот кипяченой водой. Его предупреждают о недопустимости попадания в мокроту слюны и носовой слизи; 2) мокроту собирают в стерильный широкогорлый контейнер с завинчивающейся крышкой.
Особенности взятия мокроты для бактериоскопической диагностики туберкулеза: мокрота собирают трижды. В первый день в присутствии медицинского работника, на второй день, проинструктированным больным самостоятельно, можно дома. На третий день больной приносит собранную мокроту, и материал забирается в третий раз в присутствии медицинского работника. Пациента предупреждают о важности получения именно мокроты, но не слюны или носовой слизи, о необходимости перед сбором материала почистить зубы и прополоскать рот теплой водой. 1) Медицинский работник в маске, резиновых перчатках и резиновом фартуке располагается за спиной пациента, таким образом, чтобы направление движения воздуха было от него к пациенту; 2) снимает крышку со стерильного широкогорлого контейнера для сбора мокроты и передает его пациенту; 3) пациенту рекомендуют держать контейнер как можно ближе к губам и сразу же сплевывать в него мокроту по мере ее откашливания. Кашель может быть индуцирован с помощью нескольких глубоких вдохов; 4) по завершении сбора мокроты медицинский работник оценивает ее качество, плотно закрывает контейнер и заполняет направление на исследование; срок хранения материала в холодильнике без добавления консервирующих средств не должен превышать 48—72 ч. При отсутствии у пациента мокроты накануне вечером или рано утром, в день, намеченный для сбора материала, ему назначают отхаркивающее средство или раздражающие ингаляции.
5.5.6. Промывные воды бронхов
Показания к проведению исследования: воспалительные заболевания нижних отделов дыхательных путей при отсутствии мокроты.
Необходимое оснащение: стерильный физиологический раствор; стерильный горловой шприц или аппарат Боброва; стерильный широкогорлый контейнер.
Взятие исследуемого материала: исследование промывных вод бронхов проводят при отсутствии или скудости мокроты. Это связано не только с технической сложностью взятия этого вида материала, но и с меньшей диагностической ценностью результата из-за значительного его разбавления (концентрация микроорганизмов в промывных водах в 10—1000 раз меньше, чем в мокроте). Гортанным шприцем с помощью аппарата Боброва в трахею вводят около 10 мл стерильного физиологического раствора, и после возникновения кашля собирают откашлянный трахеобронхиальный смыв в стерильный широкогорлый контейнер. У маленьких детей через катетер вводят в трахею 5—10 мл физиологического раствора и затем отсасывают трахеобронхиальный смыв. Бронхиальные смывы могут быть получены при бронхоскопии.
5.5.7. Пробы, полученные с использованием бронхоскопа
Показания к проведению исследования: воспалительные заболевания нижних отделов дыхательных путей при отсутствии мокроты.
Необходимое оснащение: бронхоскоп, другое оборудование и медикаменты, необходимое для проведения бронхоскопии; стерильные физиологический раствор, контейнеры и пробирки.
Взятие исследуемого материала: с помощью бронхоскопии удается получить: бронхоальвеолярный лаваж (предпочтительно), смыв с бронхов (низкая чувствительность при диагностике пневмоний), соскоб с бронхов (более значим, чем смыв), биоптаты. 1) Смыв с бронхов или получение бронхоальвеолярного лаважа проводят, вводя шприцем через биопсийный канал бронхоскопа отдельными порциями от 5—20 до 100 мл стерильного физиологического раствора; 2) перед введением каждой следующей порции отбирают шприцом жидкость и переносят в стерильный контейнер; 3) при этом для каждой новой порции используют новый контейнер. В дальнейшем по решению лечащего а возможно объединение отдельных порций смыва, взятых в разных участках легких. В направлении указывают общий объем введенного физиологического раствора.
Для получения соскоба с бронхов через биопсийный канал бронхоскопа вводят телескопический двойной катетер с обработанным полиэтиленгликолем (или другим соответствующим реактивом) дистальным концом для предотвращения контаминации пробы. Материал помещают в пробирку с тиогликолевой средой (средой СКС) или специальным консервантом для облигатных анаэробов. Биоптаты доставляют в лабораторию в двух небольших пробирках (типа Эппендорф), заполненных стерильным физиологическим раствором или тиогликолевой средой.
5.6. Желчь
Показания к проведению исследования: воспалительные заболевания желчного пузыря и желчных протоков (холециститы, холангиты, желчнокаменная болезнь). При острых холангитах параллельно целесообразно исследовать кровь. Диагностика брюшного тифа и брюшнотифозного бактерионосительства.
Необходимое оснащение: комплект для дуоденального зондирования; стерильные пробирки или стерильные контейнеры; транспортная система для облигатных анаэробов (со средой КериБлейр), или пробирки с тиогликолевой средой, консервантом для облигатных анаэробов или стерильный шприц со стерильной резиновой пробкой (при взятии материала во время операции).
Взятие исследуемого материала: желчь получают путем зондирования, реже, во время операции при пункции желчного пузыря; 1) желчь собрать в 3 стерильные пробирки или в стерильные одноразовые контейнеры раздельно по порциям А, В, С. Для бактериологического исследования используется проба В; 2) над пламенем спиртовки открыть пробирку или стерильный контейнер для сбора материала, 10—12 мл желчи поместить в стерильную емкость; 3) у стеклянных пробирок обжечь горлышко и закрыть пробирку; 4) пробы доставить в лабораторию: в контейнере в течение 2 ч, в транспортной системе — максимально до 48 ч. При наличии у пациента дренажа, собирают из него пробу шприцом, предварительно тщательно обработав участок пунктирования. Нельзя собирать пробу желчи из дренажного мешка. Пробы желчи, а также гноя и аспирата из печеночных абсцессов могут отбираться во время операции. Материал из очага воспаления направляют в лабораторию в транспортной системе для анаэробов, разрешенной к применению в РФ или в полностью заполненном шприце, закрыв его конец стерильной резиновой пробкой.
5.7. Испражнения
5.7.1. Нативные испражнения
Показания к проведению исследования: острые и хронические кишечные инфекции любой этиологии, дисбактериоз.
Необходимое оснащение: чистая бумага или целлофановая пленка; стерильный контейнер с ложкой-шпателем или, в его отсутствие, любой стерильный контейнер + стерильная бактериологическая петля, лопаточка, шпатель или аналогичное изделие или транспортная система; стерильная пластиковая пастеровская пипетка с замкнутым резервуаром или, в ее отсутствие, стеклянная трубочка с грушей (если стул жидкий); судно.
Взятие исследуемого материала: судно тщательно вымыть, удалить следы дезинфектантов; на дно судна поместить лист чистой плотной бумаги; больной испражняется, следя за тем, чтобы моча не попала в пробу; пробу испражнений отбирают сразу после дефекации с помощью ложки-шпателя, вмонтированного в крышку стерильного контейнера (в отсутствие контейнера со шпателем для отбора материала используют стерильную петлю, стерильный деревянный шпатель и т.п.). Количество материала: 1) в случае оформленного стула — в объеме грецкого ореха; 2) в случае жидкого стула его слой в посуде должен быть не менее 1,5—2 см; 3) в транспортную систему со средой объем материала не должен превышать 1/3 объема среды; при наличии патологических примесей необходимо выбрать участки, содержащие слизь, гной, хлопья, но свободные от крови; образцы жидких испражнений отобрать с помощью стерильной пластиковой пастеровской пипетки с замкнутым резервуаром или, в ее отсутствие, с помощью стеклянной трубки с резиновой грушей; пробы доставить в лабораторию: в контейнере в течении 2 ч, в транспортной системе — максимально до 48 ч.
5.7.2. Ректальные мазки
Показания к проведению исследования: кишечные инфекции, анальная гонорея, выявление носительства стрептококков группы В.
Необходимое оснащение: транспортная система со средой Кери Блейр или другой, в зависимости от целей исследования (среда Кэри Блер — для всех кишечных патогенов, включая кампилобактерии, среда Эймс — для энтеробактерий, среда Стюарт — для сальмонелл, шигелл). Важно отметить, что попадание транспортных сред на слизистую прямой кишки недопустимо! Поэтому ректальный тампон должен погружаться в транспортную среду только после взятия материала;
Взятие исследуемого материала: 1) больному предлагают лечь на бок с притянутыми к животу бедрами и ладонями развести ягодицы; 2) зонд-тампон ввести в задний проход на глубину 4—5 см и, аккуратно вращая его вокруг оси, собирать материал с крипт ануса; 3) осторожно извлечь зонд-тампон и погрузить его в транспортную среду; 4) доставить в лабораторию в течение 48 ч; Важно: если в направлении на исследование цель исследований не указана, или указана не конкретно, например — «на флору», «на патогенную флору», «на тифопаратифозную группу» и т.п., в лаборатории будет выполнен стандарт исследования на патогенные энтеробактерии: шигеллы, сальмонеллы, диареегенные эшерихии. Если необходимо провести исследование на определенные виды микроорганизмов, то их обязательно нужно указать. Например, исследование на кампилобактеры, иерсинии, вибрионы, условно-патогенные энтеробактерии, дисбактериоз, стрептококки группы В, гонококки. Это необходимо сделать для того, чтобы исследование не проводилось по стандартной схеме.
5.7.3. Сбор биоматериала для выделения различных видов микроорганизмов
5.7.3.1. Сбор материала для выявления стрептококков группы В
При обследовании беременных или планирующих беременность на носительство опасных для новорожденных микроорганизмов — стрептококков группы В (Streptococcus agalactiae) сбор материала производится из влагалища и прямой кишки. Во избежание ятрогенного переноса болезнетворных микроорганизмов, например, папиломавирусов, мазки из этих биотопов следует забирать двумя разными стерильными зондами-тампонами транспортных систем со средой Эймс или Стюарт. В дальнейшем обе пробы могут быть объединены.
5.7.3.2. Сбор материала для диагностики дисбактериоза и заболеваний, вызываемых условно-патогеными бактериями
Пробы для диагностики ОКИ, вызываемых условно-патогеными бактериями, и дисбактериоза забираются и транспортируются только в стерильных сухих контейнерах. Время доставки проб в лабораторию не должно превышать 2 ч, или 4 при условии хранения в холодильнике. Пролонгирование времени транспортировки может привести к увеличению численности условно-патогенных бактерий и гипердиагностике дисбактериозов и ОКИ.
5.7.3.3. Сбор материала при подозрении на холеру по МУ 4.2.1097-02
Материал может быть забран из судна или непосредственно из прямой кишки.
На дно индивидуального судна помещают меньший по размеру сосуд (лоток), удобный для обеззараживания кипячением. Испражнения собирают в стерильный контейнер стерильными ложкамишпателями, пластиковой пастеровской пипеткой или стеклянными трубками с резиновой грушей. Для взятия материала из прямой кишки могут быть использованы: резиновый катетер, стерильный зондтампон или проволочная бактериологическая петля.
Резиновый катетер используют для взятия материала у больных с обильным водянистым стулом. Один конец катетера вводят в прямую кишку, а другой опускают в контейнер. Жидкие испражнения стекают в сосуд свободно или при легком массаже брюшной стенки.
Стерильный зонд-тампон из гигроскопического хлопка вводят в прямую кишку на глубину 5—6 см и собирают им содержимое со стенок кишечника. Тампон опускают во флакон или пробирку с 1% пептонной водой, обломив часть деревянного стержня, или погружают в пробирку с транспортной средой Кери Блейр. Стандартную стерильную бактериологическую петлю из пластика или алюминиевой проволоки перед забором материала смачивают стерильным 0,9% раствором натрия хлорида и вводят в прямую кишку на 8—10 см. Взятый материал переносят во флакон или пробирку с 1% пептонной водой.
5.7.3.4. Сбор рвотных масс и промывных вод
Показания к проведению исследования: подозрение на пищевые отравления, острые кишечные инфекции.
Необходимое оснащение: стерильный широкогорлый контейнер.
Взятие исследуемого материала: 1) рвотные массы отобрать в количестве 50—100 мл (если это не получается, в меньшем количестве), промывные воды — в объеме 100 — 200 мл; 2) материал необходимо доставить в лабораторию в течение 2 ч.
После рвоты больному дают прополоскать рот теплой водой, а тяжелым или ослабленным больным очищают полость рта ватным тампоном, смоченным водой или слабым раствором гидрокарбоната натрия, перманганата калия.
5.7.3.5. Сбор биоптата для исследования на хеликобактер
Показания к проведению исследования: подозрение на хеликобактериоз.
Необходимое оснащение: оборудование для эндоскопии; пробирки «эппендорф» со стерильным 20% раствором глюкозы.
Взятие исследуемого материала: биоптаты берут во время эндоскопии в условиях строгой асептики. Пробы резецированных органов сразу после операции берут в области тела желудка, антрального отдела и луковицы двенадцатиперстной кишки, также с соблюдением правил асептики. 1) биопсийный материал поместить в пробирку «эппендорф» со стерильным 20% раствором глюкозы, хранить до отправки в холодильнике при +4 °С. Необходимо следить за тем, чтобы биоптат был полностью погружен в раствор глюкозы, так как прилипание его к стенке пробирки может привести к потере жизнеспособности микроба; 2) пробу доставить в лабораторию не позднее 3—4 ч, так как в растворе глюкозы H. pylori сохраняет жизнеспособность в течение этого времени. В качестве транспортных сред могут быть использованы, кроме глюкозы, физиологический раствор, тиогликолевая среда для контроля стерильности, среда для кампилобактерий транспортная сухая.
5.8. Раневые (хирургические) инфекции
Показания к проведению исследования: гнойно-воспалительный процесс в ране.
Необходимое оснащение: транспортная система со средой Эймс или Стюарта; стерильная пробирка или 2 пробирки (при отсутствии транспортных систем); стерильный физиологический раствор; стерильные пробирки; стерильные марлевые салфетки; антисептик.
Взятие исследуемого материала: взятие материала при подозрении на раневую инфекцию осуществляет как правило, при проведении перевязки или операции. Технология взятия образца для микробиологического исследования во многом определяется клинической ситуацией и не может быть унифицирована. Исследуемым материалом могут служить: экссудат, аспират из раны, мазки (тканевая жидкость, пропитавшая зонд-тампон), биоптаты и др. Направление для исследования собственно гноя или струпа не целесообразно.
Забор осуществляется при соблюдении правил асептики: 1) кожу вокруг раны или над очагом воспаления обработать 70° этиловым спиртом; 2) затем 1—2% настойкой йода; 3) затем 70° этиловым спиртом; 4) удалить с помощью стерильной салфетки некротические массы, детрит, гной. Использовать растворы антисептиков для снятия повязки или обработки раневой поверхности до взятия материала нельзя! 5) Взятие материала с помощью стерильного тампона: используют два ватных (коттоновых), вискозных или дакроновых тампона на деревянной или пластиковой оси; пробы для бактериологического и микроскопического исследования следует забирать отдельными тампонами; пробы отобрать прокатывая каждый зонд-тампон по раневой поверхности от центра к периферии в течении 5—10 с; тампон должен равномерно пропитаться тканевой жидкостью; манипуляцию необходимо проводить максимально осторожно, не травмируя ткани (появление даже следов крови свидетельствует о неудаче, так как кровь обладает бактерицидными свойствами); зонд-тампон, предназначенный для отбора материала на микроскопическое исследование, помещают обратно в пустую пробирку (тубсер); зонд-тампон с материалом для бактериологического исследования помещают в среду Эймс или Стюарт.
Взятие аспирата: материал забирают после обработки кожи вышеописанным способом; после высыхания дезинфектанта одноразовым шприцем объемом 3—5 мл с иглой №22 или №23 берет аспират из глубины раны. Если имеется везикула, берется жидкость и клетки у основания дефекта; если взять аспират вышеописанным способом не удается, подкожно вводят стерильный физиологический раствор и повторно пытаются взять аспират; если и эта попытка оказывается неудачной, через иглу в шприц набирают жидкую питательную среду или физиологический раствор в небольшом количестве, ополаскивают иглу и используют полученную жидкость в качестве исследуемого материала; при наличии в ране дренажей, отделяемое из них засасывают шприцем в количестве 1—2 мл; аспират из шприца, сняв иглу, переливают в пробирку с транспортной средой Кери Блейр или иной, обеспечивающей сохранение неспорообразующих анаэробов; в крайнем случае, если гарантирована немедленная доставка материала в лабораторию, допускается транспортировать материал непосредственно в шприце с иглой, надев на нее защитный колпачок.
Взятие биоптатов: при сборе пробы в процессе операции кусочки ткани (3—5 см3) помещают в стерильный контейнер, пробирку или стерильную стеклянную емкость, добавив 3—5 мл стерильного физиологического раствора для предохранения материала от высыхания.
5.9. Воспалительные заболевания различных органов
5.9.1. Глаза
5.9.1.1. Отделяемое конъюктивы
Показания к проведению исследования: воспалительные заболевания конъюнктивы.
Необходимое оснащение: транспортные системы со средой или тампоны в сухой стерильной пробирке (тубсеры); стерильный физиологический раствор.
Взятие исследуемого материала: за 6—8 ч до взятия пробы отменяются все медикаменты и процедуры. 1) На каждый глаз используют отдельный зонд-тампон; 2) пробу (отделяемое) собирают с помощью зонд-тампона с внутренней поверхности нижнего века движением в направлении от наружного к внутреннему углу глазной щели; 2) пациент должен придерживать веки руками, чтобы при моргании ресницы не касались тампона. При скудном отделяемом используют зонд-тампон предварительно смаченный стерильным физиологическим раствором, избыток влаги отжимают о внутреннюю поверхность емкости, после чего собирают материал, как описано выше; 3) зонды-тампоны маркируют «правый глаз», «левый глаз» и доставляют в лабораторию в тубсере — 2 ч, в транспортной среде — до 48 ч.
5.9.1.2. Соскоб с конъюнктивы
Показания к проведению исследования: воспалительные заболевания конъюнктивы.
Необходимое оснащение: раствор анестетика; стерильная лопаточка или специальный стерильный шпатель; 96° этиловый спирт или ацетон; предметное стекло.
Взятие исследуемого материала: материал целесообразно забирать утром, до умывания; за 6—8 ч до этого отменяют все медикаменты и процедуры. 1) Вводят 1—2 капли анестетика, например, пропаракаина гидрохлорида или другого; 2) двумя—тремя короткими резкими движениями в одном направлении специального стерильного шпателя собрать соскобы; 3) приготовить по 2 мазка из каждого глаза, нанося материал на чистое обезжиренное предметное стекло круговыми движениями на площадь диаметром примерно 1 см; 4) стекла подписать «правый глаз», «левый глаз»; 5) высушить мазок над пламенем горелки или на воздухе; 6) высушенный мазок зафиксировать в 96° этиловом спирте в течение 5 мин. Стекло с фиксированным мазком может храниться при температуре –10 °С не более 7 сут.
5.9.1.3. Соскоб с роговицы
Делается так же, как соскоб с конъюктивы
5.9.2. Уши
5.9.2.1. Отделяемое наружного слухового прохода
Показания к проведению исследования: воспалительные заболевания наружного уха.
Необходимое оснащение: транспортная система со средой или зонд-тампон в сухой пробирке (тубсер); 70° этиловый спирт; стерильный физиологический раствор.
Взятие исследуемого материала: 1) обработать кожу 70° спиртом и промыть стерильным физиологическим раствором; 2) при помощи влажного, смоченного стерильным физиологическим раствором тампона из ушного канала удаляют соринки и корки; 3) взять материал из очага стерильным зондом-тампоном из транспортной системы или из тубсера, интенсивно вращая им в наружном слуховом проходе (но осторожно, чтобы не повредить барабанную перепонку); 4) зонд-тампон помещают пробирку с транспортной средой Эймс (в том числе — с активированным углем) или Стюарт или, при их отсутствии — в пустую стерильную пробирку (тубсер); 5) если материал брали из двух слуховых проходов, зонды-тампоны маркируют «правое», «левое»; 6) доставка в лабораторию в тубсере в течение двух часов, в транспортной среде — до 48 ч.
5.9.2.2. Жидкость при тимпаноцентезе
Показания к проведению исследования: воспалительные заболевания среднего уха.
Необходимое оснащение: транспортная система со средой или зонд-тампон в сухой пробирке (тубсер); 70° этиловый спирт; стерильный физиологический раствор; шприц.
Взятие исследуемого материала: тимпаноцентез барабанной перепонки проводят для микробиологической диагностики инфекций среднего уха только в случаях, если проводимая терапия не эффективна, так как эмпирическая схема выбора антибактериальных препаратов достаточно хорошо отработана.
Если барабанная перепонка не нарушена: 1) очистить наружный канал тампоном, смоченным 70° этиловым спиртом; 2) обработать стерильным физиологическим раствором; 3) собрать жидкость из барабанной полости с помощью шприца; 4) перенести материал из шприца в пробирку транспортной системы со средой для анаэробов (Кери Блейр); 5) доставить в лабораторию в тубсере — в течение 2 ч, в транспортной среде — до 48 ч.
Если барабанная перепонка нарушена, материал собирают с помощью стерильного ушного зеркала и зонда-тампона; тампон помещают в транспортную среду или в пробирку (тубсер) — в этом случае материал должен быть доставлен в лабораторию немедленно.
5.9.3. Инфекции в стоматологии
Показания к проведению исследования: воспаление в зубодесневом кармане.
Необходимое оснащение: 70° этиловый спирт; стерильные физиологический раствор; стерильная пробирка с питательным бульоном; транспортная система со средой; предметные стекла (4 шт.).
Взятие исследуемого материала: 1) удалить слюну, остатки пищи, зубной налет, промыть стерильным физиологическим раствором десневой карман и поверхность зуба; 2) с помощью инструментов удалить участок воспаленной ткани и, соблюдая правила асептики, перенести его в пробирку с питательным бульоном; 3) энергично перемешать содержимое с помощью стерильного зонда-тампона; 4) поместить зонд-тампон в пробирку с транспортной средой. Если получить биоптат не удается, то в десневой карман вводят стерильный бумажный или другой подходящий по размеру аппликатор. После извлечения его кончик обрезают стерильными ножницами и исследуют, как описано выше.
5.9.4. Грудное молоко
Показания к проведению исследования. Мастит и острая кишечная инфекция у матери, ГСИ у ребенка.
Необходимое оснащение: 70° этиловый спирт; ватные тампоны (2 шт); стерильные широкогорлые контейнеры (2 шт.).
Взятие исследуемого материала: 1) перед сцеживанием женщина моет руки с мылом и тщательно обрабатывает соски и около сосковую область смоченными 70° спиртом ватными тампонами, каждая железа обрабатывается отдельным тампоном; 2) молоко из правой и левой молочных желез собирается отдельно, стерильные контейнеры для сбора молока заранее маркируются «П» и «Л»; 3) первые 5—10 мл молока сцеживаются и выливаются, последующие 3—4 мл сцеживаются в стерильные контейнеры с завинчивающимися крышками; исследование должно быть начато в течение 3 часов (молоко хранят при 4 °С).