From Wikipedia, the free encyclopedia
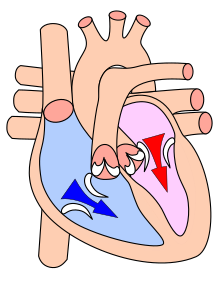
The cardiac cycle at the point of beginning a ventricular systole, or contraction: 1) newly oxygenated blood (red arrow) in the left ventricle begins pulsing through the aortic valve to supply all body systems; 2) oxygen-depleted blood (blue arrow) in the right ventricle begins pulsing through the pulmonic (pulmonary) valve en route to the lungs for reoxygenation.
Electrical waves track a systole (a contraction) of the heart. The end-point of the P wave depolarization is the start-point of the atrial stage of systole. The ventricular stage of systole begins at the R peak of the QRS wave complex; the T wave indicates the end of ventricular contraction, after which ventricular relaxation (ventricular diastole) begins.[1]
Systole ( SIST-ə-lee) is the part of the cardiac cycle during which some chambers of the heart contract after refilling with blood.[2] The term originates, via New Latin, from Ancient Greek συστολή (sustolē), from συστέλλειν (sustéllein ‘to contract’; from σύν sun ‘together’ + στέλλειν stéllein ‘to send’), and is similar to the use of the English term to squeeze.
The mammalian heart has four chambers: the left atrium above the left ventricle (lighter pink, see graphic), which two are connected through the mitral (or bicuspid) valve; and the right atrium above the right ventricle (lighter blue), connected through the tricuspid valve. The atria are the receiving blood chambers for the circulation of blood and the ventricles are the discharging chambers.
In late ventricular diastole, the atrial chambers contract and send blood to the larger, lower ventricle chambers. This flow fills the ventricles with blood, and the resulting pressure closes the valves to the atria. The ventricles now perform isovolumetric contraction, which is contraction while all valves are closed. This contraction ends the first stage of systole. The second stage proceeds immediately, pumping oxygenated blood from the left ventricle through the aortic valve and aorta to all body systems, and simultaneously pumping oxygen-poor blood from the right ventricle through the pulmonic valve and pulmonary artery to the lungs. Thus, the pairs of chambers (upper atria and lower ventricles) contract in alternating sequence to each other. First, atrial contraction feeds blood into the ventricles, then ventricular contraction pumps blood out of the heart to the body systems, including the lungs for resupply of oxygen.
Cardiac systole is the contraction of the cardiac muscle in response to an electrochemical stimulus to the heart’s cells (cardiomyocytes).
Cardiac output is the volume of blood pumped by the ventricles in one minute. The ejection fraction is the volume of blood pumped divided by the total volume of blood in the left ventricle.[3]
Types of systole[edit]
Atrial systole[edit]
The cardiac cycle at beginning of atrial systole: The left (red) and right (blue) ventricles begin to fill during ventricular diastole. Then, after tracing the P wave of the ECG, the two atria begin contracting (systole), pulsing blood under pressure into the ventricles.
Atrial systole occurs late in ventricular diastole and represents the contraction of myocardium of the left and right atria. The sharp decrease in ventricular pressure that occurs during ventricular diastole allows the atrioventricular valves (or mitral and tricuspid valves) to open and causes the contents of the atria to empty into the ventricles. The atrioventricular valves remain open while the aortic and pulmonary valves remain closed because the pressure gradient between the atrium and ventricle is preserved during late ventricular diastole. Atrial contraction confers a minor-fraction addition to ventricular filling, but becomes significant in left ventricular hypertrophy, or thickening of the heart wall, as the ventricle does not fully relax during its diastole. Loss of normal electrical conduction in the heart—as seen during atrial fibrillation, atrial flutter, and complete heart block—may eliminate atrial systole completely.
Contraction of the atria follows depolarization, represented by the P wave of the ECG. As both atrial chambers contract—from the superior region of the atria toward the atrioventricular septum—pressure rises within the atria and blood is pumped into the ventricles through the open atrioventricular valves. At the start of atrial systole, during ventricular diastole, the ventricles are normally filled to about 70–80 percent of capacity by inflow from the atria. Atrial contraction also referred to as the «atrial kick,» contributes the remaining 20–30 percent of ventricular filling. Atrial systole lasts approximately 100 ms and ends prior to ventricular systole, as the atrial muscle returns to diastole.[4]
The two ventricles are isolated electrically and histologically (tissue-wise) from the two atrial chambers by electrically impermeable collagen layers of connective tissue known as the cardiac skeleton. The cardiac skeleton is made of dense connective tissue which gives structure to the heart by forming the atrioventricular septum—which separates the atria from the ventricles—and the fibrous rings which serve as bases for the four heart valves.[5] Collagen extensions from the valve rings seal and limit electrical activity of the atria from influencing electrical pathways that cross the ventricles. These electrical pathways contain the sinoatrial node, the atrioventricular node, and the Purkinje fibers. (Exceptions such as accessory pathways may occur in this firewall between atrial and ventricular electrical influence but are rare.)
Cardiac rate control via pharmacology is common today; for example, the therapeutic use of digoxin, beta adrenoceptor antagonists, or calcium channel blockers are important historical interventions in this condition. Notably, individuals prone to hypercoagulability (abnormality of blood coagulation) are at decided risk of blood clotting, a very serious pathology requiring therapy for life with an anticoagulant if it cannot be corrected.
Right and left atrial systoles[edit]
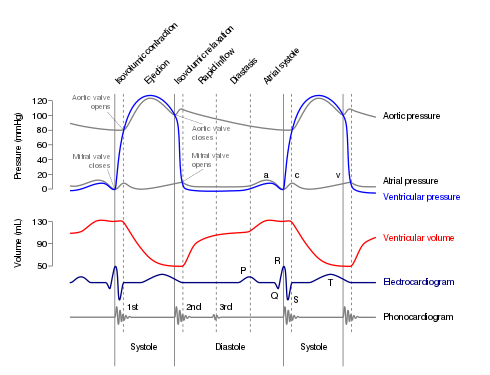
The atrial chambers each contains one valve: the tricuspid valve in the right atrium opens into the right ventricle, and the mitral (or bicuspid) valve in the left atrium opens into the left ventricle. Both valves are pressed open during the late stages of ventricular diastole; see Wiggers diagram at the P/QRS phase (at right margin). Then the contractions of atrial systole cause the right ventricle to fill with oxygen-depleted blood through the tricuspid valve. When the right atrium is emptied—or prematurely closed—right atrial systole ends, and this stage signals the end of ventricular diastole and the beginning of ventricular systole (see Wiggers diagram). The time variable for the right systolic cycle is measured from (tricuspid) valve-open to valve-closed.
The contractions of atrial systole fill the left ventricle with oxygen-enriched blood through the mitral valve; when the left atrium is emptied or closed, left atrial systole is ended and ventricular systole is about to begin. The time variable for the left systolic cycle is measured from (mitral) valve-open to valve-closed.
Atrial fibrillation[edit]
Atrial fibrillation represents a common electrical malady in the heart that appears during the time interval of atrial systole (see figure at right margin). Theory suggests that an ectopic focus, usually situated within the pulmonary trunks, competes with the sinoatrial node for electrical control of the atrial chambers and thereby diminishes the performance of the atrial myocardium, or atrial heart muscle. The ordered, sinoatrial control of atrial electrical activity is disrupted, causing the loss of coordinated generation of pressure in the two atrial chambers. Atrial fibrillation represents an electrically-disordered but well perfused atrial mass working (in an uncoordinated fashion) with a (comparatively) electrically-healthy ventricular systole.
The compromised load caused by atrial fibrillation detracts from the overall performance of the heart, but the ventricles continue to work as an effective pump. Given this pathology, the ejection fraction may deteriorate by ten to thirty percent. Uncorrected atrial fibrillation can lead to heart rates approaching 200 beats per minute (bpm). If this rate can be slowed to a normal range, say about 80 bpm, the resultant longer fill-time within the cardiac cycle restores or improves the pumping capability of the heart. The labored breathing, for example, of individuals with uncontrolled atrial fibrillation, can often be returned to normal by (electrical or medical) cardioversion.
Ventricular systole and Wiggers diagram[edit]
A Wiggers diagram, showing various events during systole (here primarily displayed as ventricular systole, or ventricular contraction). The very short interval (about 0.03 second) of isovolumetric, or fixed-volume, contraction begins (see upper left) at the R peak of the QRS complex on the electrocardiogram graph-line. + Ejection phase begins immediately after isovolumetric contraction—ventricular volume (red graph-line) begins to decrease as ventricular pressure (light blue graph-line) continues to increase; then pressure drops as it enters diastole.
A Wiggers diagram of ventricular systole graphically depicts the sequence of contractions by the myocardium of the two ventricles. Ventricular systole induces self-contraction such that pressure in both left and right ventricles rises to a level above that in the two atrial chambers, thereby closing the tricuspid and mitral valves—which are prevented from inverting by the chordae tendineae and the papillary muscles. Now ventricular pressure continues to rise in isovolumetric, or fixed-volume, contraction phase until maximal pressure (dP/dt = 0) occurs, causing the pulmonary and aortic valves to open in ejection phase. In ejection phase, blood flows from the two ventricles down its pressure gradient—that is, ‘down’ from higher pressure to lower pressure—into (and through) the aorta and the pulmonary trunk respectively. Notably, cardiac muscle perfusion through the heart’s coronary vessels doesn’t happen during ventricular systole; rather, it occurs during ventricular diastole.
Ventricular systole is the origin of the pulse.
Right and left ventricular systoles[edit]
The pulmonary (or pulmonic) valve in the right ventricle opens into the pulmonary trunk, also known as the pulmonary artery, which divides twice to connect to each of the left and right lungs. In the left ventricle, the aortic valve opens into the aorta which divides and re-divides into the several branch arteries that connect to all body organs and systems except the lungs.
By its contractions, right ventricular (RV) systole pulses oxygen-depleted blood through the pulmonary valve through the pulmonary arteries to the lungs, providing pulmonary circulation; simultaneously, left ventricular (LV) systole pumps blood through the aortic valve, the aorta, and all the arteries to provide systemic circulation of oxygenated blood to all body systems. The left ventricular systole enables blood pressure to be routinely measured in the larger arteries of the left ventricle of the heart.
LV systole is volumetrically defined as the left ventricular ejection fraction (LVEF). Similarly, RV systole is defined as the right ventricular ejection fraction (RVEF). Higher than normal RVEF is indicative of pulmonary hypertension. The time variables of the ventricular systoles are: right ventricle, pulmonary valve-open to valve-closed; left ventricle, aortic valve-open to valve-closed.
Electrical systole[edit]
The sinoatrial node (S-A Node) is the heart’s natural pacemaker, issuing electrical signaling that travels through the heart muscle, causing it to contract repeatedly in cycle. It is situated at the top of the right atrium adjacent to the junction with the superior vena cava.[6] The S-A Node is a pale yellow structure. For humans, it is approximately 25 mm long, 3–4 mm wide and 2 mm thick. It contains two types of cells: (a) the small, round P cells which have very few organelles and myofibrils, and (b) the slender elongated transitional cells, which are intermediate in appearance between the P and the ordinary myocardial cells.[7] Intact, the SA node provides continual electrical discharge known as sinus rhythm through the atrial mass, the signals of which then coalesce at the atrioventricular node, there to be organized to provide a rhythmic electrical pulse into and across the ventricles through sodium-, potassium- or calcium-gated ion channels.
The continual rhythmic discharge generates a wavelike movement of electrical ripples that stimulate the smooth muscles of the myocardium and cause rhythmic contractions to progress from top to bottom of the heart. As the pulse moves out of the (upper) atria into the (lower) ventricles, it is distributed throughout a muscular network to cause systolic contraction of both ventricular chambers simultaneously. The actual pace of the cycle—just how fast or slowly the heart beats—is cued by messages from the brain, reflecting the brain’s responses to conditions of the body, such as pain, emotional stress, level of activity, and to ambient conditions including external temperature, time of day, etc.[8]
Mechanical systole[edit]
Electrical systole opens voltage-gated sodium, potassium and calcium channels in cells of myocardium tissue. Subsequently, a rise in intracellular calcium triggers the interaction of actin and myosin in the presence of ATP which generates mechanical force in the cells in the form of muscular contraction, or mechanical systole. The contractions generate intra-ventricular pressure, which is increased until it exceeds the external, residual pressures in the adjacent trunks of both the pulmonary artery and the aorta; this stage, in turn, causes the pulmonary and aortic valves to open. Blood is then ejected from the two ventricles, pulsing into both the pulmonic and aortic circulation systems.[9]
Mechanical systole causes the pulse, which itself is readily palpated (felt) or seen at several points on the body, enabling universally adopted methods—by touch or by eye—for observing systolic blood pressure.
The mechanical forces of systole cause rotation of the muscle mass around the long and short axes, a process that can be observed as a «wringing» of the ventricles.
Physiological mechanism[edit]
Systole of the heart is initiated by electrically excitable cells situated in the sinoatrial node. These cells are activated spontaneously by depolarization of the electrical potential across their cell membranes, which causes voltage-gated calcium channels on the cell membrane to open and allow calcium ions to pass through into the sarcoplasm (cytoplasm) of cardiac muscle cells. Calcium ions bind to molecular receptors on the sarcoplasmic reticulum (see graphic), which causes a flux (flow) of calcium ions into the sarcoplasm.
Calcium ions bind to troponin C, causing a conformational (i.e., structural) change in the troponin-tropomyosin protein complex, causing the myosin head (binding) sites on F-actin filamentous proteins to be exposed, which causes muscle contraction to occur.
The cardiac action potential spreads distally (or outwardly) to the small branches of the Purkinje tree via the flux of cations through gap junctions that connect the sarcoplasms of adjacent myocytes.
The electrical activity of ventricular systole is coordinated by the atrioventricular node, which is a discrete collection of cells that receives electrical stimulation from the left and right atria and can provide an intrinsic (albeit slower) heart pacemaker activity. The cardiac action potential is propagated down electrical pathways through the bundle of His to the Purkinje fibres; this electrical flux causes coordinated depolarisation and excitation-contraction coupling from the apex of the heart up to the roots of the great vessels.
Clinical notation[edit]
When blood pressure is stated for medical purposes, it is usually written with the systolic and diastolic pressures separated by a slash, for example, 120/80 mmHg. This clinical notation is not a mathematical figure for a fraction or ratio, nor a display of a numerator over a denominator. Rather, it is a medical notation showing the two clinically significant pressures involved (systole followed by diastole). It is often shown followed by a third number, the value of the heart rate (in beats per minute), which typically is measured jointly with blood pressure readings.
See also[edit]
- Wiggers diagram
- Systole (mathematics)
- Diastole
- Blood pressure
References[edit]
- ^ Topol, Eric J (2000). Cleveland Clinic Heart Book. New York: Hyperion. pp. 134–35. ISBN 0-7868-6495-8.
- ^ Simmers, Louise (2004). Introduction to Health Science Technology. Australia: Thomson/Delmar Learning. p. 169. ISBN 9781401811280.
- ^ Lang RM, Bierig M, Devereux RB, et al. (March 2006). «Recommendations for chamber quantification». Eur J Echocardiogr. 7 (2): 79–108. doi:10.1016/j.euje.2005.12.014. PMID 16458610.
- ^ Betts, J. Gordon (2013). Anatomy & physiology. pp. 787–846. ISBN 978-1938168130. Retrieved 11 August 2014.
- ^ Pocock, Gillian (2006). Human Physiology. Oxford University Press. p. 264. ISBN 978-0-19-856878-0.
- ^ Pocock, Gillian (2006). Human Physiology (Third ed.). Oxford University Press. p. 266. ISBN 978-0-19-856878-0.
- ^ Fung, Y. C. (2010). Biomechanics : circulation. ISBN 9781441928429. OCLC 752495251.
- ^ Topol, Eric J (2000). Cleveland Clinic Heart Book. New York: Hyperion. pp. 7–8. ISBN 0-7868-6495-8.
- ^ Topol, Eric J (2000). Cleveland Clinic Heart Book. New York: Hyperion. pp. 8–9, 110–111. ISBN 0-7868-6495-8.
External links[edit]
- «Systole» at Dorland’s Medical Dictionary
- Essential Hypertension Treatment
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Категория:
КазМУНО (АГИУВ). Кафедра анестезиологии и реаниматологии
Информация
Чурсин В.В.
Клиническая физиология кровообращения
Методические материалы к лекциям и практическим занятиям
УДК — 612.13-089: 519.711.3
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. — 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
— знание нормы,
— знание отклонений от нормы приспособительного характера,
— знание «узла», или той «точки», от которых приспособительная реакция переходит в патологическую.
Более образно это можно представить в следующем виде (рисунок 1).
Рисунок 1 — Примерный график нормы приспособительных и патологических реакций
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение («излом») приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение — это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
Основными задачами кровообращения являются:
1. Доставка тканям: кислорода, питательных веществ и солей, гормонов и других активных веществ;
2. Удаление из тканей: углекислоты и прочих конечных продуктов метаболизма;
3. Участие в теплоотдаче.
Из всех предложенных классификаций сердечно-сосудистой системы (ССС) наиболее практичной оказалась классификация Б.Фолкова (1976 г.), которую В.Туркин и В.Чурсин (2003 г.) модифицировали, добавив 8-ой элемент — объем циркулирующей крови (ОЦК):
— 1-м элементом является сердце, которое представляется как насос;
— 2 — аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
— 3 — прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
— 4 — капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
— 5 — сосуды — шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
— 6 — посткапиллярные сосуды, это собирательные и отводящие венулы; в
некоторых источниках литературы их именуют посткапиллярными жомами
(сфинктерами);
— 7 — вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют «венозный возврат» крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
— 8 – объем циркулирующей крови (ОЦК) – совокупность содержимого всех сосудов.
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» — сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани – мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см3. В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см3. Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Ситуация вполне возможная и до сих пор нередко наблюдаемая в отделениях интенсивной терапии.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии — вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее — раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) – больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК — V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
Рисунок 2 — Последовательность изменений в организме при снижении ОЦК
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, «наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах» – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Основные свойства и резервы крови
Кровь — это жидкость.
1. Ньютоновские: однородные жидкости (например — вода).
2. Неньютоновские: неоднородные жидкости:
— эмульсии (нерастворимые капельки жидкости в растворе, например — жировые);
— суспензии (твердые частицы в растворе);
— пены (пузырьки газа в растворе).
Одним из наиболее важных свойств жидкости является ее текучесть.
Свойством обратным текучести является вязкость жидкости.
Используя вязкость как характеристику, жидкости можно разделить на:
— обладающие вязкостью, не зависящей от скорости перемещения жидкости;
— вязкость увеличивается при уменьшении скорости перемещения жидкости.
Кровь
представляется
неньютоновской жидкостью
— суспензией. Поэтому вязкость крови значительно увеличивается при замедлении кровотока. В норме замедление перемещения крови отмечается в капиллярах, однако капиллярный кровоток не нарушается.
В капилляре иная форма кровотока. Форменные элементы крови продвигаются по осевой линии по одиночке и отделенными друг от друга «столбиками» плазмы.
Плазма крови
, хоть и содержит белковые молекулы и другие вещества,
ближе к ньютоновской жидкости
. Такое свойство плазмы способствует поддержанию нормального кровотока в капиллярах. В целом эта естественная особенность капиллярного кровообращения подсказывает дополнительный элемент к терапии больного с патологическим замедлением перемещения крови при сердечной, сосудистой, сердечно-сосудистой недостаточности.
Наиболее важным резервом крови является гораздо больше, чем необходимое тканям содержание О2 в артериальной крови. Резерв О2 таков, что ткани могут получать его если кровоток уменьшится примерно в 3 раза. То есть коэффициент безопасности по кислороду равен 3, по глюкозе — 3, по аминокислотам — 36 и т.д. Это означает, что если кровотоком тканям доставляются достаточное количество кислорода, то «автоматически» обеспечивается доставка и других веществ: глюкозы, аминокислот и т.д.
Сердечно-сосудистая система
Сердечно-сосудистая система
Как было указано выше, это система сердца и сосудов, предназначенная для кровоснабжения органов и тканей. В функциональном плане задачами этой системы являются:
1. Обеспечение транспорта крови. Это связано, прежде всего, с работой сердца. Оно обеспечивает УО, СВ, оно обеспечивает энергией объемный поток крови (ОПК), в результате чего создается давление (Р) крови в начале сосудистой системы малого (Рл.а.) и большого (Ра) кругов кровообращения.
2. Распределение кровотока по сосудам органов и тканей в соответствии с интенсивностью их работы. Это связано с работой резистивных сосудов.
Эффективность кровообращения органов и тканей обеспечивается свойствами и резервами крови, ОЦК, возможностями общего и местного кровотока.
Сердце
Сердце
Его работу отождествляют, как правило, с работой насоса. Этот орган нередко рассматривают как два полых мышечных органа; правое и левое сердце.
Каждое состоит из предсердия и желудочка. У плода обе половины сердца функционально соединены параллельно.
После рождения и закрытия шунтов (овального отверстия, артериального протока) соединение правого и левого сердца становится последовательным.
Так как сосудистое сопротивление БКК приблизительно в 8 раз больше, чем в МКК, левый желудочек, выполняя большую работу развивается интенсивнее и его мышечная масса становится в 3 раза большей, чем правого.
Благодаря этому на единицу массы левого желудочка интенсивность работы снижается.
В 1980-е г.г. профессором Б.А.Константиновым и его сотрудниками В.А.Сандриковым, В.Ф.Яковлевым внесены существенные поправки в представление о сокращении и расслаблении сердца.
Они отмечают: основной недостаток сложившихся на протяжении многих лет представлений заключается в принятии на веру того, что систола это только сокращение, а диастола это только пассивное расслабление миокарда.
Их клинические исследования показали, что систола сердца начинается с систолы предсердий. Систола предсердий асинфазна (раньше сокращается правое, позже левое предсердия). При этом глубокие мышцы в устьях полых и легочных вен, сокращаясь и суживая просвет вен изолируют вены от полостей сердца, а также препятствуют току крови и передаче давления в вены.
Под давлением предсердной порции крови (12-18 см3 или 16-20% от УО) открываются створки атриовентрикулярных клапанов (трехстворчатого, митрального).
Образуется единая полость предсердие-желудочек (справа и слева). Главная роль этой порции крови — изменение наружной конфигурации желудочков. Наружная косая и внутренняя прямая мышцы удлиняются, верхушка смещается книзу. Одновременно удлиняются волокна средней циркулярной мышцы, боковые стенки перемещаются, в меньшей мере, латерально. Наружная конфигурация сердца приближается к элипсоидной форме.
Кроме того, систола предсердий играет роль в начальном повышении внутрижелудочкового давления. Сокращение правого предсердия повышает давление в желудочке до 9-12, а левого предсердия – до 11-15 мм Hg.
С систолой предсердий фактически начинается (1) период повышения внутрижелудочкового давления. В этом периоде различаются две фазы.
(1.1.) Фаза внутрижелудочкового перемещения крови.
Начинают сокращаться наружная косая и внутренняя прямая мышцы. Верхушка подтягивается в направлении к атриовентрикулярным отверстиям. При этом
укорачиваются пути притока крови в полости желудочков (полости как бы идут навстречу кровотоку). Несмотря на сокращение этих мышц, объем желудочков не уменьшается, так как одновременно дополнительно растягивается средняя циркулярная мышца. Благодаря этому внутрижелудочковая порция крови смещается в направлении путей оттока и располагается в близи устьев аорты и легочной артерии.
Вместе с сокращением наружной косой и внутренней прямой мышц трабекулы и сосочковые мышцы сближаются. Поэтому створки атриовентрикулярных клапанов сближаются, а их свободные края остаются направленными в полость желудочков. Это позволяет сохранять единую полость предсердие-желудочек и предупреждать регургитацию (возврат) крови из желудочка (ов) в предсердия благодаря конусообразному или воронкообразному расположению створок клапанов с образованными верхушками, которые обращены в полость желудочков.
Во время внутрижелудочкового перемещения крови многочисленными замерами было установлено непрерывное увеличение (или приращение) внутрижелудочкового давления.
В результате такой эволюции вновь изменяется конфигурация сердца: укорачивается длина и увеличивается поперечник.
(1.2.) Развивается фаза изоволемического повышения внутрижелудочкового давления.
К началу этой фазы заполнение желудочков закончено. Их объем устанавливается постоянным, несмотря на дальнейшее взаимодействие мышц, повышение внутрижелудочкового давления и изменение геометрии сердца.
Начинается сокращение средней циркулярной мышцы с одновременным растяжением наружной косой и внутренней прямой мышц. Это не сопровождается движением боковых стенок желудочков внутрь, так как кровь — это жидкость, а жидкости не сжимаются (закон Паскаля).
Сокращение — укорочение и утолщение волокон средней циркулярной мышцы увеличивает кривизну боковой наружной поверхности желудочков, она растягивается.
При этом быстро повышается давление в желудочках, створки атриовентрикулярных клапанов закрываются (но еще закрыты и полулунные клапаны).
Одновременное растяжение наружной косой и внутренней прямой мышц приводит к удлинению полостей желудочков и к спрямлению путей оттока.
В результате всех этих изменений наружная конфигурация сердца приближается к шаровидной, а полости желудочков к цилиндрической.
Далее развивается (2) период изгнания . В этом периоде также различаются две фазы.
(2.1.) С началом первой фазы максимального изгнания (ФМИ1) продолжающееся и усиливающееся сокращение волокон средней циркулярной мышцы (при закрытых
атриовентрикулярных и полулунных клапанах) обуславливает быстрый, почти мгновенный, прирост внутрижелудочкового давления, что и создает условия для
открытия полулунных клапанов. Первая и максимальная порция крови поступает в сосуды в результате изолированного сокращения средней циркулярной мышцы.
Происходит как бы «выстреливание» этой порции крови. Спустя 0,02-0,04 с присоединяется сокращение наружной косой и внутренней прямой мышц.
(2.2.) С началом сокращения всех трех мышц наступает вторая фаза максимального изгнания (ФМИ2). При этом, несмотря на непрерывно уменьшающийся внешний размер сердца и уменьшающиеся полости желудочков, также непрерывно продолжается поддерживание внутрижелудочкового давления. С началом этой фазы (сокращения всех трех мышц) изгоняемая порция крови получает основную часть кинетической энергии. Кроме того, подключившееся сокращение наружной косой и внутренней прямой мышц приводит к умеренной ротации сердца по часовой стрелке вокруг его (условно) продольной оси. Это придает изгоняемому току крови характер поступательного движения по спирали, что облегчает ее продвижение через клапанное кольцо (или отверстие).
Одновременно с выбросом крови происходит реактивное смещение желудочков книзу, что приводит к растяжению предсердий, увеличению их полостей.
Далее развивается (3) период снижения внутрижелудочкового давления. Здесь также различаются две фазы.
(3.1.) В фазе редуцированного изгнания за счет сохраняющейся разности давлений между желудочками и сосудами, за счет полученной кинетической энергии поступательное движение крови из желудочков в сосуды продолжается, уменьшаясь постепенно. В какой-то момент начинает расслабляться (и «растягиваться») средняя циркулярная мышца. Вместе с этим начинает снижаться давление в полостях желудочков. Когда оно становится ниже давления в сосудах, кровь, направляясь в полости желудочков, «отгибает» створки полулунных клапанов и закрывает их.
(3.2.) С закрытием полулунных клапанов (атриовентрикулярные тоже еще закрыты) начинается фаза изоволемического снижения внутрижелудочкового давления. При этом наружная косая и внутренняя прямая мышцы еще продолжают активно сокращаться и способствуют дальнейшему пассивному растяжению средней циркулярной мышцы. Форма желудочков приближается к шаровидной, сохраняется тот же объем. Такая шаровидная конфигурация лучше обеспечивает открытие атриовентрикулярных клапанов.
В отдельный момент они открываются и развивается (4) период наполнения желудочков. Различаются две фазы.
(4.1.) В фазе быстрого наполнения всё ещё продолжается сокращение наружной косой и внутренней прямой мышц, расслабление циркулярной мышцы и более полное приближение полостей к шаровидной форме. При этом происходит равномерное истончение стенок и усиление присасывающей силы желудочков. Присасывающее действие желудочков распространяется не только на предсердия, но и вены (с еще расслабленными жомами). Через 0,05-0,07 с от начала наполнения заканчивается сокращение наружной косой и внутренней прямой мышц и начинается (4.2.) фаза медленного наполнения. С этого момента расслабляются и растягиваются все три мышцы. Движение крови в желудочки продолжается, но с меньшей скоростью и в меньшем объеме. А конфигурация сердца все более приближается к элипсоидной. Далее весь цикл работы сердца повторяется.
Как примечание следует отметить, что с момента закрытия атриовентрикулярных клапанов расслабляются жомы в устьях вен, образуя единую полость вена-предсердие (справа и слева), сами предсердия несколько удлиняются. А дополнительное удлинение предсердий и ускорение наполнения их кровью происходит во время реактивного смещения желудочков книзу.
Итак, при клинических исследованиях Б.А.Константинова, В.А.Сандрикова, В.Ф.Яковлева (1986 г.) было установлено, что:
1) в сердечном цикле функция предсердий и желудочков едина;
2) вопреки принятому делению сердечного цикла на систолу и диастолу установлено несовпадение активности мышечных слоев сердца между собой;
3) механизмы «диастолы» тоже активны, как и механизмы систолы.
Результаты этих исследований подводят к очень важному вопросу: как при разновременной активности мышечных слоев миокарда между собой осуществляется коронарное кровообращение? Ответа пока нет.
Врачи разных специальностей часто пользуются сочетанием слов — «сила сердечных сокращений». И при этом в прямом смысле подразумевают сокращение сердца как «сжимание кисти в кулак». Сила «сжатия», сжимая кровь, выбрасывает ее из полости желудочка. Нелишне рассмотреть, что это конечно же не так:
Во-первых, жидкость не сжимается и это известно со времен Паскаля.
Во-вторых, в 1956 г. Rushmer высказал предположение, что во время систолы полость желудочка имеет форму цилиндра. Однако в 1957 г. Burton отметил, что еще раньше Woods первым предположил, что во время систолы полость желудочка имеет форму шара и первым применил закон Лапласа для объяснения систолы желудочка.
При этом напряжение стенки определяется как сила, направленная на разрыв стенки. Эта сила при напряжении и есть «сила сердечного сокращения».
Она тем больше, чем ближе к наружной поверхности толщины стенки располагается любая точка напряжения.
Мышцы, образующие стенку желудочка, при своем сокращении, «слоисто» растягивая её тем больше, чем ближе «слой» к наружной поверхности, все более и более увеличивают её напряжение. Вместе с этим растет внутрижелудочковое давление. В какой-то момент времени закрытые створки полулунных клапанов, составляющие часть стенки желудочка под действием силы напряжения («разрыва») и внутрижелудочкового давления открываются («разрываются») и кровь изгоняется из полости желудочка.
Итак, у взрослого человека «правое» сердце последовательно соединено с «левым» (рисунок 3).
Рисунок 3. Схематичное изображение «правого» сердца (ПС), малого круга кровообращения (МКК), «левого» сердца (ЛС)
Желудочки (правый и левый) при каждом изгнании выбрасывают одинаковые объёмы крови (закон Гарвея). Установлено, если выброс правого желудочка будет всего на 2% больше выброса левого, то через некоторое время может наступить отёк лёгких из-за переполнения МКК. В норме этого не происходит. В организме имеются механизмы, которые согласуют выбросы обоих желудочков, и обеспечивают приспособление сердца в целом к гидро- (точнее гемо-) динамическим изменениям.
В общем виде это два типа регулирующих механизмов:
1)экстракардиальная регуляция, в которой участвуют нервная вегетативная и эндокринная системы;
2) внутрисердечная регуляция, которая обусловлена особыми свойствами самого сердца; эта регуляция действует даже в условиях изолированного сердца (как, например, после пересадки), она связана с гемодинамическими изменениями нагрузки.
Потребление питательных веществ сердцем.
Здоровое сердце считается «всеядным» органом. По расходованию кислорода на окисление питательных веществ представляется, что сердце потребляет:
1) свободные жирные кислоты (34% O2),
2) глюкозу (31% O2),
3) молочную кислоту (28% O2),
4) пировиноградную кислоту, аминокислоты, кетоновые тела. (7% O2).
При нарушении коронарного кровообращения, как видно, главная опасность для сердца возникает не из-за недостатка энергоносителей (питательных веществ), а в дефиците окислителя (кислорода).
При физической нагрузке, сопровождающейся тахикардией (а значит при тахикардии любого происхождения) приоритеты изменяются:
1) молочная кислота (61% O2), (что предотвращает метаболический ацидоз в миокарде),
2) свободные жирные кислоты (21% O2),
3) глюкоза (16% O2),
4) пировиноградная кислота, аминокислоты, кетоновые тела. (2% O2)
У больных с пороками сердца, с гипертрофией, особенно выраженной степени, в большей мере используются свободные жирные кислоты (Е.П.Степанян, И.Н. Баркан, «Биоэнергетика оперированного сердца». М. 1971 г.).
Потребление кислорода сердцем.
Оно составляет 0,08-0,10 мл/мин/г в условиях основного обмена (в покое). Масса здорового сердца в среднем 300 г. Следовательно, сердце в целом потребляет примерно 24-30 мл кислорода в минуту. При возрастании потребности сердца в кислороде, она не обеспечивается усилием экстракции кислорода из коронарной артериальной крови. В норме экстракция составляет 0,14 мл О2 из 1 мл. коронарной артериальной крови. Содержание О2 в 1 мл этой крови в норме составляет 0,20 мл. Даже при полной экстракции добавка О2 в 0,06 мл из каждого 1 мл. крови является мизерной. Возрастающая потребность сердца в кислороде удовлетворяется главным образом путем усиления коронарного кровотока, и у здоровых лиц расширением коронарных сосудов.
Увеличение коронарного кровотока может быть избирательным (Gregg, Swipley, 1947г.). За счет расширения коронарных сосудов кровоток усиливается уже при снижении содержания О2 в артериальной крови всего лишь на 5%.
Метаболические пути окисления и получения энергии.
1. Путь Эмбдена — Меергофа — Кребса обеспечивает окисление глюкозы и продуктов ее окисления.
1 мол.глюкозы = 2 мол. провиноградной к-ты = 30 мол. АТФ.
2. Путь Варбурга — Диккенса — Липпмана обеспечивает окисление и глюкозы, и свободных жирных кислот.
1 мол.пальмитиновой к-ты = 117 мол.АТФ при расходовании такой же порции кислорода на окисление.
Энергия сердца и ее расход.
Энергия сердца (а также отдельно правого или левого желудочка) определяется уравнением
E = q*Q*ПМО2 (5),
где: Е — энергия сердца в кг * м/мин;
q — калорический эквивалент кислорода, равный 0,0048 ккал/мл;
Q — тепловой эквивалент, равный 427 кг * м/ккал;
ПМО2 — потребленный сердцем кислород (ПМО2л для Ел или ПМО2п для Еп).
Поскольку q и Q величины постоянные, можно пользоваться их произведением, вычисленным один раз и навсегда, что равно 2,05 кг * м/мл.
Ответ величины энергии можно получить в вт (1 вт = 6,2 кг * м/мин.).
Поскольку энергия прямо пропорциональна потребленному кислороду, то, назначая средства, уменьшающие потребность миокарда в кислороде, следует помнить, что будет уменьшаться энергия сердца. Бесконтрольное использование этих средств может настолько уменьшить энергию сердца, что это может стать причиной сердечной недостаточности.
Вполне естественно, что при дефиците энергии в кардиомиците в первую очередь нарушается работа K-Na насоса.
Функциональные резервы сердца и сердечная недостаточность
Несмотря на совершенные механизмы саморегуляции, широкий выбор энергоносителей для окисления, большие запасы эндогенных инотропных средств в организме, функциональные резервы сердца ограничены. Это создает предпосылки для возникновения сердечной недостаточности. В широком смысле под сердечной недостаточностью понимается состояние, при котором сердце выбрасывает крови меньше, чем надо для поддержания нормального кровотока. В узком смысле под сердечной недостаточностью понимается снижение именно сократительной способности сердца.
Физиология различает 4 варианта острой сердечной недостаточности
(ОСН).
1.) ОСН, обусловленная рефлекторными реакциями. Например, брадикардия вплоть до полной остановки сердца, обусловленная раздражением блуждающего нерва.
2.) ОСН, обусловленная гемодинамическими отклонениями от нормы. Например, изотоническая или изометрическая перегрузка.
3.) ОСН, обусловленная снижением именно сократительной способности.
а) Связанная с нарушением ресинтеза и недостатком креатинфосфата. Это уменьшает энергообеспечение сократительных белков (актина и миозина). При этом назначение (без контроля креатинфосфата) инотропных средств (гликозидов, симпатомиметиков и т.п.) еще более ускоряет и усиливает недостаточность. Рекомендуется, облегчая работу сердца, снижать его энергозатраты.
б) Связанная не с уменьшением энергии, а с нарушением электромеханического сопряжения. Это бывает при избытке (или передозировке) антагонистов Са, которые вымывают Са из активных центров актина и миозина. Показано использование Са, гликозидов, катехоламинов, которые улучшают электромеханическое сопряжение.
4.) ОСН, обусловленная повреждениями значительной части кардиомиоцитов — материальной основы сокращения. Это бывает при остром обширном инфаркте миокарда, диффузном миокардите с исходом в миомаляцию.
Остановка сердца и продолжительность реанимационных мероприятий
Внезапно остановленное или остановившееся сердце продолжает потреблять кислород в течении некоторого времени. Это, так называемое, базальное потребление кислорода равно примерно 0,015 мл/мин/г., а сердце в целом (300 г.) — 4,5 мл/мин.
Благодаря базальному потреблению предотвращаются структурные изменения в миокарде в течение некоторого времени после остановки.
При максимальных значениях коронарного кровотока и экстракции кислорода из артериальной коронарной крови, что составляет примерно 0,5 мл/мин/г., сердце в целом потребляет 150 мл/мин.
Таким образом, после внезапной остановки сердца резерв времени до начала необратимых изменений составляет (150мл/мин / 4,5мл/мин = 33 минуты. Это время и составляет продолжительность «клинической смерти сердца». По истечению этого времени наступают необратимые изменения в миокарде. Этот срок и определяет продолжительность реанимационных мероприятий.
В кардиохирургии различными методами удаётся продлить срок «клинической смерти сердца», чтобы в условиях искусственного кровообращения, после пережатия аорты в восходящей части, выполнить коррекцию пороков сердца.
Факторы, определяющие нагрузку на сердце
Физиология различает два вида гемодинамической нагрузки на желудочки сердца: пред- и постнагрузку.
Это нагрузка объёмом крови, которым заполняется полость желудочка перед началом изгнания. В клинической практике мерой преднагрузки является конечно-диастолическое давление (КДД) в полости желудочка (правого — КДДп, левого — КДДл). Это давление определяется только инвазивным методом. В норме КДДп = 4-7 мм Hg, КДДл = 5-12 мм Hg.
Для правого желудочка косвенным показателем может быть величина центрального венозного давления (ЦВД). Для левого желудочка очень информативным показателем может быть давление наполнения левого желудочка (ДНЛЖ), которое возможно определить неинвазивным (реографическим) методом.
К увеличению преднагрузки (справа или слева) любого происхождения желудочек приспосабливается к новым условиям работы по закону О.Франка и Е.Старлинга. Е.Старлинг так охарактеризовал эту закономерность: «ударный объём пропорционален конечному диастолическому объему»:
Суть закона состоит в том, что чем больше растягиваются мышечные волокна желудочка при его избыточном наполнении, тем больше сила их сокращения в последующую систолу.
Правомочность этого закона была подтверждена многочисленными исследованиями, даже на клеточном уровне (сила сокращения кардиомиоцита является функцией длины саркомера перед началом его сокращения). Главный вопрос в законе О.Франка и Е.Старлинга в том, почему сверхнормальное увеличение длины мышечного волокна увеличивает силу его сокращения?
Здесь уместно привести ответ Ф.З.Меерсона (1968 г.). Сила сокращения мышечного волокна определяется количеством актино-миозионовых связей, которые могут возникнуть в мышечном волокне одновременно. Удлинение волокна до определенного предела так меняет взаимное расположение актиновых и миозиновых нитей, что при сокращении возрастает либо количество актино-миозиновых связей (точнее скорость их образования), либо контрактильная сила, которую каждая такая связь развивает.
До какой границы (предела) действует приспособительная реакция О.Франка и Е.Старлинга, когда изменение длины волокна изменяет напряжение, а оно изменяет силу сокращения?
Этот закон действует, пока длина мышечного волокна увеличивается на 45% сверх обычной длины при нормальном заполнении желудочка (т.е. примерно в 1,5 раза). Дальнейший рост диастолического давления в желудочке увеличивает длину мышечного волокна в малой мере, т.к. волокна становятся трудно растяжимыми потому, что в процесс вовлекается трудно растяжимый соединительно-тканный эластический каркас самих волокон.
Ориентиром, контролируемым в клинических условиях, для правого желудочка может быть повышение ЦВД более 120 мм Н2О (норма 50-120). Это косвенный ориентир. Непосредственным ориентиром является повышение КДДп до 12 мм Hg. Ориентиром для левого желудочка является увеличение КДДл (ДНЛЖ) до 18 мм Hg. Иными словами, когда КДДп в пределах от 7 до 12 или КДДл в пределах от 12 до 18 мм Hg, то правый или левый желудочек уже работает по закону О.Франка и Е.Старлинга.
При приспособительной реакции О.Франка и Е.Старлинга, УО левого желудочка не зависит от диастолического артериального давления (ДАД) в аорте, а систолическое артериальное давление (САД) и ДАД в аорте не изменяются. Эту приспособительную реакцию сердца S.Sarnoff назвал гетерометрической регуляцией (heteros по греч. — другой; применительно к теме раздела — регуляция посредством другой длины волокна).
Надо отметить, что еще в 1882 г. Fick и в 1895 г. Blix отметили, что «закон сердца таков же, как закон скелетной мышцы, а именно, что механическая энергия, освобождающаяся при переходе из состояния покоя в состояние сокращения, зависит от площади «химически сокращающихся поверхностей», т.е. от длины мышечного волокна».
В желудочках, как и во всей сосудистой системе, какая-то часть объема крови является заполняющей и какая-то часть является растягивающей, она то и создает КДД.
Поскольку приспособительная реакция сердца, подчиняющаяся закону, имеет определенную границу, за которой этот закон О.Франка и Е.Старлинга уже не действует, то возникает вопрос: а можно ли усилить эффект этого закона? Ответ на этот вопрос имеет очень важное значение для врачей анестезистов и интенсивистов. В исследованиях E.H.Sonnenblick (1962-1965 г.г.) было установлено, что при чрезмерной преднагрузке миокард способен значительно увеличивать силу сокращения под воздействием положительно инотропных средств. Изменяя функциональные состояния миокарда посредством воздействия инотропных средств (Са, гликозиды, норадреналин, дофамин) при одном и том же притоке крови (одно и то же растяжение волокон), он получил целое семейство «кривых Е.Старлинга» со смещением кверху от исходной кривой (без действия инотропика).
Рисунок 4. График изменения кривой напряжения без инотропного средства и с ним при одинаковой длине мышечного волокна
Из рисунка 4 видно, что:
1. Увеличение напряжения (Т2) при использовании инотропного средства и неизменной исходной длине мышечного волокна (L1) за тот же отрезок времени (t1) связано с ускорением образования актиномиозиновых связей (V2 > V1);
2. С инотропным средством получается такой же эффект величины Т1, как и без него, за меньший отрезок времени — t2 ( 3 ).
3. С инотропным средством получаемый эффект величины Т1 достигается как бы при меньшей длине волокна L2 ( 3 ).
Обусловлено уменьшением притока крови в полость желудочка. Это может быть вследствии уменьшения ОЦК, сужения сосудов в МКК, сосудистой недостаточности, органических изменений в сердце (стеноз АВ — клапанов справа или слева).
Вначале включаются следующие приспособительные элементы:
1. Усиливается изгнание крови из предсердия в желудочек.
2. Увеличивается скорость расслабления желудочка, что способствует его заполнению, т.к. основная масса крови поступает в фазу быстрого наполнения.
3. Увеличивается скорость сокращения мышечных волокон и возрастания напряжения, благодаря чему поддерживается фракция изгнания и уменьшается остаточный объем крови в полости желудочка.
4. Увеличивается скорость изгнания крови из желудочков, что способствует сохранению продолжительности диастолы и заполнения желудочка кровью.
Если совокупность этих приспособительных элементов оказывается недостаточной, то развивается тахикардия, направленная на поддержание СВ.
Далее ход событий и их оценка известны.
Постнагрузка
Это нагрузка сопротивлением току крови при изгнании её из полости желудочка. В клинической практике мерой постнагрузки является величина общего легочного сопротивления (ОЛС) для МКК, равная в норме 150-350 дин*с*см-5, и общего периферического сосудистого сопротивления (ОПСС) для БКК, равная в норме 1200-1700 дин*с*см-5. Косвенным признаком изменения постнагрузки для левого желудочка может быть величина АДср, равная в норме 80-95 мм Hg.
Однако в физиологии классическим представлением о постнагрузке является давление над полулунными клапанами перед изгнанием крови желудочками. Иными словами это конечно-диастолическое давление над полулунными клапанами в легочной артерии и аорте. Естественно, чем больше периферическое сопротивление сосудов, тем больше конечно-диастолическое давление над полулунными клапанами.
Такая ситуация возникает при функциональном сужении артериальных периферических сосудов, хоть в МКК, хоть в БКК. Она может быть обусловлена органическими изменениями в сосудах (первичная лёгочная гипертензия или гипертоническая болезнь). Это может быть при сужении выходного отдела из правого или левого желудочка (подклапанные, клапанные стенозы).
Закон, по которому желудочек приспосабливается к нагрузке сопротивлением, впервые открыл Г.Анреп (1912г., лаборатория Е.Старлинга).
Дальнейшие исследования этого закона были продолжены самим Е.Старлингом и далее многими известными физиологами. Результаты каждого исследования были опорой и толчком к следующему.
Г. Анреп установил, что при увеличении сопротивления в аорте, вначале кратковременно объём сердца увеличивается (похоже на приспособительную реакцию О.Франка и Е.Старлинга). Однако затем объём сердца постепенно уменьшается до новой, больше исходной, величины и далее остается стабильным. При этом, несмотря на увеличение сопротивления в аорте, УО остается прежним.
Приспособительную реакцию сердца по закону Г. Анрепа и А. Хилла при увеличении нагрузки сопротивлением Ф.З.Меерсон объясняет следующим образом (1968 г.): по мере повышения нагрузки сопротивлением количество актиномиозиновых связей увеличивается. А количество свободных центров, способных реагировать между собой, в актиновых и миозиновых волокнах уменьшается. Поэтому с каждой, всё большей, нагрузкой количество вновь образующихся актиномиозиновых связей уменьшается в единицу времени.
Одновременно уменьшается и скорость сокращения, и количество механической и тепловой энергии, освобождающейся при распаде актиномиозиновых связей, постепенно приближаясь к нулю.
Очень важно, что количество актиномиозиновых связей увеличивается, а их распад уменьшается. Это означает, что с увеличением нагрузки наступает пересократимость актиномиозиновых волокон, что и ограничивает эффективность работы сердца.
Итак, когда нагрузка сопротивлением увеличивается на 40-50%, адекватно ей увеличивается мощность и сила мышечного сокращения. При большем увеличении нагрузки эффективность этой приспособительной реакции утрачивается из-за потери мышцей способности расслабляться.
Другим фактором, со временем ограничивающим эту приспособительную реакцию, является, как было установлено Ф.З.Меерсоном и его сотрудниками (1968 г.), снижение сопряжения окисления и фосфорилирования на 27-28% на участке – «цитохром с» — «кислород», при этом в миокарде уменьшается количество АТФ и особенно креатинфосфата (КФ).
Значит, закон Г. Анрепа и А. Хилла обеспечивает приспособление сердечной мышцы к нагрузке сопротивлением путём увеличения мощности желудочка, приводящей к увеличению силы сокращения без изменения исходной длины мышечного волокна.
Приспособительную реакцию Г. Анрепа и А. Хилла S.Sarnoff назвал гомеометрической регуляцией (homoios по греч. — подобный; применительно к теме раздела — регуляция посредством такой же длины волокна).
Здесь также важен вопрос: можно ли усилить эффект закона Г. Анрепа и А. Хилла? Исследования E.H. Sonnenblick (1962-1965 г.г.) показали, что при чрезмерной постнагрузке миокард способен увеличивать мощность, скорость и силу сокращения под воздействием положительно инотропных средств.
Уменьшение постнагрузки.
Связано с уменьшением давления над полулунными клапанами. При нормальном ОЦК уменьшение постнагрузки становится возможным только при единственном обстоятельстве — при увеличении объема сосудистого русла, т.е. при сосудистой недостаточности.
Уменьшение давления над полулунными клапанами способствует укорочению периода повышения внутрижелудочкового давления и уменьшению самой величины этого давления перед началом изгнания крови. Это уменьшает потребность миокарда в кислороде и его энергозатраты на напряжение.
Однако все это уменьшает линейную и объемную скорость кровотока. В связи с этим уменьшается и венозный возврат, что ухудшает наполнение желудочков. В таких условиях единственно возможной приспособительной реакцией становится увеличение ЧСС, направленное на поддержание СВ. Как только тахикардия станет сопровождаться снижением СВ, эта приспособительная реакция переходит в разряд патологической.
Совокупность всех исследований, выполненных О.Франком, Е.Старлингом, Г.Анрепом, А.Хиллом и другими физиологами того периода позволила выделить два варианта сокращения сердечного волокна: изотоническое и изометрическое сокращения.
В соответствии с этим выделены два варианта работы желудочков сердца.
1. Когда желудочек работает преимущественно с нагрузкой по объему — он работает по варианту изотонического сокращения. При этом тонус мышцы изменяется в меньшей мере (изотония), преимущественно изменяется длина и поперечное сечение мышцы.
2. Когда желудочек работает преимущественно с нагрузкой по сопротивлению — он работает по варианту изометрического сокращения. При этом преимущественно изменяется напряжение мышцы (тонус), а её длина и поперечное сечение изменяются в меньшей мере или почти не изменяются (изометрия).
При работе желудочка с нагрузкой по сопротивлению (даже при функциональном изменении ОЛС или ОПСС) многократно увеличивается потребность миокарда в кислороде. Поэтому исключительно важным является обеспечение такого больного в первую очередь кислородом.
Врачам нередко приходится усиливать работу сердца инотропными средствами. В физиологии кровообращения (в т.ч. и клинической) под инотропизмом понимается (Ф.З. Меерсон, 1968 г.) регулирование скорости сокращения и расслабления, и поэтому мощности и эффективности работы сердца при неизменных размерах желудочка.
Инотропизм направлен не на сверхнормальное увеличение силы сокращений сердца, а на поддержание силы сокращений, в лучшем случае близкой к норме.
Инотропизм отличается от закона О.Франка и Е.Старлинга тем, что при этом не изменяется исходная длина волокон миокарда. Он отличается от закона Г. Анрепа и А. Хилла тем, что при этом увеличивается не только скорость сокращения, но и (главное!) скорость расслабления волокон миокарда (чем предупреждается пересократимость, или контрактура, миокарда).
Однако при искусственной инотропной регуляции работы сердца норадреналином и др. аналогичными средствами может быть серьезная опасность. Если резко и значительно уменьшить введение инотропного средства или прекратить введение его, то может резко снизиться тонус миокарда.
Возникает острая тоногенная дилатация желудочка. Его полость увеличивается, резко снижается внутрижелудочковое давление. В этих условиях, чтобы достигнуть прежней величины напряжения необходимы большие затраты энергии.
Процесс наращивания напряжения является самым главным потребителем энергии в сердечном цикле. Кроме того, он идет в первую очередь. В физиологии существует закон, что первый процесс всегда старается как можно полнее использовать наличную энергию, чтобы завершить его целиком и полностью. Остаток энергии расходуется на выполнение следующего процесса и т.д. (т.е. каждый предыдущий процесс как Людовик XV: «после нас хоть потоп»).
За процессом увеличения напряжения идет работа по перемещению крови из желудочков в сосуды. Из-за того, что на напряжение затрачивается почти вся наличная энергия, а на изгнание ее недостает, от напряжения начинает отставать работа желудочков по перемещению крови. В результате общая эффективность сердца снижается. С каждым таким неполноценным сокращением прогрессивно увеличивается остаточный объем крови в полости желудочка и, в конце концов, наступает асистолия.
Каппиляры
Главный интерес к капиллярам связан с тем, что в них происходит обмен между кровью и интерстициальной жидкостью. У среднего человека имеется примерно 40 млд. капилляров. Эффективная обменная поверхность капилляров составляет в сумме примерно 1000 м2. Плотность капилляров в различных органах не одинакова. Она больше «средней» (усредненной) величины в 4-5 раз в головном мозге, миокарде, почках. Это значит, что при нарушениях микроциркуляции в жизненно важных органах вероятность возникновения их отека увеличивается. Относительно «средней» величины плотность капилляров меньше в костной, соединительной и жировой ткани.
Функциональной или обменной единицей считается совокупность сосудов от артериол до венул. Общая длина функциональной единицы составляет примерно 750 мкм.
Различают 3 типа капилляров:
1 тип. С непрерывной стенкой. Образованы слоем эндотелиальных клеток, в мембранах которых имеются мельчайшие поры диаметром 4-5 нм. Этот тип капилляров преобладает в сосудах легких, мышечной, соединительной и жировой ткани.
2 тип. С фенестрированной стенкой. Между эндотелиальными клетками имеются фенестры — «окошки» диаметром 0,1 мкм. Часто фенестры прикрыты тончайшей мембраной («окошки застеклены»). Этот тип капилляров преобладает в слизистой кишечника, клубочках почек (где осуществляется фильтрация).
3 тип. С прерывистой стенкой, в которой эндотелиальные клетки, прерываясь, образуют просветы. Через просветы могут проходить даже клетки крови. Этот тип капилляров имеется в синусоидах печени, селезенки, костном мозге.
Рисунок 5. Схема капилляра
Кроме того, крупные молекулы могут переноситься через капиллярную стенку путем пино- и эмиоцитоза. Подошедшую молекулу эндотелиальная клетка «обнимает», поглощает в протоплазму (пиноцитоз) и, переместив к другой части клетки «выталкивает» (эмиоцитоз). Обмен в капиллярах осуществляется в основном благодаря диффузии, а также фильтрации и реабсорбции.
Диффузия в капиллярах описывается уравнением Фика. Скорость диффузии очень велика. При движении по функциональной единице капилляра жидкость плазмы успевает 40 раз обменяться с жидкостью межклеточного пространства. Иными словами при общей длине функциональной единицы капилляра в 750 мкм (/40) через каждые примерно 19 мкм стоит как «регулировщик движения» закон Фика, который меняет вектор направления жидкости то в одну, то в противоположную сторону.
Благодаря этому происходит непрерывный обмен жидкостей. Через общую эффективную обменную поверхность перемешивается таким образом 60 л. жидкости в минуту, 85000 л. жидкости в сутки (85000 примерно 85000 кг., 85 тонн!).
Фильтрация и реабсорбция в капиллярах описывается уравнением Старлинга. Их интенсивность определяется гидростатическим давлением в капилляре (Ргк), гидростатическим давлением в тканевой жидкости (Ргт), онкотическим давлением плазмы в капилляре (Рок), онкотическим давлением в тканевой жидкости (Рот) и коэффициентом фильтрации (К). К — соответствует проницаемости капиллярной стенки для изотонических растворов: 1 мл жидкости в 1 мин. на 100 г. ткани при Т 37оС:
В норме во всех капиллярах скорость фильтрации составляет примерно 14 мл/мин или 20 л/сут; скорость реабсорбции составляет примерно 12,5 мл/мин или 18 л/сут. Около 2 л/сут оттекает из интерстициального пространства по лимфатическим сосудам и впадает в правое предсердие, дополняя таким образом объем жидкости в сосудистом русле.
На сегодня физиологи пересматривают вышеизложенный механизм транскапиллярного обмена. Возможно, что в норме нет ни интенсивной фильтрации, ни интенсивной абсорбции воды и обмен ионами и метаболитами осуществляется за счет концентрационной разницы. Фильтрация или абсорбция — только медленно стабилизирующие или аварийный механизм, срабатывающий только при изменении осмолярности или кровопотере, и возможный объем аварийного обмена в единицу времени неизвестен.
Реология крови
Кроме перечисленных законов, которым подчиняется движение крови по сосудам, оно подчиняется также законам реологии. Реология — это наука о течении и деформациях. Она рассматривает механическое поведение различных материалов, если в процессе течения и деформации материал проявляет не менее двух из трех основных свойств: вязкость (свойство обратное текучести), пластичность, упругость. В реологии гемореология представляется как частный
вариант реологии.
Кровь обладает по меньшей мере двумя свойствами: вязкостью и пластичностью. Поэтому кровь относят к нелинейно-вязкопластичной среде. Это означает, что главной особенностью такой среды является сочетание переменной вязкости с пластичностью. При этом переменная вязкость зависит от скорости деформации (скорости течения жидкости). Вязкость — это свойство жидкости, сдерживающее ее течение или перемещение.
Таким образом, реологические свойства крови обусловлены тремя главными показателями: вязкостью крови, количеством частиц в крови (форменных элементов, крупных молекул) и скоростью потока крови.
На реологические свойства крови влияют многие факторы:
— Внешней среды (главный — температура): при ↑ Т — вязкость крови и плазмы ↓.
— Взаимодействие (главный — скорость кровотока): при↓ V — вязкость крови ↑, способность к агрегации ↑.
— Плазменные:
↑ гамма-глобулина, фибриногена, жирных кислот, триглицеридов, холестерина — ↑ вязкость крови.
— рН крови независимо от направления — ↑ вязкость крови (ацидоз — разбухание, алкалоз — сморщивание эритроцитов).
Под синдромом повышенной вязкости принято понимать комплекс изменений реологических свойств крови. Комплекс изменений составляют:
1) повышение вязкости плазмы и крови (косвенно — время свёртываемости крови);
2) увеличение гематокрита (Ht);
3) усиление склонности к агрегации (косвенно СОЭ);
4) уменьшение пластичности (или деформируемости) эритроцитов (косвенно pH),
5) увеличение концентрации фибриногена.
Иногда с целью улучшения микроциркуляции приходиться разбавлять кровь. А.Н. Филатовым и Ф.В. Баллюзеком (1972) установлено, что при патологических состояниях, требующих гемодилюции, наиболее оптимальным является разбавление (или разведение) крови на 30 %, что случайно совпадает с гематокритом 30-31 %.
При большем разведении и хорошей скорости потока увеличивается вероятность перехода ламинарного потока в турбулентный вследствие «кувыркания» форменных элементов и крупных частиц крови. Кроме того, избыточная гемодилюция изменяет концентрацию факторов свёртывающей системы крови, что опасно повышенной кровоточивостью.
Регуляция кровообращения
1. Регуляция местного кровотока
а) Электролитные изменения в клетках эндотелия, эластических и мышечных волокнах оказывают влияние на базальный тонус сосудов.
Накопление Nа внутри клеток эндотелия и отек их (с увеличением высоты клеток направленным внутрь сосуда) уменьшают внутренний диаметр сосуда, величину кровотока, увеличивают сосудистое сопротивление. Направление Mg в мышечных волокнах и вытеснение им Са в соответствии с законом Шайна
уменьшает напряжение мышечных волокон, сопротивление сосудов, увеличивает их внутренний диаметр, кровоток.
б) Метаболические факторы: АТФ, АДФ, АМФ, особенно аденозин и молочная кислота, а также накопление Н+ оказывают выраженное местное сосудорасширяющее действие.
2. Нейрогуморальная регуляция.
При этой регуляции импульсы с афферентных волокон на эфферентные переключаются в сосудодвигательных центрах продолговатого мозга.
С этим видом регуляции связывают:
— механизмы кратковременного действия;
— механизмы промежуточного действия;
— механизмы длительного действия.
1) К механизмам кратковременного действия относят:
а) барорецепторные рефлексы;
б) хеморецепторные рефлексы:
в) рефлекс на ишемию ЦНС.
Все эти рефлексы могут реализовываться в течение нескольких секунд. Однако при постоянном раздражении (в течение нескольких дней) они либо полностью исчезают (барорецепторные рефлексы), либо ослабевают (хеморецепторные рефлексы, рефлекс на ишемию ЦНС).
Барорецепторные рефлексы.
А) Это рефлексы с аорты и ее верхних ветвей.
Рецепторы, активизирующие эти рефлексы, расположены в стенке дуги аорты (связаны с левым депрессорным нервом), плечеголовного ствола и общих сонных артерий (связаны с правым и левым депрессорным нервом), в каротидном синусе (связаны с правым и левым синокаротидным нервом).
Депрессорные нервы связаны с Х парой, а синокаротидные нервы с IX парой черепно-мозговых нервов.
Рецепторы возбуждаются при увеличении напряжения и растяжения стенки сосуда при повышении внутрисосудистого давления или механическом воздействии (хирургические манипуляции). Частота импульсов с этих рецепторов прямо пропорциональна изменению систолического артериального давления (САД) от 80 до 180 ммНg. Импульсы поступают к сосудодвигательному и кардио-депрессному центрам. При этом тормозятся симпатические и возбуждаются парасимпатические центры, уменьшается сужение сосудов преимущественно скелетных мышц, а также сила и частота сердечных сокращений.
Барорецепторы обладают свойством адаптироваться к повышенному давлению. Однако при этом их функция не нарушается, то есть при еще большем повышении давления они реагируют, по окончанию их раздражения давление возвращается не на исходный, а на предыдущий, уровень и т.д.
Б) Это рефлексы с крупных вен и предсердий.
Рецепторы расположены в стенке около устья вен и в стенке обоих предсердий. Различают два типа рецепторов:
— А-типа возбуждаются при сокращении предсердий и усиливают влияние симпатического отдела нервной системы. При усилении напряжения и растяжения стенки предсердия, обусловленные его перегрузкой объемом крови, при сокращении предсердия часто (но не всегда) возникает приступ тахикардии — рефлекс Бейнбриджа.
— В-типа возбуждаются при чрезмерном растяжении предсердия до начала его сокращения. При этом усиливается влияние парасимпатического отдела сосудодвигательного центра, которое приводит к брадикардии. Одновременно с ней (особенность реакции) возникает сужение сосудов почек. Кроме всего этого, раздражение рецепторов крупных вен и предсердий через центры осморегуляции в гипоталамусе уменьшает секрецию гормона вазопрессина.
Рефлексы с артериальных хеморецепторов.
Они расположены в дуге аорты, синокаротидных зонах. Их раздражителями являются снижение напряжения кислорода в артериальной крови (РаО2) и повышение напряжения углекислоты (РаСО2) или увеличение концентрации Н+ в артериальной крови. От этих рецепторов импульсы поступают и в сосудодвигательный, и в дыхательный центры в продолговатом мозге. В итоге возникают прямо противоположные реакции. Если исключить влияние изменения механики дыхания на кровообращение посредством ИВЛ, то возбуждение хеморецепторов приводит к сужению сосудов и уменьшению ЧСС.
При этом эффект сужения сосудов преобладает над эффектом уменьшения ЧСС.
Заключается в возбуждении сосудодвигательного центра продолговатого мозга. Она сопровождается сужением сосудов и повышением АД. Она возникает при снижении кровоснабжения головного мозга, нарушениях при сосудистой патологии головного мозга, при снижении содержания кислорода в артериальной крови и повышении содержания СО2 и Н+.
При этом повышение содержания СО2 и Н+ возбуждает центры продолговатого мозга либо через ретикулярную формацию, либо путем раздражения внеклеточно расположенными Н+ хеморецепторов поверхности ствола мозга (увеличение кислотности ликвора). Эта реакция (по наблюдениям у пилотов) кратковременна и быстро становится не эффективной при не устранении причины.
2). К механизмам промежуточного действия относят:
а) Изменения транскапиллярного обмена;
б) Реакцию ренин-ангиотензивной системы;
в) Релаксацию напряжения.
Последнее мало известно врачам.
Различают прямую релаксацию напряжения. Суть её состоит в следующем: при внезапном увеличении объёма крови в сосуде, давление крови вначале резко повышается. При этом эластические волокна сосуда растягиваются, а мышечные волокна сокращаются. Затем, хотя объём крови в сосуде не изменяется и эластические волокна остаются в прежнем состоянии, мышечные волокна расслабляются, приводя свой тонус в соответствие со степенью растяжения эластических волокон. Давление в сосуде понижается.
Различают обратную релаксацию напряжения. При внезапном снижении объёма крови в сосуде давление крови вначале резко понижается. При этом усиливается напряжение эластических волокон сосуда, а мышечные волокна расслабляются. Затем хотя объём крови в сосуде не изменяется и эластические волокна остаются в прежнем состоянии, мышечные волокна сокращаются, приводя свой тонус в соответствие со степенью напряжения эластических волокон. Давление в сосуде повышается.
3). Механизмы длительного действия касаются регуляции связи:
внутрисосудистый объём — ёмкость сосудистой системы — внеклеточный объём жидкости. Эта сложная регуляция осуществляется посредством:
а) почечной регуляции объема жидкости;
б) вазопрессина;
в) альдостерона.
В центральной регуляции кровообращения выделяют три уровня регуляции:
В ретикулярной формации продолговатого мозга, бульбарных отделах моста имеются образования, объединяющиеся в так называемые медуллярные и ромбэнцефальные центры. От них начинаются симпатические сосудосуживающие, сердечные положительно хроно- и инотропные нервы. Здесь же берёт начало блуждающий нерв.
2. «Центры» гипоталамуса.
В каудальных отделах «эрготропные зоны». Раздражение сопровождается ↑ АД, ↑ ЧСС, ↑ СВ, ↑ активности других отделов ЦНС, вызывающих «состояние тревоги» (возбуждение и настороженность) и в крайних случаях — ярость, агрессию, страх.
В ростральных отделах располагаются «трофотропные зоны». Раздражение сопровождается торможением сердечно-сосудистой системы и реакциями внутренних органов, способствующими восстановлению организма (потребление и переваривание пищи, активизируются меридианы: желудка — поджелудочной железы — селезенки, тонкого кишечника — сердца, печени — желчного пузыря).
Здесь две области:
А. Палеокортекс: медиальные поверхности полушарий и базальные поверхности лобных и теменных долей. Их раздражение вызывает разнонаправленные сердечно-сосудистые реакции (прессорные, депрессорные).
Б. Неокортекс: наружная поверхность полушарий, особенно премоторная и моторная зоны. Их раздражение вызывает также разнонаправленные сердечно-
сосудистые реакции (прессорные, депрессорные). Преимущественно прессорные. При раздражении двигательных зон возникает «состояние тревоги», но без аффективных проявлений (без ярости, агрессии, страха). В целом исследования центральной регуляции кровообращения труднодоступны, поэтому мало изучены.
Определение показателей центральной гемодинамики
Чтобы определить величину ИПК и ИПО2 необходимо знать величину сердечного индекса (СИ). Чтобы знать величину СИ, надо определить величину СВ (т.е. МСВ) или УО (УСВ). К настоящему времени предложено более 30 методов определения величины СВ или УО. Из них наиболее главными считаются следующие:
1. Основан на принципе A.Fick. Метод, основанный на принципе или гемодинамическом законе A.Fick исторически признан эталонным. Для специальности анестезия и интенсивная терапия методически он ценен тем, что его можно многократно использовать у одного и того же больного. Однако практически он пока считается достаточно трудоёмким.
2. Метод гемодилюции, предложенный W.F.Hamilton в 1928 г. Мало пригоден для отделения интенсивной терапии, так как обладает эффектом накопления вводимого в вену вещества (краситель), поэтому при повторном использовании метода у того же больного еще не выведенная часть вещества будет влиять на точность измерения. Разновидностью этого метода является радиологический метод.
3. Метод термодилюции, предложенный в 1968г. M.A.Brauthweite, K.D.Bredley и усовершенствованный в 1971-1972 гг. W.Ganz, H.Swan. Это инвазивный метод, требующий введения многоканального катетера так, чтобы окончание одного канала было в полости правого предсердия, а другого (с высокоточным термистором в конце) — в легочной артерии. Кроме специального катетера в комплекс входит прибор, регистрирующий изменение температуры крови после введения «навески» раствора в правое предсердие, и рассчитывающий величину СВ. Метод многократный, так как не обладает эффектом накопления. При соблюдении технологии использования достаточно точный, по сравнению с методом, основанным на принципе A.Fick. Но требует определенных умений, пока всё ещё дорогостоящий, немаловажно и то, что он инвазивный. В целом он считается опасным и неприемлимым для большинства больниц.
4. Электрофизиологические методы: эхо-кардиографический, доплер-кардиографический, импедансный или реографический. В этой группе методов наибольшей точностью обладает реографический. Он наименее дорогостоящий, неинвазивный, его можно использовать многократно у одного и того же больного. Этот метод доступен для отделения интенсивной терапии больницы любой мощности. Даже в США, где наибольшее распространение получил метод термодилюции, начинает обосновываться предпочтение импедансному методу.
Этим методом можно определить УО с ошибкой не более 10%, что приемлемо для клиники. Следует отметить, что один их наиболее распространенных методов (термодилюции) позволяет определить величину СВ, второй (импедансный или реографический) — величину УО. Исходя из их величин можно получить величины других показателей центральной гемодинамики, которые именуются производными от СВ или от УО.
Итак, посредством ипедансного метода определили величину УО в см3. Далее можно определить величины следующих показателей.
СВ (МСВ) = УО * ЧСС в см3/мин.
Этот показатель принято описывать в л/мин (после деления произведения на 1000). Надо отметить, что этот классический показатель сам по себе не обладает достаточной информативностью (рисунок 6)
Рисунок 6 — Информативность МСВ (СВ).
Из рисунка видно, что при нормальных величинах ЧСС (Х1) и УСВ (УО) (У1) мы имеем нормальную величину СВ (это площадь прямоугольника). Такую же площадь прямоугольника (такую же величину СВ) можно получить при брадикардии (Х2) с увеличенным УО (У2) и при выраженной тахикардии (Х3) со сниженным УО (У3). Все это качественно различные состояния организма, хотя во всех случаях СВ одинаков (площади всех трёх прямоугольников равны друг другу).
Из СВ исходит другой показатель – объёмный поток крови (ОПК):
ОПК = СВ см3/мин / 60 с в см3/с
Видимо не совсем полная удовлетворенность МСВ заставила клиницистов ввести (Kirklin, 1948 г.) другой показатель — СИ.
СИ = СВ / S в л/мин/м2
где S — площадь тела человека в м2, ее можно определить по номограмме Дюбуа или Оркина, можно вычислить: S = m 0,423 * l 0,725 * 0,007184 (где: m — масса тела человека в кг., l — рост человека в м.).
Где АДср или СДД – среднединамическое давление определяется как 1/3*(САД-ДАД)+ДАД).
В соответствии с уравнением Л.З. Полонецкого (1985 г.) можно определить давление наполнения левого желудочка.
ДНЛЖ = 742 * Тр — 19 в мм Hg,
где: Тр — период расслабления левого желудочка в секунду (определяется из реограммы).
В.И.Лищук в соответствии с уравнениями Е.Старлинга ввел такие показатели, как насосный коэффициент (НК) левого (НКл) и правого (НКп) желудочков для характеристики производительности каждого желудочка как насоса.
НКл = СИ / ДНЛЖ *10 в Г*см/с.
Аналогично можно получить приближенное к классическому виду уравнение:
НКп = СИ / ЦВД *10 в Г*см/с.
В связи с тем, что известна величина СИ и, следовательно, величина ИПО2, становится возможным объективно определить энергетические возможности больного (ЭВБ), исходя из величины его аэробных способностей (ИПО2): ЭВБ = 7,2 * ИПО2 * S в ккал/сут.
Дело в том, что тяжелым больным с целью обеспечения их энергией назначаются средства, имеющие соответствующую калорическую ценность (глюкоза и т.д.). При их назначении обычно исходят из того, что в условиях основного обмена (то есть когда человек в покое и не выполняет никакой физической нагрузки) энергетические потребности организма (в среднем) составляют приблизительно 1800-2000 ккал/сут. В соответствии с этим подбирается количество и состав «питательных» растворов, которые вводятся больному в вену или через зонд в желудочно-кишечный тракт. Все это правильно, но с затаившейся ошибкой. Назначенные растворы являются всего лишь энергоносителями и не более. Чтобы из энергоносителя получить энергию, энергоноситель надо окислить (сжечь). Однако никто не определяет и не вычисляет: хватит ли фактически потребляемого больным кислорода на окисление
назначенного количества энергоносителей? Если количество назначенных энергоносителей будет избыточным, то организм постарается в лучшем случае вывести избыточную часть энергоносителей. В худшем случае введенные энергоносители из-за недостатка окислителя (кислорода) окислятся до промежуточных продуктов. А это, как правило, кислоты. Они и становятся дополнительной причиной метаболического ацидоза у больного. Из этого можно сделать очень важный вывод: при гипоксемии энтеральное или особенно парэнтеральное питание неэффективно и может наносить вред!
Принято классифицировать варианты центральной гемодинамики исходя из величины СИ и ОПСС. Используя наиболее удачное название каждого варианта, приводим эту классификацию.
|
Вариант центральной гемодинамики |
СИ в л/мин/м2 |
ОПСС дин*с*см-5 |
|
>4 3 — 4 <3 |
↓ нормы 1200-1700 ↑ нормы |
В более поздних публикациях часто используются другие названия этих вариантов кровообращения – гиперкинетический, нормо- или эукинетический и гипокинетический.
В некоторых клинических ситуациях, в зависимости от эффективности работы сердца, могут наблюдаться неклассические варианты кровообращения.
Например, при гипертоническом кризе – при первичном повышении ОПСС и достаточной мощности сердца, СИ может быть нормальным или повышенным.
Однако, будет иметь место гипоперфузия – гипоциркуляция с повышенной постнагрузкой и, по нашему мнению, такой вариант кровообращения следует относить к гипоциркуляторному. Поэтому и термины «–кинетический» не совсем соответствуют предлагаемой классификации.
Клиническая диагностика вариантов кровообращения
Для врача чрезвычайно важно дифференцировать вариант кровообращения у тяжёлого больного. Однако не всегда и не везде есть возможность определения параметров ЦГ. Поэтому очень важно уметь по клиническим признакам определить состояние кровообращения.
Очень просто написать, что у больного есть сердечно-сосудистая недостаточность (более точно – дисфункция), сложнее обосновать это утверждение, оценить степень компенсации и уточнить что превалирует – сердечная или сосудистая недостаточность (дисфункция). Термин дисфункция более применим в практике интенсивной терапии, т.к. гипертонический криз нелогично называть недостаточностью, хотя он и приводит к её развитию.
Клинические признаки дисфункции сердечно-сосудистой системы:
— Предположить наличие сердечно-сосудистой дисфункции можно, в первую очередь, на основании ненормальных АД, ЧСС, ЦВД. Однако нормальные величины этих показателей могут быть и при наличии скрытых – ещё компенсированных нарушений.
— Состояние кожных покровов – холодные или горячие — являются признаком изменённого сосудистого тонуса.
— Диурез – снижение или повышение мочеотделения также могут быть признаком дисфункции кровообращения.
— Наличие отеков и влажных хрипов в лёгких.
Функциональные показатели для оценки состояния кровообращения.
— Физиологический прирост АД к ЧСС – в норме зависимость величины САД от ЧСС отражается следующим уравнением:
САД = ЧСС + 40(±10)
Это значит, что при ЧСС 80 в минуту САД должно быть от 110 до 130 мм рт.ст.
Соответственно при ЧСС 120 в минуту САД должно быть как минимум 150 мм рт.ст.
— Индексы кровообращения (индексы Туркина). Первый из них определяется отношением СДД и ЧСС. Если это отношение равно 1 или близко к 1 (0,9-1,1), то СВ в норме. Второй определяется отношением СДД в мм рт.ст и ЦВД в мм вод.ст. Если это отношение равно 1 или близко к 1 (0,9-1,1), то артериальные и
венозные потоки крови равны.
Исходя из этих положений можно выявить, и на основании имеющихся данных необходимо попытаться диферинцировать вид дисфункции сердечно- сосудистой системы. Главное попытаться, а не просто констатировать клинические данные.
Гипоциркуляторный вариант кровообращения
Наиболее распространённый в практике интенсивной терапии. Характерен для «холодных» шоков (централизация), потерь жидкости, сердечной недостаточности, стресса. Опасен повышенной постнагрузкой и увеличением потребности в кислороде сердца. Клинически может проявляться отсутствием прироста САД к ЧСС при холодных кожных покровах. При этом САД может быть нормальным или сниженным, обычно на фоне тахикардии.
При гипертоническом кризе и высоком АД, кожные покровы могут быть и тёплыми.
Опасность этого варианта кровообращения не только в дисбалансе между высокой нагрузкой на сердце и его возможностями (у больных с скомпроментированным сердцем возможна декомпенсация), но и в том, что при гиперкоагуляции и длительном периоде централизации возможен необратимый блок микроциркуляции – патогенетическая основа развития полиорганной недостаточности.
Уровень САД можно считать критерием наличия или отсутствия сердечной недостаточности: если при повышенной постнагрузке (ОПСС>1700) и холодных кожных покровах отсутствует физиологический прирост САД к ЧСС, то однозначно имеет место сердечная недостаточность – сердце не способно продавливать кровь через спазмированную периферию с достаточной силой. Подтверждением наличия сердечной недостаточности является нормальное или повышенное ЦВД.
Если сердце способно прокачать повышенную постнагрузку, то САД повышено (гипертонический криз) и потребность миокарда в кислороде высокая. Величина ЦВД будет зависеть от ЧСС и волемии. При тахикардии нормальное или повышенное ЦВД сигнализирует о скорой декомпенсации.
Особенно «опасны» больные, имеющие отеки и нарушения ВСО. При контроле сатурации плетизмограмма имеет низкую амплитуду, особенно при низком АД.
В любом случае – первоочередная задача врача – устранить причину повышенной постнагрузки и нормализовать ОПСС — снизить его, используя вазодилятаторы: изокет, магнезию, β-блокаторы, ганглиоблокаторы.
Применение вазодилятаторов на фоне низкого давления выглядит «не логичным и опасным». Но в этом есть патогенетическая логика – уменьшить нагрузку и дать сердцу развить возможную мощность, так же как логично разгрузить машину, чтобы она заехала на гору. Необходимо понимать, что при гипоциркуляции (и так повышенном ОПСС) введение вазопрессоров с целью поднять давление – кривая и тупая «логика», свойственная безграмотным врачам, не знающим патофизиологию. При такой тактике машину еще больше загружают, что неизбежно приводит к перегреву и остановке двигателя, его поломке, а применительно к сердцу – к смерти больного.
Для уточнения наличия этого варианта нарушения кровообращения можно провести пробу с магнезией или изокетом. Магнезию (при отсутствии противопоказаний – см.инструкцию по применению) вводят в количестве 5-10 мл болюсно в/в, контролируя ЧСС и АД. Изокет – 0,5мл 0,1% р-ра разводят до 20 мл физ.р-ром и вводят в/в 0,5-1мл под контролем ЧСС и АД. Проба считается положительной, если на фоне введения магнезии или изокета ЧСС уменьшается, а АД приближается к норме – исходно сниженное поднимается, а исходно повышенное снижается, улучшается состояние и кожных покровов.
На фоне стресса обязательно применение седативных или обезболивающих препаратов. При отсутствии артериальной гипертензии обязательно введение кардиотоника – дофамина в почечной или кардиотонической дозировке. Мочегонные препараты только при признаках гипергидратации – при наличии отёков и гемодилюции, и то после снижения постнагрузки и стабилизации АД. Очень частая ошибка терапевтов и невропатологов – применение мочегонных при ОКС, гипертонических кризах и инсультах на фоне гемоконцентрации – данная тактика только ухудшает состояние больных за счёт ухудшения реологии крови и свидетельствует о полном непонимании патогенеза критических состояний.
Вопрос о необходимости объемной инфузии решают, ориентируясь на:
— наличие потерь жидкости или крови (плазмы), особенно острых-быстрых, предшествующих развитию критического состояния;
— комплексные признаки дегидратации – гемоконцентрация, снижение тургора и сухость кожных покровов, языка;
— низкое ЦВД или его снижение после начала вазодилятационной терапии;
— снижение артерио-венозной разницы по кислороду и увеличение лактата за счет нарушения капиллярной перфузии.
— пробу на инфузию – быстро (10-20мл в минуту) вводят 200-400мл физ.р-ра под контролем ЧСС и АД. Если при этом уменьшается тахикардия и нормализуется АД, то это говорит в пользу объемной инфузии.
Проведение объёмной инфузии при отсутствии вышеперечисленного комплекса клинических и лабораторных признаков или до начала вазодилятации приведет к выдавливанию всей инфузии в интерстиций. При наличии признаков нормо- и гипергидратации объёмная инфузия не показана, так как необходимо вернуть жидкость из интерстиция в сосудистое русло, а не продолжать его переполнять. Необходимо понять, что сосуды не «резиновые», чтобы воспринимать объемную инфузию и вмещать ее без предварительного изменения тонуса – нужно сначала расслабить артериолы, увеличить количество функционирующих каппиляров, т.е. увеличить емкость «сосудистого вместилища». Резервная емкость венозной системы определяется изменением конфигурации вен из «сплющенных» до округлых и ориентировочно составляет не более 800-1000мл у взрослого человека и не может оправдать инфузионную терапию в несколько литров.
Нормоциркуляторный вариант кровообращения
Чаще всего свидетельствует о нормальном функционировании ССС. Однако при разной производительности сердца при разных условиях, но при нормальном ОПСС может быть и выраженная дисфункция ССС. Например, если достаточная производительность сердца и достаточный уровень АД поддерживается за счет тахикардии. Могут наблюдаться и клинические варианты, когда может иметь место артериальная гипотония или гипертензия на фоне любых нарушений ритма. В этих случаях имеет место отсутствие физиологического прироста АД к ЧСС, или его избыточный прирост. Состояние кожных покровов зависит от уровня АД.
Тактика коррекции будет зависеть от первопричины, которую необходимо устранить в первую очередь, и вида нарушений ритма. Необходимо учитывать воздействие на ОПСС препаратов, которые решено применять для лечения, чтобы не усугубить гемодинамическую ситуацию.
Гиперциркуляторный вариант кровообращения
Патологический вариант кровообращения, более «легкий» для сердца, но чрезвычайно опасный, т.к. обычно развивается на фоне нарушения регуляторных механизмов сосудистого тонуса, связанных с тяжелыми нарушениями КЩС, ВСО, интоксикацией или выраженной дисфункцией ЦНС или надпочечников. Этот вариант кровообращения сопровождает анафилаксию, септический шок.
Опасен снижением скорости кровотока, особенно на фоне гиперкоагуляции (ДВС синдрома), когда развиваются массивные генерализованные микротромбозы, блокирующие микроциркуляцию во всех органах и приводящие к необратимой полиорганной недостаточности. Также, за счет снижения скорости кровотока, уменьшается доставка кислорода к тканям, прогрессирует метаболический ацидоз, что еще больше нарушает регуляцию сосудистого тонуса. В конечном итоге, за счет блока микроциркуляции и повышения ОПСС, гиперциркуляция сменяется гипоциркуляцией, предвещая печальный исход.
Клинически характеризуется хорошим периферическим кровотоком даже при низком АД. Сопровождается компенсаторной тахикардией и высокой амплитудой плетизмограммы при контроле сатурации, опять же, несмотря на низкое АД. Обычно сопровождается повышенным диурезом. Диурез сохраняется даже при АД, меньшим, чем «почечный порог» — САД ниже 80 мм.рт.ст.
Подтвердить данный вариант кровообращения можно «мезатоновой пробой» (Туркин В.Ф.) — мезатон 0,5мл (5мг) разводят до 10-20мл и начинают дробно (по 1-2мл р-ра) вводить в/в с интервалами в 1-2 минуты под контролем ЧСС и АД. Проба считается положительной, если при введении мезатона значимо снижается ЧСС и увеличивается АД. Это подтверждает наличие сосудистой недостаточности и определяет показания для дозированного введения мезатона.
Дозу мезатона подбирают с учетом величины ЧСС и АД. Обычно достаточно введение 2-5мг мезатона в час (4мл мезатона на 20мл физ.р-ра, скорость перфузора – 1-3мл в час). Необходимо контролировать и состояние кожных покровов, чтобы со временем не перевести сосудистую недостаточность в периферический спазм. По мере стабилизации состояния, дозу мезатона уменьшают, опять же, ориентируясь на ЧСС, АД и состояние кожных покровов.
Удобно введение мезатона подкожно (0,5-1мл 1%р-ра), когда срабатывает «автоматизм резорбции» — при расслабленных сосудах резорбция хорошая и доза мезатона, попадающего в кровоток высокая, по мере спазмирования периферии степень резорбции уменьшается и доза «автоматически» уменьшается.
Следует подчеркнуть, что обычно развивающаяся при гиперциркуляции тахикардия носит компенсаторный характер и лечить ее антиаритмическим препаратами непатогенетично и опасно – устранение механизма компенсации при неустраненной причине приводит к сердечной недостаточности или к ее декомпенсации. Тем более, что практически все антиаритмические препараты еще более уменьшают ОПСС.
Гиперциркуляция достаточно часто сопровождает регионарные методы анестезии за счет симпатического блока и регионарной вазодилятации. В таких случаях, при отсутствии гемоконцентрации и явного дефицита жидкости, протекает благоприятно, так как хорошо коррегируется введением симпатомиметиков (эфедрин или мезатон дозировано или подкожно). Однако, в таких ситуациях достаточно часто применяют и объемную инфузию, заполняя дилятированные сосуды.
При решении вопроса о необходимости применения вазопрессоров или объемной инфузии при регионарной анестезии, необходимо учитывать несколько факторов и представлять отдаленные последствия — через несколько часов прекратиться действие анестетика и восстановиться сосудистый тонус – емкость сосудистой системы уменьшиться. Если сердце здорово и почки функционируют нормально, то организм достаточно быстро избавиться от избыточной инфузии. При неполноценной же функции почек и наличии хронической сердечной недостаточности вся инфузированная жидкость (за исключением коллоидов) не уйдет через почки, а выдавиться в интерстиций, прежде всего в ткань мозга, в легкие и в кишечник. Последствия понятны и достаточно часто наблюдаются в послеоперационном периоде у пациентов преклонного возраста с сопутствующими заболеваниями – энцефалопатия с головными болями (отек ГМ), которую принимают за токсическое действие анестетиков или «подкол»; развитие или декомпенсация сердечно-легочной недостаточности, которую принимают за пневмонию; парез кишечника, который воспринимают как послеоперационный.
При необоснованном применении коллоидов ситуация усугубляется тем, что коллоиды могут «добить» скомпроментированные почки (см.инструкцию по применению), либо, уходя рано или поздно в интерстиций, поддерживать отеки.
Особенно быстро коллоиды уходят в интерстиций при любой интоксикации – синдроме капиллярной утечки.
Влияние медикаментов на показатели кровообращения
Необходимо помнить, что практически любой препарат в той, или иной мере воздействует на показатели кровообращения, иногда регионарного. В настоящее время такая информация пока ещё не всегда указывается в инструкции по применению. Обычно изучается действие фармаколгических средств на организм с использованием параметров ЦГ. Основоположником таких детальных исследований можно считать Крис Р.Манк. Им предложено целенаправленно изучать действие лекарственных средств на ДНЛЖ, СИ и ОПСС.
Во всяком случае, необходимо стараться учитывать известное влияние препаратов на гемодинамику, особенно нарушенную, чтобы не усугубить ситуацию.
Кардиотоническая поддержка
Кардиотоническая (инотропная) поддержка в условиях отделения интенсивной терапии может быть обеспечена введением дофамина.
Суть и эффект кардиотонической поддержки определяется фармакологическим действием дофамина на сердечно-сосудистую систему.
Дофамин в кардиотонической дозировке повышает производительность и выносливость сердца за счет оптимизации сердечного выброса – увеличения его скорости без повышения потребности в кислороде и без увеличения ОПСС. За счет этого уменьшается ЧСС, повышается АД.
Также дофамин обладает мягким диуретическим эффектом. В почечной дозировке за счет дилатации почечных сосудов, а в кардиотонической и за счет повышения скорости общего кровотока и активизации эффекта Бернулли – жидкость из интерстиция начинает более интенсивно поступать в сосудистое русло, а далее выводиться через почки.
Показанием для начала кардиотонической поддержки являются любые нарушения кровообращения, за исключением тех, которые сопровождаются артериальной гипертензией. Показанием для введение дофамина являются признаки задержки жидкости в интерстиции, хроническая или острая почечная недостаточность, особенно при олигоанурии. Хотя доказано, что дофамин не улучшает прогноз при ренальной ОПН, но улучшение почечного кровотока никому не помешает.
Есть литературные данные, что рутинное-профилактическое назначение дофамина у больных в критических состояниях или после объемных вмешательств, даже при отсутствии клинических признаков нарушений кровообращения, значимо уменьшает количество осложнений и летальность.
Дофамин особенно показан при тахикардии, обусловленной хронической или острой сердечной недостаточностью. Мнение, что дофамин противопоказан при тахикардии, основано на безграмотном его применении в слишком высокой дозе. Так же безграмотен отказ от применения дофамина со ссылкой на нормальное АД, несмотря на отсутствие прироста АД к ЧСС или наличие отеков, в т.ч. и интерстициальных.
В то же время следует помнить об опасности дофамина, а точнее опасности для жизни пациента при его передозировке. Именно дофамином добивают больных в шоковых состояниях, пытаясь поднять АД без устранения причины гипотонии — не устраняя высокую постнагрузку или не восполняя кровопотерю. Только безграмотный врач вводит ампулу дофамина (200мг – 5 мл 4%р-ра) в чистом виде или даже в разведении за несколько минут или за два-три часа. Такой дозой можно убить абсолютно здорового человека! 200 мг дофамина вводятся как минимум 5-8 часов!
Дозировка дофамина рассчитывается исходя из веса пациента: почечная – 3-5мкг/кг в минуту, кардиотоническая – 5-10 мкг/кг в минуту.
Расчет может производиться следующим образом: больному 70 кг при кардиотонической дозе в 5 мкг/кг в минуту, за минуту необходимо вводить 350 мкг (70кг*5мкг), за час 21000мкг (350мкг*60мин) или 21 мг. Одной ампулы – 200мг хватит почти на 10 часов (200мг/21мг). Скорость введения будет зависеть от способа введения. Если 200мг развести до 20мл и вводить перфузором (шприц-дозатором), то скорость будет составлять примерно 2мл в час. Если 200мг развести на 400мл физ.р-ра, то этот флакон будет капаться примерно 10 часов, т.е. 40 мл в час = примерно 0,65 мл в минуту(40мл/60минут). Если в одном мл 18 капель (количество капель в 1 мл обычно пишут на упаковке системы), то скорость будет составлять примерно 12 капель за минуту. Если во флакон на 400 мл добавить 2 ампулы дофамина (400мг), то скорость соответственно уменьшиться в 2 раза – примерно 6 капель за минуту.
Такой расчет, так же как и рекомендованные дозы, достаточно относительны. После начала введения, минут через 10-15, необходимо оптимизировать скорость введения с учетом клиники. При недостаточной дозе клинического эффекта в виде уменьшения тахикардии или подъема АД не будет, а при передозировке тахикардия увеличиться. Таким образом, необходимую кардиотоническую дозу можно подобрать, изменяя – повышая скорость введения до повышения ЧСС, а затем уменьшив скорость введения на 20-25%.
Одним из условий эффективного и безопасного применения дофамина является правило его введения через отдельный катетер или через отдельный просвет многопросветного катетера. Суть такой рекомендации в том, что если просвет катетера будет заполнен раствором дофамина, а это 2-3мл раствора, и в это время через катетер начать вводить другой раствор или препарат, то в кровоток попадет сразу несколько мг дофамина. Это, обычно, вызывает тахикардию, аритмию, артериальную гипертензию и может стать причиной остановки сердца. Именно поэтому также рекомендуется использовать растворы дофамина с низкой концентрацией – 1-2 ампулы (200-400мг) разводят в 250-500 мл физ.р-ра.
Список использованных источников
1 Fick A. Mechanische Arbeit und Warmeentwicklung bei der Muskeltatigkeit.- Leipzig, 1982.- 273 S.
2 Putterman C. The Swan-Gans catheter: A decade of hemodynamic monitoring. //J.Crit. Care.- 1989. — №4. — Р.127-146.
3 Swan H.J. Balloon flotation catheters: their use in hemodynamic monitoring in clinical practic// J.A.M.A. – 1975.-Vol.233-P.865
4 Багатурия Д.Ш. Допплер-эхокардиографическое определение степени легочной гипертензии и давления в правом желудочке у больных с дефектами межжелудочковой перегородки. //Кардиология.-1991.-№6.-С.67-70.
5 Дерябин И.И., Насонкин О.С. Травматическая болезнь. – Л.: Медицина, 1987. – 246 с.
6 Карпман В.Л. Физиология сердечного выброса. -Киев, 1970. –С.175-180.
7 Кассиль В.Л. Искусственная вентиляция лёгких в интенсивной терапии. -М.: Медицина, 1987. -255 с.
8 Кедров А.А. Электроплетизмография как метод объективной оценки кровообращения: дис.канд.мед.наук., Л., 1949.
9 Костантинов Б.А., Сандриков В.А., Яковлев В.Ф. Оценка производительности и анализ поцикловой работы сердца. – Л.: Медицина, 1986. – 98 с.
10 Крис Р.Манк. Новые инотропные препараты, применяемые в интенсивной терапии. // Вестник интенсивной терапии. – 1992. — №1. – С.43-44.
11 Лебедева Р.Н. Осложнения в системе кровообращения после хирургических вмешательств. – М., 1989. – 176 с.
12 Лищук В.А. Математическая теория кровообращения. – М.: Медицина, 1991. – 256 с.
13 Лынёв С.Н. Оценка кислородтранспортной функции крови. //Анестез. и реаниматол. — 1986. — №2. — С.57-59.
14 Малышев В.Д., Острая дыхательная недостаточность. М.: Медицина, 1989.- 240 с.
15 Маршалл Р.Д., Шеферд Д.Т. Функция сердца у здоровых и больных /пер. с англ./.- М., 1972.- 391 с.
16 Митьковская Н.П., Пименова Т.Н. Ультразвуковая оценка состояния сердца и давления в легочной артерии у больных ревматическими заболеваниями. //Тер.архив. – 1992. — №12.- С.37-41.
17 Морган Дж.Э., Мэгид С.М. Клиническая анестезиология. Книга вторая. -М.: Бином, 2000г.- 365 с.
18 Мухарлямов Н.М., Беленков Ю.Н. Ультразвуковая диагностика в кардиологии. – М.: Медицина, 1981. -188 с.
19 Плесков Л.П., Мазурина О.Г. Гемодинамический мониторинг: современные тенденции развития. //Анестез. и реаниматол. — 1998. — №3. — С.44-48.
20 Полонецкий В.Г. Клиническая реография. //Кардиология. -1985. — №3. — С.50-52.
21 Пушкарь Ю.Т. и др. Определение сердечного выброса методом тетраполярной грудной реографии и его метрологические возможности. //Кардиология.- 1977. -№7. — С.85-90.
22 Рябов Г.А. Гипоксия критических состояний. – М.: Медицина, 1988. – 288 с.
23 Рябов Г.А. Синдромы критических состояний.- М., 1994. — 368 с.
24 Старлинг Э. Основы физиологии человека /пер. с англ./. – М. 1933. — Т.2. – С. 168-214.
25 Фолков Б., Нил Э. Кровообращение /пер. с англ./. –М.: Медицина, 1976. — 214 с.
26 Чурсин В.В. Моделирование центральной гемодинамики в интенсивной терапии у больных с хирургическими заболеваниями. Дисс к.м.н. – Алматы 2007.
27 Шанин В.Ю. Патофизиология критических состояний. — С.-Петербург, 2003. — С.161-185.
28 Шмидт Р., Тевс Г. Физиология человека /пер. с англ./.- М., 1986.- Т.3.- 425 с.
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Сердце и кровеносные сосуды – основная транспортная система человеческого организма. Строение и функции сердечно-сосудистой системы, регуляция ее работы. Сердечный цикл. Методы исследования сердечно-сосудистой системы. Тренировка сердца.
Сердечно-сосудистая система обеспечивает все процессы метаболизма в организме человека и является компонентом различных функциональных систем, определяющих гомеостаз. Основой кровообращения является сердечная деятельность.
Наше сердце всегда первым откликается на потребности организма: будь то физические нагрузки, подъем в горы, воздействие эмоций или других факторов. Так, при средней продолжительности жизни человека в 70 лет оно сокращается свыше 2,5 миллиардов раз. За это время перекачивается огромное количество крови, для перевозки которой потребовался бы состав из 4 000 000 вагонов. И эта работа выполняется органом, масса которого 250 г (у женщин) и немногим больше 300 г (у мужчин).
У людей, занимающихся спортом, сердце в состоянии напряжения может работать с частотой свыше 200 сокращений в минуту и при этом обладать удивительной выносливостью. В это время увеличивается сила и скорость сокращений сердца, а через его сосуды проходит крови в 4-5 раз больше, чем в состоянии покоя . Мышца сердца при этом не испытывает дефицита питательных веществ и кислорода. Однако нетренированным людям стоит только немного пробежаться, как у них появляется сердцебиение и одышка. Почему это происходит? Давайте попробуем разобраться и решить для себя: действительно ли так важны для нашего организма занятия спортом.
Рассмотрим кратко строение сердечно-сосудистой системы и ее функции.
|
Сердечно-сосудистую систему составляют: |
|||
Сосуды, отводящие кровь от сердца, называют артериями, а доставляющие ее к сердцу – венами. Сердечно-сосудистая система обеспечивает движение крови по артериям и венам и осуществляет кровоснабжение всех органов и тканей, доставляя к ним кислород и питательные вещества и выводя продукты обмена. Она относится к системам замкнутого типа, то есть артерии и вены в ней соединены между собой капиллярами. Кровь никогда не покидает сосуды и сердце, только плазма частично просачивается сквозь стенки капилляров и омывает ткани, а затем возвращается в кровяное русло.
Строение и работа сердца человека. Сердце – полый симметричный мышечный орган размером примерно с кулак человека, которому оно принадлежит. Сердце разделено на правую и левую части, каждая из которых имеет две камеры: верхнюю (предсердие) для сбора крови и нижнюю (желудочек) с впускным и выпускным клапанами для предотвращения обратного тока крови. Стенки и перегородки сердца представляют собой мышечную ткань сложного слоистого строения, называемую миокардом.
|
Сердце обладает уникальным свойством самовозбуждения, то есть импульсы к сокращению зарождаются в нем самом. |
|||
Если извлечь у животного сердце и подключить к нему аппарат искусственного кровообращения, оно будет продолжать сокращаться, будучи лишенным каких бы то ни было нервных связей. Это свойство автоматизма обеспечивает проводящая система сердца, расположенная в толще миокарда. Она способна генерировать собственные и проводить поступающие из нервной системы электрические импульсы, вызывающие возбуждение и сокращение миокарда. Участок сердца в стенке правого предсердия, где возникают импульсы, вызывающие ритмические сокращения сердца, называют водителем ритма. Тем не менее, сердце связано с центральной нервной системой нервными волокнами, оно иннервируется более чем двадцатью нервами. Казалось бы, зачем они, если сердце может сокращаться самостоятельно?
Регуляция работы сердца. Нервы выполняют функцию регуляции сердечной деятельности, которая служит еще одним примером поддержания постоянства внутренней среды (гомеостаза).
|
Сердечная деятельность регулируется нервной системой – одни нервы увеличивают частоту и силу сердечных сокращений, а другие – уменьшают. |
|||
Импульсы по этим нервам поступают на водитель ритма, заставляя его работать сильнее или слабее. Если перерезать оба нерва, сердце все равно будет сокращаться, но с постоянной скоростью, так как перестанет приспосабливаться к потребностям организма. Эти нервы, усиливающие или ослабляющие сердечную деятельность, составляют часть вегетативной (или автономной) нервной системы, которая регулирует непроизвольные функции организма. Примером такой регуляции является реакция на внезапный испуг – вы чувствуете, что сердце “замирает”. Это приспособительная реакция ухода от опасности.
Коротко рассмотрим, как происходит регуляция сердечной деятельности в организме (рисунок 1.5.6).
Рисунок 1.5.6. Гомеостатическая регуляция сердечной деятельности
Нервные центры, регулирующие деятельность сердца, находятся в продолговатом мозге. В эти центры поступают импульсы, сигнализирующие о потребностях тех или иных органов в притоке крови. В ответ на эти импульсы продолговатый мозг посылает сердцу сигналы: усилить или ослабить сердечную деятельность. Потребность органов в притоке крови регистрируется двумя типами рецепторов – рецепторами растяжения (барорецепторами) и хеморецепторами. Барорецепторы реагируют на изменение кровяного давления – повышение давления стимулирует эти рецепторы и заставляет посылать в нервный центр импульсы, активирующие тормозящий центр. При понижении давления, наоборот, активируется усиливающий центр, сила и частота сердечных сокращений увеличиваются и кровяное давление повышается. Хеморецепторы “чувствуют” изменения концентрации кислорода и углекислого газа в крови. Например, при резком увеличении концентрации углекислого газа или понижении концентрации кислорода эти рецепторы тотчас же сигнализируют об этом, заставляя нервный центр стимулировать сердечную деятельность. Сердце начинает работать более интенсивно, количество крови, протекающей через легкие, увеличивается и газообмен улучшается. Таким образом, перед нами пример саморегулирующейся системы.
Но не только нервная система влияет на работу сердца. На функции сердца влияют и гормоны, выделяемые в кровь надпочечниками. Например, адреналин усиливает сердцебиение, другой гормон, ацетилхолин, наоборот, угнетает сердечную деятельность.
Теперь, наверное, вам не составит труда понять, почему, если резко встать из лежачего положения, может даже наступить кратковременная потеря сознания. В вертикальном положении кровь, питающая мозг, движется против силы тяжести, поэтому сердце вынуждено приспосабливаться к этой нагрузке. В лежачем положении голова ненамного выше сердца, и такой нагрузки не требуется, поэтому барорецепторы дают сигналы ослабить частоту и силу сердечных сокращений. Если же неожиданно встать, то барорецепторы не успевают сразу отреагировать, и на какой-то момент произойдет отток крови от мозга и, как следствие, головокружение, а то и помутнение сознания. Как только по команде барорецепторов темп сердечных сокращений ускорится, кровоснабжение мозга окажется нормальным, и неприятные ощущения исчезнут.
Сердечный цикл. Работа сердца совершается циклически. Перед началом цикла предсердия и желудочки находятся в расслабленном состоянии (так называемая фаза общего расслабления сердца) и наполнены кровью. Началом цикла считают момент возбуждения в водителе ритма, в результате которого начинают сокращаться предсердия, и в желудочки попадает дополнительное количество крови. Затем предсердия расслабляются, а желудочки начинают сокращаться, выталкивая кровь в отводящие сосуды (легочную артерию, несущую кровь в легкие, и аорту, доставляющую кровь в остальные органы). Фаза сокращения желудочков с изгнанием из них крови называется систолой сердца. После периода изгнания желудочки расслабляются, и наступает фаза общего расслабления – диастола сердца.
|
С каждым сокращением сердца у взрослого человека (в состоянии покоя) в аорту и легочный ствол выбрасывается 50-70 мл крови, в минуту – 4-5 л. При большом физическом напряжении минутный объем может достигать 30-40 л. |
|||
Во время диастолы полости желудочков и предсердий вновь заполняются кровью, одновременно происходит восстановление энергетических ресурсов в клетках миокарда за счет сложных биохимических процессов, в том числе за счет синтеза аденозинтрифосфата. Затем цикл повторяется. Этот процесс фиксируется при измерении артериального давления – верхний предел, регистрируемый в систоле, называют систолическим, а нижний (в диастоле) – диастолическим давлением. Измерение артериального давления (АД) является одним из методов, позволяющим контролировать работу и функционирование сердечно-сосудистой системы.
Одним из первых, кто детально проанализировал показатели АД, был немецкий физиолог К. Людвиг. Он вводил канюлю в сонную артерию собаки и регистрировал АД с помощью ртутного манометра, с которым была соединена канюля. В манометр погружался поплавок, который соединялся с прибором, регистрирующим колебания различной амплитуды.
В настоящее время АД измеряют бескровным методом с помощью специального прибора – тонометра, что позволяет определить следующие показатели:
1. Минимальное, или диастолическое АД – это та наименьшая величина, которой достигает давление в плечевой артерии к концу диастолы. Минимальное давление зависит от степени проходимости или величины оттока крови через систему капилляров, частоты сердечных сокращений. У молодого здорового человека минимальное давление составляет – 80 мм рт.ст.
2. Максимальное, или систолическое АД – это давление, выражающее весь запас потенциальной и кинетической энергии, которым обладает движущаяся масса крови на данном участке сосудистого русла. В норме у здоровых людей максимальное давление составляет 120 мм рт.ст.
В медицинской практике для определения работы и состояния сердечно-сосудистой системы используют различные методы исследования сердечно-сосудистой системы, информативность, клиническая значимость и клиническая доступность которых весьма различны. В настоящее время ведущее место в клинической практике занимают такие методы как электрокардиография, эхокардиография, рентгенокардиография (более подробно о которых рассказано в разделе 2.1.2) и многие другие. Подобные исследования проводятся специалистами с помощью различных приборов в лечебных учреждениях.
Сердце – это мышечный насос, основная функция которого – сократительная – заключается в непрерывном круговом перемещении крови по всему организму. Кислород доставляется от легких к тканям, а углекислый газ, являющийся одним из “шлаков”, – к легким, где кровь снова обогащается кислородом. Кроме того, с кровью во все клетки организма доставляются питательные вещества, а из них уносятся другие “шлаки”, которые с помощью органов выделения (например почки) удаляются из организма, как зола из печки хорошим хозяином.
От сердца кровь движется по артериям, артериолам и капиллярам. Самая крупная артерия – аорта, она идет непосредственно от сердца (от левого желудочка), самые мелкие сосуды – капилляры, через стенки которых и происходит обмен веществ между кровью и тканями. Кровь, насыщенная углекислым газом и отходами обмена веществ, собирается в венулах и далее по венам, освобождаясь от шлаков в органах выделения, движется обратно к сердцу, которое выталкивает ее в легкие для освобождения от углекислого газа и обогащения кислородом. Обогащенная кислородом кровь из легких по легочным венам поступает в левое предсердие, перекачивается левым желудочком в аорту, и начинается новый цикл кругового перемещения крови.
Коронарные артерии и вены снабжают саму сердечную мышцу (миокард) кислородом и питательными веществами. Это питание для сердца, которое выполняет такую важную и большую работу.
|
Различают большой и малый (легочный) круг кровообращения. |
|||
Малый круг начинается в правом желудочке и заканчивается в левом предсердии. Он служит для питания сердца, обогащения крови кислородом. Большой круг (от левого желудочка до правого предсердия) отвечает за кровоснабжение всего тела, кроме легких.
Стенки кровеносных сосудов очень эластичны и способны растягиваться и сужаться в зависимости от давления крови в них. Мышечные элементы стенки кровеносных сосудов всегда находятся в определенном напряжении, которое называют тонусом. Тонус сосудов, а также сила и частота сердечных сокращений обеспечивают в кровяном русле давление, необходимое для доставки крови во все участки тела. Этот тонус, так же как интенсивность сердечной деятельности, поддерживается с помощью вегетативной нервной системы. В зависимости от потребностей организма парасимпатический отдел, где основным посредником (медиатором) является ацетилхолин, расширяет кровеносные сосуды и замедляет сокращения сердца, а симпатический (посредник – норадреналин) – наоборот, суживает сосуды и ускоряет работу сердца.
Тренировка сердца. Теперь попробуем разобраться, почему у нетренированного человека при незначительной физической нагрузке появляются признаки “кислородного голодания”: сердцебиение, одышка и другие. К примеру, во время бега, тяжелой физической работы потребность организма в кислороде возрастает примерно в 8 раз. А это означает, что сердце должно перекачивать в 8 раз больше крови, чем обычно.
Знаете ли вы, что…
Ученые подсчитали, что за сутки сердце расходует количество энергии, достаточное для поднятия груза в 900 кг на высоту 14 м (!)
У человека, ведущего малоподвижный образ жизни, учащение сердечных сокращений не приводит к увеличению кровоснабжения сердца, как это требуется организму. В этом случае мышца сердца и скелетные мышцы получают недостаточное количество кислорода, работают в условиях кислородного голодания, в результате накапливаются вредные продукты обмена веществ, что приводит к более быстрому износу сердечной мышцы. Нетренированное сердце со слабой сердечной мышцей не может долго работать с повышенной нагрузкой. Оно быстро устает, причем кровоснабжение сначала ненадолго усиливается, а затем ухудшается. Поэтому человек должен с детства заботиться о своем сердце и тренировать его.
|
Подвижный образ жизни, физическая работа заметным образом способствуют укреплению сердечной мышцы. |
|||
Подробная информация о препаратах, применяемых при болезнях сердечно-сосудистой системы представлена в главе 3.5.