Крупнейшие фармацевтические компании (PhRMA) США возмущены тем, что им тяжело попасть на российский рынок, так как Россия активно занимается импортозамещением. Об этом говорится в докладе (есть у «Известий») ассоциации ведущих фармацевтических компаний Штатов, который был подготовлен в феврале 2016 года. Как отмечается в документе, Россия якобы дискриминирует зарубежные компании, в частности американские. Дело в том, что в РФ бюджетным учреждениям запрещено закупать ввозимые из-за рубежа лекарства, аналоги которых уже производятся в стране.
«Члены ассоциации сталкиваются с препятствиями, когда пытаются попасть на российский рынок, в том числе потому, что РФ ведет политику импортозамещения, — отмечается в докладе ассоциации. — Несмотря на то что Россия входит во Всемирную торговую организацию (ВТО), страна занимается дискриминацией в системе госзакупок. Она запрещает иностранным компаниям, в том числе из США и ЕС, участвовать в торгах, если аналоги их лекарств уже изготавливают в РФ как минимум две компании».
Как отметил генеральный директор Ассоциации российских фармацевтических производителей (АРФП) Виктор Дмитриев, сейчас в России реализуется до 80% отечественных препаратов и только 20% — зарубежных. По его словам, такое положение сохраняется в том числе благодаря введенным ограничениям в системе госзакупок для лекарств из-за рубежа.
— За последние 6 лет (2010–2016) количество российских лекарств выросло на 10%. Это потому, что производство отечественных препаратов увеличилось, появились более дешевые аналоги зарубежных лекарств. Американцы теряют сектора своего рынка в конкурентной борьбе, — говорит он. — Производители лекарств, которые не могут попасть в бюджетный сектор, работают в коммерческом — в частности, на аптеки и т.д.
С аналогичной проблемой сталкиваются и индийские фармацевтические компании, говорит директор компании «МедИндия» Анна Вербина.
— Чтобы получить разрешение на продажу лекарств, компаниям, в том числе иностранным, необходимо провести клинические испытания на территории РФ. Не принимаются к рассмотрению результаты испытаний, которые были проведены на территории других стран, в частности США, ЕС, Индии, — говорит она.
Из-за усложненных процедур многие необходимые для россиян лекарства не попадают на российский рынок, полагает эксперт.
— Полтора года назад в Индии был зарегистрирован препарат в таблетках высокой эффективности для лечения гепатита С «Софосбувир», который еще не появился в РФ. Жители стран бывшего Союза постоянно приезжают в Индию, чтобы купить это лекарство. В России же пока лечатся менее эффективными методами, используя инъекции. То, что в РФ не появилось лекарство «Софосбувир», объясняется тем, что зарегистрировать препарат очень трудно, — пояснила она.
В документе PhRMA также сообщается, что некоторые российские фармацевтические компании не соблюдают патентное право, когда производят аналоги американских лекарств. В связи с этим американские производители просят Торговое представительство Штатов (USTR) договориться с РФ и заключить с ней специальное соглашение о препятствии распространению таких продуктов без согласия патентообладателей.
«Российские производители лекарств-аналогов могут подать заявку на получение разрешения на продажу и изготовление копий американских продуктов, но сейчас они этого не делают, — говорится в докладе. — Россия должна помочь зарубежным компаниям, а именно не допустить появления лекарств-аналогов без разрешения патентообладателей».
Практикующий в Чикаго, штат Иллинойс, адвокат Федор Козлов полагает, что американские патентообладатели находятся «в отчаянном положении», потому что не могут контролировать производителей аналогов в РФ так же, как в Штатах.
— Когда в США кто-то начинает производить копии лекарств, патентовладельцы могут подать иск. В суде определят, заимствован ли состав лекарства или нет. Если да, то патентообладатели могут потребовать запретить производство и продажу этого средства на территории всей страны и возместить материальный ущерб, — рассказал он. — Запретить российским производителям выпускать аналоги они не смогут. Поэтому, видимо, надеются на то, что производители России будут отчислять проценты с продаж.
В документе PhRMA также отмечается, что в прошлом году в РФ был принят закон, согласно которому подделка лекарств уголовно наказуема. Так, по ст. 235.1 УК РФ производство препаратов без разрешения наказывается штрафом до 2 млн рублей или лишением свободы до 5 лет, если стоимость всей продукции не превышает 100 тыс. рублей. Если общая стоимость лекарств-подделок выше, то нарушителю будет грозить штраф до 3 млн рублей или лишение свободы до 8 лет.
«Компании — члены PhRMA рады, что соответствующий закон был принят, но всё равно будут вести тщательный контроль его исполнения», — отмечается в докладе ассоциации.
— Вообще есть несколько типов лекарств: оригинальные — их производят патентообладатели, дженерики — менее качественные копии с другим названием, а также подделки — в этом случае имя не меняется и они выпускаются без разрешения, — пояснил партнер юридического бюро «Гамбит» Айнур Нуриев. — Американцы недовольны тем, что в Россию перевозят оригинальные препараты без разрешения владельцев. Подделки в РФ встречаются редко, в большей степени на рынке реализуются аналоги американских лекарств.
Напомним, что ранее в Госдуму был внесен законопроект о принудительном лицензировании производителя — механизме, который позволит копировать препараты без согласия патентообладателя. В таком случае предполагается, что органы власти смогут принимать решение о копировании зарубежных лекарств, в том числе если компания-патентообладатель отказывается поставлять их в Россию, не может этого сделать из-за введения санкций по отношению к РФ или предлагает необоснованно высокую цену.
По словам экспертов, в основном механизм принудительного лицензирования используют развивающиеся страны.
К примеру, в 2006–2007 годах правительство Таиланда, ссылаясь на свою обязанность обеспечить доступность важных лекарств, приняло решение о принудительном лицензировании трех препаратов из национального перечня необходимых лекарственных средств под названием «Эфавиренц», «Лопинавир/Ритонавир» и «Клопидогрель» (для больных СПИДом).
В 2008 году правительство Бразилии выдало принудительную лицензию, дающую возможность производить дженерик препарата «Эфавиренц» (для больных СПИДом).
Как отметил генеральный директор Ассоциации российских фармацевтических производителей (АРФП) Виктор Дмитриев, развитые страны, в том числе Канада и США, также считают механизм принудительного лицензирования приемлемым и заявляют о готовности его ввести.
— Когда в США была угроза эпидемии атипичной пневмонии (ТОРС), были теракты, граждане получали письма с поражающим веществом, а противодействующего препарата не хватало, то Штаты вели переговоры с компанией Bayer о понижении цены. Позже шла речь и о принудительном лицензировании, — рассказал эксперт. — В итоге решения об этом принято не было, но история в прессу попала. Принудительное лицензирование в случаях реальной угрозы населению поддерживает и Всемирная организация здравоохранения (ВОЗ). Здоровье превыше бизнеса.
Что на самом деле написано в законопроекте о запрете на ввоз лекарств из США, как много препаратов могут запретить и к чему это приведет
В Государственной Думе РФ зарегистрирован Законопроект № 441399–7 под не лишенным рифмы и ритма названием «О мерах воздействия (противодействия) на недружественные действия Соединенных Штатов Америки и (или) иных иностранных государств». Текст законопроекта о запрете американских лекарств более чем серьезный. Ведь он, пожалуй, впервые и весьма широко распространяет подобные меры на лекарственную сферу. Попробуем вчитаться в законопроект и спрогнозировать, к чему он может привести, если вступит в силу в предложенной или аналогичной редакции. Нам помогут эксперты — директор по развитию аналитической компании RNC Pharma Николай Беспалов и президент Общероссийской общественной организации «Лига защитников пациентов» Александр Саверский.
Не только Америка
Не будем углубляться в рассказ о международных событиях, из‑за которых появился проект закона № 441399–7 о запрете импортных лекарств. Во-первых, их широко освещают по телевидению и в интернете. Во-вторых, эти события к здравоохранению отношения не имеют. Второй момент важно подчеркнуть, поскольку предлагаемые контрсанкции не похожи на симметричный или зеркальный ответ. Иначе говоря, в отношении российских препаратов, пациентов или лекарственного рынка санкции никто не вводил — во всяком случае, напрямую.
Перейдем непосредственно к законопроекту, точнее, к тем его положениям, которые могут оказать влияние на состояние российской лекарственной отрасли. В этом смысле наиболее важным представляется пункт 15 статьи 2, в которой перечисляются те самые «меры воздействия», они же — санкции России о запрете на ввоз импортных лекарств в 2018 году.
Итак, пункт 15 законопроекта определяет, что Правительство РФ может ввести такую меру, как запрет или ограничение ввоза на территорию РФ лекарств, произведенных в США и (или) других иностранных государствах. Выделенное курсивом означает государства, присоединившиеся к действиям США по введению экономических санкций в отношении российских юридических и физических лиц, отраслей российской экономики или поддержавшие такие действия. Если с формулировкой «присоединившиеся» всё более-менее понятно, то, что подразумевается под «поддержкой», — неясно, нигде в законопроекте это не уточняется даже косвенно. Разумеется, эта формулировка распространяется как на страны, которые уже поддержали санкционную политику США (или присоединились к ней), так и на государства, которые сделают это в будущем.
На это обстоятельство следует обратить особое внимание. В первые дни после появления новости о проекте закона о запрете на импорт комментаторы стали подсчитывать количество лекарств из США на российском лекарственном рынке, вычислять их долю, приводить в качестве примера названия брендов и фармкомпаний. Некоторые из них комментируют тему под таким углом, как будто введение лекарственных контрсанкций — дело уже решенное, а также прогнозируют, производители каких стран смогут заменить американский импорт.
Но ведь в пункте 15 говорится о запрете ввоза в Россию импортных лекарств, а не только о США. Кто может знать наверняка в нашем непредсказуемом мире, какая страна и как себя поведет через полгода, год или два. Поэтому теоретически предпосылки для введения контрсанкций могут появиться в отношении лекарственных препаратов очень многих западных стран, в частности, почти всех европейских. То есть запрет может затронуть значительную долю от общего числа зарубежных лекарств, включая многие жизненно важные препараты.
Rp.: аналог
Правда, необходимо уточнить, что законопроект определяет, так сказать, общие рамки санкций, а конкретные детали, включая список лекарств иностранного производства, на которые распространяется запрет или ограничение, оставляет на усмотрение Правительства РФ. Кроме того, в пункте 15 имеется оговорка, которую стоит привести дословно: «Указанные запрет или ограничение не распространяются на лекарственные средства и лекарственные препараты, аналоги которых не производятся в Российской Федерации и (или) иностранных государствах».
Председатель Государственной Думы Вячеслав Володин, комментируя в интервью телеканалу «Россия 24» эту тему, упомянул о 1019 лекарственных наименованиях американского производства, которые зарегистрированы и могут поставляться в РФ, и отметил, что 90 из них не имеют аналогов. В отношении этих 90 препаратов законопроектом уже предусмотрена норма, которая не предполагает введение каких‑либо ограничений. Что касается остальных американских лекарств в списке, то, как подчеркнул Вячеслав Володин, если и будет вводиться запрет на поставки, Правительство будет принимать это решение исходя из того, имеется ли у этого препарата американского производства российский аналог и существует ли возможность получать аналогичный препарат из других, не подпадающих под ограничительные меры Законопроекта № 441399–7 государств. В этом случае идет речь о «дружественных» иностранных государствах — тех, кто не поддержал санкционную политику США.
Однако эксперты рынка не склонны поддаваться панике. Так, директор по развитию аналитической компании RNC Pharma Николай Беспалов отмечает наличие нормы о том, что запрет или ограничение на ввоз может касаться только тех американских лекарств, которые уже имеют аналоги, обращающиеся в нашей стране. Он считает, что на сегодняшний день в законопроекте не содержится предложений, которые привели бы к ухудшению системы лекарственного обеспечения.
Серьезные и банальные
Комментируя тему запрета импорта лекарств в Россию, Николай Беспалов обращает внимание на то, что речь идет как о собственно прямых поставках из США в Россию, так и о поставках препаратов из отдельных европейских стран, в которых у американских корпораций существуют дочерние предприятия. Статистика от Николая Беспалова выглядит следующим образом: «Всего в 2017 году в РФ ввозилось порядка 220 американских лекарственных наименований, из них 130 наименований уже имеют аналоги и, соответственно, могут попасть в санкционный перечень. Суммарный объем поставок таких препаратов, которые могут быть заменены, составляет весьма внушительную сумму — около 45 млрд руб. (в ценах производителей), это порядка 7 % от общего объема импорта лекарственных препаратов».
Так что речь идет о весьма значительной части лекарственной номенклатуры, если к тому же учесть, что за отсутствием или присутствием многих наименований на рынке стоят зависящие от этого человеческие судьбы. Николай Беспалов напоминает, что в списке лекарств из США, которые рискуют оказаться под запретом, находится как «весьма банальная» продукция — например, спреи для снятия симптомов насморка, ферментные препараты или препараты для лечения эректильной дисфункции — так и «довольно серьезные» группы препаратов, скажем, для лечения онкологических заболеваний, эпилепсии и т. д. Санкции могут затронуть бизнес таких крупных производителей, как Pfizer, Abbott, Johnson & Johnson, MSD, Unipharm и др. — всего они могут коснуться 17 различных компаний.
Николай Беспалов добавляет, что подавляющее большинство из 130 наименований относится к препаратам химической природы. С его точки зрения, они могут быть относительно легко заменены на аналоги без опасений потери терапевтического эффекта. Тем более, напоминает он, что при желании можно будет выбрать не только из продукции отечественных компаний, но и из числа иностранных лекарств в России (не подпадающих под запрет на ввоз), как об этом говорилось выше.
Но Николай Беспалов оговаривает, что даже из этих 130 лекарственных препаратов не все имеют замену на уровне формы выпуска и не все обладают полной биоэквивалентностью. «Так что хотелось бы, — отмечает эксперт, — чтобы ограничительный перечень был составлен регуляторами с учетом мнения профессионального сообщества». Если это соблюсти, полагает Николай Беспалов, никаких рисков для системы здравоохранения в целом и для отдельных пациентов ответные санкционные меры не несут, замечая все‑таки, что при этом можно говорить «о некоторых неудобствах для потребителя, но не более того».
По жизненным показаниям
В том‑то и вопрос, будет ли это соблюдено и идет ли речь всего лишь о неудобстве потребителя. Поэтому в данном случае важно мнение не только отраслевых экспертов, но и представителей, если так можно выразиться, «пациентского сообщества».
Многие люди критически зависят от конкретного лекарственного препарата, поскольку аналог им не помогает вообще либо плохо помогает, а также вызывает неприемлемые побочные эффекты и т. д. Александр Саверский, президент «Лиги защитников пациентов», в интервью Общественному телевидению России (ОТР) привел пример судебного разбирательства в связи с лечением ребенка не конкретным необходимым ему препаратом, а более дешевым аналогом, вызывавшим у него аллергическую реакцию.
Разумеется, это не единичный случай. И подтверждение тому — наличие в нашем законодательстве специальной нормы о том, что по жизненным показаниям или в случаях индивидуальной непереносимости лекарственные препараты по решению врачебной комиссии могут выписывать больным по торговому наименованию, а не по МНН.
Но ведь в рассматриваемом нами законе о запрете ввоза импортных и американских лекарств ничего не говорится о жизненных показаниях и индивидуальной непереносимости, да их и невозможно учесть при введении подобных санкций. Не будет же импорт «запретных» препаратов «иногда разрешаться» по решению врачебных комиссий. Не может быть у врачебной комиссии каждого лечебного учреждения, как у Штирлица, «окна на границе», то есть на таможне. И как быть с этой проблемой — исчерпывающего и обнадеживающего ответа пока нет.
Невольно возникает вопрос, не может ли эта ситуация привести к нарушению конституционного права граждан на охрану здоровья и медицинскую помощь (статья 41 Конституции РФ). Все‑таки, как заметил Александр Саверский в том же интервью, одно дело — санкции/контрсанкции в таких областях, как, например, предприятия фастфуда, и другое дело — принятие подобных мер в сфере, где речь идет о жизни и здоровье детей, пожилых людей, инвалидов и т. д. В связи с этим Александр Саверский выразил надежду, что в ходе анонсированных консультаций наших законодателей с экспертами и деловыми кругами по поводу предлагаемого законопроекта лекарства из перечня предлагаемых контрмер «просто выпадут».
Аналог — это еще не замена
На сегодняшний день известно, что по меньшей мере до мая законопроект Государственной Думой принят не будет. Но вообще вероятность его принятия вместе с «15‑м лекарственным пунктом» высока. По этому поводу хотелось бы сказать пару слов.
Во-первых, аналог — это еще не замена. В терапевтическом смысле аналогом может считаться только тот препарат из линейки, который лечит не менее эффективно и безопасно, чем исходный препарат. Лишить больного «исходника» и предложить ему менее эффективную и безопасную замену — значит оставить его без надлежащей медицинской помощи.
Второе. Рамки запрета на закупку лекарств иностранного производства сформулированы в законопроекте так, что они могут коснуться не только американских поставок, но и препаратов других стран, причем из числа наиболее развитых с точки зрения качества фармацевтической продукции.
Третье. Хотелось бы привести напоминание Александра Саверского о том, что в нашем законодательстве уже действует известная протекционная мера «третий лишний», дающая существенные преимущества фармкомпаниям РФ и стран ЕАЭС. То есть мы уже имеем в сфере лекарственного обращения серьезную ограничительную меру, принятую, если так можно выразиться, в «период санкций и контрсанкций». На этом фоне, по мнению Александра Саверского, введение дополнительного запрета на ввоз лекарств из Америки выглядит излишним.
Четвертое. Не приходилось слышать, чтобы кто‑либо в здравом уме отказывался от самого эффективного препарата по причине того, что он произведен в «не той» стране. Как‑то мы давно привыкли к тому, что у лекарств паспорт не требуют и гражданство не проверяют. Это всё равно, что в случае временного ухудшения отношений с Германией выгнать из дома немецкую овчарку. Немецкая овчарка — не гражданка Германии, а лекарственная упаковка из США — не гражданка этого государства.
Всякое случается между государствами и сторонами — несогласия, противостояния, войны. Но даже в последнем случае по госпиталям и прочим медицинским объектам не стреляют. Есть вещи, которые нельзя включать в обойму обмена ударами ни при каких обстоятельствах: это больные, дети, старики, инвалиды, поликлиники и больницы, лекарства, медицинская техника. Остается надеяться, что понимание этого придет раньше, чем законопроект будет принят.
Бизнес ,
16 мар 2022, 09:30
0
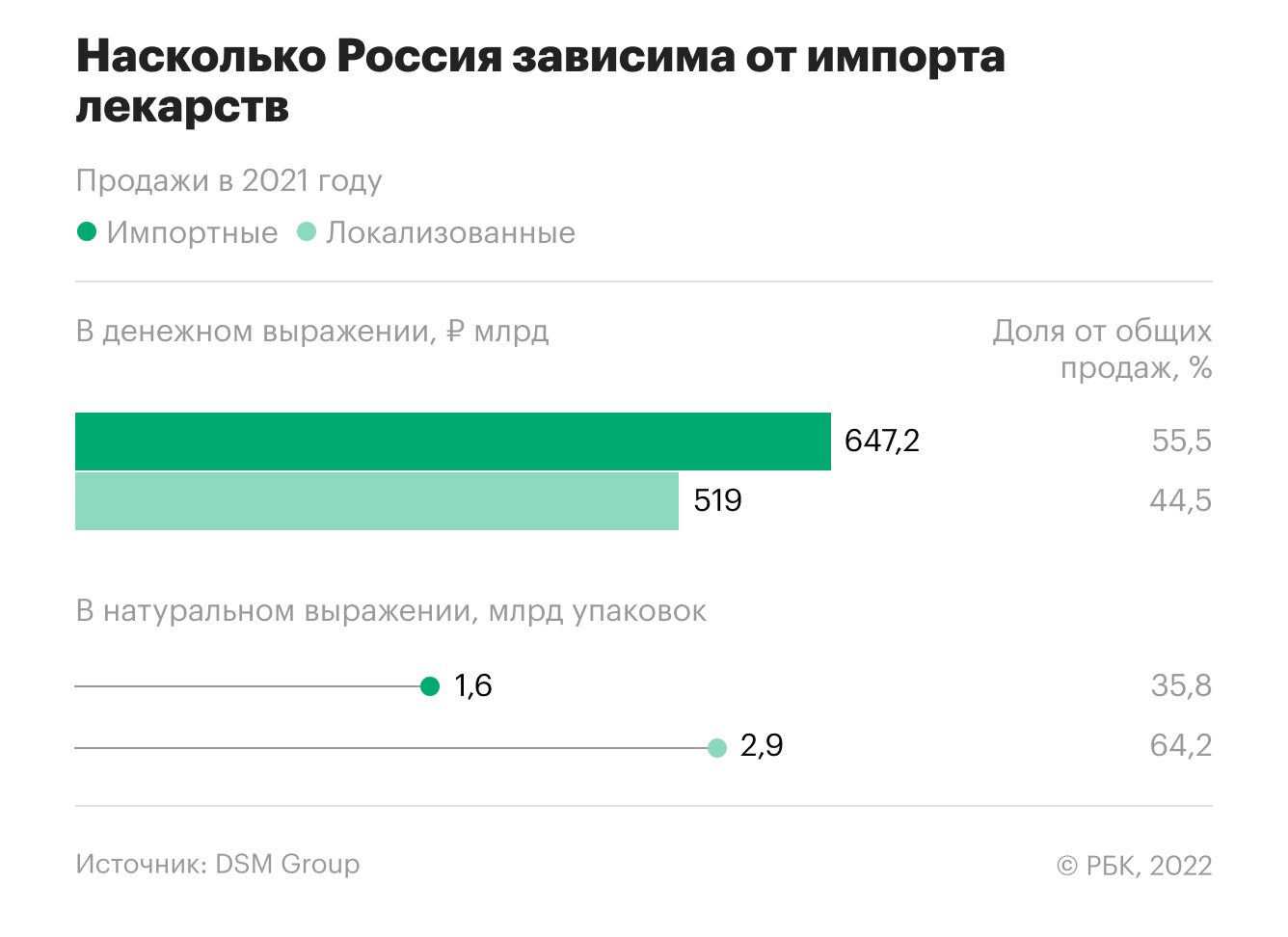
Насколько Россия зависима от импортных лекарств. Инфографика
Три международные фармацевтические компании заявили о сокращении инвестиций в Россию. Что представляет собой отечественный рынок лекарств, много ли производится оригинальных препаратов и как они дорожают — в инфографике РБК
В понедельник, 14 марта, немецкая Bayer и американская Pfizer первыми из крупнейших глобальных фармацевтических производителей объявили о приостановке своих инвестиций в России. Это означает, что компании временно не будут вкладывать в России в маркетинг, работу местных поставщиков, а также новые клинические исследования с участием россиян.
Днем позже к ним присоединилась американская Eli Lilly, но помимо сокращения инвестиций она также прекратит экспорт не жизненно необходимых лекарств. Какие из них войдут в перечень, компания не уточнила.
В отличие от других иностранных компаний потребительского сектора, которые прекращают операции, закрывают розницу и сужают ассортимент продукции, Bayer и американская Pfizer продолжат поставки препаратов на российский рынок. Ранее в передаче CBS News гендиректор Pfizer Ричард Бурла напомнил, что зачастую торговые ограничения исключают фармацевтические препараты по гуманитарным причинам: «Как можно говорить о том, что я не собираюсь поставлять онколекарства россиянам из-за того, что они сделали».
Дело не только в этике, но и в абсолютном прагматизме, считает гендиректор консалтинговой компании DSM Group Сергей Шуляк. «Большинство иностранных игроков — публичные компании, и потеря любого из рынков приведет к снижению стоимости акций», — полагает эксперт.
Что важно знать про отечественный фармацевтический рынок — разбирался РБК.
Насколько высок уровень локализации
Высокий уровень локализации, по мнению директора по развитию RNC Rharma Николая Беспалова, это стабилизирующий элемент рынка — компании имеют определенные запасы сырья и компонентов и могут гибко реагировать на спрос.
В последние недели аптеки столкнулись с ажиотажным спросом, к которому не была готова ни розница, ни логистические мощности производителей. Некоторые пациенты сталкиваются с дефицитом лекарств в аптеках, сообщила «Интерфаксу» исполнительный директор Российской ассоциации аптечных сетей Нелли Игнатьева.
Спрос, по данным RNC Rharma, вырос в десятки, а на некоторые позиции и в сотни раз. Это очень стрессовая ситуация, логистика просто не готова к таким нагрузкам, добавляет Беспалов.
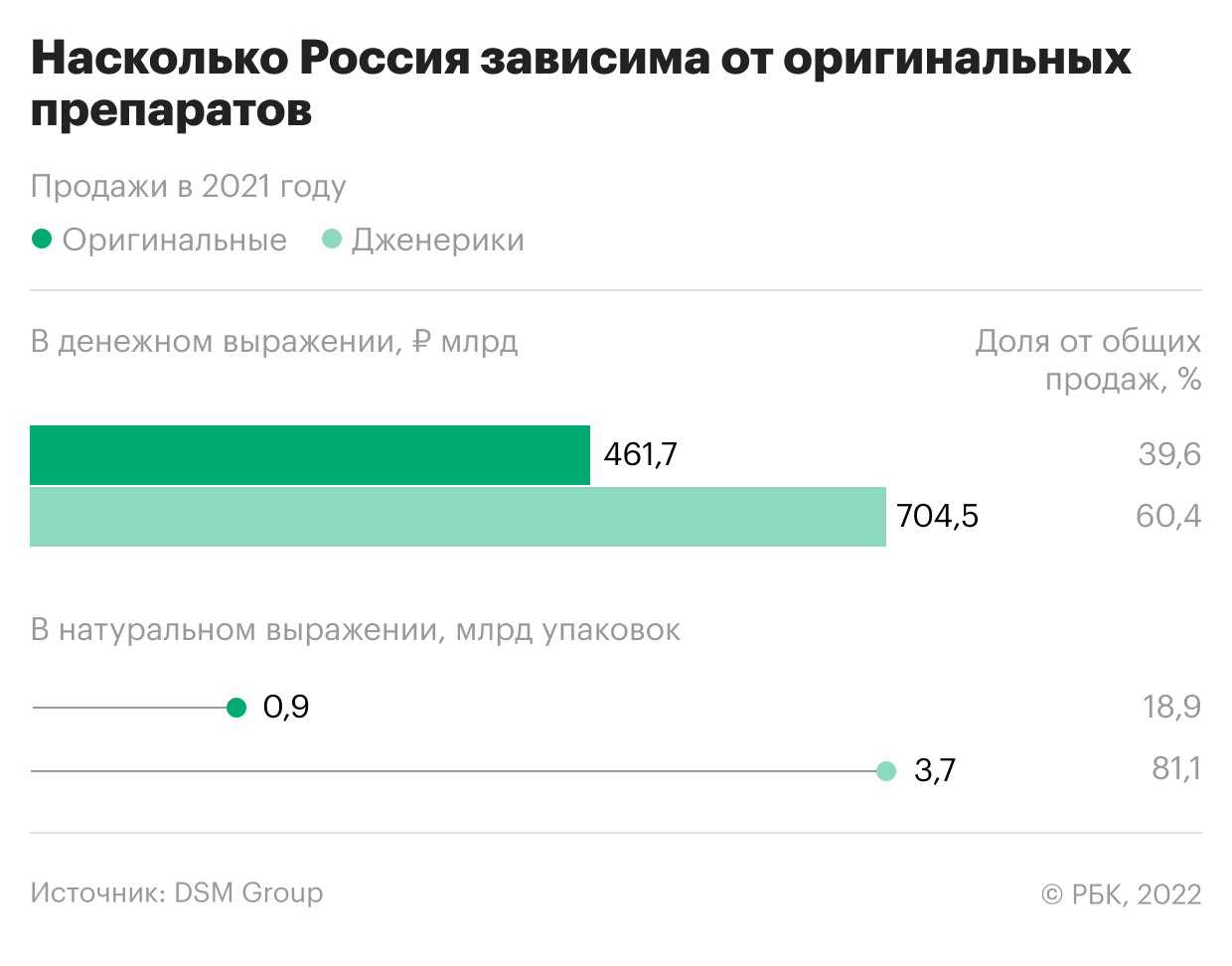
Как много в России производится оригинальных препаратов
Сергей Шуляк считает, что большая доля дженериковых препаратов в большой степени плюс для отрасли — опасаться прекращения поставок или сложностей с наличием препаратов не стоит, они производятся разными компаниями в различных странах, в том числе и в России.
Большое количество как оригинальных, так и дженериковых препаратов дает большое преимущество российскому рынку, согласен Беспалов. По его словам, качество дженериков абсолютно сопоставимо с оригинальными препаратами, а их большое количество дает определенный резерв для замещения востребованного продукта.
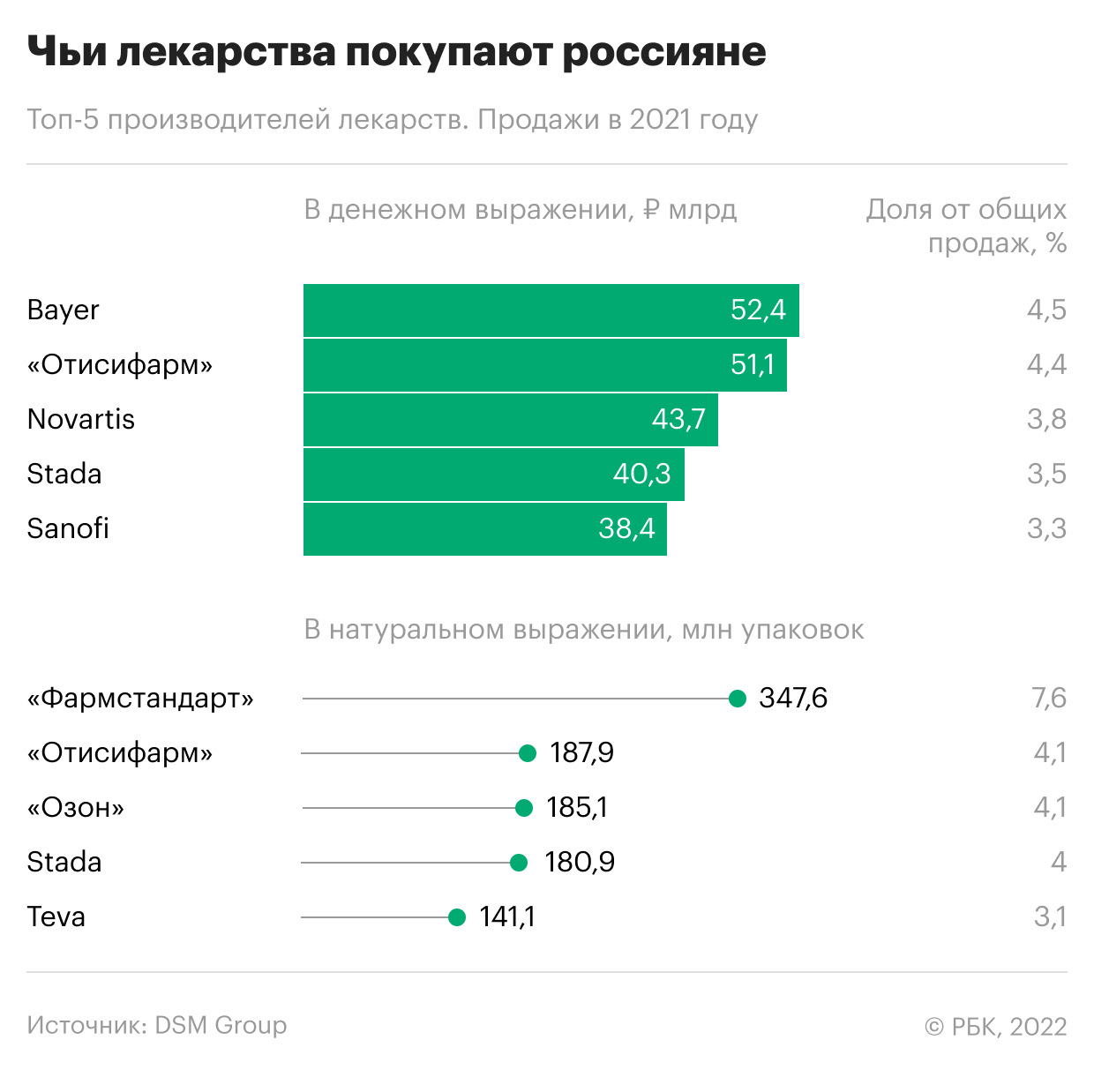
Кто основные производители лекарств в России
В среднем стоимость отечественных фармацевтических препаратов в три раза ниже иностранных, указывает Беспалов, объясняя, почему в денежном выражении лидерами являются одни, преимущественно международные компании, в натуральном — другие, преимущественно отечественные.
Не всегда цена препарата отражает высокую стоимость разработки, клинических исследований и производства лекарства, оговаривается Беспалов. В цену закладывается также дорогостоящая составляющая продвижения, добавляет эксперт.
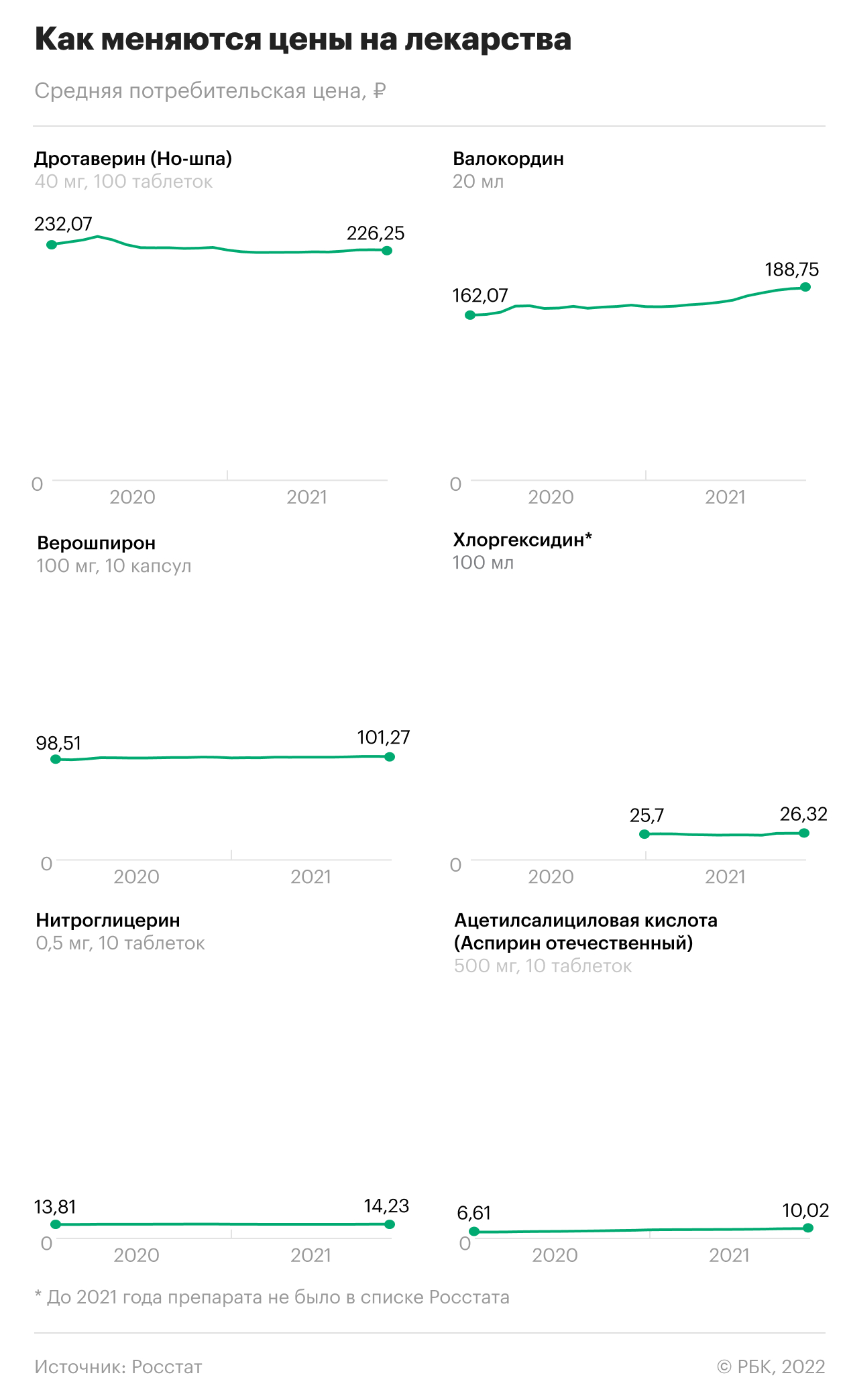
Почему дорожают даже отечественные лекарства
Основная причина роста стоимости лекарственных препаратов, производящихся в России, — зависимость от иностранного сырья. По словам Беспалова, 85% контрактов на сырье оплачивается в валюте. Для синтеза субстанций на территории России нужны зарубежные интермедиаты, вспомогательные вещества, даже фольга и бумага для упаковки импортируется, объясняет Сергей Шуляк.
Эксперты высказывают предположения, какие именно лекарственные препараты могут исчезнуть с российского рынка в случае принятия законопроекта «О мерах воздействия (противодействия) на недружественные действия США и (или) иных иностранных государств».
По мнению специалистов компании «Видаль», россиянам придется отказаться, в частности, от ряда инсулинов, противопростудных, противовирусных, гормональных лекарств.
В список, составленный этими экспертами, вошли следующие препараты:
Обезболивающее «Нурофен»
Антибиотик «Аугментин»
Антибиотик «Клацид»
Препараты инсулина
Средство от ревматоидного артрита и псориаза «Хумира»
Препарат от болезней суставов «Артра»
Гормональный препарат «Дюфастон»
Гормональный препарат «Дипроспан»
Препарат от давления «Капотен»
Препарат от болезней суставов «Терафлекс»
Противоэпилептическое средство «Лирика»
Поливитаминный препарат «Кальцемин Адванс»
Витаминные комплексы «Витрум»
Ферментное средство «Креон»
Гепатопротектор «Гептрал»
Слабительное «Дюфалак»
Лекарство от гепатита B «Бараклюд»
Препарат от гепатита С «Совальди»
Препарат от аллергии «Телфаст»
Вакцина от вируса папилломы человека, защищающая от рака шейки матки «Гардасил»
Вакцина от пневмококковой инфекции «Превенар»
Антидепрессант «Паксил»
Антидепрессант «Симбалта»
Снотворное «Мелаксен»
Средство от мигрени «Экседрин»
Назальный спрей «Тизин»
Назальный спрей «Назонекс»
Препарат от простуды «ТераФлю»
Противоопухолевый препарат «Сутент»
Препараты для повышения потенции «Виагра», «Сиалис»
Из российских аптек могут исчезнуть также амоксиклав (антибиотик), кетонал (обезболивающее), феррум лек (применяется при анемии), считает управляющий партнер Экспертной группы Veta Илья Жарский. Все эти препараты производятся под брендом Sandoz.
Всего под санкции может попасть 130 международных патентованных наименований и 140 торговых марок.
Доля европейских производителей (теоретически они тоже могут попасть под ответные санкции) на российском рынке лекарств очень велика – 70%. Американских препаратов значительно меньше – не более 10%. «Но принимать решение о запрете таких препаратов, основывая его на доле рынка – категорически неправильно. Вопрос не в том, кто сколько продал или купил. Многие такие препараты имеют статус инновационных. И зачастую им нет замены. А значит, есть риск того, что пациенты не смогут правильно лечиться», – считает глава ГБУ НИИ организации здравоохранения и медицинского менеджмента Департамента здравоохранения Москвы Давид Мелик-Гусейнов.
Ранее лидеры всех фракций Госдумы внесли на рассмотрение парламента законопроект, предусматривающий введение ряда ограничительных мер в ответ на санкции США против России. В частности, предлагается запретить ввоз на территорию Российской Федерации сельскохозяйственной продукции и сырья, алкоголя и табачных изделий из стран, поддерживающих антироссийские санкции, сократить международное сотрудничество с этими государствами в некоторых отраслях, таких как атомная энергетика и авиастроение, и т.д.
Критику общественности в первую очередь вызвал тот пункт законопроекта, который касается ограничений на импорт лекарств из США и других стран. Перечень запрещенных для ввоза медикаментов будет определяться правительством РФ. Запрет коснется только тех лекарственных средств, аналоги которых производятся в России или в других странах, откуда импорт будет возможен.
Однако около 90% отечественных лекарств — это дженерики, оригинальных препаратов, которые были бы синтезированы Россией или СССР, на рынке не более 10%, заявил гастроэнтеролог, гепатолог Давид Матевосов. «Применяя российские аналоги, мы в два раза чаще наблюдаем побочные эффекты: аллергические реакции, тошноту, рвоту, бессонницу. Дженерики могут производиться с использованием другого технологического процесса, это может влиять как на количество, так и на состав примесей», — пояснил он.
Госдума рассмотрит проект закона о контрсанкциях РФ в отношении США в первом чтении 15 мая.
Зачем нужно импортозамещение
С середины 2000-х годов в России начали активно продвигать идею импортозамещения лекарственных средств. Беспокойство властей и представителей бизнеса было связано с доминированием импортных препаратов на российском рынке. Так, в 2004 году доля лекарств иностранного производства составляла 77% против 23% отечественных в денежном выражении. В единицах проданных упаковок соотношение было 35% к 65%, соответственно, что объясняется высоким и стабильным спросом на дешевые, «повседневные» лекарства.
Другой проблемой являлось то, что значительная часть отечественных препаратов производилась (и сейчас производится) из импортного сырья — реагентов, которые труднодоступны или недоступны в РФ вовсе. Главным поставщиком сырья для фарминдустрии выступает Китай, который в целом доминирует на рынке субстанций и интермедиатов, чему способствуют низкие цены. Китай производит более 120 субстанций, а цены на них в среднем в 50 (!) раз ниже, чем у европейских поставщиков.
В зависимость от китайских производителей попала не только Россия, но и Индия, и даже США. По данным на 2020 год, до 85% сырья и промежуточных продуктов для производства фармацевтических активных ингредиентов индийской промышленности, включая дженерики, зависит от Китая. Как ни странно, но и такие страны, обладающие развитой фармпромышленностью, как Германия, Израиль и Франция, производят менее 40% препаратов в режиме полного цикла. А в США серьезные опасения о зависимости фармацевтики от Китая высказывают с 2012 года.
Многие российские предприятия по производству лекарственных препаратов используют готовые импортные фармацевтические субстанции, в первую очередь дешевые продукты из Китая или Индии, также зависящей от китайских поставщиков. Долгие годы эта схема успешно работала, но в 2017–2018-х годах в Китае начали бороться за улучшение экологической обстановки, что вызвало массовое закрытие химических и фармацевтических производств. В то же время в Индии закрылась часть фабрик. Как следствие, доступность субстанций и интермедиатов на мировом рынке снизилась, а цены выросли.
Другим неприятным сюрпризом стали массовые нарушения логистики и закрытия китайских заводов во время пандемии COVID-19. Наибольшие сложности вызвало нарушение поставок ключевых интермедиатов и крупнотоннажных химических реагентов, которое привело к росту цен на фармпродукцию по всему миру. Есть и положительный момент: полагают, что кризис с поставками из Китая и Индии поспособствует развитию производства субстанций в Восточной Европе.
Такая тенденция сохранилась и в 2021 году: цены на ряд субстанций повысились в два-три раза. В России ситуация усугубляется продолжающейся девальвацией рубля, тогда как большая доля контрактов на поставку субстанций заключается в долларах США или евро.
Таким образом, для многих стран импортозамещение — важный шаг к обеспечению людей необходимыми лекарствами, особенно во время кризисных ситуаций, вызывающих нарушение логистики сырья и субстанций. Импортозамещение подразумевает не только выпуск готовых лекарственных средств, но в первую очередь необходимых исходных и промежуточных реагентов для получения фармацевтических субстанций. Смысл замещения конечного продукта на отечественный, который синтезируется из импортного сырья, близок к нулю, поскольку такой подход не снимает зависимость от иностранных поставщиков и возможных сбоев поставок.
Это относится не только к России, но и к США, и к странам ЕС.
В России для импортозамещения в 2011 году запустили программу «Фарма-2020». На тот момент импортные препараты занимали 76,5% от российского рынка в денежном выражении и 35,3% — по проданным упаковкам. Доля отечественных лекарств на российском рынке и их качество требовали существенных изменений в фарминдустрии.
Как «заместить» лекарство?
Для создания импортозамещающих аналогов лекарств есть два пути: условно «простой» — изготовление дженериков и более сложный — разработка новых препаратов с такой же или более высокой эффективностью, чем у известных. Но для того, чтобы один лекарственный препарат можно было применять вместо другого, он должен отвечать ряду жестких требований.
Может быть интересно
Дженерики: можно ли сэкономить на лекарствах без вреда для здоровья
В РФ взаимозаменяемость лекарств определяется по следующим параметрам: эквивалентность (для биоаналогов — сопоставимость) качественных и количественных характеристик фармацевтических субстанций; эквивалентность лекарственной формы; эквивалентность или сопоставимость вспомогательных веществ; идентичность способа введения и применения; отсутствие клинически значимых различий при проведении исследования биоэквивалентности или терапевтической эквивалентности; соответствие производителя требованиям международного стандарта GMP. Эти параметры определяет комиссия экспертов, сравнивая нормативную документацию на лекарственные препараты, отчеты о проведенных исследованиях терапевтической или биоэквивалентности.
- Биоэквивалентность, или фармакокинетическая эквивалентность — это сходство фармакокинетических параметров препарата по отношению к референтному (оригинальному) лекарственному средству. Биоэквивалентность определяют in vivo экспериментально.
- Терапевтическая эквивалентность — проявление исследуемым препаратом аналогичной безопасности и эффективности по отношению оригинальному лекарственному средству. Проверяется в клинических испытаниях.
- Стандарт GMP (Good Manufacturing Practice, Надлежащая производственная практика) — признанная во всем мире система обеспечения качества, включающая нормы, правила и указания в отношении производства лекарственных средств, активных ингредиентов, продуктов питания, пищевых добавок и т. д.
В США терапевтическая эквивалентность включает в себя эквивалентную безопасность и эффективность воспроизведенного лекарства, биоэквивалентность, а также соблюдение стандартов GMP. В странах ЕС и ЕАЭС биоэквивалентность и терапевтическая эквивалентность рассматриваются практически как альтернатива. Данные по биоэквивалентности — фармакокинетические, и их можно получить довольно быстро на малой выборке испытуемых. Дженерик обязательно должен демонстрировать биоэквивалентность. Терапевтическая эквивалентность требует более тщательного исследования. Стоит отметить, что в РФ до сих пор нет специального стандарта проведения таких испытаний на терапевтическую эквивалентность. Работы в этом направлении ведутся.
Чем отличается производство дженериков от разработки новых препаратов?
ВОЗ называет дженерики «мультиисточниковыми лекарственными препаратами», то есть производящимися из фармсубстанций и других веществ, имеющих разное происхождение.
Дженерики — одна из самых спорных областей в мировой медицине и фармакологии. Неоспоримыми плюсами таких препаратов являются их экономическая доступность, так как дженерики могут стоить в десять раз дешевле оригинального препарата, и возможность производить в любой точке мира. С помощью производства дженериков во многих странах, включая Россию, решается задача импортозамещения. Если рассматривать дженерики исключительно с экономической стороны, то эти препараты максимально выгодны для пациентов. По этим же причинам использование дженериков часто поддерживается органами здравоохранения. Чтобы оценить минусы дженериков, надо разобраться, в чем они схожи с оригинальными препаратами и в чем отличаются.
Многие путают импортозамещение и производство лекарств-дженериков. Новое импортозамещающее лекарство может не иметь ничего общего ни по химической структуре активного ингредиента, ни по качественному или количественному составу с «замещаемым» препаратом, но при этом оказывать сходное действие на организм и лечить то же самое заболевание. Напротив, дженерики нацелены на максимально точное копирование известного брендового лекарства, что отражается в официальном названии — «воспроизведенный лекарственный препарат». Дженерик может производиться в той же стране, где изначально был выпущен оригинальный препарат, таким образом вовсе не относясь к импортозамещению. Однако дженерик способен выступать «заместителем» импортного оригинала или другого, уже доступного на рынке дженерика иностранного производства. Еще одно понятие, которое следует иметь ввиду в контексте импортозамещения, — это псевдодженерик.
Такие препараты продаются по сниженным ценам, чтобы конкурировать на рынке дженериков без значительного снижения цены оригинального лекарства. Псевдодженерики, также называемые разрешенными или брендированными дженериками, влияют на динамику рынка, поскольку ставят ценовой барьер для выпуска истинных дженериков. Разница в цене между псевдодженериками и настоящими дженериками может достигать 40%. Таким образом, псевдодженерики вообще не относятся к импортозамещению, если оно не касается исходного сырья.
Второй подход — разработка новых препаратов. «Фарма-2020» была преимущественно ориентирована на технологическую модернизацию отечественных фармпредприятий, запуск новых производств, импортозамещение лекарственных средств, в особенности входящих в Список жизненно необходимых и важнейших лекарственных препаратов. Другими задачами обозначили создание «инновационной российской фармацевтической и медицинской промышленности» и трансфер современных фармтехнологий в РФ. Трансфер подразумевал приобретение прав на уже разрабатываемые препараты, находящиеся на ранних стадиях испытаний. Целью было повышение доли препаратов российского производства до порядка 50%, причем к концу реализации программы список ЖНВЛП должен включать 85% отечественных лекарств (для сравнения: в 2009 году их доля в денежном выражении составляла ~20%). «Фарму-2020» продлили до 2024 года. Сейчас разрабатывается стратегия «Фарма-2030», основным приоритетом которой должно стать «инновационное импортозамещение, основанное на ускоренном, эффективном внедрении перспективных лекарственных разработок, в первую очередь отечественных». Также предполагается обеспечить фармацевтическую отрасль сырьем, усилить связь между производством и наукой. То есть принципиально смещается акцент с технического переоснащения предприятий и формального импортозамещения на создание новых эффективных препаратов с полным циклом производства на территории РФ. Новый подход, вероятно, позволит перейти от «догоняющего» типа развития российской фарминдустрии на уровень развитых стран.
Проблемы с созданием аналогов лекарств
Создание «замещающих» лекарств — сложная задача. Во-первых, в отечественной фарминдустрии существуют фундаментальные и до сих пор не решенные проблемы. Одна из них связана с качеством лекарств. По данным на 2011 год, недоброкачественные лекарства, изъятые из оборота, на 65% являлись российскими. К 2020 году их стало значительно меньше. Что наиболее важно — 63,8% случаев выявления некачественных лекарств были связаны с производственными ошибками, недостаточной стандартизацией и неэффективным контролем качества. К 2011 году лишь 10% отечественных производителей перешли на стандарты GMP, 40% — следовали GMP на отдельных производственных участках, 50% — даже не начинали переход.
Переход к стандартам GMP также являлся целью «Фармы-2020», но до сих пор не завершен. К 2017 году 78% предприятий перешли на новый стандарт. И сейчас часть отечественных фармпроизводств не соответствует требованиям.
Примером последствий несоблюдения GMP может служить затянувшаяся регистрация вакцины против COVID-19 — «Гам-КОВИД-Вак» («Спутник V»). Группа экспертов ВОЗ обнаружила нарушения на производстве вакцины, в частности — по микробиологическому мониторингу, уровню стерильности и др. Так несоответствие стандартам GMP подрывает репутацию яркого достижения современной российской науки и фарминдустрии — создание и запуск в широкое производство эффективной вакцины в сжатые сроки в условиях форс-мажорной ситуации.
Возникает вопрос: почему не все предприятия перешли на стандарты GMP? Переход конкретной площадки на GMP требует некоторых внутренних и внешних условий. К внешним относится развитая нормативно-правовая база по стандартизации фармацевтической продукции. Внутренние условия, то есть ситуация на производстве, подразумевают наличие подходящей инфраструктуры и современного оборудования, источников качественного сырья, квалифицированных специалистов производства и контроля качества, соответствующей организации труда, приведение технологической документации к требованиям стандарта и достаточной прибыли, чтобы осуществить переход. Одновременно все эти условия могут выполняться только в крупной современной компании со стабильно высокой прибылью. Таким образом, для некоторых производств переход на стандарты GMP принципиально невозможен.
Можно ли производить лекарства без перехода на GMP? Практика показывает, что да. На таких предприятиях пользуются старыми ГОСТами и внутренней нормативной документацией. В принципе, продукт может получаться качественным, но выход на международный рынок для него будет закрыт.
Со стороны пациента стоит остерегаться продукции, выпущенной без соблюдения стандарта GMP, особенно в случае препаратов, требующих очень точного дозирования и высокой степени стерильности.
Дженерики
Другая проблема заключается в том, что даже «простой» путь импортозамещения лекарств через производство дженериков не так прост, как может показаться. Из перечисленных требований к воспроизведенным лекарственным препаратам самое легкое — получить эквивалентную субстанцию, то есть синтезировать то же самое вещество, что и в оригинальном препарате, довести его до требуемой чистоты и поместить нужную массу в лекарственную форму. Но, помимо химической эквивалентности, у химически сложных препаратов из-за различия методов обработки могут меняться физические свойства. Например, некоторые вещества способны кристаллизоваться в зависимости от условий более чем в одной кристаллической форме, то есть образовывать полиморфы. Для одной субстанции может существовать более десятка полиморфов, которые отличаются по температуре плавления и скорости растворения. Последнее является критичным в плане биодоступности препарата и скорости достижения максимальной концентрации, что прямо влияет на биоэквивалентность. Примерами образующих полиморфы субстанций являются противовирусный препарат для лечения ВИЧ тенофовир, антитромботический тикагрелор, противорвотный фосапрепитант, противовоспалительный декскетопрофен. Таких препаратов десятки. Способы получения оптимальных полиморфов тщательно охраняются разработчиками, а доступная информация, приведенная в патентах, как правило, недостаточна, чтобы воспроизвести все условия. Еще одна особенность полиморфов — они способны переходить друг в друга самопроизвольно или под внешним воздействием, включая обычные манипуляции — сушку, измельчение, таблетирование и т. д. Поэтому производители дженериков иногда идут на компромиссные решения. Однако всё это не исключает получения нужной формы другим способом или иной формы, но проявляющей биоэквивалентность по отношению к оригинальному препарату.
Еще одна сложность в создании дженериков — вспомогательные вещества, обеспечивающие стабильность лекарственной формы и плавное, предсказуемое высвобождение активного компонента в организме человека. Обычно их описания в патентах скудны. Качественный и количественный анализ позволяет установить состав вспомогательных компонентов, но на лекарственную форму влияет также условия и последовательность введения этих ингредиентов. И снова производителям дженериков приходиться искать компромиссы, чтобы не застрять на стадии разработки технологического процесса.
Все вышеперечисленное приводит к тому, что дженерик может не соответствовать требованиям по биоэквивалентности или терапевтической эквивалентности. Конечно, это не так важно, если речь идет о повседневных препаратах — условный дженерик-аспирин может быть для конечного потребителя ничем не хуже брендового лекарства от корпорации Bayer, даже если в нем содержится чуть больше или меньше активного компонента, который высвобождается из таблетки неравномерно. Но когда речь идет о сложных препаратах, с небольшой разницей между активной и токсичной концентрациями, или когда необходимо длительно поддерживать конкретный уровень вещества в крови в узком диапазоне — такие отклонения недопустимы. Снижение концентрации может привести к развитию лекарственной устойчивости у патогенного микроорганизма или к падению эффективности при лечении онкологических заболеваний, повышение — к усилению побочных эффектов и нежелательных лекарственных взаимодействий. Критические категории, в которых вариации биодоступности могут изменить клинический результат, включают сердечно-сосудистые препараты, психотропные, противосудорожные и бронходилатирующие средства, низкодозированные пероральные контрацептивы, диуретики и антикоагулянты.
Соблюдая все условия, можно получить «идеальный дженерик».
Если дженерик изготовлен в строгом соответствии GMP, безопасен, эффективен, проявляет био- и терапевтическую эквивалентность, то его можно считать полноценной заменой оригинальному препарату, но при этом гораздо более доступной по цене.
И в таком случае некоторые исследователи рассматривают обилие дженериков как фактор, тормозящий конкуренцию и введение на рынок новых, более эффективных препаратов. Кроме того, фармкомпании, создавшие оригинальный препарат, теряют прибыль, которую могли бы вкладывать в дальнейшие исследования.
На практике «идеальный дженерик» встречается нечасто, особенно в странах с низким экономическим уровнем. Например, Медицинский совет и Минздрав Индии обязали врачей выписывать только непатентованные препараты и не назначать брендовые лекарства. В связи с этим медики отмечали проблемы с дженериками: различные дозы и комбинации активных компонентов в препаратах разных компаний.
В России ситуация несколько проще — врач должен указывать международное непатентованное наименование, действующее вещество, а не торговое название. Так ответственность за выбор конкретного лекарства ложится на пациента, а врач может подсказать, опираясь на клинический опыт, какой из доступных препаратов лучше. По идее такой подход должен уберечь пациента от сговора медицинских представителей с врачами и клинически неоправданного навязывания дорогостоящих лекарств. Но здесь реальность не совсем совпала с ожиданиями: из-за требования закона о госзакупках указывать на торгах непатентованное наименование ожидаемо побеждают дешевые дженерики. И если у амбулаторного пациента есть выбор между дженериками разных производителей и оригинальным препаратом (если он доступен в стране), то в больнице, где лекарства предоставляются за счет государства, — нет.
Как писали в издании «Коммерсантъ», онкологи отмечали, что в дженериках содержится меньше действующего вещества, чем в оригинальном лекарстве. О неэффективности дженериков там же сообщалось и при лечении муковисцидоза.
«В прошлом [2019] году РДКБ направила в Росздравнадзор 300 негативных отзывов на дженерики, которыми лечила пациентов, однако ведомство на эти сигналы не отреагировало».
Статья полна негативных эмоций относительно дженериков, их ругают и врачи, и пациенты. Но проблема кроется не в том, что это дженерики, а в отсутствии четкой схемы доказательства терапевтической эквивалентности, «золотого стандарта» испытаний таких препаратов, что позволило бы отсеять неэффективные средства еще до выхода на рынок, а не после гибели пациентов. То, что в непатентованном лекарстве содержится меньше активного компонента, чем в оригинальном, — это проблема контроля качества на производстве, но не бренда. А обеспечить качество можно только одним способом — завершить переход к стандартам GMP на всех предприятиях, без каких-либо исключений. Тогда и только тогда дженерики перестанут быть русской рулеткой для пациентов и врачей.
Инновации
Второй путь — разработка новых препаратов — еще сложнее. По переносу фармтехнологий, предусмотренному стратегией «Фарма-2020», из 57 препаратов, права на которые были приобретены на ранних стадиях исследования, до производства и выхода на рынок дошли только четыре. Наиболее успешные — это «Элпида» (элсульфавирин, антиретровирусный препарат для лечения ВИЧ) и «Арланса» (нарлапревир, противовирусный, лечение гепатита С). Другие два — «Мирклудекс Б» (булевиртид, противовирусный, лечение гепатита B и D) и «Биогиал» (гиалуронидаза, ранозаживляющее средство). С остальными препаратами исследователи потерпели неудачу. Всего по итогам стратегии «Фарма-2020» зарегистрировано примерно 90 препаратов, которые основаны на ранее известных активных субстанциях.
К новым препаратам есть ряд претензий, связанных со слабой доказательной базой их эффективности. Эффективность препарата «Элпида» показана в многоцентровом РКИ фазы 1 и 2 длительностью 96 недель (два этапа по 48 недель), в котором участвовало 120 человек с ВИЧ-инфекцией, 60 из которых были рандомизированы в группу приема исследуемого лекарства. Препарат сравнения — эфавиренз. Некоторые организации пациентов высказывают сомнения, что такая небольшая выборка испытуемых достаточна для нового препарата. В пострегистрационных исследованиях должны участвовать 2000 пациентов, в настоящее время продолжается набор добровольцев.
Некоторые организации пациентов высказывали сомнения в эффективности препарата как против ВИЧ, так и для лечения COVID-19.
«Арланса» исследован лучше и прошел фазу 3 клинических исследований с участием 420 пациентов. По «Мирклудекс Б» испытания фазы 3, проходящие на 150 добровольцах, еще не завершены, однако интересе к препарату со стороны крупных зарубежных компаний и EMA говорят о его перспективности. Что касается «Биогиал», его активный компонент, гиалуронидаза, хорошо изучен и эффективен, а сам препарат основан на достаточно исследованном «Актиногиале». Однако при обсуждении размера выборки испытуемых следует иметь в виду вопрос этичности — можно ли не давать эффективное, как обычно подразумевается разработчиками, лечение контрольной группе, обрекая участников на страдания или смерть? Это серьезный дискуссионный вопрос, однозначного ответа на который ждать не приходится.
Еще одно слабое место фарминдустрии, общее для обоих подходов, — свыше 80% российских препаратов изготавливают из импортного сырья.
Соответственно, лишь 20% являются строго отечественными, с полным циклом производства в РФ. Такая ситуация обусловлена тем, что в России многие реагенты не производятся вообще, а часть отечественных химикатов имеют низкое качество и непригодны для фармсинтеза без дорогостоящей очистки. Влияет также жесткое регулирование оборота прекурсоров, в список которых включены ценные, широко применяемые реагенты и растворители. Поэтому небольшие предприятия просто отказываются от производства субстанций, технологический процесс получения которых включает использование (и даже образование в реакторе без выделения) прекурсоров, чтобы избежать лишней отчетности и серьезных санкций за малейшие нарушения.
Ценовое регулирование и доступность лекарств
Увеличение доли лекарств российского производства в перечне ЖНВЛП входило в задачи «Фармы-2020». В 2020 году она достигла 39,0% в денежном выражении и 58,8% — по проданным упаковкам.
Но становятся ли препараты, внесенные в список ЖНВЛП, действительно более доступными для пациентов? Идея ЖНВЛП хороша, если взглянуть на нее со стороны конечного потребителя — так он получает лекарства по низкой цене. Но со стороны производителя и дистрибьютора искусственное ограничение цен в условиях рыночной экономики не вызывает энтузиазма. Так, в 2010 году заработали новые правила в ценообразовании на позиции из ЖНВЛП: наценка стала строго регламентированной — ее следовало рассчитывать от зарегистрированной Минздравом цены. За 2010 год цены на ЖНВЛП упали на −4,7%, основное снижение на −2% пришлось на апрель, когда заработала новая система ценообразования. Цена других лекарств не снижалась, а в сезон распространения ОРЗ, наоборот, повысилась на 3%. При этом выручка аптек снизилась на 2–4%.
Как следствие регулирования цен — производители стали отказываться завозить свои препараты в РФ.
Например, в конце 2020 года израильская компания Teva прекратила ввоз восьми лекарств, включая «Купренил» (пеницилламин). Причиной были искусственно заниженные отпускные цены, которые не устраивали производителя. Позднее Teva вернула «Купренил» на российский рынок, достигнув компромиссного соглашения с Минздравом. Также сообщалось о недостаточных объемах 26 лекарств для терапии онкозаболеваний от компании «Верофарм», которая входит в состав американской корпорации Abbott Laboratories, по той же причине. Аналогичная история произошла в начале 2021 года с противоастматическим таблетированным препаратом «Эуфиллин» (аминофиллин) — компании отказались от его производства, так как предельная отпускная цена была зафиксирована на 65% ниже себестоимости. Другой способ «ответить» на недостаточные цены со стороны производителей — ограничение поставок, как произошло с иммуноглобулином.
Помимо низких цен, иностранных поставщиков отпугивает правило «третий лишний», действующее с 2015 года и запрещающее выбирать поставщика из стран, не входящих в ЕАЭС, если на торги выходит не менее двух поставщиков из Союза. Это правило должно было стимулировать импортозамещение лекарственных препаратов. На практике из оборота исчезли десятки наименований лекарств. С 2020 года некоторые препараты можно закупать в виде исключения, однако эта мера не является достаточной, по мнению пациентов и благотворительных фондов.
Таким образом, кажущаяся растущая экономическая доступность препаратов сопровождается их физическим исчезновением с рынка. Очевидно, что регулирующим органам следует проявлять большую гибкость, чтобы найти баланс между доступностью лекарств для конечных потребителей, но при этом сохранить рентабельность производства для фарминдустрии. Нужны механизмы, облегчающие доступ к импортным лекарствам для всех желающий.
Вместо заключения
Импортозамещение, в том числе и выпуск качественных дженериков, — процесс медленный и трудный, но оно возможно и постепенно происходит: в 2020 году отечественных препаратов стало 43,7% в денежном выражении, включая 13% локализованных (произведенных на территории РФ иностранными компаниями), и 68,9% — по проданным упаковкам.
Производство недорогих дженериков позволяет лечиться тем людям, которые не могли позволить себе покупку дорогостоящих брендовых лекарств. Кроме того, продажа дженериков повышает прибыль отечественных фармкомпаний, часть которой может направляться на разработку инновационных препаратов, их клинические исследования и выведение на рынок.
Однако проблема с доступом к качественным лекарствам в России остается нерешенной. С одной стороны, благодаря производству дженериков и регулированию цен на ЖНВЛП формально повышается доступность недорогих лекарств, с другой — пациентам теперь сложнее приобретать эффективные препараты иностранного производства, которые в некоторых случаях оказываются незаменимыми с клинической точки зрения.
Другая нерешенная проблема — нехватка отечественного сырья для фармпроизводства, от простых реагентов до сложных интермедиатов и субстанций, а также чрезмерный контроль оборота прекурсоров, отвращающий малые предприятия от их использования в технологических процессах.
Импортозамещение не следует превращать в самоценный фетиш, здесь необходим баланс интересов фарминдустрии и пациентов, как в плане цен на лекарства, так и по доступности иностранных препаратов для нуждающихся в них. Пациенты должны сохранять право выбора между дженериками и оригинальными препаратами, независимо от страны производства, ориентируясь в первую очередь на реакцию организма и эффективность.
Всероссийский союз пациентов обратился к Правительству РФ с просьбой ввести мораторий на клинические исследования на территории России как обязательное условие для одобрения иностранных препаратов. Из-за решения многих западных фармкомпаний прекратить такие испытания в РФ пациенты рискуют остаться без инновационных разработок «Большой фармы».
Всероссийский союз пациентов (ВСП) написал премьер-министру России Михаилу Мишустину письмо с просьбой на время отменить предписанное российским законом требование обязательного проведения в РФ клинических исследований новых препаратов. Пациенты опасаются, что из-за «текущей геополитической ситуации» и приостановки испытаний по инициативе фармкомпаний россияне могут вовсе остаться без современной терапии, пишет «Коммерсантъ».
Напомним, с марта 2022 года фармацевтические компании, зарегистрированные в США и ЕС, начали отказываться от проведения новых испытаний лекарств в России, мотивируя это нестабильной геополитической и экономической обстановкой и сложностями с доставкой в лаборатории образцов, полученных в ходе таких исследований. При этом они продолжают поставлять в РФ уже одобренные препараты.
Закон об «Об обращении лекарственных средств» говорит о том, что все разработанные за рубежом лекарства перед регистрацией должны пройти клинические исследования на территории страны и с участием российских пациентов. Правило не распространяется на препараты для лечения орфанных (редких) заболеваний из-за малого числа таких пациентов.
В Минздраве считают введение моратория нецелесообразным. Из-за того что клинические исследования за рубежом могут проходить по разным правилам, а также из-за отсутствия единых правил проведения инспекций и единых критериев оценки результатов исследований, автоматически принимать итоги зарубежных испытаний нельзя, прежде всего ради безопасности пациентов. Впрочем, ведомство согласилось пойти на определенные уступки.
Если российские лекарства точно так же будут признаваться за границей, то страна готова пойти на взаимное признание зарубежных препаратов при условии допуска для проведения инспекций клинических баз. Об этом заявил заместитель министра здравоохранения России Сергей Глаголев, уточнив, что соответствующие принципы заложены в праве ЕАЭС (куда входит и Россия), и что соответствующие подзаконные акты уже разрабатываются. По мнению Минздрава, такой компромисс обеспечит пациентов инновационными лекарствами и позволит подтвердить их качество и безопасность.
Post Views:
291
Подготовлена редакция документа с изменениями, не вступившими в силу
КонсультантПлюс: примечание.
С 01.09.2023 ст. 47 дополняется ч. 10 (ФЗ от 02.07.2021 N 317-ФЗ). См. будущую редакцию.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
Лекарственные средства в Российскую Федерацию могут ввозить:
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
1) производители лекарственных средств для целей собственного производства лекарственных средств;
2) иностранные разработчики лекарственных средств и иностранные производители лекарственных средств или другие юридические лица по поручению разработчика лекарственного средства для проведения клинических исследований лекарственного препарата, осуществления государственной регистрации лекарственного препарата, включения фармацевтической субстанции в государственный реестр лекарственных средств, контроля качества лекарственных средств при наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии лекарственных средств;
3) организации оптовой торговли лекарственными средствами;
4) научно-исследовательские организации, образовательные организации высшего образования, производители лекарственных средств для разработки, исследований, контроля безопасности, качества, эффективности лекарственных средств при наличии разрешения уполномоченного федерального органа исполнительной власти;
(в ред. Федерального закона от 02.07.2013 N 185-ФЗ)
(см. текст в предыдущей редакции)
5) медицинские организации, иные указанные в пунктах 1 — 4 настоящей статьи организации для оказания медицинской помощи по жизненным показаниям конкретного пациента при наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии лекарственного препарата, выданного в установленном порядке в форме электронного документа, подписанного усиленной квалифицированной электронной подписью;
(в ред. Федерального закона от 12.03.2014 N 33-ФЗ)
(см. текст в предыдущей редакции)
КонсультантПлюс: примечание.
С 01.01.2024 п. 6 ст. 48 утрачивает силу (ФЗ от 27.12.2019 N 475-ФЗ).
6) государственные унитарные предприятия, имущество которых находится в федеральной собственности, определяемые Правительством Российской Федерации, в части ввоза в Российскую Федерацию незарегистрированных лекарственных препаратов, содержащих наркотические средства или психотропные вещества, для оказания медицинской помощи по жизненным показаниям конкретного пациента или группы пациентов в соответствии с частью 3.1 статьи 47 настоящего Федерального закона.
(п. 6 введен Федеральным законом от 27.12.2019 N 475-ФЗ)