Лабораторные работы
ПО
ФИЗИЧЕСКОЙ ХИМИИ
2009
Издательский
центр
МГУИЭ
Федеральное
агентство по образованию
Федеральное агентство
по образованию
Московский
государственный университет
инженерной
экологии
Ф
экологии и природопользования
Кафедра «Общая и физическая химия»
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО ФИЗИЧЕСКОЙ ХИМИИ
Методические
указания
Под редакцией
проф. А.М.Большакова
Составители:
А.И.Мишустин,
к.ф. бЕЛОУСОВА
Москва
МГУИЭ
2009
Учебное издание
Составители:
Мишустин Александр
Иванович,
Белоусова
Кира Филипповна
Лабораторные
работы
по
физической химии
под
редакцией проф. А.М.Большакова
Редактор В.И. Лузева
Формат
бум. 60 x
84 1/16.
Объем
усл. п. л. . Уч.-изд. л. . Тираж экз. Зак.
МГУИЭ, издательский
центр,
105066 Москва, Старая
Басманная ул., 21/4
УДК 541.1
ББК
М
Рецензенты: кафедра
канд. хим. наук
Допущено
редакционно-издательским советом МГУИЭ
Мишустин А.И.,
Белоусова К.Ф.
М
Лабораторные работы по физической
химии: Методические указания /Сост.:
А.И. Мишустин, К.Ф. Белоусова. Под
ред. А.М. Большакова. Федер. агентство
по образованию, Моск. гос. ун-т инж.
экологии, ф-т экологии и природопользования,
каф. «Общая и физическая химия». — М.:
МГУИЭ, 2009. — с.
Методические
указания предназначены студентам,
обучающимся
по всем специальностям
МГУЭИ, при изучении дисциплины
«Физическая
химия».
УДК 541.1
ББК
© А.И.
Мишустин, , К.Ф. Белоусова,
составление
2009
© МГУИЭ,
2009
Лабораторная работа 1. Кинетика каталитической реакции разложения перекиси водорода
Цель работы
-
Нахождение
кинетического уравнения для каталитической
реакции разложения перекиси водорода
с определением численных значений
порядка реакции и константы скорости
реакции при температуре опыта. -
Определение
зависимости константы скорости
исследуемой реакции от температуры с
нахождением констант в уравнении
Аррениуса – предэкспоненциального
множителя и энергии активации.
Теоретическое
введение
Химическая
кинетика изучает скорость и механизм
химических реакций.
Скорость химической
реакции(w)в
гомогенной системе, имеющей постоянный
объем, измеряется изменением концентрации
вещества (C), прореагировавшего
в единицу времени (t)
w =
dC/dt.
d–
знак дифференциала, то есть бесконечно
малого изменения величины.
Скорость
всегда положительная величина, поэтому
в приведенной формуле выбирают
соответствующий знак: плюс, если скорость
выражают через концентрацию конечного
продукта реакции и минус, если скорость
выражают через концентрацию начального
продукта, так как со временем начальные
продукты расходуются, а конечные
накапливаются.
Скорость химической
реакции можно выразить изменением
молярной концентрации любого из
участников реакции в единицу времени,
(например, в секунду). Единицы измерения
скорости реакции в этом случае –
моль/(л·с).
Будем рассматривать
реакции, которые идут практически до
конца, — односторонние реакции.
Пусть количества
реагирующих веществ связаны между собой
уравнением реакции:
aA+bBlL+mM,
где a,b,l,m– стехиометрические коэффициенты.
Соотношения между
скоростью реакции по разным компонентам
можно выразить следующим образом:
dC/dt
= 1/a(-dCA/dt)
=1/b(-dCB/dt)
=1/l· dCL/dt
=1/m·dCM/dt,
Скорость реакции
тем больше, чем больше концентрации
веществ, вступающих в реакцию, так как
при большем числе реагирующих частиц
в единице объема и при большом числе
столкновений между ними в единицу
времени увеличивается вероятность их
химических превращений. Однако между
скоростью и концентрацией нет прямой
зависимости, поэтому уравнение химической
реакции отражает материальный баланс
процесса и, в общем случае, не отражает
истинного механизма реакции.
Основной постулат
химической кинетики – кинетический
закон действующих масс (ЗДМ): —
при постоянной температуре скорость
химической реакции прямо пропорциональна
произведению концентраций реагирующих
веществ, каждая из которых возведена в
степень, называемую порядком реакции
по данному веществу. Для приведенной
выше реакции ЗДМ имеет вид:
w =
dC/dt = kCAnA
CBnB,
где k– коэффициент пропорциональности,
называемыйконстантой скорости
реакции;nА,nВ–порядок реакции по компонентам А
и В соответственно.Общий порядок
реакции n = nA+nB.
Порядок – безразмерная величина,
которая, как правило, может принимать
как целые (0,1,2,3), так и дробные значения.
В общем случае
порядок по компоненту не совпадает с
соответствующим стехиометрическим
коэффициентом в уравнении реакции.
Совпадение возможно только для простых
(одностадийных) процессов, например
для реакции :H2+I2= 2HI-dCH2/dt= -dCI2/dt=k·CH2
·C
2, гдеnH2
=nI2= 1,n= 1+1=2.
Константу скорости
реакцииназываютудельной скоростью,
она численно совпадает со скоростью
реакции в момент времени, когда
концентрации всех реагирующих веществ
равны единице. Единицы измерения
константы скорости реакции – [(л/моль)n
— 1(с)-1].
Выведем
кинетическое уравнение для реакции
n-порядка,
представленной следующим уравнением
A
+ B
+··
L
Допустим, что CA=CB=
… =C, исходные концентрации
этих веществ также одинаковы и каждая
из них равнаC0.
Тогда w= -dC/dt=kCn
Поле интегрирования
и нахождения константы интегрирования
(при t= 0,C=C0) получаем
кинетическое уравнение для реакцииn-порядка
kt
= [1/(n – 1)] ·{[1/C(n
– 1)] – [1/C0(n
– 1)]}
Важной
кинетической характеристикой реакции
является время
полупревращения( период полураспада)
— ½
– время, за которое начальная концентрация
исходного вещества уменьшается в два
раза, C
= 1/2C0.
Для
определения порядка реакции используют
следующие методы
-
Метод
подстановки. -
Графический
метод. -
Универсальный
метод. -
Метод,
основанный на определении определенной
доли превращения исходного вещества. -
Метод
избытков Оствальда,
Большинство
методов требует построения графической
зависимости изменения концентрации
реагирующего вещества от времени.
В
данной лабораторной работе студентам
предлагается использовать метод
определения порядка реакции по времени
превращения определенной доли исходного
вещества. Подробно этот метод рассмотрен
в описании расчетной части работы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Методические указания к электронным лабораторным работам по курсу физической химии для студентов дневной формы обучения химико-технологического факультета и факультета строительного материаловедения
Подобный материал:
- Методические указания к лабораторным работам по курсу «Математическое моделирование, 921.14kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания к выполнению курсовой работы по дисциплине «Технология программирования», 278.46kb.
- Методические указания к лабораторным работам по биологической химии для студентов, 948.06kb.
- Методические указания к лабораторной работе по курсу «Информатика» Основы алгоритмизации, 441.82kb.
- Методические указания к лабораторным работам по курсу, 438.32kb.
- Методические указания для студентов заочной формы обучения факультета Коммерции и маркетинга, 405.26kb.
- Методические указания для студентов заочной формы обучения факультета Национальной, 287.81kb.
- Методические указания и вопросы самостоятельной работы по курсу «свиноводство и технология, 590.32kb.
- Рабочая программа и методические указания к контрольным работам для студентов специальности, 482.62kb.
ЛАБОРАТОРНАЯ РАБОТА К9
МЕТОД ПОЛУПРЕВРАЩЕНИЯ. МЕТОД ОСТВАЛЬДА-НОЙЕСА
Цели работы
- Познакомиться с теоретическими основами методов.
- Определить порядок реакции и константу скорости методом полупревращения.
- Определить порядок реакции и константу скорости методом Оствальда-Нойеса.
Рекомендации по работе и задание на лабораторную работу
Сначала программа по введенным студентом данным строит кинетическую кривую, при этом на координатной плоскости и появляется горизонтальная полоса, соответствующая определенной доле от начальной концентрации. Это сделано для удобства определения времени превращения исходного вещества на эту долю.
Согласно варианту лабораторной работы, указываемому преподавателем, нужно по табл. 2 определить номера опытов, характеризующих исследуемую реакцию, а экспериментальные данные по этим опытам нужно найти в табл. 1 Приложения.
Таблица 2
Номера опытов, необходимых для выполнения лабораторной работы
| Вариант | Номера опытов | |||||
| 1 | 109 | 110 | 111 | 112 | 113 | 114 |
| 2 | 121 | 122 | 123 | 124 | 125 | 126 |
| 3 | 133 | 134 | 135 | 136 | 137 | 138 |
| 4 | 151 | 152 | 153 | 154 | 155 | 156 |
| 5 | 169 | 170 | 171 | 172 | 173 | 174 |
| 6 | 115 | 116 | 117 | 118 | 119 | 120 |
| 7 | 187 | 188 | 189 | 190 | 191 | 192 |
| 8 | 127 | 128 | 129 | 130 | 131 | 132 |
| 9 | 139 | 140 | 141 | 142 | 143 | 144 |
| 10 | 163 | 164 | 165 | 166 | 167 | 168 |
| 11 | 145 | 146 | 147 | 148 | 149 | 150 |
| 12 | 157 | 158 | 159 | 160 | 161 | 162 |
| 13 | 175 | 176 | 177 | 178 | 179 | 180 |
| 14 | 181 | 183 | 183 | 184 | 185 | 186 |
| 15 | 151 | 152 | 153 | 154 | 155 | 156 |
| 16 | 169 | 170 | 171 | 172 | 173 | 174 |
| 17 | 115 | 116 | 117 | 118 | 119 | 120 |
| 18 | 187 | 188 | 189 | 190 | 191 | 192 |
| 19 | 127 | 128 | 129 | 130 | 131 | 132 |
| 20 | 121 | 122 | 123 | 124 | 125 | 126 |
Первая часть работы посвящена определению порядка реакции по времени полупревращения. Для выполнения этой части нужно выбрать две или три кинетические кривые из указанного списка.
Вторая часть работы позволяет определить порядок реакции по методу Оствальда-Ноейса. Тут, поскольку используется графический метод, нужно использовать данные по всем кинетическим кривым.
Анализу подвергаются результаты опытов, в которых изменяется только лишь начальная концентрация реагента. Если в реакции участвует несколько веществ, то их начальные концентрации берутся одинаковыми. Температура проведения реакции во всех опытах одинакова и равна 298 К.
Следуя указаниям программы студент находит порядок реакции и величину константы скорости реакции.
Программа составлена таким образом, что вначале порядок исследуемой реакции определяется методом полупревращения (расчетным), а затем методом Оствальда-Нойеса (графическим).
Стехиометрические уравнения реакций не приводятся, но известно, что реакции имеют дробный порядок и протекают при 298 К.
Выполнение лабораторной работы не представляет особой трудности, если следовать указаниям программы и внимательно вводить экспериментальные данные в соответствующие таблицы программы.
В отчете по лабораторной работе нужно привести:
1. Краткую теоретическую часть по указанному методу.
2. Таблицу с вычисленными значениями времен полупревращения, или времен превращения на какую-либо часть.
3. Графическую зависимость, позволяющую определить порядок реакции.
4. Выводы.
Задачи по лабораторной работе
1. Найдите порядок реакции термического разложения N2O при температуре 1030 К на основании следующих экспериментальных данных:
-
Начальное давление, торр 86,5 164,0 290,0 360,0 Время полупревращения, с 634 393 255 212
2. При изучении реакции C2H5I + OH = C2H5OH + I проводимой при условии, что 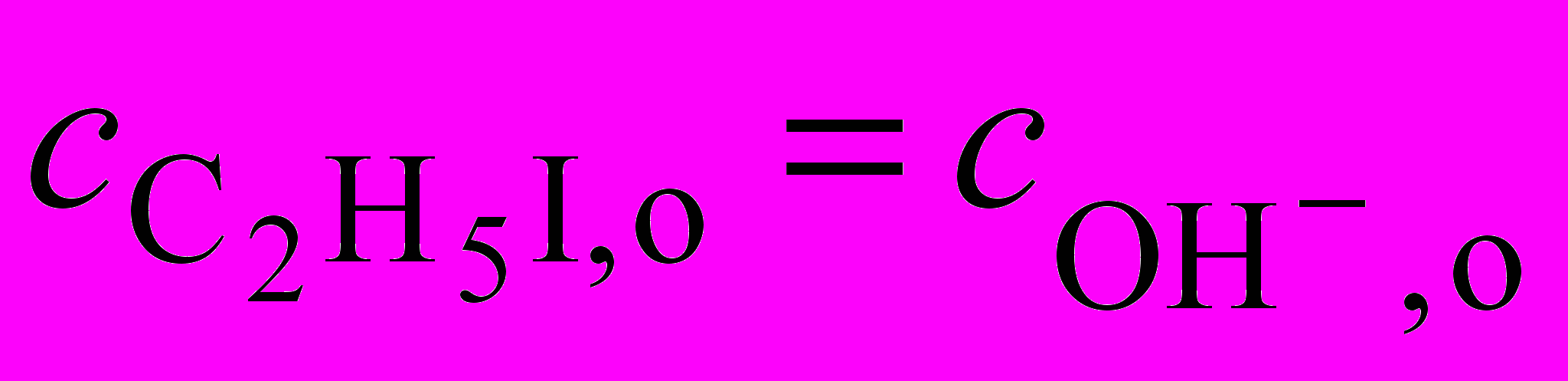
-
Начальная концентрация, моль/л 0,01 0,025 0,05 0,075 0,100 Время полупревращения, мин 1110 445 220 150 110
Покажите, что эти результаты отвечают кинетике второго порядка и найдите значение константы скорости реакции.
3. Для газофазной реакции разложения N2O при 1030 К получены экспериментальные результаты по зависимости времени полупревращения от начального давления N2O:
-
Начальное давление N2O , торр 360 290 139 52,5 Время полупревращения, с 212 255 470 860
Определите порядок реакции и найдите значение константы скорости.
4. Для газофазной реакции между NO и H2 при 1100 К получены опытные данные времени полупревращения в зависимости от начального давления реагентов при условии, что 
-
Начальное давление , торр 354 341 288 202 Время полупревращения, с 81 102 140 224
5.Для определения порядка реакции разложения амида серебра
3AgNH2 = 2NH3 + Ag3N провели три опыта с различными начальными концентрациями AgNH2 , измеряя в каждом опыте времена полупревращения 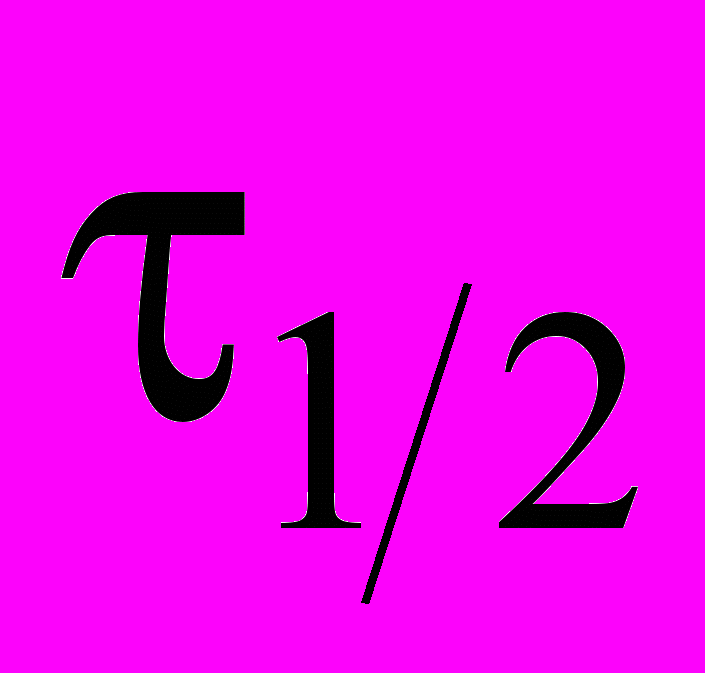
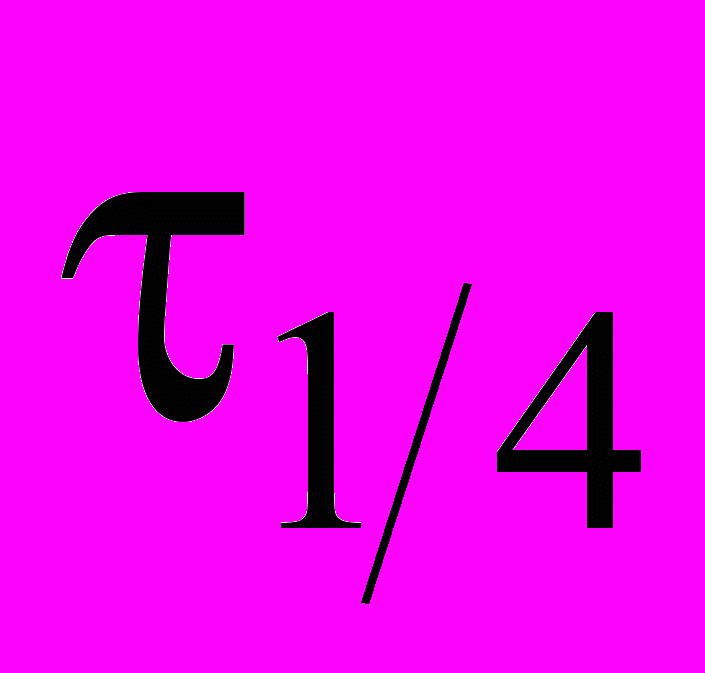
-
Начальная концентрация, моль/л , ч
,ч
1,0 15 7 0,66 34 16 0,50 60 28
Установите порядок реакции, протекающей по простому механизму.
ЛАБОРАТОРНАЯ РАБОТА К10
ДИФФЕРЕНЦИАЛЬНЫЙ МЕТОД ОПРЕДЕЛЕНИЯ ПОРЯДКОВ РЕАКЦИИ
Цели работы
- Ознакомиться с основами дифференциального метода определения порядков реакции
- Проанализировать серию опытов и определить дифференциальным методом порядок исследуемой реакции.
Рекомендации по работе и задание на лабораторную работу
Для определения порядка реакции по одному из исходных веществ этим методом нужно будет проанализировать серию кинетических кривых и по начальным скоростям реакций, протекающих при разных начальных концентрациях реагента, определить порядок реакции.
Общий вид стехиометрического уравнения исследуемой реакции
А + В = продукты.
Начальная концентрация вещества В равна увеличенной в 102 раз начальной концентрации вещества А.
Сначала программа по введенным студентом данным строит кинетическую кривую одного какого-либо опыта. По этой кинетической кривой нужно определить начальную скорость реакции. Методика определения начальной скорости подробно рассмотрена в лабораторной работе К-7, однако для удобства в рамках этой лабораторной работы также приведен фрагмент работы К-7.
Следуя указаниям программы, студент определяет начальные скорости реакции по всем кинетическим кривым и находит затем и порядок реакции и константу скорости реакции.
Исследованию подвергаются кинетические кривые, полученные в шести опытах, номера которых согласно варианту, указанному преподавателем, находятся по таблице 2.
Исследуемая реакция во всей серии опытов проводится при одной температуре, известно, что порядок реакции по веществу А дробный.
Возможно определение частного порядка реакции по одной кинетической кривой. Тогда нужно уметь определять скорости реакции в любой момент времени. Об этом подробно также рассказано в лабораторной работе К-7, однако, для удобства выполнения работы К-10, в нее включен фрагмент расчета лабораторной работы К-7.
Выбрать кинетическую кривую для анализа студент должен самостоятельно из предложенной серии опытов.
Отчет по лабораторной работе должен содержать:
- Краткую теоретическую часть по сути вопроса.
- Таблицу расчетных данных по скоростям реакций.
- Графическую зависимость, позволяющую определить частный порядок реакции и константу скорости.
- Выводы.
В выводах следует не только привести полученные значения порядка реакции и константы скорости, но и пояснить, каким образом можно определить порядок реакции по одному компоненту, если в реакции участвует два вещества.
Задачи по лабораторной работе
1. Изучение термического разложения диметилсульфоксида (DMSO) при 340 оС проводили путем измерения начальной скорости образования продукта метана. Для начальной концентрации DMSO равной 4,3 103 моль/л получены следующие результаты:
| Время, с | 30 | 150 | 300 | 600 |
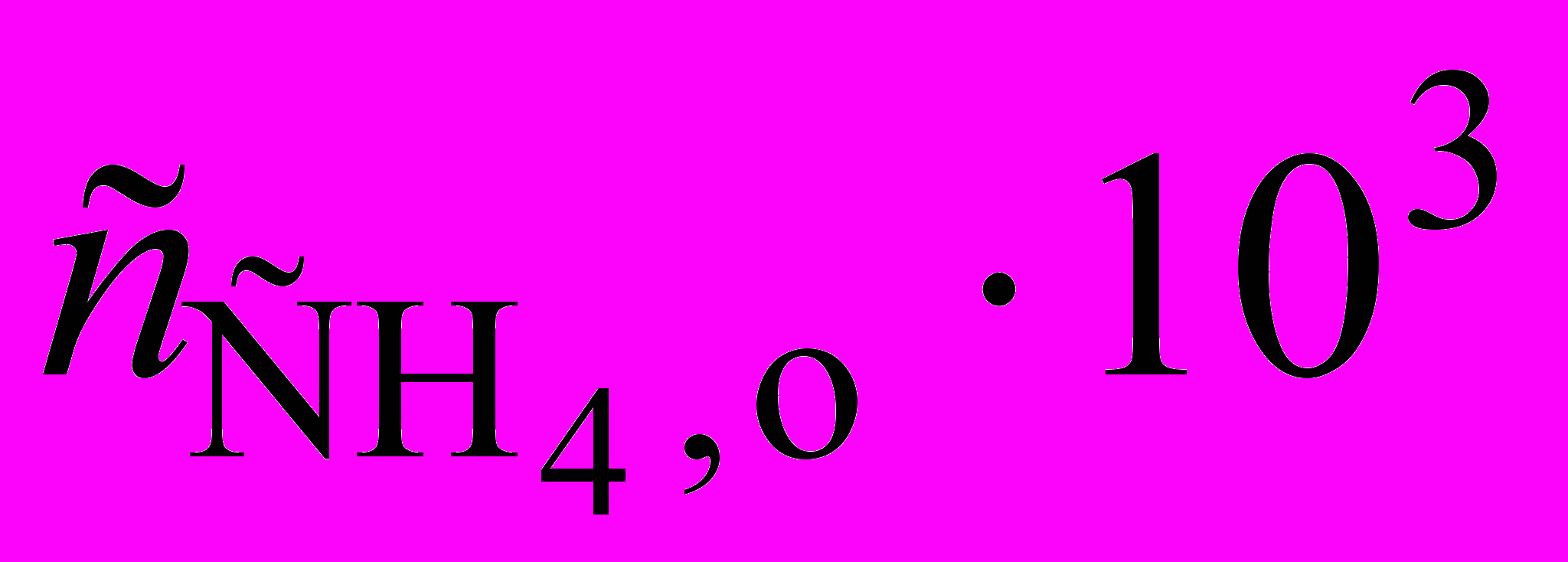 , моль/л , моль/л |
0,125 | 0,50 | 1,00 | 1,85 |
Определите начальную скорость образования метана; найдите начальный порядок реакции и константу скорости образования метана, если известны значения начальных скоростей для других начальных концентраций при 340 оС:
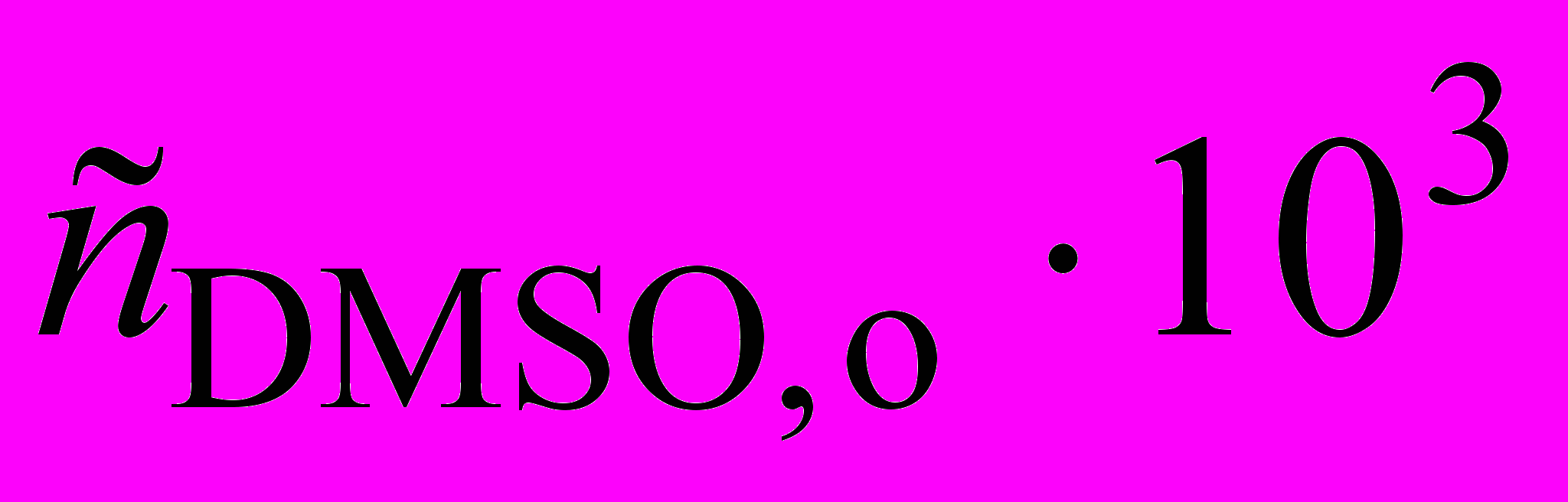 , моль/л , моль/л |
2,5 | 10 |
| wo106 , моль/(лc) | 1,95 | 7,94 |
2. Окисление в газовой фазе углеводорода RH приводит к образованию гидропероксида RO2H. В опытах, проведенных при температуре 127 оС и постоянном объеме, получены следующие значения для начальной скорости окисления wо , измеренные при анализе гидропероксида:
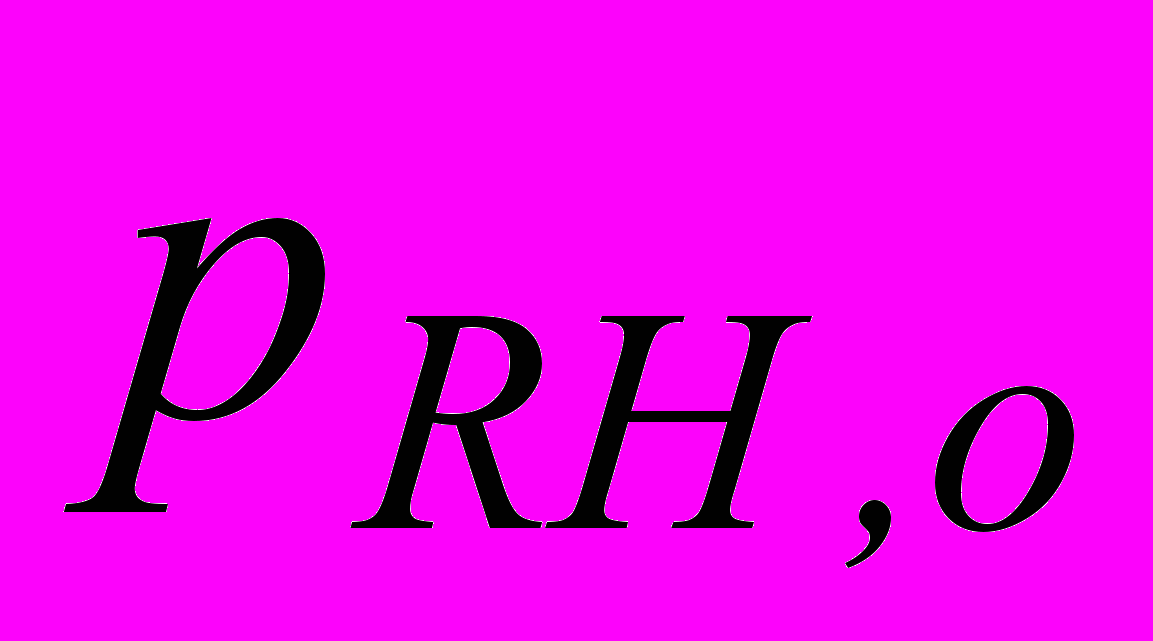 , торр , торр |
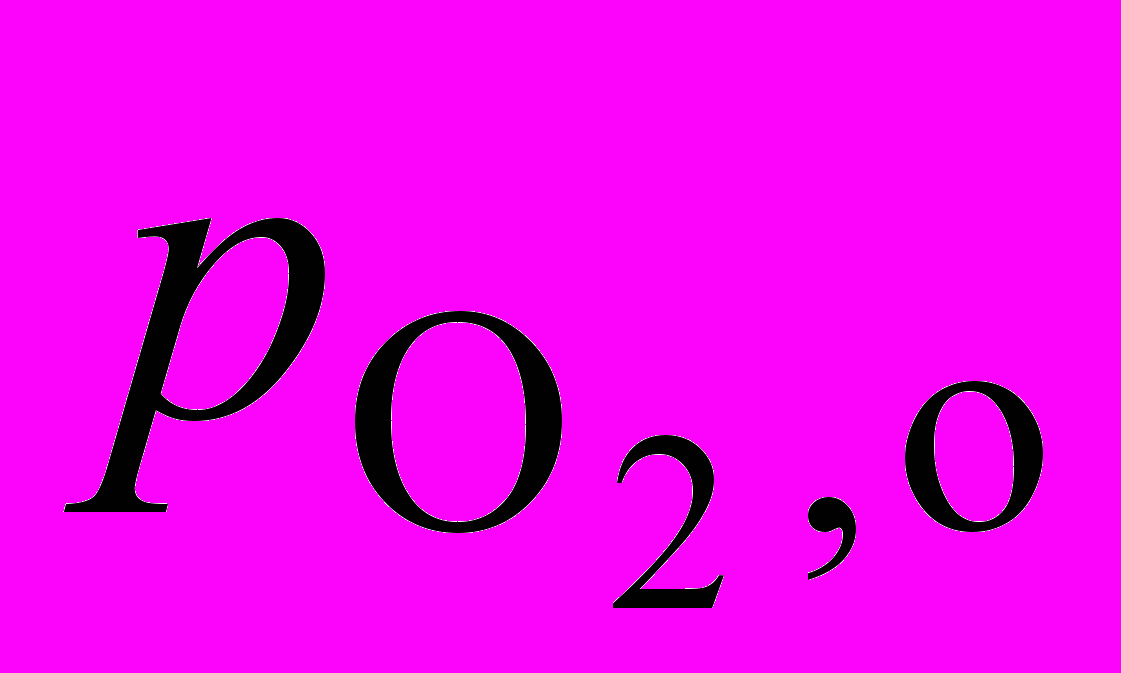 , торр , торр |
wo108 , моль/(лc) |
| 200 | 152 | 9,30 |
| 200 | 130 | 8,37 |
| 200 | 85 | 5,45 |
| 150 | 85 | 4,10 |
| 120 | 85 | 3,45 |
Найдите порядок реакции по каждому реагенту и рассчитайте константу скорости.
- Изучение газофазной реакции при постоянной температуре
2NO + Cl2 = 2 NOCl позволило получить следующие экспериментальные данные:
| Опыт 1 | Опыт 2 | Опыт 3 | |
Начальное давление 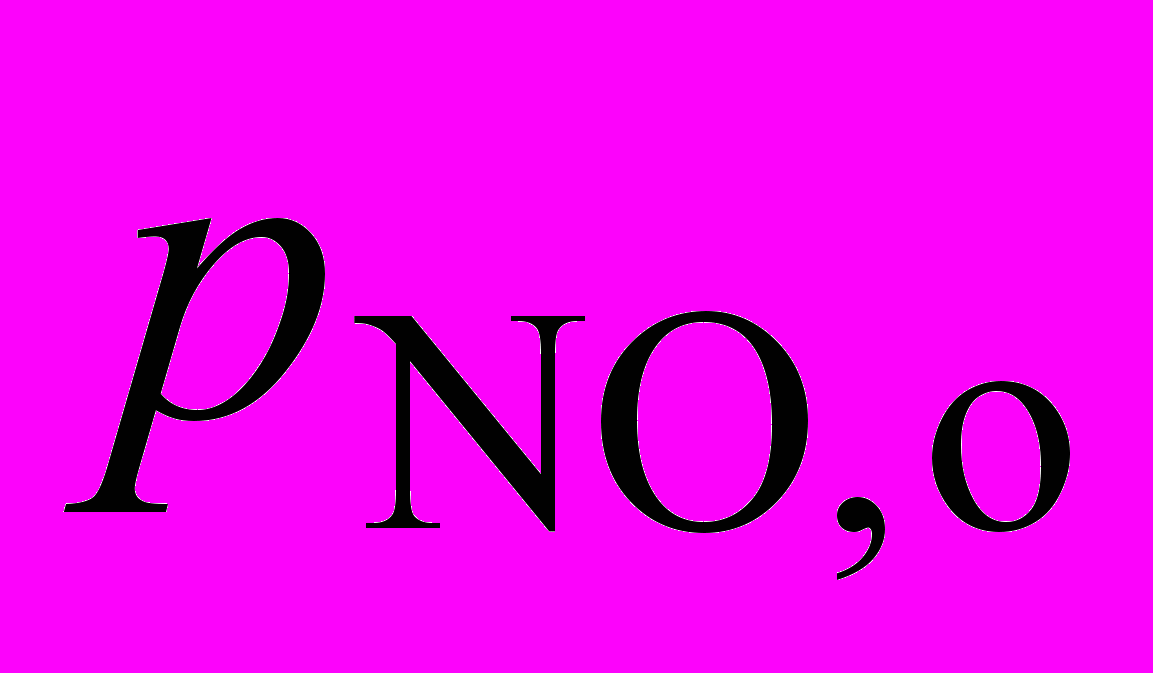 , атм , атм |
0,50 | 1,0 | 0,50 |
Начальное давление 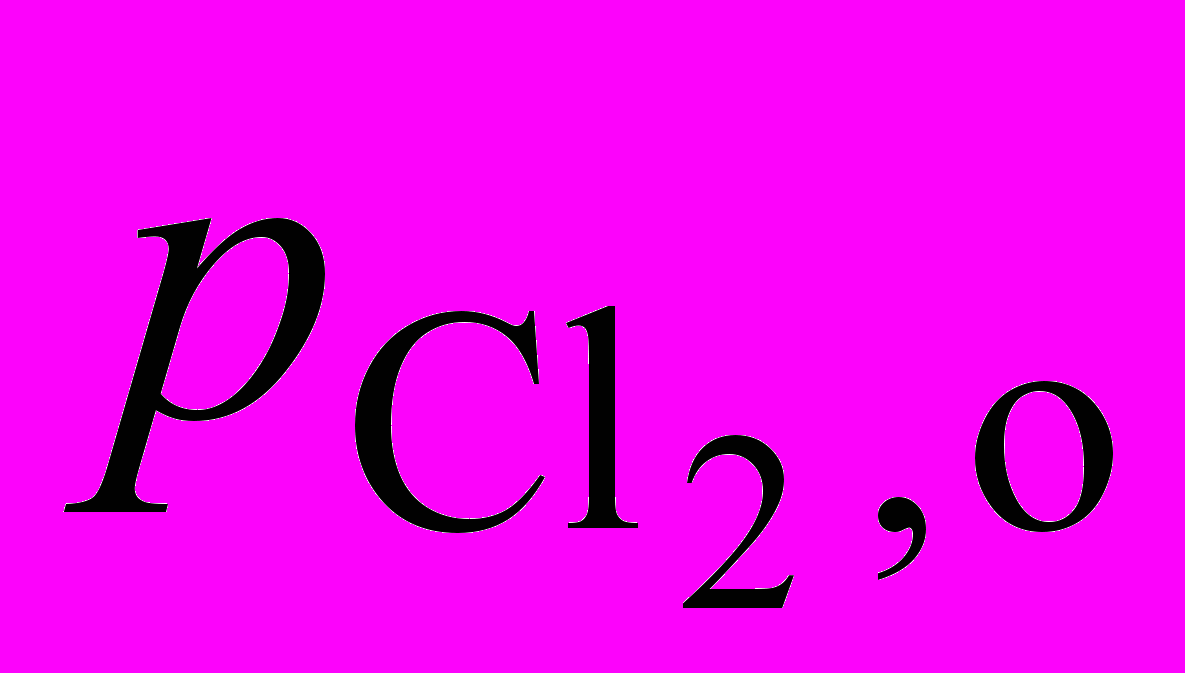 , атм , атм |
0,50 | 1,0 | 1,0 |
| Начальная скорость wо, атм/с | 5,1103 | 4,0102 | 1,0102 |
Получите кинетическое уравнение скорости данной реакции; укажите порядок реакции по веществам и в целом; определите значение константы скорости.
4. Для реакции типа 2А + 3В = Р1 + Р2 при одинаковой температуре получены следующие опытные данные:
| Опыт 1 | Опыт 2 | Опыт 3 | |
| Начальная концентрация А, моль/л | 0,10 | 0,20 | 0,20 |
| Начальная концентрация В, моль/л | 0,10 | 0,10 | 0,20 |
| Начальная скорость wо, моль (А)л1с1 | 0,10 | 0,40 | 0,40 |
Установите кинетическое уравнение скорости реакции; укажите порядок реакции по веществам и в целом; вычислите значение константы скорости и скорость самой реакции для текущих концентраций 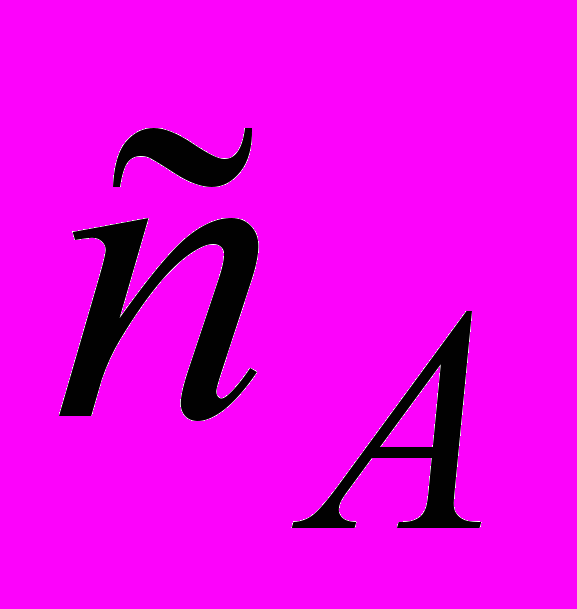
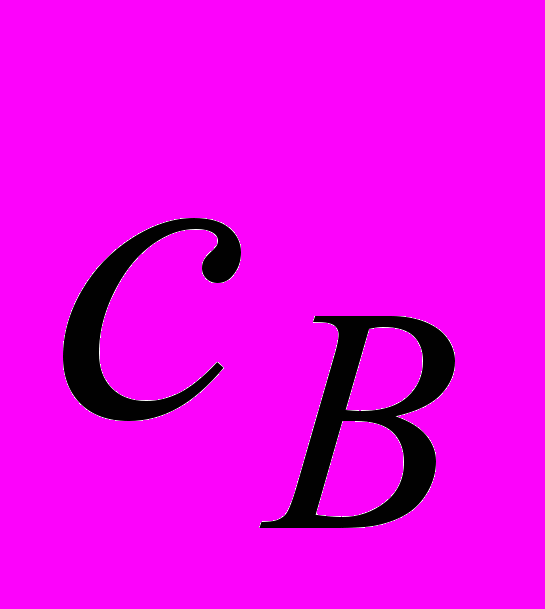
. Для реакции 2NO + 2H2= N2+ 2H2O при определенной температуре получены следующие экспериментальные результаты:
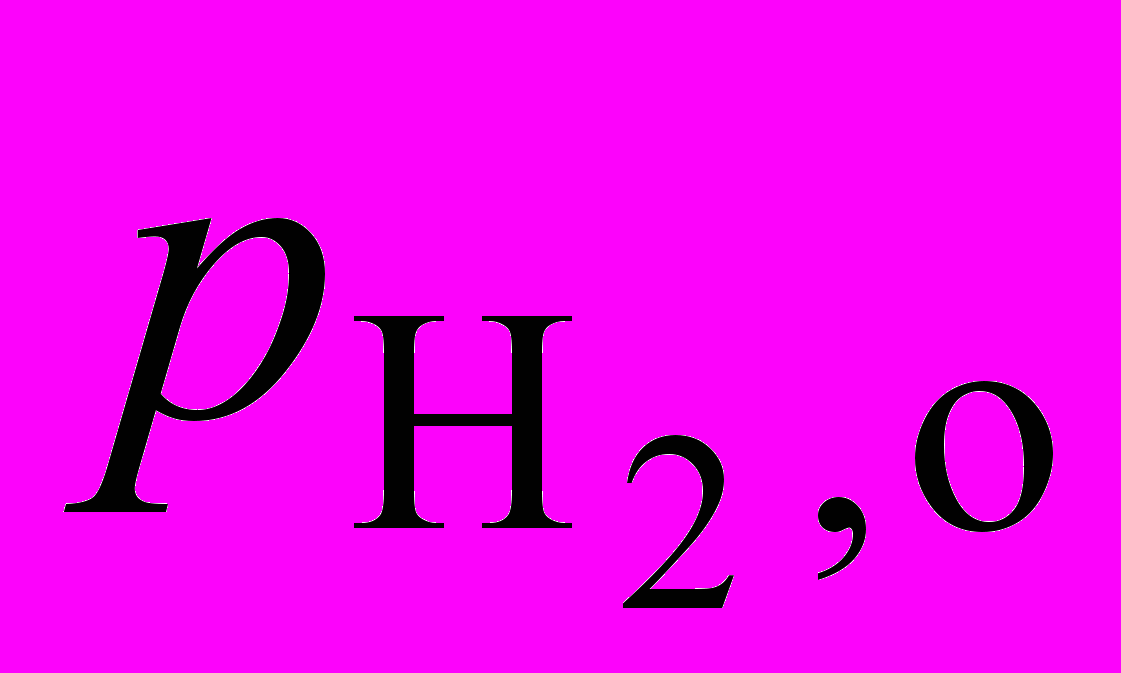 , торр , торр |
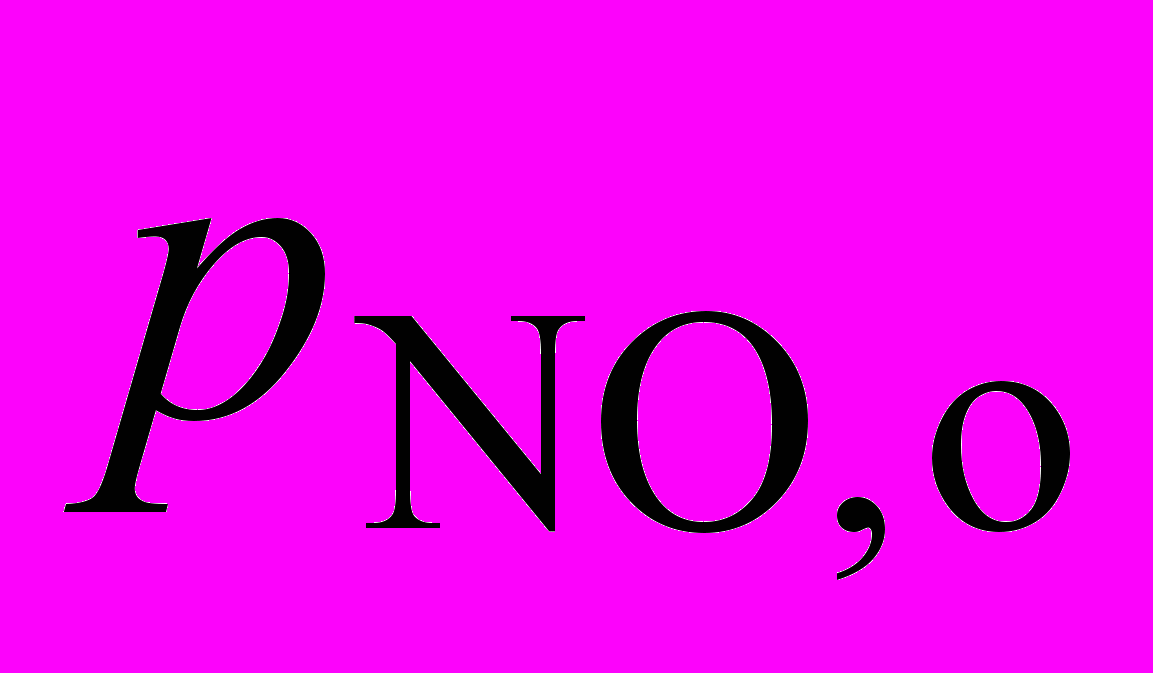 , торр , торр |
wо, атм/с | 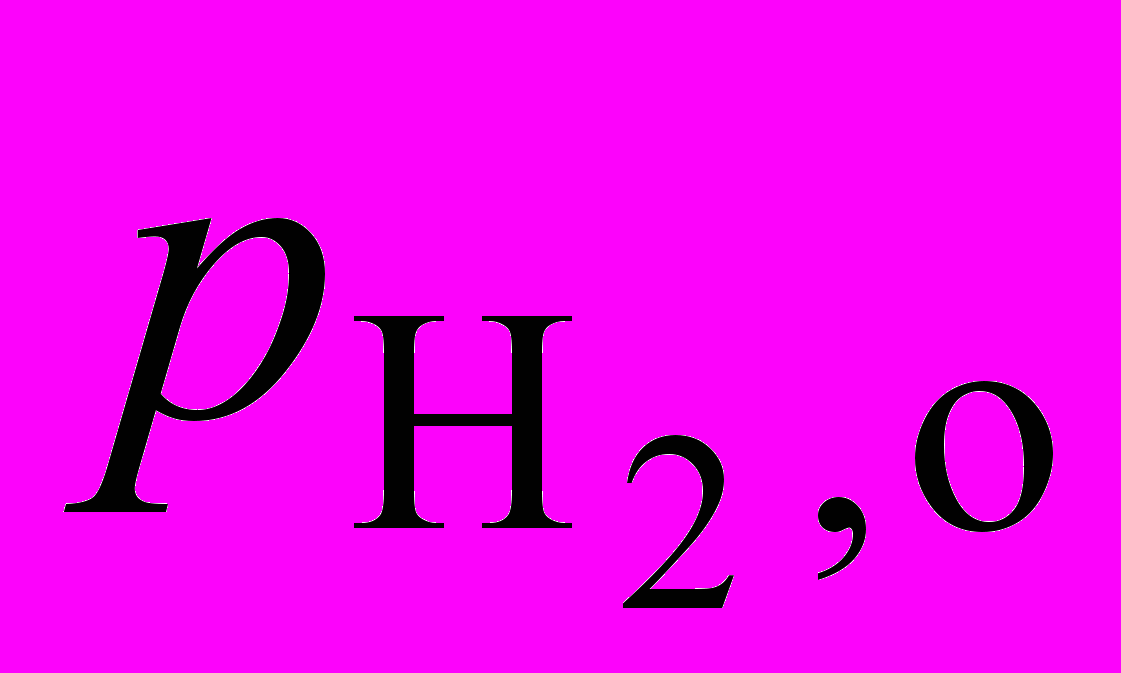 , торр , торр |
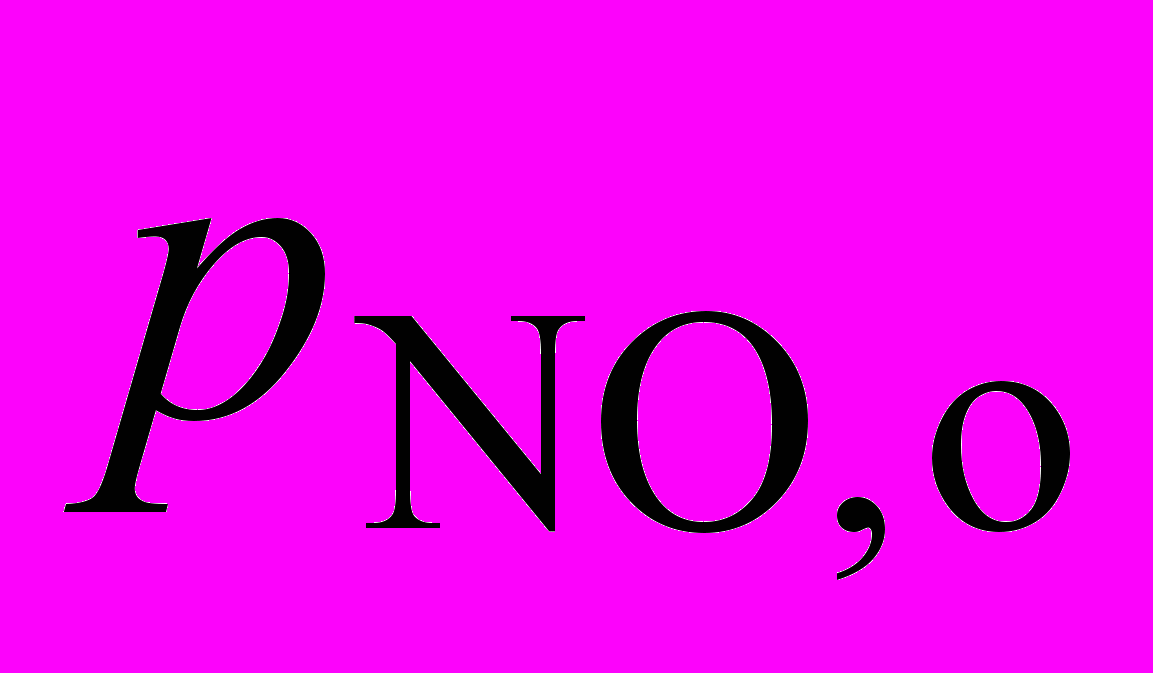 , торр , торр |
wо, атм/с |
| 289 | 400 | 0,160 | 400 | 359 | 0,150 |
| 205 | 400 | 0,110 | 400 | 300 | 0,103 |
| 147 | 400 | 0,079 | 400 | 152 | 0,025 |
Определите порядок реакции по каждому веществу и получите кинетическое уравнение реакции.
1. Скорость химической реакции
1.5. Методы определения порядка реакции
Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации другого (других) и скорость реакции зависит от концентрации только этого реагента, используется для определения частных порядков реакции – это т.н. метод избыточных концентраций или метод изолирования Оствальда. Порядок реакции по данному веществу определяется одним из перечисленных ниже методов.
Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных частных порядков эти зависимости имеют следующий вид:
|
Порядок реакции |
Зависимость концентрации от времени |
|
1 |
|
|
2 |
|
|
3 |
|
Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться прямой линией. Если, например, график, построенный по опытным данным, оказался прямолинейным к координатах lnC = f(t), то частный порядок реакции по данному веществу равен единице.
Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведённые в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаётся постоянной во времени.
|
Порядок реакции |
Выражение для константы скорости |
|
1 |
|
|
2 |
|
|
3 |
|
Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых в таблице уравнений, для реакции первого порядка время полупревращения не зависит от Co, для реакции второго порядка – обратно пропорционально Co, и для реакции третьего порядка – обратно пропорционально квадрату начальной концентрации.
|
Порядок реакции |
Выражение для периода полупревращения |
|
1 |
|
|
2 |
|
|
3 |
|
По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный метод, в отличие от описанных выше, применим и для определения дробных порядков.

