Покупка малых биотех-стартапов означает рост для всей отрасли, но удастся ли налоговой реформе США заставить крупные фармацевтические компании активнее инвестировать в подобные предприятия
Исследователи и инвесторы собрались на ежегодной фармацевтической конференцию по здравоохранению компании JPMorgan. На главном мероприятии в года для данной сферы участники решали множество вопросов. Вполне вероятно, ответы на них они получат еще нескоро.
Покупка малых биотехнологических фирм означает рост для всей отрасли — но удастся ли налоговой реформе США заставить крупные фармацевтические компании активнее вкладывать капитал в подобные предприятия? Справится ли система здравоохранения с высокими ценами на новые лекарства, такие как препарат для генной терапии против рака или каких-либо редких заболеваний, ведь ценник на них обычно колеблется от $300 000 до $900 000? Смогут ли страховые компании и государство обуздать рост цен на лекарства вообще и ежегодное повышение стоимости продукции фармацевтических гигантов в частности?
Возможно.
Скучная встреча биотех-стартапов
Самыми перспективными игроками на встрече оказались мелкие компании, едва оправившиеся от прошлых неудач. После того, как некоторые инвесторы разглядели в многострадальной вакцине фирмы Novavax новую надежду для бизнеса, ее акции выросли в цене на 50% и сейчас торгуются на уровне $2. Благодаря урегулированию патентного спора с компанией Teva, цена акций Alder Therapeutics, разрабатывающей препарат против мигрени, подскочила на 30%, однако по сравнению с прошлым годом их стоимость все еще ниже на 25%. Ценные бумаги компании Nektar Therapeutics, которая сейчас может похвастаться рыночной капитализацией в $10 млрд, выросли в цене на 16%: инвесторы не теряют надежды, что лекарство этой компании от рака отлично себя проявит в сочетании с иммунотерапией от Merck и Bristol-Myers Squibb.
- Наука против старости. Как разогнать эволюцию и быть вечно молодым
Не обошлось также и без оглушительных провалов. После того, как компания Axovant обнародовала данные о том, что малоэффективный препарат против болезни Альцгеймера снова доказал свою бесполезность, а потом еще по ошибке заявила о действенности другого своего лекарства (от болезни Паркинсона), котировки акций компании Axovant обрушились на 50%. Председатель совета директоров Вивек Рамасвами и генеральный директор Дэвид Ханг, должно быть, чувствовали себя как на эшафоте. Тем не менее, у них по-прежнему имеются огромные суммы, которые удалось привлечь компании Roivant Sciences, материнскому предприятию Axovant, и на эти средства можно придумать что-то новое и более впечатляющее.
Перспективы
А что с крупными сделками? Инвесторы и сами бы рады, но если спросить потенциальных покупателей, то они скажут, что из-за новых налоговых законов, которые помогут компаниям получить доступ к заокеанским рынкам сбыта и прибыли, а также вернуть капитал в Соединенные Штаты, ровным счетом ничего не изменится. Сомневаться в этом пока не приходится. Адам Шехтер, президент по разработкам в области здравоохранения в компании Merck приветствует налоговую реформу и считает, что она также «уравняет в возможностях» и предприятия, ведущие бизнес только в США. Но важно ли для заключения сделок что-нибудь еще? Эксперт полагает: «На рост числа слияний и поглощений указывает не только это. Многое зависит от типа и стоимости конкретных активов».
Пол Бионди, руководитель развития бизнеса в Bristol-Myers Squibb, утверждает, что налоговая реформа может стать мощным «стимулом» для проведения нескольких крупных сделок. Впоследствии, по его мнению, число сделок возрастет, потому что сейчас объем операций по слияниям или поглощениям относительно мал, а рынок всегда стремится к средним значениям: «Я считаю, что скоро сделок будет заключаться больше, долгосрочный тренд заключается в стремлении к некой средней величине».
Новый лидер отрасли
Одной из крупнейших сделок в JPMorgan стала покупка корпорацией Celgene компании Impact Biomedicines за совокупную планируемую сумму $7 млрд ($1,1 млрд в качестве первоначального взноса) — и эта сделка чуть было не сорвалась. По словам Джона Худа, исполнительного директора Impact, о продаже компании и об условиях сделки никто еще не думал даже в декабре. Он утверждает, что внутри компании разгорались «серьезные споры» о том, стоит ли компанию продавать вообще. Окончательное решение приняли после главного вывода: запуск препарата в продажу (лекарства для больных миелофиброзом, которым не помог «Джакафи» производства Incyte) состоится скорее и без значительных рисков именно под началом корпорации Celgene.
«Есть только одна компания, располагающая самой обширной инфраструктурой для исследований в области рака и заболеваний крови. Эта компания не станет для нас препятствием. А если вдруг они не смогут предоставить лекарство больным, я буду лично говорить об этом с руководителем развития бизнеса Celgene Робертом Хершбергом». Исполнительный директор Impact Чарли Макдермотт объясняет: «Мы все время получаем от больных письма о том, что они умирают и этот препарат им просто необходим».
Джон Худ успел стать для мира биотехнологий настоящей звездой, потому что те, кто занимается разработками лекарственных средств, компаниями обычно не руководят. В течение всего нескольких лет он привлек для своего предприятия инвестиции в размере $100 млн и продал компанию Celgene.
Это цена или номер телефона?
Как бы там ни было, в JPMorgan больше обсуждают не Impact, а Celgene. Многие считают, что корпорация слишком много переплатила, а еще более широкий круг наблюдателей задается вопросом, не придётся ли фармацевтическому гиганту заключать еще более дорогостоящую сделку, особенно с учетом истекающего срока патента на «Ревлимид», один из ключевых препаратов для Celgene. Многие инвесторы советовали корпорации приобрести компанию Bluebird Bio, ведущую разработки в области генной терапии.
Даже несмотря на все приобретения Celgene, ясно становится одно: люди, занятые в фармацевтической индустрии реагируют на цены частных биотехнологических компаний так же, как обычные люди, не связанные с фармацевтикой, реагируют на цены лекарств. Неужели это может стоить столько? Я задал этот вопрос Кристине Бароу, партнеру инвестиционной фирмы ARCH Venture Partners и признанному виртуозу по поиску инвестиций для стартапов. Она отмечает, что, Denali, одна из компаний, в которые инвестирует ее фирма, в этом году вышла на рынок ценных бумаг — отчасти для того, чтобы обеспечить себе выход на массовые рынки в будущем. Она просчитывает все далеко наперед: «Мне совсем не хочется, чтобы компания занимающаяся здравоохранением и имеющая капитализацию в размере $10 млрд оставалась частной и закрытой организацией».
Помимо поглощений и слияний, огромный интерес представляет то, как новые научные прорывы (например, первая генная терапия от Spark Therapeutics или уничтожающие раковые образования T-лимфоциты, разрабатываемые компаниями Novartis и Gilead) поведут себя в условиях открытого рынка. А чем все это обернется в итоге, мы сможем увидеть лишь через некоторое время.
Перевод Антона Бундина
Подборка наиболее крупных по размеру вложений компаний.
Список зарубежных стартапов составлен на основе рейтинга сайта Medical Startups. Компании распределены исходя из общей суммы инвестированных в них средств.
NantHealth
На первом месте по сумме вложений находится американская компания NantHealth. В 2007 году её основал Патрик Синьсян, самый богатый врач в мире по версии Forbes. Общий объём инвестиций в развитие компании составляет $640 млн. Стартап предлагает усовершенствованную диагностику онкологических заболеваний, основанную на анализе реальных клинических данных.
Наша миссия — расширение клинических возможностей в режиме реального времени благодаря новым технологиям 21 века — суперкомпьютингу, геномному анализу и молекулярному.
В 2012 году телекоммуникационная компания Verizon инвестировала в NantHealth, чтобы доставлять клинические данные с помощью смартфонов.
В 2014 году кувейтский суверенный фонд Kuwait Investment Authority вложил в стартап $250 млн. Также биотехнологическая компания Celgene профинансировала NantHealth в размере $25 млн. В том же году компанию поддержал и мобильный производитель BlackBerry. Тогда журнал Forbes оценил рыночную стоимость компании в $1,6 млрд.
В 2015 году NantHealth получила $200 млн от компании Allscripts Healthcare Solutions. В 2016 году компания стала публичной, выручив $90 млн во время IPO.
Я думаю, что это хороший долгосрочный шаг для обеих компаний. Allscripts сейчас — одна из ведущих компаний в предоставлении клинической информации больницам и врачам, у неё есть уникальный доступ к большим объёмам данных. Эта информация — то, что NantHealth пытается получить, чтобы создать индивидуальные подходы к лечению больных.
По данным Yahoo! Finance, сейчас приблизительная рыночная капитализация NantHealth чуть меньше $150 млн. Доход компании за 2017 год составил $86,7 млн.
Guardant Health
С 2011 года по октябрь 2018 года в этот американский стартап вложили около $550 млн. Guardant Health разрабатывает продукты для анализа крови на ранних стадиях рака с помощью метода использования жидкой биопсии. Результаты анализов позволяют обнаружить и отследить развитие опухоли в реальном времени, а также узнать о потенциальных вариантах её лечения.
Как одно из преимуществ этого теста отмечается быстрота проведения анализов — в два или три раза быстрее обычных. Guardant360 — это один из основных продуктов компании, который выявляет прогрессирующие твёрдые опухоли: с момента появления на рынке в 2014 году его использовали более 70 тысяч раз.
Название Guardant созвучно названию антивирусного ПО. Так мы объясняем, что такое рак: это «вредоносная программа» в клетке. Если мы сможем обнаружить эту программу на ранней стадии, то результаты лечения и профилактики могут значительно улучшиться.
Хелми Элтукху, исполнительный директор и сооснователь компании
Наиболее крупный вклад в развитие Guardant внесла корпорация Softbank, она вложила $360 млн. Среди других инвесторов — T. Rowe Price, Associates, Temasek, Sequoia Capital, Khosla Ventures, Lightspeed Venture Partners, OrbiMed и 8VC.
4 октября 2018 года компания провела IPO, в ходе которого продала акции на сумму $237,5 млн.
ADC Therapeutics
Швейцарская компания с 2011 года занимается разработкой патентованных лекарств для борьбы с твёрдыми и гематологическими раковыми опухолями. Лаборатория ADC находится в Лондоне, с 2015 года исполнительным директором является доктор Крис Мартин.
ADC привлекла $200 млн инвестиций от AstraZeneca, в развитие биотехнологий свои средства вложили и компания Auven Therapeutics, и инвестиционные фонды Redmile Group, и Wild Family Office. Общая сумма вложенных средств составила около $455 млн. Как сказал Крис Мартин в интервью для Bloomberg, компания планирует первичное публичное обращение, если реализует шесть запланированных на 2018 год клинических программ.
Allogene Therapeutics
Американская биотехнологическая компания, основанная Дэвидом Чангом, борется с раком, используя Т-клетки иммунной системы (CAR T-клетки). Согласно рейтингу Medical Startups, её финансирование составляет $411 млн.
В апреле 2018 года Allogene завершила финансирование серии A (процесс обмена привилегированных акций на инвестиции) в размере $300 млн. В состав венчурных инвесторов вошли компании Two River, TPG, Vida Ventures, BellCo Capital, Gilead, Pfizer и главный инвестиционный директор Университета Калифорнии.
Мы полагаем, что при сильной научной, клинической разработке и контрольной экспертизе команды Allogene инвестиции Pfizer позволят быстро продвинуть потенциально инновационные методы лечения и обеспечить к ним доступ пациентов.
Роберт Абрахам, старший вице-президент, руководитель группы онкологических исследований и разработок в Pfizer
11 октября 2018 года Allogene стала публичной компанией. По данным Crunchbase, в процессе IPO она получила $288 млн.
Flatiron Health
Продукты этого американского стартапа объединяют местных онкологов, учёных, медицинских работников, исследователей и государственных регуляторов на общей технологической платформе. Компания собирает и анализирует данные о лечении рака и продаёт программное обеспечение на основе этих сведений.
Сейчас в Flatiron суммарно вложили около $313 млн, стартап находится на инвестиционном раунде C. В 2013 году он получил $8 млн от Google Ventures, в 2014 году — $130 млн. В 2016 году фармацевтическая компания Roche инвестировала в Flatiron $175 млн, а уже зимой 2018 года — объявила, что купит технологический стартап за $1,9 млрд. В июне компания Roche также приобрела Foundation Medicine — она проводит геномные тесты для скрининга опухолей мозга.
Flatiron даёт нам лучшее представление о потенциале наших продуктов.
Йенс Гругер, начальник отдела ценообразования Roche — в интервью для Reuters в 2016 году
Forbes также выделяет несколько стартапов, которые занимаются анализом клинических данных на своих технологических платформах, но их реже обсуждают в прессе.
Cota
Доктор Эндрю Пекора, онколог из Нью-Джерси, основал свой стартап в 2011 году. Его название — аббревиатура от “Cancer Outcomes Tracking and Analysis” (отслеживание и анализ раковых заболеваний).
Компания использует схожий с Flatiron метод анализа данных — собирает информацию от специалистов-онкологов, обрабатывает её автоматически и вручную и создаёт категории, к которым относит того или иного пациента. Эти категории подразумевают схожий метод лечения, необходимый больным. С их помощью можно также определять, какие доктора предлагают своим пациентам наименее затратные и наиболее эффективные методы лечения — с учётом их затрат и результатов назначенной терапии.
В 2014 году Cota получила $7 млн в серии А, возглавляемой компанией Horizon Blue Cross. В 2016 году в рамках раунда В инвестиции составили $18 млн вместе с Celgene и Novartis в качестве лидеров. Раунд С, собравший $40 млн, возглавила IQVIA — компания, созданная в результате слияния двух американских гигантов в области данных и здравоохранения — IMS и Quantiles.
Tempus
Стартап появился в 2015 году. Жене его создателя Эрика Лефкофски диагностировали рак, тогда семья лично столкнулась с недостатком клинической информации о способах его лечения. На своей платформе Tempus собирает генетические данные об опухолях и клинические данные о том, как пациент реагирует на то или иное лечение.
Я не могу поверить, что у нас с женой нет доступа к большему количеству информации и данных.
По данным Crunchbase, финансирование частной компании сейчас составляет $320 млн: наибольший взнос в размере $110 млн стартап получил летом 2018 года от британской инвестиционной компании Baillie Gifford.
Стартапы из России
По данным Skolkovo Ventures, в технологии генной терапии и молекулярной биологии и диагностики онкологических заболеваний всего инвестировали около 84 млн рублей.
Например, компания «Биочип» фонда «Сколково» разработала систему, которая диагностирует онкологические заболевания в течение трёх-четырёх дней вместо 14-35 суток в обычной практике.
Такие сроки связаны с тем, что пациент, например, из районной больницы, должен получить для прохождения биопсии направление в областной онкодиспансер, где, как правило, очереди на исследования. Мы предлагаем упростить всю цепочку за счёт виртуальной передачи данных напрямую врачу-морфологу. В результате пациент уже через три дня будет иметь на руках диагноз.
Её пилотный проект сейчас запустили в Новгородской области. Компания также предлагает биочипы, которые могут с помощью флуоресцентного свечения распознать восемь типов рака в течение часа после помещения в контейнер биологического материала.
Проект Unim Алексея Ремеза, основанный в 2013 году и предоставляющий возможность дистанционного диагностирования онкологических заболеваний, дважды получил инвестиции от ФРИИ: в год своего основания и в 2016 году — в рамках единой сделки фонда и вице-президента «Ростелекома» Алексея Басова. Суммарно эти вложения составили 11 млн рублей. В декабре 2017 года компания открыла свою лабораторию онкодиагностики в технопарке «Сколково».
Бывший участник фонда «Сколково» стартап «ХимСервис», созданный в 2013 году и принадлежащий Дмитрию Коваленко, разработал систему скрининга онкологических заболеваний по слюне и подал российскую, евразийскую и PCT патентные заявки. Также компания подписала соглашение о совместной работе со Страсбургским университетом, в команду официально вошёл главный торакальный хирург Франции Гилберт Массард и главный онколог Омской области Виктор Косенок.
У стартапа есть свой «коробочный» продукт, однако в планах создание европейской клиники, для которой нужны новые денежные вложения. «ХимСервис» уже прошёл два раунда частных инвестиций и привлёк денежные средства через краудфандинговую площадку Boomstarter, сейчас готовится третий раунд. Для выхода на европейский рынок стартапу необходимо около $5 млн, на этом этапе количество вложенных средств составляет около $500 тысяч.
В 2018 году на площадке фонда «Сколково» появилась корпоративная акселерационная программа биофармацевтической компании AstraZeneca. Своей целью акселератор назвал в том числе поиск проектов и решений в области онкологических заболеваний.
В номинации «Лекарственные препараты и биомедицинские клеточные продукты» третье место занял проект Pamdeca, задача которого — «разработка пептидного препарата, активирующего макрофаги иммунной системы человека для борьбы с раком».
В мае 2018 года акселератор G4A Moscow, организованный компанией Bayer при поддержке ФРИИ, отобрал для совместной шестимесячной работы восемь стартапов в сфере цифровой медицины. Один из них — «Информатизация клинических исследований в онкологии» — направлен на улучшение процессов исследований при помощи искусственного интеллекта и блокчейна.
19 октября 2018 года фонд «Сколково» вместе c Bayer объявили о совместном конкурсе Patents Power, принять участие в котором смогут медицинские компании, занимающиеся созданием клеточных продуктов для женского здоровья и разработкой лекарств от сердечно-сосудистых и офтальмологических заболеваний, злокачественных новообразований. Победители смогут получить поддержку от экспертов и побороться за гранты суммой до 5 млн рублей.
Мы продолжаем рассказ о последних достижениях российской медицины в области лечения онкологии. В предыдущем материале речь шла о диагностике онкозаболеваний и новейшей отечественной медтехнике для их лечения. Также мы рассказывали о новейших способах борьбы с детской онкологией. Сегодня поговорим о лекарствах — оригинальных российских разработках и аналогах современных импортных препаратов, а также радиофармпрепаратах, которые у России закупают многие страны мира, включая Запад.
Чем заменить зарубежные препараты против рака
Не секрет, что существенную часть отечественного рынка онкопрепаратов занимают дженерики — воспроизведенные аналоги проверенных временем лекарств. Они нужны для доступности лечения большинства онкобольных. В условиях нестабильности внешнеэкономической ситуации и риска прекращения поставок пациентам нельзя остаться без лекарств, рак ждать не будет.
За 2022-2023 годы российские производители довольно успешно продвинулись вперед в импортозамещении онкопрепаратов. Недавно в столице провели два конкурса по открытию новых фармзаводов по офсетным контрактам. Это означает, что город обязуется покупать препараты у производителя в течение нескольких лет в ответ на инвестиции в создание производств. Среди лекарств, выпуск которых начнется в течение ближайших лет, есть и препараты от онкологии. Это, в частности, препараты на основе моноклональных антител пембролизумаб для лечения меланомы и рака легкого (аналог зарубежного препарата с торговым названием Китруда) и даратумумаб (от множественной миеломы) разработки отечественной компании «Р-Фарм». У компании уже заключены офсетные контракты по выпуску лекарств, в том числе и от рака, с властями Санкт-Петербурга (с 2026 года) и Москвы (на 2023 год). Кстати, препарат с действующим веществом пембролизумаб выпускает еще одна российская компания BIOCAD. В 2022 году его зарегистрировали с торговым названием Пемброриа, а в 2023 этот российский дженерик подтвердил соответствие оригинальному зарубежному лекарству.
Победителем второго конкурса, объявленного властями столицы, стало предприятие «Велфарм-М». В течение ближайших лет на открытом в 2023 году новейшем заводе по мере его выхода на полную мощность планируют выпускать лекарства от рака, которые закроют потребность российского здравоохранения на 80%.
Активно занимаются импортозамещением онкопрепаратов и другие отечественные фармпроизводители. По словам министра здравоохранения России Михаила Мурашко, за 2021-2022 годы было зарегистрировано 135 противоопухолевых препаратов, и еще около 250 находятся в процессе регистрации.
Благодаря этому в России сейчас стали доступны собственные аналоги онкопрепаратов тамоксифена (показан при раке груди, яичников, предстательной железы), с которым с осени 2022 года наблюдались перебои в аптеках, эрибулина (рак молочной железы, неоперабельная липосаркома), абиратерона (рак предстательной железы), леналидомида (множественная миелома), эверолимуса (распространенный и/или метастатический почечно-клеточный рак, также профилактика отторжения трансплантата почки и сердца) и других важных лекарств. Кроме того, начал проходить испытания и скоро станет доступным для пациентов отечественный аналог пертузумаба (рак груди). А еще с 2022 года в России разрабатывается препарат от рака желудка, местно-распространенного или метастатического немелкоклеточного рака легкого и метастатического колоректального рака с действующим веществом рамуцирумаб. Это будет аналог единственного доступного на сегодняшний день препарата рамуцирумаба (в продаже под названием Цирамза) зарубежной компании Eli Lilly, которая в марте прошлого года уже объявляла о прекращении поставок части своих лекарств в Россию, правда, онкопрепараты в тот раз не вошли в ее стоп-лист.
Говоря об импортозамещении лекарств от рака, нельзя не вспомнить и о расширении производственных мощностей российских компаний, что позволит им выпускать еще больше лекарств. В 2022 году объявили о создании новых производственных линий или даже заводов по выпуску именно онкопрепаратов следующие отечественные производители:
- «Фармасинтез» — запланировано строительство нового завода в Новосибирске;
- «Амедарт» — запущено производство онкопрепаратов на территории особой экономической зоны «Технополис Москва»;
- «БиоДжет» (в составе «ФармЭко») — планируется запуск производства таргетных препаратов от рака в 2023 году в ОЭЗ «Технополис Москва»;
- Завод «Биохимик» компании «Промомед» — откроет три производственные линии по выпуску лекарств против рака в Саранске;
- Предприятие «Полисинтез» фармкомпании «Полисан» из Санкт-Петербурга открыло в Белгороде две новые линии для производства фармацевтических субстанций, из которых будут выпускать, в том числе, и онкопрепараты.
Что нового в РФ по инновационным разработкам от рака
В нашей стране есть и инновационные оригинальные разработки препаратов, аналогов которых пока нет в мире. Какие-то из них уже используются для лечения пациентов, при этом проходя испытания по новым показаниям, а какие-то только готовятся выйти на рынок. Расскажем о них подробнее.
Иммунотерапия рака
В 2022 году началось сразу несколько испытаний по новым показаниям у оригинального отечественного препарата Фортека (действующее вещество пролголимаб) от компании BIOCAD. Пролголимаб – это человеческое моноклональное антитело, первый оригинальный PD-1 ингибитор изотипа IgG1 с модифицированным Fc-фрагментом. Такие препараты действуют системно на весь опухолевый процесс, уничтожая не только основной очаг, но и метастазы, в том числе и отдаленные. При этом здоровые ткани организма препаратом не повреждаются, как при токсичной химиотерапии.
Интересный факт, в названии препарата прОлГолимаб зашифровано имя сотрудницы BIOCAD Ольги Гончаровой. Под ее руководством была разработана первая в России технология промышленного производства терапевтических антител. Это лекарство вышло в 2020 году для лечения меланомы кожи и слизистых оболочек у взрослых пациентов с неоперабельной или метастатической меланомой.
Для исследования препарата по другим показаниям была создана программа клинических исследований HARMONY. Препарат исследуется для терапии таких заболеваний, как рак шейки матки, рак легкого и других злокачественных новообразований. Итак, за прошедший год у этого лекарства появились обнадеживающие результаты испытания по новому показанию. Компания объявила об успешном проведении второй фазы клинических исследований Фортеки против метастатического рака шейки матки (исследование CAESURA на территории России). Препарат также проходит по этому заболеванию исследование FERMATA, в котором участвуют пациентки из РФ, ЕС, включая Турцию, и Китая. Руководство компании не исключает, что после завершения этого исследования препарат будет зарегистрирован и для нового показания. Также есть вероятность, что оригинальную российскую разработку будут использовать и для лечения немелкоклеточного рака легкого. Для ее испытания против этой болезни проводится исследование DOMAJOR с участием пациентов из России, Китая и ЕС. Кстати, Китай уже готов одобрить у себя российский инновационный препарат, для чего в 2023 году проводит отдельные клинические испытания. Их организовывают разработчик — BIOCAD и китайский партнер – Shanghai Pharmaceuticals Holding.
Что касается показания неоперабельной или метастатической меланомы — то по нему препарат уже второй год входит в клиническое исследование в Москве, которое правительство столицы проводит для испытания новейших перспективных препаратов против рака. Что немаловажно, пациенты, которые не могут позволить себе оплатить такое инновационное лечение, получают его бесплатно — за счет городского бюджета.
Таргетные препараты
Таргетные, или нацеленные, лекарства против рака отличает одна особенность. Они сами находят в организме опухоль — свою единственную мишень — не затрагивая при этом здоровые клетки. Одним из примеров таких инновационных лекарств является противоопухолевый препарат на основе генно-модифицированного онколитического вируса (инактивированного рекомбинантного вируса осповакцины VV-GMCSF-Lact). Это первый в мире случай, когда в противоопухолевый препарат ввели ген для синтеза белка, уничтожающего рак. Над его разработкой совместно трудились в Институте химической биологии и фундаментальной медицины Сибирского отделения РАН, в ГНЦ вирусологии и биотехнологии «Вектор» и в компании «Онкостар» в «Сколково». В мае 2022 года его начали испытывать у женщин с раком груди в НМИЦ онкологии им. Н. Н. Петрова. Окончание первой фазы этого клинического исследования запланировано на середину 2023 года. В дальнейших планах компании — испытать инновационный препарат в лечении глиомы, аденокарциномы кожи и рака легкого.

Еще одним примером таргетного препарата является новый противоопухолевый препарат «Алофаниб» от компании «Русфармтех» (резидент «Сколково» – группа ВЭБ.РФ). Лекарство относится к ингибиторам рецептора фактора роста фибробластов. Это первый из класса аллостерический ингибитор рецептора FGFR2, отличающийся высокой избирательностью к раковым клеткам.
Он уже успешно прошел первую фазу клинического исследования у пациентов с тяжелой формой рака желудка — аденокарциномой — и остановил развитие злокачественных опухолей у 70% больных на поздней стадии с метастазами. Помимо того, что это само по себе хороший результат, препарат стал первой отечественной оригинальной разработкой против солидных (иначе — твердых, развившихся не из клеток кроветворной системы) опухолей, дошедшим до клинических испытаний. Хорошей новостью для пациентов стало соглашение о его производстве, предположительно, к концу 2025 года. Индустриальным партнером выступит компания «Р-Фарм». Сообщается, что для российских пациентов «Алофаниб» войдет в программу государственных гарантий оказания медпомощи.
Генная терапия
Первый этап клинических испытаний в начале 2023 года с успехом прошел еще один инновационный российский препарат против рака. Это генотерапевтическое лекарство «АнтионкоРАН-М», известное также как «убийца раковых клеток». В его основе два гена, один из которых уничтожает клетки опухоли, а другой активизирует иммунитет против них. При этом весь процесс идет внутри опухоли, не затрагивая здоровые органы и ткани.
Это разработка биотехнологической компании «Генная хирургия» (участника рынка НТИ «Хелснет»). Препарат испытывали против меланомы, хондросаркомы и рака груди. В 2023 году «АнтионкоРАН-М» ждут расширенные вторая и третья фаза испытаний, после чего можно будет надеяться на его регистрацию.
Радиотерапия: как современные технологии спасают даже безнадежных онкобольных
Говоря о достижениях российской науки в области борьбы с раком, нельзя не упомянуть разработку радиофармацевтических препаратов. С их помощью проводится диагностика опухолей, также врачи удаляют их даже на поздних стадиях, когда другие способы лечения могут быть уже неэффективны. По оценке главы Минздрава, сегодня в России выпускают уже около 90% зарегистрированных радиофармпрепаратов — всего их 54.
«Именно эти разработки сейчас дают надежду пациентам с запущенными онкозаболеваниями и позволяют лечить заболевание на 3-4 стадии»,
— сказал министр, выступая на XIII Форуме международной общественной организации «Движение против рака» 16 февраля.
Сегодня можно без преувеличения сказать, что Россия становится одним из мировых лидеров по разработкам и производству препаратов радиотерапии. В Обнинске Калужской области на площадке Научно-исследовательского физико-химического института (НИФХИ) им. Л. Я. Карпова под эгидой госкорпорации «Росатом» сейчас строится самый крупный в Европе завод по производству изотопной продукции медицинского назначения. Это будет современное предприятие, соответствующее мировым стандартам производства. Ожидается, что с 2025 года на 21 технологической линии нового завода начнется выпуск радиофармпрепаратов для лечения опухолей нейроэндокринной системы, головного мозга, предстательной железы, почек, костных тканей, слюнных желез, легких, яичников, мочевого пузыря, груди, кожи, печени, поджелудочной железы, кишечника, щитовидной железы, нейробластом, неходжкинских лимфом, миелоидных заболеваний и многих других нозологий.
Благодаря появлению такого предприятия, многие востребованные препараты радиотерапии станут доступнее для пациентов. В частности, это продукты на основе йода‑131, самария‑153, молибдена‑99 и перспективные радиофармпрепараты на основе лютеция‑177, актиния‑225 и радия‑223, хлорида стронция-89, а также оксабифор уреакапс (С-14), фтордезоксиглюкоза (F-18), МИБГ (I-123) для диагностики и лечения рака. Их планируют использовать не только в России, но и отправлять на экспорт, не менее чем в 50 стран, с которыми «Росатом» давно сотрудничает по поставке стабильных и радиоактивных изотопов для медицины, промышленности и науки. Кстати, среди таких стран есть и США, которые покупают у России более 40 изотопов для медицинских нужд.
Площадка НИФХИ им. Л. Я. Карпова — не единственное место, где выпускают радиофармпрепараты. Изотопы радия-223 и 224, актиния-225, йода-123 и 124, индия-111, тербия-149, галлия-68, рубидия-92, технеция-99, меди-64 и 67, висмута-212 производятся на циклотроне Ц-80 на базе Петербургского института ядерной физики им. Б.П. Константинова (ПИЯФ) в составе Курчатовского института в Ленинградской области (город Гатчина). Учреждение, которое также входит в состав ГК «Росатом», сейчас проводит модернизацию своего ускорителя протонов, попутно строя вокруг него целый научно-производственный комплекс. Ожидается, что проект будет готов в 2025 году. И тогда с помощью выпускаемых в Гатчине радиофармпрепаратов можно будет лечить и выявлять не только рак, но и болезни глаза и его придаточного аппарата, системы кровообращения, нервной системы и другие заболевания.

Отрадно, что российские ученые не останавливаются на достигнутом, и разработка новой продукции продолжается. Так, в Курчатовском институте изучают свойства изотопа свинца-212 в борьбе с раком груди. По мнению исследователей, его излучение более сильное, чем например, у лютеция-177, и позволяет уничтожать даже устойчивые к воздействию радиации раковые клетки. А достаточно долгий период полураспада даст возможность успеть доставить радиофармпрепарат в больницу и ввести пациенту. В Томском политехническом университете идет работа по импортозамещению изотопов радия для лечения рака простаты. И в НИИ онкологии Томского национального исследовательского медицинского центра испытывают сразу три новых радиофармпрепарата для выявления сложных случаев рака молочной железы. Впоследствии с их помощью можно будет удалять устойчивые к лечению опухоли, меняющие свои параметры во время других видов терапии.
В Российском научном центре радиологии и хирургических технологий им. академика А.М. Гранова Минздрава РФ разработали препараты ядерной медицины на основе актиния, с помощью которых сегодня удается вернуть к жизни самых безнадежных пациентов хосписов. Это люди с гормоноустойчивыми формами рака предстательной железы, а также нейроэндокринными опухолями с метастазами. Все они прежде считались неизлечимыми, а сегодня многие не только вернулись домой к привычной жизни, но даже вышли на работу, с гордостью рассказывают разработчики. Благодаря законодательной системе, разрешающей не регистрировать радиофармпрепараты, разрабатываемые для пациентов медучреждений, их производят и применяют прямо в Центре.
Такие научные разработки нередко удостаиваются государственных наград. В 2022 году премию Правительства РФ в области науки и техники получил, в том числе, научный коллектив НМИЦ радиологии, создавший импортозамещающую технологию производства отечественных микросфер с радионуклидом иттрий-90 для лечения опухолей в печени. Такое лечение используют, когда уже нет другой альтернативы. Больные получают несколько дополнительных лет жизни, а опухоли прекращают расти в 90% случаев, показывает практика применения отечественных микросфер с 2021 года.
Текст: Екатерина Янкевич
Фото: iStock by Getty Images
Post Views:
1 000
«Фармкомпании давно разработали средство от рака, но скрывают его, потому что им выгоднее постоянно продавать вам малоэффективные лекарства, чем один раз — то, что реально вылечит», — считают некоторые поклонники теорий заговора. Однако современная наука и законодательство устроены так, что изобрести что-то полезное втихомолку не получится: на каждом этапе требования регуляторов и собственные амбиции вынуждают ученых и фармкомпании громко трубить об успехе (а иногда и преувеличивать его). Почему же лечение рака до сих пор такое сложное, а идеальное лекарство не изобретено? Объясняет биолог Мария Кондратова — T&P публикуют отрывок из ее книги «Кривое зеркало жизни».
И числом, и умением!
[…] Поиск потенциальных лекарственных субстанций многие века был делом скорее интуиции и везения, чем расчета — вспомните историю пенициллина, выделенного из плесени, которая случайно выросла на чашке с бактериальной культурой у Флеминга, или иприт, ставший родоначальником химиотерапии. Везение продолжает оставаться немаловажным фактором успеха, однако в наши дни поиск потенциальных лекарств стал гораздо более целенаправленным. Понимание того, что в основе любого физиологического процесса лежит сеть определенных молекулярных взаимодействий, привело к формированию концепции «лекарственной мишени», целенаправленного воздействия на которую и добиваются ученые, занимающиеся разработкой новых лекарств в наши дни.
Лекарственная мишень может быть более или менее доступна прямому воздействию в зависимости от того, находится она на поверхности клетки, циркулирует в крови (как большинство токсинов) или же действует внутри клетки. В первом и втором случае основным направлением фармацевтических исследований становятся поиск и оптимизация специфических антител к данной целевой молекуле. Моноклональные антитела, о которых подробно говорилось в предыдущей главе, берут на себя решение многих фармацевтических задач, но не всех. По-прежнему непростой проблемой остается поиск препаратов, действующих на мишени, которые находятся внутри клетки, куда белки проникнуть не могут. Здесь на помощь биологам приходят химики.
До середины 1980-х годов биологическую активность новых веществ — кандидатов в лекарства — изучали, как правило, на животных либо на клеточных культурах. Такие исследования длились долго и были сильно ограничены в количестве и разнообразии тестируемых веществ. (За неделю плотной работы при таком подходе в среднем можно было оттестировать 20–50 соединений.) Все кардинально изменилось с появлением технологий так называемого высокопродуктивного скрининга, в ходе которого за несколько дней можно провести тестирование на конкретную мишень сотен тысяч и миллионов соединений. Появление этого метода значительно ускорило процесс поиска новых активных молекул. Как правило, на первых этапах проводится скрининг больших и разнообразных массивов (библиотек) химических веществ. В настоящее время большинство крупных фармкомпаний и исследовательских центров имеют такие коллекции веществ и регулярно пополняют их новыми соединениями, чтобы обеспечить как можно более разнообразный состав молекулярной библиотеки.
Первичный скрининг никогда не дает готовое лекарство. Однако полученные данные по активности того или иного вещества или группы веществ (хитов) становятся отправной точкой для дальнейшего поиска и «оптимизации» активных молекул. Оптимизация хитов включает зачастую синтез сотен и тысяч различных соединений, пока не будет достигнута нужная активность. Чтобы сократить число лабораторных экспериментов, ученые используют компьютерные методы исследования. Анализ трехмерной структуры белка, взятой из Банка данных белковых структур (PDB), может подсказать потенциальные точки (сайты) связывания для будущих лекарств, а дальнейшее компьютерное моделирование молекулярных взаимодействий предскажет пути оптимизации дизайна вещества (чаще группы веществ), способного связаться с данным белком в выбранных местах (эдакий биохимический пазл), и т. д. […]
© obewon / istockphoto.com
Тайное становится явным
[…] Для того чтобы в первом приближении заставить пошатнуться миф «Средство от рака существует, но ученые и (или) фармкорпорации скрывают его от общества», достаточно обратиться к самой что ни на есть бытовой логике. От рака умирают не только обычные люди, но и весьма богатые, знаменитые, влиятельные персоны, люди-кумиры, такие как Дмитрий Хворостовский или Стив Джобс. Трудно представить, чтобы среди разработчиков тайного суперлекарства, существуй оно на самом деле, не оказалось бы ни одного поклонника Apple. Так же как невозможно представить себе фармацевтическую корпорацию, владеющую подобным секретом и удержавшуюся от искушения вылечить столь богатого и влиятельного пациента. (Единичное выздоровление всегда можно списать на спонтанную ремиссию, так что риск разоблачения тут был бы ничтожен, а возможные выгоды — огромны.) И все-таки, ко всеобщему глубокому сожалению, Джобс умер.
Любая «теория заговора» в науке базируется на архетипических историях об ученых-одиночках, совершающих переворот в научной картине мира.
Пастер и Флеминг в свое время действительно могли бы утаить сделанные открытия, что, вероятно, отсрочило бы появление вакцины от бешенства и открытие антибиотиков на пару десятков лет. Но современная фундаментальная наука устроена иначе, чем даже 100 лет назад, а уж такая прикладная задача, как разработка нового лекарственного препарата, и подавно требует участия десятков, если не сотен людей, полностью посвященных в происходящее. Предположить, что все они окажутся упертыми маньяками-человеконенавистниками, думающими исключительно о выгоде нанявшей их фармацевтической компании, — даже в «голливудской логике» фильмов о суперзлодеях подобный сценарный ход кажется чересчур неправдоподобным. Парочка суперзлодеев — это еще куда ни шло, но сотня — явный перебор. Разумеется, настоящего конспиролога никакими доводами не проберешь, но, к счастью, таких упертых не много. Будем надеяться, что вам повезет.
Впрочем, шутки в сторону — существуют и более глубокие и далеко не столь «бытовые» объяснения того факта, что современная онкофармакология (а шире — современная наука в целом) может порой преувеличивать свои достижения, но не в состоянии скрыть их. Эти объяснения коренятся в принципах организации научного поиска в наши дни.
Дело тут не в каких-то особых личных качествах ученых. Фундаментальной наукой занимаются отнюдь не святые, а самые обычные люди со своими слабостями и недостатками. А уж прикладные исследования фармацевтических компаний и вовсе ставят во главу угла исключительно будущую доходность. И в науке, и в фарминдустрии периодически происходят скандалы из-за подлогов (реже, чем в других сферах, но случаются). Однако, если присмотреться к этим разоблачениям, легко увидеть, что они всегда связаны с преувеличением того или иного эффекта и никогда — с преуменьшением. И подобная закономерность далеко не случайна.
Рассмотрим в общих чертах процесс разработки лекарства на основе предложенных химиками активных субстанций, технология получения которых была описана выше. Часто он начинается в какой-нибудь независимой биологической или медицинской лаборатории.
Фармацевтические корпорации редко ведут свои исследования «с нуля», обычно они лишь «снимают сливки» с результатов фундаментальной науки.
Получив от коллег вещества, которые связывают предполагаемую «лекарственную мишень», биологи начинают изучать их биологическую активность сначала в культурах клеток, а потом на лабораторных животных — мышах или крысах.
Результаты своих экспериментов ученые в обязательном порядке должны публиковать в научных журналах: количество и рейтинг научных статей — это главный критерий успеха в современном научном мире. Причем, поскольку онкологической тематикой занимается очень много ученых, в этой области особенно важно не просто совершить открытие, но успеть опубликовать его первым. Успел — слава и денежные гранты для новых исследований достанутся тебе. Не успел — уйдут в другой институт. В такой ситуации «придерживать» многообещающие результаты — себе дороже.
С точки зрения научного метода отрицательный результат — тоже результат, но на практике дела обстоят совсем не так радужно. Опубликовать статью, состоящую из одних лишь «не» — «не действует», «не влияет», «не изменяет», — очень сложно. Это приводит к тому, что ученым приходится раз за разом «изобретать велосипед». Из-за того что результаты неудачных экспериментов почти никогда не публикуются, такие эксперименты обречены повторяться снова и снова. Однако есть у подобной расточительности и своя положительная сторона. Во-первых, очень сложно опубликовать ложное сообщение о неэффективности потенциально интересного вещества, чтобы «закрыть тему». Во-вторых, эффект, по небрежности пропущенный одной лабораторией, может быть обнаружен в другой при повторной постановке опыта.
Если научный институт видит в результатах изысканий своих сотрудников коммерческий потенциал, он может запатентовать ту или иную молекулу, тот или иной метод. Но патентование — это публичная официальная процедура. Чтобы защитить свои права на интеллектуальную собственность, ее необходимо обнародовать. Если же просто «спрятать открытие под подушкой», то на него с высокой вероятностью наткнется кто-то другой. Такая система (от которой многие исследователи далеко не в восторге) побуждает отдельных, не слишком щепетильных ученых преувеличивать свои достижения, но совершенно не располагает скрывать их.
Прежде чем активная молекула станет лекарством, она должна пройти множество проверок — на токсичность, на усваиваемость, на канцерогенность — и показать свою эффективность сначала в экспериментах на животных, а потом в клинических испытаниях на людях. Эти проверки требуют огромных финансовых вложений, которые могут достигать нескольких миллиардов долларов. Такие затраты ни одной лаборатории не по карману. Кроме того, биологические институты, работающие с клеточными культурами и лабораторными животными, просто не имеют права организовывать исследования с участием пациентов. Поэтому, проведя предварительные опыты на животных и убедившись в хорошем потенциале метода, ученые, как правило, предлагают свою разработку фармацевтической компании.
Та изучает результаты исследований (обращая внимание на качество и количество публикаций в том числе) и, если находит их достаточно перспективными, вкладывает деньги в разработку препарата. Скрывается ли этот факт? Вовсе нет. Фармацевтическая корпорация, как любой бизнес, стремится увеличить свою капитализацию и привлечь побольше рыночных средств. Открытие нового направления повышает стоимость акций компании, поэтому о нем будут трубить на всех углах. А вот если лекарство-кандидат не оправдает возложенных на него ожиданий, то это, напротив, будут замалчивать до последнего, чтобы избежать обвала.
Так же как и в науке, в фармацевтическом бизнесе иногда бывает выгодно преувеличить свои успехи, но никогда — преуменьшить.
Крупных компаний на лекарственном рынке несколько. Узнав о том, что конкуренты взялись разрабатывать перспективное направление, другие игроки начинают собственные исследования. Молекула или антитело запатентованы? Не беда, можно попытаться найти аналог для химического вещества или синтезировать другое антитело с похожей активностью. Наличие конкуренции и высокая стоимость клинических испытаний не дают компании-лидеру расслабиться и «почивать на лаврах». Вот, например, как на сегодняшний день обстоят дела с иммунотерапией нового поколения на основе ингибиторов контрольных точек иммунного ответа. В 2011 году компания BMS выпустила на американский рынок уже упоминавшийся препарат «Ипилимумаб» (торговое название Yervoy). В 2014 году эта же компания вывела на рынок «Ниволумаб» (Opdivo). В том же году компания Merck выпустила «Пембролизумаб» (Keytruda). В 2016 году корпорация Roche совместно с компанией Genentech представили «Атезолизумаб» (Tecentriq), а в 2017 году на рынке появились еще два препарата — «Авелумаб» (Bavencio) и «Дурвалумаб» (Imfinzi). Первая разработка стала результатом сотрудничества сразу трех больших фармацевтических компаний — Merck KGaA, Pfizer и Eli Lilly, вторая — плодом кооперации двух компаний, MedImmune и AstraZeneca. Этот краткий обзор новостей фармацевтического рынка держит в напряжении не хуже репортажа с марафонского забега: «Бегун под номером “43” вырвался вперед… Но нет, на повороте его обходит бегун под номером “112”…» Компании в этом «забеге» буквально «дышат в спину» друг другу. Победитель получит если не «все», то, во всяком случае, многое. Опоздавший потратит те же миллиарды долларов зря — захватить пустующий рынок неизмеримо легче, чем пытаться отвоевать кусок, который успели «застолбить» твои конкуренты.
Фармацевтические корпорации ускоряют выход лекарства на рынок как могут. Частенько в жертву этой гонке приносится детальное исследование побочных эффектов, иногда эффективность препарата преувеличивается в недобросовестной рекламе. Это нехорошо, но выгодно и потому объяснимо. Но «закрытие» препарата, уже готового к массовому производству, влечет за собой гарантированные многомиллиардные убытки и «головы с плеч». На подобную меру компании идут лишь в исключительных случаях и никогда из соображений «вдруг препарат окажется слишком эффективным и другие наши лекарства станут не нужны», но всегда по причине всплывших побочных эффектов, чреватых огромными исками со стороны пациентов. Важно понимать, что оценить эффективность препарата заранее — до клинических испытаний — невозможно. Препарат, показавший впечатляющую эффективность на крысах, может оказаться совершенно неэффективным в отношении людей. Так что на этом этапе скрывать фармацевтической компании просто нечего, а после клинических испытаний скрыть их результаты почти нереально. Формат современного медицинского эксперимента с участием людей требует абсолютной прозрачности и информированного согласия от пациентов и врачей (иначе его результаты просто не будут признаны официальными инстанциями и деньги окажутся потрачены впустую). Количество людей, вовлеченных в процесс на данном этапе, исчисляется уже сотнями, а иногда и тысячами. Какая уж тут «абсолютная секретность»…
Так устроен союз фундаментальной науки и прикладной фармакологии в наши дни. Слабые стороны подобной системы видны, что называется, невооруженным глазом. Запредельно высокая стоимость клинических испытаний оборачивается дороговизной новых онкопрепаратов, а стремление к публикации «любой ценой» приводит к тому, что ученые самокритично называют «низкой воспроизводимостью» целого ряда опубликованных научных результатов. Все же одного у нее не отнять — эта система исключает возможность сокрытия важной научной информации (во всяком случае, в таких конкурентных областях, как молекулярная онкология). Тайное в ней неизменно становится явным.
Факт: самым известным случаем отзыва с рынка уже одобренного медицинского препарата стала история «Талидомида» — снотворного, совершенно безопасного для лабораторных животных, но обнаружившего тератогенный эффект у человека. Женщины, принимавшие этот препарат во время беременности, рожали детей с выраженными уродствами, например без рук. Талидомидовая трагедия, в результате которой в мире в период с 1956 по 1962 год родилось около 10 000 детей с врожденными уродствами, заставила многие страны пересмотреть существующую практику лицензирования лекарственных средств и ужесточить требования к клиническим испытаниям препаратов. Фармацевтическая компания была обязана выплатить значительные денежные компенсации семьям пострадавших детей, но иски в ее адрес (уже от самих выросших жертв) продолжают поступать до сих пор.
© PAVEL IARUNICHEV / istockphoto.com
Персональная медицина — светлое будущее человечества
Скорость прироста научных данных меняет не только облик академической науки. Постепенно на стыке взаимодействия научных лабораторий, фармацевтических компаний и медицинских учреждений начинают вырисовываться контуры нового подхода к лечению рака и других сложных заболеваний. Этот подход по-русски называют «персональная медицина», хотя зарубежные исследователи предпочитают использовать термин precision medicine — точная медицина. Суть его в краткой форме можно выразить формулой «лечить не болезнь, а больного».
Эта максима подразумевает, что,
преломляясь в особенностях организма, обусловленных его уникальным генотипом и неповторимой личной историей, любая болезнь — а особенно такое многоликое и многофакторное заболевание, как рак, — приобретает индивидуальные черты,
без учета которых не может быть эффективного лечения. […]
В идеальном (но уже обозримом, а частично даже и воплощаемом) будущем лечение злокачественных опухолей представляется таким: пациент обращается к врачу, тот берет у него на анализ небольшой фрагмент опухоли. Определяется генотип новообразования, сравнивается с генотипом здоровых клеток пациента, выявляются ключевые и сопутствующие мутации. Одновременно проводится анализ клеток микроокружения опухоли, позволяющий понять механизмы, вовлеченные в угнетение местного иммунного ответа. Анализируются особенности местного энергетического обмена и кровоснабжения. Результаты всех этих многочисленных измерений вносятся в специальную компьютерную программу, которая анализирует данные на основе имеющейся у нее информации о чувствительности опухолей к различным типам лекарств в зависимости от мутаций, типа энергетического обмена, пола, возраста, генотипа пациента и предлагает одну или несколько схем лекарственной терапии из нескольких препаратов, взаимно усиливающих друг друга, для уничтожения опухоли и оптимальный вариант иммунотерапии. […]
В рубрике «Открытое чтение» мы публикуем отрывки из книг в том виде, в котором их предоставляют издатели. Незначительные сокращения обозначены многоточием в квадратных скобках. Мнение автора может не совпадать с мнением редакции.
Читайте нас в Facebook, VK, Twitter, Instagram, Telegram (@tandp_ru) и Яндекс.Дзен.
Новости онкологии
17.03.2022
Карасева Вера Витальевна
Исполнительный директор RUSSCO, доктор медицинских наук, профессор кафедры онкологии факультета усовершенствования врачей ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва
Общее количество лекарственных препаратов, которые находились в клинических разработках в 2021 году, составило более 6000, что на 68% превысило показатели 2016 года. Продолжаются разработки инновационных средств и вакцин, направленных на лечение заболеваний в различных терапевтических областях, несмотря на изменение акцентов в период пандемии COVID-19.
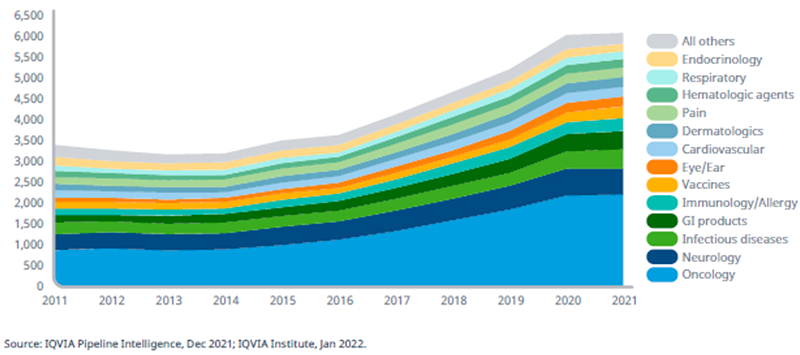
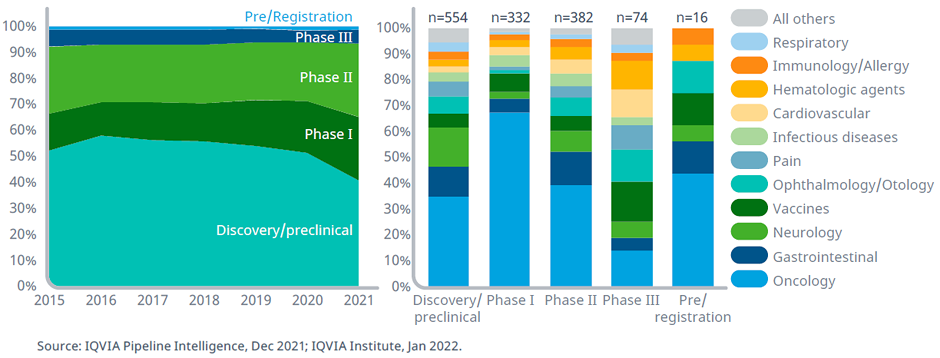
Наибольшее число исследований лекарственных средств проводится в области онкологии, гастроэнтерологии и неврологии. При этом доля лекарственных препаратов, направленных на лечение инфекционных заболеваний и вакцин, в последнее время уменьшалась, но после начала пандемии COVID-19 отмечается значительный рост этого сегмента. Панель препаратов в клинических разработках вышла на плато в 2021 г. (всего 6085 продуктов). При этом рост изучаемых препаратов в активной стадии исследования (от I фазы до подачи заявки в регуляторные органы) составил менее 1% по сравнению с 2020 г. Но по сравнению с 2016 г. отмечено увеличение на 68%. Выход на плато в 2021 г., вероятнее всего, связан с замедлением научной деятельности в результате продолжающейся пандемии. Исследования в области онкологии остаются наиболее быстро развивающимися и составляют 37% (2226 препаратов) от общего числа в 2021 г.
Число препаратов в клинических разработках с I фазы до подачи на регистрацию в различных терапевтических областях, 2011–2021 гг.
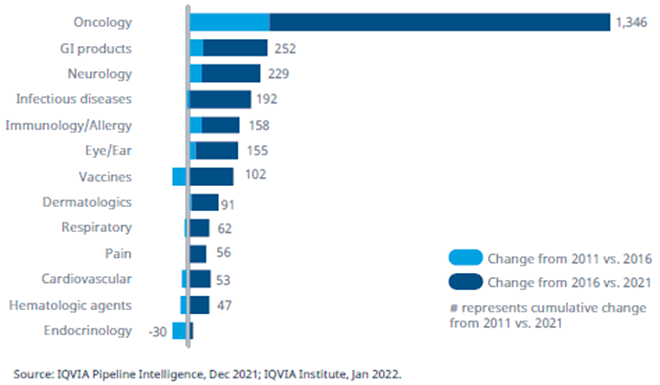
В онкологии количество препаратов, находящихся в клинических разработках, возросло вдвое, начиная с 2011 года, а наибольший рост отмечается с 2016 года.
Число препаратов в клинических разработках с I фазы до подачи на регистрацию в различных терапевтических областях: 2011 год в сравнении с 2021 годом.
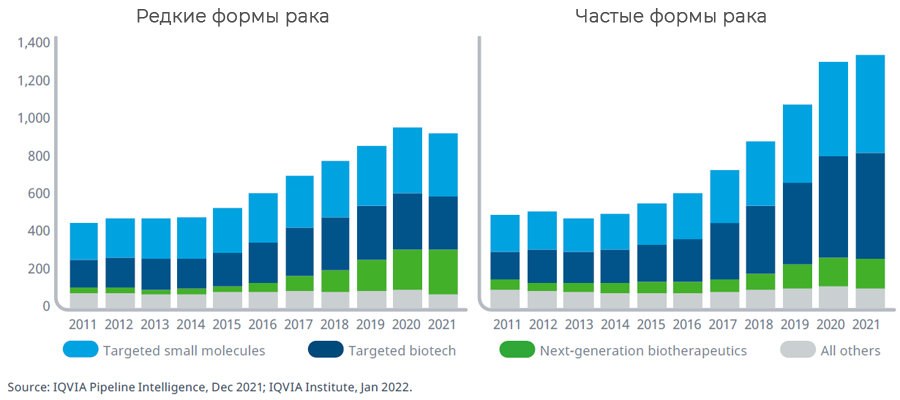
В 2021 году 930 препаратов находились в разработке для лечения редких онкологических заболеваний, что составляет 42% от общего числа исследуемых препаратов в онкологии. Показатель успеха в регистрации препаратов для редких онкологических заболеваний достигает 16%, что почти в 10 раз больше, чем успех, достигаемый для частых форм злокачественных новообразований. Вероятность того, что эти препараты перейдут в более поздние фазы исследований и в итоге придут в клиническую практику, очень высока. Таргетная низкомолекулярная терапия и биотерапия продолжают развиваться как для лечения редких, так и для более частых форм злокачественных новообразований. Они включают большое число новых средств для иммунотерапии, ингибиторов контрольных точек и ингибиторов киназ. Несмотря на то, что биотерапевтические препараты следующего поколения представляют все же меньшую долю в общем объеме клинических разработок, клеточная, генная и РНК-терапия представляется более перспективной для персонализированной терапии в онкологии. Так, биотерапия следующего поколения для лечения редких видов опухолей составляет четверть в клинических разработках. Поскольку применение большинства таргетных препаратов или препаратов следующего поколения связано с выявлением генетических мутаций или других биомаркеров, использование сопутствующей диагностики должно стать более доступным, чтобы обеспечить более точное и эффективное лечение онкологических пациентов.
Число клинических разработок от I фазы до подачи на регистрацию в зависимости от типа злокачественного новообразования: 2011-2021 гг.
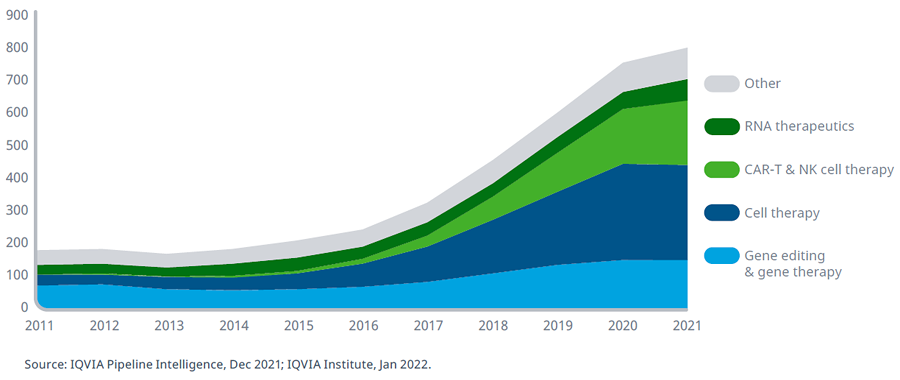
В 2021 году 804 биотерапевтических препарата следующего поколения находились на разных этапах клинических разработок от I фазы до регистрации регуляторными агентствами в различных терапевтических областях. Под термином «препараты следующего поколения» понимают клеточную терапию, генную терапию, редактирование генома, подавление нукледотидов и РНК или мРНК терапию. Количество исследований биотерапевтических препаратов следующего поколения возросло на 27% по равнению с 2016 годом. Клеточная терапия составляет наибольшую долю клинических разработок в этом направлении, и более 40% из них изучаются для лечения преимущественно часто встречающихся солидных опухолей. Несмотря на то, что изучение терапии CAR-T и естественными клетками-киллерами (NK) началось в 2012 году, 199 препаратов находятся в клинических разработках, что занимает 2 место среди биотерапевтических препаратов, находящихся в исследованиях. Значительное количество нежелательных явлений в клинических исследованиях привело к разработке профилактических мер для обеспечения более высокого уровня безопасности пациентов при исследовании этой группы препаратов.
Биотерапевтические препараты следующего поколения в клинических разработках от I фазы до подачи в регуляторные органы в различных терапевтических областях, 2011-2021 гг.
Почти две трети (886) исследований биотерапевтических препаратов следующего поколения находятся на ранних фазах исследований (предклиническая и I фаза) и меньшее количество на поздних, подчеркивая быструю эволюцию этих методов лечения на сегодняшний день. Число открытий и доклинических исследований лекарственных средств следующего поколения значительно снизилось в 2021 г., вероятно, в результате перерывов в работе с 2020 по 2021. Онкология по-прежнему составляет основную часть разработок биотерапевтических препаратов нового поколения, однако растет количество исследований и в других областях медицины.
Предклинические и клинические разработки биотерапевтических препаратов следующего поколения в различных терапевтических областях, 2011-2021 гг.
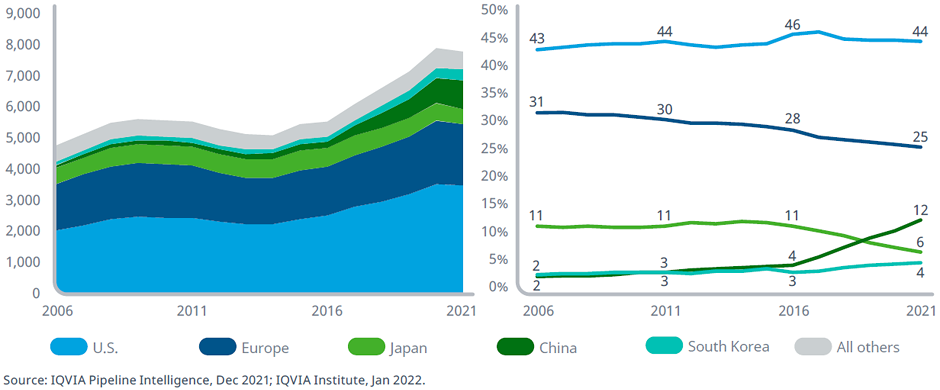
В настоящее время более 3200 компаний и более 200 академических или исследовательских групп по всему миру участвуют в создании и клинических разработках лекарственных средств в разных областях медицины.
Число препаратов в клинических разработках от I фазы до регистрации и доля разработок по странам, 2006-2021 гг.
Доля США в мировом объеме исследований во всех областях медицины остается неизменной и за последние 15 лет сохраняется на уровне 40%. Доля Европы снизилась с 31% до 25% за последние 15 лет, при этом абсолютное количество активных программ выросло на 32% — с 1492 до 1966. Компании со штаб-квартирой в Японии столкнулись со снижением доли исследовательского объема с 11% до 6% в 2021 году. Лекарственные препараты от компаний со штаб-квартирой в Китае уже сейчас составляют 12% от общего числа клинических разработок (5 лет назад их доля составляла 4%, а в 2006 году – 2%), что связано с недавними большими инвестициями, сделанными в области естественных наук в этой стране. Доля Южной Кореи остается относительно стабильной, несмотря на значительный рост перспективных исследований на ранней стадии.
По данным ВОЗ, онкологические заболевания являются одной из основных причин заболеваемости и смертности во всем мире. Кластер инновационных лекарственных средств на основе новых перспективных механизмов действия, предназначенных для лечения пациентов с разнообразными типами злокачественных новообразований, породил надежду на повышение выживаемости таких больных. Наличие большого количества кандидатов в препараты в сфере онкологии, которые на данный момент находятся на различных стадиях клинических исследований, позволяет предположить, что движение в этом направлении будет продолжаться и дальше. Однако вопросы доступности и стоимости лечения для пациентов с онкопатологией по-прежнему находятся в центре внимания дискуссий и дебатов во всем мире. В данной публикации читатели смогут ознакомиться с «ландшафтом» современных лекарственных средств, применяемых для лечения при онкологических заболеваниях, динамикой объема продаж таких препаратов на мировом рынке, а также с вопросами относительно стоимости и доступности лечения для пациентов с онкологическими заболеваниями.
ГЛОБАЛЬНАЯ ПРОБЛЕМА
Согласно данным Международного агентства по изучению рака (International Agency for research on cancer), ежегодно онкопатология диагностируется более чем у 12 млн человек во всем мире. Порядка 8 млн жителей планеты ежегодно умирают от рака. По данным ВОЗ, во всем мире наибольшее количество мужчин умирает от 5 видов онкологических заболеваний: рак легкого, желудка, печени, ободочной и прямой кишки, пищевода. В свою очередь, наибольшая смертность среди женщин отмечается от рака молочной железы, легкого, желудка, прямой и ободочной кишки, шейки матки.
Современные методы терапии онкопатологии постепенно улучшают результаты лечения пациентов с онкологическими заболеваниями, что отображается в повышении показателя 5-летней выживаемости таких пациентов за последние два десятилетия. Так, данный показатель среди пациентов с раком предстательной железы за период 1990–2010 гг. увеличился на 18%, раком печени — на 12%, молочной железы — на 8%, яичника — на 6%, поджелудочной железы, легкого и колоректальным раком — на 4%. Повышения выживаемости пациентов удается достичь с помощью скрининга и ранней диагностики, а также благодаря достижениям в сфере хирургии и химиотерапии онкопатологии. Выживаемость пациентов со злокачественными новообразованиями зависит также от их возраста и расовой принадлежности.
Темпы изменений в терапии онкопатологии ускоряются. Ранняя диагностика, увеличение продолжительности лечения, а также разработка новых перспективных методов противораковой терапии способствуют повышению уровня расходов на лекарственные средства, предназначенные для лечения онкологических заболеваний. Сегодня на R&D-разработку лекарственных средств и выбор терапии для пациента значительное влияние оказывает молекулярная диагностика. Считается, что онкопатология представляет собой гетерогенную группу заболеваний, каждое из которых вызывается комплексом генетических нарушений, определяющих свойство неконтролируемого роста и способность к метастазированию. Эти знания открыли новые возможности в диагностике и лечении злокачественных новообразований. Выявление конкретных генетических нарушений, лежащих в основе опухолевого роста, позволило установить специфические молекулярные биомаркеры и разработать на их основе тесты ранней диагностики опухолей.
«ЛАНДШАФТ» СОВРЕМЕННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ ТЕРАПИИ ПРИ ОНКОПАТОЛОГИИ
Новые терапевтические классы препаратов, а также комбинированные методы лечения при онкопатологии обещают в скором будущем изменить терапию этих заболеваний. Так, ожидается, что с помощью новых классов таких лекарственных средств удастся повысить выживаемость пациентов, а также сократить количество побочных эффектов от проводимой терапии. В свою очередь, комбинированная терапия позволит воздействовать на развитие злокачественных новообразований одновременно с нескольких сторон, что потенциально повысит эффективность лечения и повысит выживаемость пациентов с онкопатологией. По данным компании «IMS Health», за период 2010–2014 гг. на мировой фармацевтический рынок вышло 45 новых молекул (рис. 1), имеющих в целом 53 показания к применению. По итогам 2014 г. состоялся лонч 10 лекарственных средств, предназначенных для лечения онкопатологии, 5 из которых имеют биологическое происхождение: ниволумаб, пембролизумаб, блинатумомаб, рамуцирумаб и силтуксимаб.
Рис. 1 Новые молекулы, предназначенные для терапии онкопатологии, вышедшие на мировой рынок в 2010–2014 гг.*
Ожидается, что многие из новых противоопухолевых препаратов в конечном итоге будут иметь несколько показаний к применению, обеспечивая новые возможности для других пациентов с онкологическими заболеваниями. Так, по данным компании «IMS Health», из 88 лекарственных средств, предназначенных для лечения онкопатологии, маркетируемых в 2014 г., 40 имеют 1 показание к применению, а 48 — несколько. При этом уже в 2020 г. такое соотношение может составить 21:67. То есть, ожидается, что те противоопухолевые препараты, которые на данный момент имеют 1 показание к применению, в дальнейшем получат разрешение на расширение показаний к применению и будут назначаться для лечения при других видах онкопатологии. При этом ожидается, что из 88 противоопухолевых препаратов, маркетируемых в 2014 г., к 2020 г. 23 из них будут иметь 2 показания к применению, 12 — 3 показания и 32 — более 3.
Одним из наиболее перспективных направлений в сфере лечения онкопатологии является иммунотерапия. Ожидается, что в R&D-разработки в данном направлении будет вкладываться все больше инвестиций, которые впоследствии преобразуются в запуск новых коммерчески успешных продуктов и их комбинаций.
Появление все большего количества перспективных лекарственных средств для лечения онкопатологии, как ожидается, приведет к активизации конкуренции между производителями таких препаратов в ближайшие 5 лет. Так, например, несколько классов лекарственных средств, а также препаратов внутри одного класса, по прогнозам компании «IMS Health», будут конкурировать за внимание онкологов и пациентов в сфере лечения немелкоклеточного рака легкого.
ДИНАМИКА МИРОВОГО РЫНКА ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ
Высокая распространенность и социальная значимость онкологических заболеваний, а также прогресс науки обусловили приоритетность данного направления для мировой фарминдустрии, о чем свидетельствуют рыночные показатели. Согласно данным компании «IMS Health» в 2014 г. мировой рынок лекарственных средств, предназначенных для терапии при онкопатологии (включая средства паллиативной терапии), по ценам производителей без учета скидок и дисконтов достиг порога в 100 млрд дол. США. При этом 5 лет назад данный показатель составлял 75 млрд дол. Ожидается, что к 2018 г. расходы на эту категорию лекарственных средств составят 117–147 млрд дол. при среднегодовом темпе роста (CAGR) 6–8%.
При этом CAGR данного рынка в США в 2010–2014 гг. составил 5,3%, топ-5 стран ЕС — 5,8%, Японии — 4,3%, развивающихся стран — 15,5%, других стран — 5,9%. Таким образом, в развивающихся странах происходит наиболее быстрый рост рынка противоопухолевых препаратов. В свою очередь, наиболее медленные темпы роста данного рынка отмечают в Японии. При этом больше всего на противоопухолевые препараты тратят в США (42,2% общемировых затрат). Далее идут топ-5 стран ЕС — Германия, Франция, Великобритания, Испания и Италия.
Стоит отметить, что инвестиции ведущих фармацевтических компаний смещаются в сторону разработки таргетных препаратов, которые, по данным компании «IMS Health», за последние 5 лет совершили настоящий прорыв на мировом фармацевтическом рынке, увеличив за данный период свою долю в общем объеме противоопухолевых препаратов на 14,6%. Таргетные препараты имеют наименьшую долю среди противоопухолевых препаратов на рынках развивающихся стран, однако темпы ее роста на таких рынках выше, чем на рынках развитых стран — 19 и 14,4% соответственно. По итогам 2014 г., таргетная терапия аккумулирует 48% мирового рынка противоопухолевых препаратов. Для сравнения данный показатель в 2010 г. составил 36%.
Стоит отметить также увеличение расходов на противоопухолевые препараты на душу населения за период 2010–2014 гг. в большинстве развитых стран (США, Франция, Италия, Канада, Великобритания и др.), что, в свою очередь, совпало с выведением на рынок новых таргетных и биопрепаратов. При этом США продолжает оставаться лидером по данному показателю. Так, расход на противоопухолевые препараты на душу населения в данной стране достиг 100 дол. в 2014 г., при этом в 2010 г. данный показатель находился на уровне 71 дол. Однако наиболее высокие темпы роста данного показателя за последние 5 лет принадлежат другой стране — Великобритании (67%).
ДОСТУПНОСТЬ ЛЕЧЕНИЯ ДЛЯ ПАЦИЕНТОВ С ОНКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
Доступность новых лекарственных средств, предназначенных для лечения пациентов с онкопатологией, варьирует в широких пределах среди ведущих развитых стран: наиболее широкий доступ к новым противоопухолевым препаратам отмечается в США, Германии и Великобритании. В свою очередь, в Южной Корее, Испании и Японии пациентам доступны менее половины новых лекарственных средств, предназначенных для терапии онкологических заболеваний (рис. 2). Такие различия могут быть результатом деятельности регуляторных органов, а также определяться приоритетами системы здравоохранения и бюджетными ограничениями в различных странах мира.
Рис. 2 Доступность для пациентов с онкопатологией новых молекул, вышедших на мировой рынок в период 2009–2013 гг. (37 молекул), по итогам 2014 г. в 9 развитых странах мира*
Даже наличие реимбурсации стоимости препаратов для лечения онкологических заболеваний часто не повышает доступности лечения для пациентов с онкопатологией. Доступ пациентов к новым противоопухолевым препаратам затрудняется даже в развитых странах, где национальные приоритеты системы здравоохранения могут спровоцировать отказ в возмещении пациентам стоимости лечения некоторыми препаратами, показанными для применения при онкопатологии (рис. 3).
Рис. 3 Доступность лечения для пациентов с онкопатологией в контексте реимбурсации стоимости противоопухолевых препаратов в развитых странах*
Стоит отметить, что страны, использующие методологию QALY (The quality-adjusted life year) для реимбурсации стоимости лекарственных средств (Швеция, Южная Корея, Канада, Австралия), с меньшей вероятностью будут возмещать пациентам стоимость лечения новыми препаратами, предназначенными для терапии при онкопатологии, чем страны, использующие другие подходы для реимбурсации (США, Франция, Германия, Италия, Испания). Под QALY подразумевают качественные и количественные показатели жизни пациента с целью определения эффективности лекарственного средства. Более высокие показатели эффективности лекарственного средства по сравнению с его аналогом, а также меньшие затраты на его приобретение являются главными аргументами при принятии положительного решения о реимбурсации по тому или иному препарату. Также предпочтение отдается лекарственному средству с тем же уровнем эффективности, что и у препарата-аналога, но меньшими затратами на его приобретение.
Между тем прогресс в лечении тормозится недоступностью современной лекарственной терапии для многих пациентов с онкопатологией. Эта проблема актуальна во всем мире, поскольку средняя стоимость лечения брэндированными противоопухолевыми лекарственными средствами постоянно повышается (в том числе за счет увеличивающейся доли орфанных лекарственных средств). Так, по данным компании «IMS Health», средняя стоимость лечения такими препаратами в США за последние 10 лет (2004–2014 гг.) повысилась на 5,9 тыс. дол./мес или на 39% (CAGR — 3,4%), с 14,8 до 20,7 тыс. дол./мес соответственно.
Но если в развитых странах эта проблема частично решается благодаря высоким общим расходам на здравоохранение и государственной поддержке в реализации современных программ лечения онкологических больных, то в странах с развивающейся экономикой ситуация несколько хуже.
Таким образом, инновационная стратегия участников рынка способствует появлению принципиально новых методов лечения, позволяющих кардинально изменить течение болезни и одновременно обеспечить активное развитие самого рынка. В свою очередь, внедрение эффективных экономических механизмов для обеспечения доступности такого лечения для пациентов с онкологическими заболеваниями позволит добиться повышения социальной и финансовой защищенности населения, поскольку проблема доступности лечения перестала быть сугубо медицинской и требует консолидации всех смежных секторов экономики.
Светлана Шелепко,
по материалам http://www.imshealth.com, http://www.iarc.fr,
http://www.fda.gov, http://www.ema.europa.eu, http://www.who.int
Источник: apteka.ua
В среду, 17 июня, на бирже NASDAQ свои акции разместит крупнейший игрок на рынке роялти Royalty Pharma. Ожидается, что первичное размещение 70 млн обыкновенных акций привлечет около $1,86 млрд

Дата IPO: 17 июня
Биржа: NASDAQ
Тикер: RPRX
Ценовой диапазон размещения акций: $25–28
Риски: от валютных рисков до неопределенности на рынке роялти
Royalty Pharma покупает лицензионные доли в биофармацевтических препаратах и финансирует клинические испытания. Она сотрудничает с университетами и больницами, финансируя их инновационные разработки и методы лечения. Компания также инвестирует в фармацевтические и биофармацевтические компании, покупая роялти как на существующие препараты, так и на препараты-кандидаты.
Роялти — вид лицензионного вознаграждения, периодическая компенсация, как правило денежная, за использование патентов, авторских прав, франшиз, природных ресурсов и других видов собственности.
По сути, Royalty Pharma — это структура прямых инвестиций в фармацевтическую промышленность. Компания основана в 1996 году в Нью-Йорке. Ею руководит Пабло Легоррета, выходец из компании Pharmakon Advisors, которая финансировала займы для биофармацевтической отрасли.
Среди партнеров Royalty Pharma — университет Эмори, университет Нью-Йорка, Массачусетская больница общего профиля, небольшие биофармацевтические компании Nektar, Biohaven, а также гиганты отрасли Pfizer, Sanofi, AstraZeneka, Astellas и многие другие.
Согласно проспекту IPO, компания собрала портфель роялти, который дает ей право получения выплат с продаж многих известных препаратов, таких как Imbruvica, Januvia, Kalydeco, Trikafta, Truvada, Tysabri и Xtandi.
Сильные стороны бизнеса
Роялти играют фундаментальную роль в современной биофармацевтической промышленности. Из-за высокой стоимости и сложности разработки препаратов в их производство включается целый ряд участников.
Сначала ученые проводят фундаментальные исследования и лицензируют новые технологии. Затем эти лицензии получают биотехнологические компании и проводят прикладные исследования и клинические разработки на ранней стадии. Завершив свои исследования, они переоформляют лицензии крупным биофармацевтическим компаниям. Также они могут заняться коммерциализацией самостоятельно. В результате разработка одного нового препарата может привести к созданию нескольких роялти на разных этапах.
С момента основания и до 31 декабря 2019 года Royalty Pharma приобрела биофармацевтических роялти на сумму $18 млрд, сообщается в проспекте. По оценкам компании, это более 50% всех сделок на рынке роялти за данный период. При этом ближайший конкурент компании за тот же период совершил сделки на сумму $2,4 млрд, его доля на рынке составляет 7%.
Портфолио Royalty Pharma состоит из роялти на более чем 45 уже реализуемых на рынке препаратов и трех препаратов-кандидатов на стадии разработки. Это лекарства для лечения редких заболеваний, онкологии, неврологии, ВИЧ, кардиологии и диабета.
В сфере биотехнологий препаратом-кандидатом называется молекула, которая среди нескольких других продемонстрировала достаточную активность для обоснования дальнейшей разработки. Это еще не лекарственный препарат — он должен пройти серию доклинических и клинических исследований.
В 2019 году объем продаж каждого из 22 препаратов из портфеля Royalty Pharma превысил $1 млрд, из них продажи каждого из семи лекарств превзошли $3 млрд.
Финансовые показатели
Согласно данным, представленным в проспекте IPO, Royalty Pharma за последние два года увеличила и выручку, и прибыль. В сравнении с 2018-м выручка компании в 2019 году выросла на 1,1%, с $1,79 млрд до $1,81 млрд. Операционную прибыль Royalty Pharma в 2019-м сумела увеличить на 92% — с $1,36 млрд до $2,62 млрд.
Чистая прибыль компании в 2019 году выросла на 70,3%, с $1,38 млрд до $2,35 млрд. В 2019-м она получила операционный денежный поток в размере $1,67 млрд.
В первом квартале 2020 года выручка компании выросла в годовом выражении на 15,2%, до $500,9 млн, а чистая прибыль составила $71,24 млн. По состоянию на 31 марта 2020 года у компании было $1,2 млрд наличными и $6,2 млрд в совокупных долговых обязательствах.
Свободный денежный поток
за вычетом приобретений роялти за 12 месяцев, закончившихся 31 марта 2020 года, составил $220,2 млн.
Размер рынка
Подъем биофармацевтической промышленности обусловлен глобальными тенденциями — ростом населения, увеличением продолжительности жизни и численности среднего класса в развивающихся странах. Кроме того, резкое ускорение медицинских исследований в последние годы привело к лучшему пониманию молекулярных причин заболеваний. Это создало возможности для исследований и разработок новых лекарств.
Растущее число биофармацевтических компаний и высокие темпы роста инноваций в отрасли увеличивают потребность в капитале. Поэтому Royalty Pharma вполне может рассчитывать на устойчивый рост своего бизнеса.
По оценкам исследовательского агентства EvaluatePharma, глобальные продажи лекарств по рецепту вырастут с $875 млрд в 2019 году до $1,2 трлн в 2024-м.
Риски вложения в бизнес компании
Компания предупредила о рисках, которые сопутствуют вложениям в ее бизнес:
- биофармацевтические продукты подвержены рискам продаж;
- приобретение роялти на препараты-кандидаты на стадии разработки сопряжено с рисками;
- бизнес компании зависит от бизнеса других компаний, чьи роялти она приобретает;
- бизнес компании подвержен валютному риску;
- рынок роялти может не расти такими же темпами, как в прошлом.
Больше новостей об инвестициях вы найдете в нашем телеграм-канале «Сам ты инвестор!»
Свободный денежный поток. Средства, оставшиеся у компании после уплаты всех операционных расходов.