- Центр Испытаний и Регистрации Медицинских Изделий / ООО «ЦИРМИ»
- INFO@GOSZDRAVNADZOR.RU
- Главная
- Услуги по оформлению регистрационных удостоверений в Росздравнадзоре
Регистрация медицинских изделий в Росздравнадзоре
Регистрация медицинских изделий в Росздравнадзоре – это государственная процедура, целью которой является разрешение реализации на рынке качественных и безопасных медицинских изделий.
Федеральный закон «Об основах охраны здоровья граждан» № 323-ФЗ сообщает о том, что на территории Российской Федерации разрешается использование медицинских изделий, имеющих действующее регистрационное удостоверение Росздравнадзора.
* Общий порядок и правила проведения процедуры регистрации медицинских изделий утверждён Постановлением правительства РФ № 1416 от 27 декабря 2012 года.
English version
Регистрационное удостоверение на медицинские изделия – это документ, выдаваемый Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) и предоставляющий официальное право реализации медицинских изделий в России, либо в странах Евразийского экономического союза (ЕАЭС).
* Форма регистрационного удостоверения и указываемые в нём данные утверждены приказом Росздравнадзора № 40-Пр/13 от 16 января 2013 года.
Образец регистрационного удостоверения Росздравнадзора
Содержание:
- Что такое медицинское изделие?
- Классы опасности медицинских изделий
- Документы, необходимые для регистрации медицинского изделия
- Госпошлина за регистрацию медицинского изделия
- Процесс регистрации медицинского изделия в Росздравнадзоре
- Преимущества сотрудничества с компанией ЦИРМИ
- Стоимость и срок регистрации медицинских изделий
- Этапы оплаты услуг за регистрацию медицинского изделия
- Ответственность за отсутствие регистрационного удостоверения
Что такое медицинское изделие?
В соответствии с ГОСТ 31508-2012 и 38 статьей 323-ФЗ медицинскими изделиями являются приборы, устройства и оборудование, которые применяют в медицинских целях по отдельности, либо в сочетании между собой.
* Термин «медицинское изделие» был утверждён 1 января 2013 года, а ранее такая продукция называлась «изделия медицинского назначения» или «медицинская техника».
Классы опасности медицинского изделия:
Класс опасности медицинского изделия – это условная величина, которую применяют для упрощённой классификации медицинских изделий по степени потенциального риска.
Всего выделяют четыре класса опасности:
- Класс 1 – медицинские изделия с низкой степенью риска;
- Класс 2а – медицинские изделия со средней степенью риска;
- Класс 2б – медицинские изделия с повышенной степенью риска;
- Класс 3 – медицинские изделия с высокой степенью риска.
Медицинское изделие может иметь только один из четырёх классов опасности. Если медицинское изделие состоит из нескольких компонентов, и у каждого из них разный класс опасности, то всему медицинскому изделию присваивается класс опасности по наивысшему из классов его компонентов.
* Для определения класса опасности медицинского изделия воспользуйтесь таблицей, либо уточните у эксперта нашей компании.
Документы, необходимые для регистрации медицинского изделия:
При запуске проекта в работу от заказчика необходим минимальный комплект документации и информации для медицинского изделия. Зачастую необязательно иметь полный пакет документов, и можно предоставлять информацию частями.
→ Для отечественных производителей медицинских изделий:
- ИНН, ОГРН, выписка из ЕГРЮЛ;
- Доверенность от компании-уполномоченного представителя на эксперта нашей компании на право взаимодействия с Росздравнадзором в интересах заявителя (образец);
- Сертификат системы менеджмента качества ИСО-13485 от компании-изготовителя медицинских изделий (при наличии);
- Технические условия (при наличии);
- Информация о составе и материалах, применяемых в медицинских изделиях;
- Эксплуатационная документация на медицинские изделия (инструкция по применению или руководство по эксплуатации) (при наличии);
- Фотографии регистрируемых медицинских изделий (при наличии).
* При отсутствии технической или эксплуатационной документации на медицинское изделие наш экспертный отдел разработает её без дополнительной оплаты со стороны заказчика!
→ Для иностранных производителей медицинских изделий:
- Юридические документы от производителя медицинских изделий (например, бизнес лицензия);
- Разрешительная документация на медицинские изделия (сертификаты и декларации соответствия) (при наличии);
- Доверенность от компании-производителя медицинских изделий на уполномоченного представителя в России (образец);
- Доверенность от компании-уполномоченного представителя на эксперта нашей компании на право взаимодействия с Росздравнадзором в интересах заявителя (образец);
- Сертификат системы менеджмента качества ИСО-13485;
- Технический файл (technical file) для медицинских изделий;
- Информация о составе и материалах, применяемых в медицинских изделиях;
- Эксплуатационная документация на медицинские изделия (инструкция по применению или руководство по эксплуатации) (при наличии);
- Фотографии регистрируемых медицинских изделий (при наличии).
* При отсутствии технической или эксплуатационной документации на медицинское изделие наш экспертный отдел разработает её без дополнительной оплаты со стороны заказчика!
Государственная пошлина за регистрацию медицинских изделий:
Размер государственной пошлины установлен статьёй 333.32.2 Налогового кодекса Российской Федерации и отличается в зависимости от класса опасности регистрируемого медицинского изделия:
- Класс опасности 1 – 72 000 рублей (экспертиза) + 11 000 рублей (бланк РУ);
- Класс опасности 2а – 104 000 рублей (экспертиза) + 11 000 рублей (бланк РУ);
- Класс опасности 2б – 136 000 рублей (экспертиза) + 11 000 рублей (бланк РУ);
- Класс опасности 3 – 184 000 рублей (экспертиза) + 11 000 рублей (бланк РУ).
* Госпошлина за проведение экспертизы качества и безопасности медицинского изделия, а также за бланк регистрационного удостоверения оплачивается заказчиком напрямую по реквизитам Росздравнадзора.
Процесс регистрации медицинского изделия в Росздравнадзоре:
- Проводим анализ имеющейся технической и эксплуатационной документации, уточняем назначение и характеристики, подбираем аналоги по зарегистрированным в Росздравнадзоре медицинским изделиям;
- Определяем класс опасности медицинского изделия по степени потенциального риска применения;
- Разрабатываем с нуля, либо дорабатываем имеющуюся конструкторскую и эксплуатационную документацию для медицинского изделия.
- По согласованию с заказчиком проводим переговоры с зарубежным представителем производителя медицинского изделия (при необходимости);
- Обеспечиваем перевод конструкторской и эксплуатационной документации на русский язык (при необходимости);
- Подбираем испытательные лаборатории (типы и методы испытаний зависит от спецификации медицинского изделия);
- Обеспечиваем проведение испытаний в аккредитованных лабораториях (технические и токсикологические);
- Подготавливаем пакет документации, формируем первичный комплект регистрационного досье и согласовываем его в Росздравнадзоре;
- Получаем официальное разрешение от Росздравнадзора на проведение клинических испытаний;
- Обеспечиваем проведение клинических испытаний в специализированной организации и получаем положительное решение по ним;
- Передаём окончательно сформированный пакет документации в экспертную организацию;
- Получаем оригинал регистрационного удостоверения и положительное решение Росздравнадзора о внесении медицинского изделия в реестр;
- Передаём заказчику полный комплект документации вместе с регистрационным удостоверением на медицинское изделие.
* Для удобства восприятия вы можете ознакомиться с графиком регистрации медицинских изделий.
Компания ЦИРМИ выполняет взятые на себя обязательства!
Мероприятия, этапы и сроки при оказании услуг по регистрации медицинских изделий мы прописываем в договоре и строго соблюдаем их.
- 1 этап
- 2 этап
- 3 этап
* Экспертный отдел компании ЦИРМИ вовремя выполняет свою работу, а положительные отзывы наших клиентов подтверждают это!
Обратите внимание: некоторые исполнители скрывают часть этапов оказания услуг, тем самым вводя клиентов в заблуждение! Зачастую недобросовестные «регистраторы» заключают договор, а в процессе работы доводят конечную стоимость проекта до несоизмеримо высоких цифр.
Компании–конкуренты Компания ЦИРМИ Работу проводят менеджеры по продажам, специалисты по звонкам, юристы, бухгалтера и кто угодно, кроме обученных экспертов Регистрацию медицинских изделий осуществляют эксперты с профильным образованием и знанием иностранного языка Сопровождение регистрации шаблонное, по заранее подготовленным формам документов, без глубокого проникновения в суть процесса и устройства медицинского изделия, что зачастую приводит к отказам в регистрации медицинского изделия Регистрация медицинских изделий проходит с учетом индивидуальных особенностей медицинского изделия, технологического процесса и принципа работы. Самостоятельно разрабатываем отсутствующую документацию Проведение испытаний заканчивается передачей контактов заказчика испытательной лаборатории без дальнейшего контроля проведения испытаний Весь процесс проведения испытаний контролируется с нашей стороны. После испытаний при необходимости эксперт вносит правки в протоколы для их успешного принятия Росздравнадзором Общение с заказчиком осуществляется в рабочее время и только по электронной почте, что существенно затягивает срок регистрации медицинского изделия Приветствуется любой удобный для заказчика способ связи. Общаемся с заводом-изготовителем на иностранном языке Стоимость работы увеличивается по причине «внезапной» дополнительной разработки каких-либо документов Окончательная стоимость наших услуг заранее известна, фиксируется в договоре и остается неизменной до завершения проекта Высока вероятность выйти на посредника, что значительно увеличит срок и стоимость работ по сопровождению регистрации медицинского изделия. Появляется эффект «сломанного телефона» Работаем напрямую с государственными органами. Мы самостоятельно дорабатываем документацию и передаем досье (не по почте, а лично в руки сотрудникам Росздравнадзора) Без гарантий успешного проведения регистрации медицинского изделия Предоставляем гарантию на проведение успешной регистрации медицинского изделия. В случае отказа в регистрации по нашей вине возвращаем оплаченные денежные средства
Стоимость и срок регистрации медицинских изделий:
Медицинские изделия класса опасности 1 – от 650 000 рублей;
Срок выполнения проекта – до 6 месяцев.
Медицинские изделия класса опасности 2а – от 780 000 рублей;
Срок выполнения проекта – до 8 месяцев.
Медицинские изделия класса опасности 2б – от 940 000 рублей;
Срок выполнения проекта – до 9 месяцев.
Медицинские изделия класса опасности 3 – от 1 200 000 рублей;
Срок выполнения проекта – до 12 месяцев.
* В случае, если часть документации на медицинское изделие уже разработана, а некоторые из этапов работ успешно пройдены, то срок и стоимость регистрации можно уменьшить. Для получения точного расчёта стоимости услуг обращайтесь к нам!
Поэтапная оплата услуг за регистрацию медицинского изделия:
Регистрация медицинских изделий в Росздравнадзоре сравнительно долгая процедура. Для удобства распределения бюджета наших заказчиков оплата услуг производится в несколько этапов:
- 35% – после заключения договора с ООО «ЦИРМИ» на оказание услуг по регистрации медицинского изделия в Росздравнадзоре;
- 35% – после разработанной (либо доработанной) экспертным отделом документации для медицинских изделий и началом проведения испытаний;
- 30% – по факту успешного получения регистрационного удостоверения Росздравнадзора на заявленное медицинское изделие.
* При необходимости можно согласовать индивидуальные условия оплаты.
Полная стоимость процедуры регистрации медицинских изделий включает в себя:
- Государственную пошлину за проведение экспертизы качества документации и бланк регистрационного удостоверения;
- Услуги лабораторий и экспертной организации за проведение испытаний и исследований медицинского изделия;
- Услуги по переводу и нотариальному заверению документации (при необходимости);
- Услуги экспертного отдела компании ЦИРМИ за сопровождение регистрации медицинского изделия.
Испытания оплачиваются заказчиком напрямую по счетам от лабораторий, а пошлина – по реквизитам Росздравнадзора. В процессе работы эксперты нашей компании подберут необходимые показатели и стандарты для проведения испытаний медицинского изделия в аккредитованных лабораториях.
В случае, если часть документации на медицинское изделие уже разработана, а некоторые из этапов работ успешно пройдены, то срок и стоимость регистрации можно уменьшить. Для получения точного расчёта стоимости услуг обращайтесь к нам!
* Образец предоставляемого коммерческого предложения здесь.
Прайс-лист на оказание услуг компанией ЦИРМИ смотрите по ссылке.
Ответственность за отсутствие регистрационного удостоверения:
Процедура регистрации медицинских изделий является обязательной по закону, а штрафы за реализацию таких изделий без регистрационного удостоверения доходят до нескольких миллионов рублей. Ответственность, вплоть до уголовной, предусмотрена статьями 6.28, 6.33 КоАП РФ, а также статьей 238.1 УК РФ.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Внесение изменений в регистрационное досье (ВИРД)
Внесение изменений в регистрационное досье на медицинское изделие – это процедура, подразумевающая собой изменение данных и информации в регистрационных документах для ранее зарегистрированного в Росздравнадзоре медицинского изделия.
Так как при регистрации медицинского изделия в архив Росздравнадзора передается комплект регистрационного досье, которое хранится в соответствии с российским законодательством, то при необходимости внесения каких-либо данных в это досье проводится процедура внесения изменений в регистрационное досье.
Содержание:
- Основания для внесения изменений в регистрационное досье
- Документация, необходимая для внесения изменений в регистрационное досье
- Процесс внесения изменений в регистрационное досье
- Пример внесения изменений в регистрационное досье
- Экспертиза качества, эффективности и безопасности
- Ответственность за несвоевременную актуализацию регистрационного досье
- Стоимость услуг за внесение изменений в регистрационное досье
Основания для внесения изменений в регистрационное досье:
Среди основных причин, по которым проводится процедура внесения изменений в регистрационное досье для зарегистрированного медизделия можно выделить следующие:
- Изменение конструкции медицинского изделия, при котором меняются свойства и характеристики этого медицинского изделия;
- Добавление, или исключение новых материалов, входящих в состав медицинского изделия;
- Добавление, или исключение ГОСТов, нормативов или стандартов, применимых к медицинскому изделию;
- Изменение количества единиц медицинского изделия, или его составных частей (комплектующих), указанных в приложении к регистрационному удостоверению;
- Добавление, или исключение принадлежностей (комплектующих) к медицинскому изделию, либо изменение их наименования;
- Добавление, или исключение вариантов исполнения (спецификаций) медицинского изделия;
- Изменение сроков действия документации из регистрационного досье на медицинское изделие.
Документация, необходимая для внесения изменений в регистрационное досье:
Для успешного проведения процедуры внесения изменений в регистрационное досье в Росздравнадзор предоставляется следующий комплект документации:
- Заявление о внесении необходимых изменений;
- Платёжное поручение об уплате государственной пошлины в размере 2 500 рублей (в случае, когда не требуется проведение экспертизы качества, эффективности и безопасности медицинского изделия);
- Документация, подтверждающая вносимые изменения в регистрационное досье (например протоколы испытаний медицинского изделия от лаборатории и экспертной организации).
Процесс внесения изменений в регистрационное досье:
- Собираем, анализируем и дорабатываем, конструкторскую и эксплуатационную документацию для медицинского изделия. При необходимости помогаем с переводом документов на русский язык;
- Формируем заявление и опись о внесении изменений в регистрационное досье;
- Сопровождаем проведение испытаний и исследований в соответствии с вносимыми изменениями и типом медицинского изделия;
- Подготавливаем необходимый комплект документации по медицинскому изделию и передаём его в Росздравнадзор;
- Отвечаем на дополнительные запросы и уведомления от Росздравнадзора в процессе внесения изменений;
- Получаем приказ о внесении изменений в регистрационное досье на медицинское изделие;
- Передаем полный комплект документации вместе заказчику.
В ходе оказания услуг возможно добавление, или изменение этапов работы. Процесс оказания услуги формируется индивидуально для каждого заказчика в соответствии с конкретным типом медицинского изделия и вносимыми в регистрационное досье изменениями. Свяжитесь с нами для уточнения деталей внесения изменений в регистрационное досье по вашему медицинскому изделию.
Пример внесения изменений в регистрационное досье:
Российский производитель изменил конструкцию медицинского изделия, при этом изменились свойства и характеристики медицинского изделия. В таком случае экспертный отдел нашей компании подготавливает и сдаёт в Росздравнадзор следующие документы:
- Заявление о внесении изменений в регистрационное досье с указанием причины этого изменения в соответствии с Постановлением правительства Российской Федерации № 1416 от 27 декабря 2012 года);
- Квитанцию (платёжное поручение с отметкой банка о списании денежных средств) об оплате государственной пошлины за проведение процедуры внесения изменений в регистрационное досье;
- Письмо от аккредитованной испытательной лаборатории с подтверждением того, что вносимые изменения в конструкции медицинского изделия влекут за собой изменения свойств и характеристик этого медицинского изделия;
- Акты и протоколы проведенных испытаний, доказывающие и подтверждающие, что внесенные изменения в конструкцию медицинского изделия являются безопасными при его эксплуатации;
- Обновленную конструкторскую и эксплуатационную документацию с указанием новой информации о конструкции медицинского изделия.
Экспертиза качества, эффективности и безопасности:
Экспертиза качества и безопасности медицинского изделия – это процедура, проводимая экспертной организацией в целях государственной регистрации медицинского изделия, либо при внесении изменений в комплект регистрационных документов (досье) для ранее зарегистрированного медицинского изделия.
Основания для проведения экспертизы качества и безопасности медицинского изделия при внесении изменений в регистрационное досье:
- В зарегистрированное в Росздравнадзоре изделие вносятся изменения, которые повлияют на качество, эффективность и безопасность этого медицинского изделия;
- В зарегистрированное в Росздравнадзоре изделие вносятся изменения, которые его совершенствуют, при этом внешний вид, функциональное назначение и (или) принцип его работы остаётся неизменным.
* Подробнее о проведении экспертизы читайте в этой статье.
Ответственность за несвоевременную актуализацию регистрационного досье:
Так как регистрационное досье для медицинского изделия должно быть своевременно актуализировано, то держателю этого регистрационного удостоверения следует помнить о необходимости внесения изменений в него.
В случае, если по результатам проверки регистрационного досье будет выявлено, что документация в нём не соответствует фактически реализуемым на рынке медицинским изделиям, то на юридическое лицо-заявителя может быть наложен штраф в соответствии со статьями 6.28, 6.33 КоАП РФ и статьей 238.1 УК РФ.
Стоимость услуг за внесение изменений в регистрационное досье:
Для медицинских изделий класса опасности 1 – от 190 000 рублей;
Для медицинских изделий класса опасности 2а – от 220 000 рублей;
Для медицинских изделий класса опасности 2б – от 250 000 рублей;
Для медицинских изделий класса опасности 3 – от 300 000 рублей.
Конечная стоимость и срок оказания услуги зависит от необходимости проведения экспертизы качества безопасности медицинского изделия, а также от объёма разрабатываемой документации, страны производства и типа медицинского изделия. Для расчёта точного срока и стоимости за выполнение работ обращайтесь к нам!
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Внесение изменений в регистрационное удостоверение (ВИРУ)
Внесение изменений в регистрационное удостоверение — это процедура, подразумевающая собой изменение каких-либо данных в ранее оформленном регистрационном удостоверении на медицинское изделие. Вносимые в изменения не затрагивают информацию из регистрационного досье, а только данные в бланке регистрационного удостоверения.
Процедура внесения изменений в регистрационное удостоверение (РУ) осуществляется в соответствии с правилами, указанными в Постановлении Правительства РФ № 1416 от 27 декабря 2012 года.
Содержание:
- Основания для внесения изменений в регистрационное удостоверение
- Документация, необходимая для внесения изменений в регистрационное удостоверение
- Процесс внесения изменений в регистрационное удостоверение
- Пример внесения изменений в регистрационное удостоверение
- Стоимость услуг за внесение изменений в регистрационное удостоверение
Основания для внесения изменений в регистрационное удостоверение:
Среди основных причин, по которым проводится процедура внесения изменений в регистрационное удостоверение Росздравнадзора можно выделить следующие:
- Изменение сведений, касающихся заявителя регистрационного удостоверения:
- Реорганизация юридического лица;
- Изменение названия юридического лица (полного или сокращенного), в том числе изменение фирменного наименования (бренда);
- Изменение адреса места нахождения юридического лица;
- Изменение фамилии, имени или отчества, индивидуального предпринимателя;
- Изменение адреса места жительства индивидуального предпринимателя;
- Изменение реквизитов документов, удостоверяющих личность индивидуального предпринимателя.
- Изменение адреса места производства медицинского изделия;
- Изменение наименования медицинского изделия (в случае, если не затрагиваются свойства и характеристики медицинского изделия, влияющие на его качество, эффективность и безопасность);
- Указание вида медицинского изделия в соответствии с номенклатурной классификацией медицинских изделий (при отсутствии такового).
* Для большинства остальных случаев внесения изменений производится процедура внесения изменений в регистрационное досье (ВИРД). Для точного определения процедуры внесения изменений по вашему медицинскому изделию свяжитесь с нами.
Документация необходимая при внесении изменений в регистрационное удостоверение:
- Заявление о внесении изменений в регистрационное удостоверение;
- Актуальная справка из ЕГРЮЛ;
- Копия документа, подтверждающего полномочия уполномоченного представителя от производителя медицинского изделия (образец);
- Номер регистрационного досье (найти номер можно в реестре);
- В случае изменения сведений о заявителе, а также месте производства медицинского изделия — документы, подтверждающие такие изменения (договор аренды производственной площадки, либо свидетельство собственности на неё);
- В случае изменения наименования медицинского изделия:
- Сведения о нормативной документации;
- Техническая документация производителя, приведённая в соответствие с новым наименованием медицинского изделия;
- Эксплуатационная документация производителя, в том числе инструкция по применению или руководство по эксплуатации, приведённые в соответствие с новым наименованием медицинского изделия;
- Фотографии общего вида медицинского изделия вместе с принадлежностями, необходимыми для использования медицинского изделия по назначению (размер фотографий не менее 18×24 сантиметра);
- Заполненная опись.
Обратите внимание: указанный список является примерным, и представлен исключительно с целью пояснения того, какие документы могут понадобиться для оказания услуги. Актуальный перечень необходимой документации экспертный отдел нашей компании формирует индивидуально для каждой процедуры внесения изменений в регистрационное удостоверение на медицинское изделие.
Процесс внесения изменений в регистрационное удостоверение:
- Собираем, анализируем, дорабатываем, а в случае необходимости – переводим необходимую для работы документацию на медицинское изделие;
- Формируем заявление и опись о внесении изменений в регистрационное удостоверение;
- Подготавливаем официальное письмо о том, что вносимые изменения в регистрационное досье не влекут за собой изменения свойств и характеристик медицинского изделия;
- Помогаем заказчику с оплатой государственной пошлины за выполнение процедуры;
- Формируем и передаем полный комплект документации в Росздравнадзор и сопровождаем его рассмотрение;
- Отвечаем на дополнительные вопросы от Росздравнадзора в процессе сопровождения процедуры (при необходимости);
- Получаем регистрационное удостоверение на медицинское изделие с внесенными изменениями и передаем его заказчику вместе с обновленными документами.
Пример внесения изменений в регистрационное удостоверение:
Российский производитель, указанный в регистрационном удостоверении как заявитель (держатель РУ), изменил юридический адрес компании. В таком случае экспертный отдел нашей компании подготавливает и сдаёт в Росздравнадзор следующие документы:
- Заявление о внесении изменений в регистрационное удостоверение с указанием причины в соответствии с ПП РФ № 1416 от 27.12.2012 года);
- Квитанцию об оплате госпошлины (2 500 рублей);
- Письмо от испытательной лаборатории с подтверждением того, что вносимые изменения в регистрационное удостоверение не влекут за собой изменения свойств и характеристик медицинского изделия;
- Актуальную выписку из ЕГРЮЛ, подтверждающую смену юридического адреса держателем регистрационного удостоверения;
- Свидетельство о собственности, либо договор аренды на изменяемый адрес;
- Опись предоставляемых документов.
Стоимость услуг за внесение изменений в регистрационное удостоверение:
Для медицинских изделий класса опасности 1 – от 60 000 рублей;
Для медицинских изделий класса опасности 2а – от 65 000 рублей;
Для медицинских изделий класса опасности 2б – от 70 000 рублей;
Для медицинских изделий класса опасности 3 – от 75 000 рублей.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Получение дубликата регистрационного удостоверения
Дубликат регистрационного удостоверения на медицинское изделие – это копия ранее выданного документа от Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор). Дубликат после выдачи имеет такую же юридическую силу, как и оригинал регистрационного удостоверения.
Основания получения дубликата регистрационного удостоверения:
- Утрата регистрационного удостоверения на медицинское изделие;
- Порча регистрационного удостоверения на медицинское изделие.
Обратите внимание: на дубликате регистрационного удостоверения будут указаны пометки «Дубликат» и «Оригинал регистрационного признается недействующим». Номер и дата регистрационного удостоверения останутся прежними, а номер бланка документа будет изменён. Также будет добавлена информация о дубликате регистрационного удостоверения в реестр медицинских изделий.
Документация, необходимая для получения дубликата РУ:
- Заполненное заявление о выдаче дубликата регистрационного удостоверения на медицинское изделие;
- В случае порчи регистрационного удостоверения к заявлению прикладывается испорченное регистрационное удостоверение.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Технические испытания медицинских изделий
Технические испытания медицинских изделий – это процедура подтверждения качества и безопасности медицинских изделий в соответствии с утверждёнными и согласованными с испытательной лабораторией техническими показателями и нормативами. Технические испытания проводятся для целей регистрации в Росздравнадзоре и дальнейшего оформления регистрационного удостоверения на медицинское изделие.
Порядок проведения технических испытаний утвержден приказом Министерства здравоохранения РФ № 2н от 9 января 2014 г. и решением совета Евразийской экономической комиссии № 28 от 12 февраля 2016 г.
Содержание:
- Варианты проведения технических испытаний
- Процедура проведения технических испытаний
- Сведения, подтверждаемые при технических испытаниях
Варианты проведения технических испытаний для медицинских изделий:
- Реальные испытания медицинского изделия в аккредитованной лаборатории на поверенном оборудовании и испытательных стендах;
- Оценка и анализ данных для проверки качества и безопасности медицинского изделия при его эксплуатации.
Технические испытания в форме оценки и анализа данных применимы только к тем медицинским изделиям, для монтажа которых требуется получение разрешений (лицензий), а также создание специальных условий, или строительство отдельных капитальных сооружений. Другими словами – для массивных медицинских изделий, которые не представляется возможным доставить в испытательную лабораторию.
Для точного определения варианта проведения технических испытаний обратитесь к нам!
Процедура проведения технических испытаний:
- Проводим идентификацию медицинского изделия;
- Определяем вид медицинского изделия и класс потенциального риска применения;
- Подбираем необходимые показатели и нормативы технических испытаний для медицинского изделия;
- Анализируем предоставленную документацию (техническую и эксплуатационную) для медицинского изделия, а также проводим оценку достаточности информации для составления программы технических испытаний. При необходимости дорабатываем документацию для медицинского изделия;
- Совместно с лабораторией составляем программу проведения технических испытаний и согласовываем её с заказчиком;
- Определяем количество образцов медицинских изделий необходимых для проведения технических испытаний;
- Проводим технические испытания медицинского изделия в аккредитованной испытательной лаборатории;
- Получаем от лаборатории программу и протокол технических испытаний и согласовываем их с заказчиком.
Сведения, подтверждаемые при технических испытаниях:
- Соответствие медицинского изделия и документации к нему требованиям национальных или международных стандартов;
- Полнота и объективность требований по испытаниям, которые указаны в документации на медицинское изделие;
- Возможность использования эксплуатационной документации в эксплуатации (использования) медицинского изделия;
- Качество медицинского изделия и безопасность его применения.
Наши заказчики вправе самостоятельно выбрать для себя испытательную лабораторию, осуществляющую проведение технических испытаний, и вместе с этим мы также предлагаем воспользоваться собственными испытательными лабораториями, у которых оптимальный срок и стоимость работ.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Токсикологические испытания медицинских изделий
Токсикологические испытания (исследования) медицинских изделий – это процедура подтверждения качества и безопасности медицинских изделий в соответствии с утверждёнными токсикологическими показателями и нормативами. Исследования проводятся для целей регистрации медицинского изделия в Росздравнадзоре и дальнейшего оформления регистрационного удостоверения. Токсикологические исследования проводятся для оценки биологического воздействия медицинского изделия на организм человека и включают в себя проверку санитарно-химических и физико-химических показателей.
Порядок проведения токсикологических исследований утверждён приказом Министерства здравоохранения России № 2н от 9 января 2014 года.
Содержание:
- Необходимость проведения токсикологических исследований
- Типы влияния медицинского изделия на организм человека
- Процедура проведения токсикологических исследований
- Результат проведения токсикологических исследований
Необходимость проведения токсикологических исследований:
Токсикологические исследования проводятся для тех медицинских изделий, которые напрямую контактируют (соприкасаются) с организмом и кожей человека при их эксплуатации и применению по назначению.
Типы влияния медицинских изделий на организм человека:
- Медицинские изделия, либо принадлежности к ним, контактирующие с поверхностью тела человека;
- Медицинские изделие, временно вводимые в организм человека извне;
- Медицинские изделия, имплантируемые в организм человека.
Процедура проведения токсикологических исследований:
- Проводим идентификацию медицинского изделия или материала, входящего в состав медицинского изделия;
- Совместно с лабораторией подбираем нормативы для проведения токсикологических исследований медицинского изделия;
- Определяем длительность контакта медицинского изделия с организмом человека;
- Определяем количество образцов медицинских изделий для проведения токсикологических исследований;
- Составляем программу проведения токсикологических исследований;
- Сопровождаем проведение токсикологических исследований медицинского изделия в аккредитованной испытательной лаборатории;
- Для стерильных медицинских изделий оформляем отчёт о валидации процесса стерилизации медицинского изделия;
- Для медицинских изделий, контактирующих с кровью и её компонентами сопровождаем проведение исследований на пирогенность и гемосовместимость;
- Получаем от лаборатории программу и протокол токсикологических исследований и согласовываем их с Заказчиком.
В процессе проведения токсикологических исследований подтверждается:
- Соответствие медицинского изделия и документации к нему требованиям национальных и/или международных стандартов;
- Возможность использования эксплуатационной документации в процессе применения медицинского изделия;
- Качество медицинского изделия и безопасность его применения.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Клинические испытания медицинских изделий
Клинические испытания медицинских изделий – это процедура подтверждения качества и безопасности медицинских изделий в соответствии с утверждёнными клиническими показателями и нормативами. Клинические испытания проводятся для регистрации медицинского изделия в Росздравнадзоре и последующего оформления регистрационного удостоверения, а также для целей внесения изменений в регистрационное досье для зарегистрированного медицинского изделия.
Порядок проведения клинических испытаний утверждён приказом Министерства здравоохранения РФ № 2н от 9 января 2014 года и решением совета Евразийской экономической комиссии от 12 февраля 2016 года № 29.
Содержание:
- Варианты проведения клинических испытаний
- Проведение клинических испытаний с участием человека
- Документация, необходимая для проведения клинических испытаний
- Процедура проведения клинических испытаний для медизделий
Варианты проведения клинических испытаний:
- Исследования (анализ и оценка клинических данных);
- Реальные испытания с участием человека (проводятся на основании положительного заключения совета по этике).
Проведение клинических испытаний с участием человека:
Проведение клинических испытаний медицинского изделия с привлечением людей происходит в следующих случаях:
- Если проходит регистрация нового вида медицинского изделия (безаналоговое медицинское изделие);
- Если проходит регистрация медицинского изделия с новой (сложной) технологией диагностики и лечения заболеваний;
- Если при проведении анализа и оценки клинических данных в рамках экспертизы не подтверждены эффективность и безопасность медицинского изделия.
* В остальных случаях проведение клинических испытаний проводится в форме анализа и оценки клинических данных экспертной организацией. При этом предоставление образцов медицинских изделий не требуется.
Обратите внимание: проведение клинических испытаний медицинского изделия возможно только после получения разрешения от Росздравнадзора на данные испытания. Для определения варианта проведения клинических испытаний для медицинского изделия и стоимости их проведения свяжитесь с нами.
Документация, необходимая для проведения клинических испытаний:
Для успешного проведения клинических испытаний медицинского изделия экспертный отдел нашей компании подготавливает следующую документацию:
- Заявление на проведение клинических испытаний;
- Разрешение на проведение клинических испытаний (получаем в Росздравнадзоре);
- Протоколы (заключения) по результатам ранее проведённых технических и токсикологических испытаний регистрируемого медицинского изделия (при необходимости);
- Документы/обзоры/отчёты/публикации/доклады, содержащие данные о клиническом применении медицинского изделия (в том числе на иностранном языке);
- Сведения о нормативной документации (СНД) с перечнем стандартов, которым соответствует регистрируемое медицинское изделие (при необходимости самостоятельно разрабатываем СНД);
- Техническую и эксплуатационную документацию для медицинского изделия;
- Фотографии медицинского изделия общего вида вместе с принадлежностями к нему.
Процедура проведения клинических испытаний медизделий:
- Проверяем представленные клинические данные и документы (при необходимости);
- Проверяем сведения о приостановлении применения медицинского изделия (при необходимости);
- Проверяем сведения об изъятии из обращения (отзывах) медицинского изделия;
- Проводим анализ научной литературы и соотносим её с заявленным на испытания медицинским изделием;
- Находим сведения о взаимозаменяемости и эквивалентности по зарегистрированным в Росздравнадзоре медицинским изделиям;
- Определяем количество образцов медицинских изделий необходимых для проведения клинических испытаний;
- Подготавливаем совместно с экспертной организацией программу клинических испытаний;
- Сопровождаем проведение клинических испытаний медицинских изделий на людях (в случае проведения таких испытаний с участием человека);
- Дорабатываем эксплуатационную документацию на медицинское изделие по результатам клинических испытаний (при необходимости);
- Совместно с экспертной организацией подготавливаем акт оценки клинических испытаний медицинского изделия и передаём его заказчику.
Клинические испытания проводят медицинские организации, одобренные Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор). Требования к таким организациям отражены в Приказе Министерства здравоохранения РФ № 300н от 16 мая 2013 года.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Разрешение на ввоз медицинского изделия
Разрешение на ввоз медицинского изделия – это официальный документ, выдаваемый Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор), позволяющий медицинскому изделию пересечь таможню при ввозе на территорию Российской Федерации. Разрешение на ввоз оформляется для проведения процедуры регистрации медицинского изделия в Росздравнадзоре, либо в рамках внесения изменений в действующее регистрационное удостоверение (ВИРД). Порядок оформления разрешения на ввоз медицинского изделия отображен в приказе Министерства здравоохранения РФ № 661н от 30 июня 2020 года (приказ вступил в силу с 1 января 2021 года).
Обратите внимание: В соответствии с информационным письмом Росздравнадзора № 04И-879/22 от 08 августа 2022 года «Об изменениях в порядке ввоза медицинских изделий» оформление разрешения на ввоз медицинского изделия в целях его регистрации в Росздравнадзоре – не требуется.
Содержание:
- Процедура оформления разрешения на ввоз медицинского изделия
- Документы, необходимые для получения разрешения на ввоз
- Данные, указываемые в заявлении на выдачу разрешения на ввоз
- Срок действия разрешения на ввоз медицинского изделия
- Стоимость оформления разрешения на ввоз в нашей компании
- В каких случаях оформлять разрешение на ввоз необязательно?
Процедура оформления разрешения на ввоз медицинского изделия:
- Подготавливаем доверенность на представителя нашей компании с правом действовать от лица заказчика в рамках взаимодействия с Росздравнадзором (образец);
- Определяем количество образцов медицинских изделий, для которых планируется оформление разрешения на ввоз;
- Формируем комплект необходимой документации и предоставляем его в Росздравнадзор;
- Получаем разрешение на ввоз медицинского изделия и передаем его заказчику.
* Также вы можете ознакомиться с реестром ранее оформленных разрешений на ввоз для медицинских изделий.
Документы, необходимые для получения разрешения на ввоз:
- Договора с лабораториями на проведение необходимых испытаний и исследований медицинского изделия;
- Заверенная печатью и подписью руководителя доверенность на представителя нашей компании;
- Заполненное заявление о выдаче разрешения на ввоз.
Данные, указываемые в заявлении на выдачу разрешения на ввоз:
- Наименование, спецификации (модели), комплектация, принадлежности и вариант исполнения медицинского изделия;
- Сведения о ранее выданном регистрационном удостоверении (в случае получения разрешения на ввоз для внесения изменений в регистрационное досье для медицинского изделия);
- Назначение медицинского изделия;
- Сведения о заявителе (наименование юридического лица, адрес места нахождения, реквизиты);
- Наименование и адрес производства изготовителя медицинского изделия;
- Сведения об организациях, в которых планируется проведение технических, токсикологических и клинических испытаний;
- Аттестаты аккредитаций испытательных лабораторий, выданные Росаккредитацией.
Срок действия разрешения на ввоз медицинского изделия:
Срок действия разрешения на ввоз для медицинского изделия составляет один год с момента выдачи его Росздравнадзором. В случае, если за срок его действия не удалось ввести образцы медицинских изделий, то разрешение на ввоз оформляется заново, при этом комплект документации для его получения остается прежним.
Стоимость оформления разрешения на ввоз в нашей компании:
В процессе регистрации медицинского изделия в Росздравнадзоре разрешение на ввоз оформляется бесплатно. При этом мы берем на себя всю работу по заполнению необходимой документации, в том числе поиск и составление договоров с испытательными лабораториями.
В каких случаях оформлять разрешение на ввоз необязательно:
- Медицинское изделие является программным обеспечением;
- Производство медицинского изделия осуществляется на территории Российской Федерации.
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Дополнительные услуги, предоставляемые компанией ЦИРМИ:
- Разрабатываем документацию для регистрации медицинского изделия;
- Консультируем по вопросам регистрации медицинских изделий;
- Проводим полный и частичный аудит конструкторской и эксплуатационной документации для медицинских изделий;
- Исправляем «чужие ошибки» при отрицательном результате регистрации медицинского изделия;
- Отправляем уточняющие (разъяснительные) запросы в Росздравнадзор;
- Согласовываем и продлеваем сроки действия технических условий на медицинские изделия;
- Подбираем вид номенклатурного классификатора для медицинских изделий;
- Подбираем класс риска для медицинских изделий;
- Оформляем товарные знаки на медицинские изделия;
- Представляем интересы зарубежных организаций на территории РФ (под ключ).
С 2011 года экспертный отдел компании ЦИРМИ профессионально занимается оказанием услуг по оформлению разрешительной документации. За время деятельности нам удалось изучить это направление до самых мельчайших нюансов. И сегодня мы с уверенностью заявляем о том, что являемся одними из лидеров по оформлению и разработке разрешительной документации для медицинских изделий!
Работаем без задержек
Лучше других понимаем ценность времени наших клиентов и никогда не затягиваем проекты!
Ориентируемся в законах
Умеем правильно общаться с экспертными организациями и Росздравнадзором.
Работать с нами надёжно
За всё время работы компании ни одного поданного иска в суд. Наша гордость!
Ваши преимущества сотрудничества с компанией ЦИРМИ:
Команда с единой целью
Компания ЦИРМИ это организм, объединенный общей целью — выполнить работу так, чтобы клиент остался доволен, обратился к нам повторно, и посоветовал коллегам и друзьям. Оптимально подобранный штат сотрудников успешно решает любые задачи при выполнении проектов, к тому же делает это без привлечения других исполнителей. Наш клиент никогда не «потеряет» своего проект-менеджера поскольку у нас нет текучки кадров.
На словах, в договоре и в работе
Очевидное превосходство компании ЦИРМИ над конкурентами — прозрачное и честное взаимодействие с заказчиком. После получения коммерческого предложения вы можете быть уверены в том, что цены и сроки оказания услуг в нём окончательные. За все время работы еще не было случая, когда согласованная с заказчиком стоимость работы была завышена или изменена. При допуске ошибок с нашей стороны расходы на их исправление компенсируем за свой счет. Оплату клиент производит поэтапно — по факту выполнения работы.
Гарантия успешного выполнения проекта
К моменту заключения договора специалисты с профильным образованием проводят тщательный анализ имеющейся документации на медицинское изделие. При отсутствии нужной информации мы обязательно уведомляем об этом заказчика. Таким образом мы сокращаем риск отрицательного результата и уменьшаем срок выполнения работы.
Опыт, знания и авторитет.
С 2011 года эксперты компании ЦИРМИ выполняют проекты различной сложности и направленности. Мы работали и с простыми (однокомпонентными) медицинскими изделиями с низким классом опасности, и с высокотехнологичным медицинским оборудованием. Обширные знания экспертов и налаженные связи с госорганами позволяют проводить работу быстрее, испытания проводить с первого раза, а документацию разрабатывать без головной боли для заказчика.
Центр Испытаний и Регистрации Медицинских Изделий
Команда профессионалов компании ЦИРМИ была сформирована в 2011 году, для оказания услуг в оформлении разрешительной документации для медицинских изделий и техники. Мы уверенно решаем задачи, возникающие в условиях стремительно меняющейся экономической ситуации. Нам доверяют проекты, поскольку ценят комплексный подход к работе, своевременное оказание услуг и высокую степень ответственности. Внимательно изучая мнения и пожелания наших заказчиков компания ЦИРМИ постоянно совершенствуется.
Главное для нас это обеспечение высокого качества услуг и достойное выполнение взятых на себя обязательств, и именно поэтому сотрудничество с нами простое и продуктивное!
Отзывы довольных клиентов
Хотим поблагодарить вашу компанию за выполненную работу. Вы проделали колоссальный труд для оформления разрешительных документов на нашу продукцию, сократив тем самым время ожидания на таможне. Спасибо за все, что Вы делаете, чтобы помочь нам в развитии!

Чебаненко А.Н.
ЗАО «Себряков-Цемент» выражает свою признательность коллективу компании ЦИРМИ за организацию и проведение экспертизы промышленной безопасности объектов газопотребления ГПУ-28. Ваша профессиональная работа позволила в кратчайшие сроки запустить объект в эксплуатацию.

Ельницкий В.Т.
Компания ООО «Атон-Глобал» выражает благодарность Вашей организации за скорость и качество проведенных работ по регистрации поставляемых медицинских изделий. Взятые Вами обязательства были на высоком профессиональном уровне. Желаем коллективу ООО ЦИРМИ успехов в процветании!

Шипилин В.В.
ПАО «КурскХлеб» выражает благодарность Вашей компании за профессиональное партнерство в государственной регистрации наших продуктов питания. С компанией ЦИРМИ приятно иметь дело в любой сфере. Надеемся на дальнейшее сотрудничество.

Филатов Е.Д.
От имени руководства компании «Медикалтех» выражаем благодарность за качественно разработанный технический файл с дальнейшей регистрацией поставляемой нами медицинской продукции. Мы получили компетентные экспертные заключения от ФГБУ «ВНИИИМТ» и надеемся на дальнейшую работу с вами!

Чуднов С.Е.
Выражаем искреннюю благодарность за проведение сертификации котлов и экспертизы газопровода низкого давления объектов ООО «АгроГрин». Остались очень довольны скоростью и компетентностью работы Ваших сотрудников. В дальнейшем будем обращаться в компанию ЦИРМИ.

Сидоренко П.В.
Ассоциация «Сити-Гарант» выражает благодарность сотрудникам компании ЦИРМИ за качественно оказанные услуги по получению сертификата менеджмента качества ISO-13485. Мы будем рекомендовать Вас как хорошо организованную команду и рады, что приняли решение о сотрудничестве с вами!

Орлов Д.А.
Профессионализм в проведении регистрации медицинских изделий позволил приобрести нам неоценимые опыт и знания. Впоследствии это сделало нас одним из лидеров данной отрасли!
Подпишитесь на рассылку полезных новостей о регистрации медицинских изделий!
Отправьте ваш запрос в свободной форме на нашу почту Info@goszdravnadzor.ru, либо воспользуйтесь формой запроса.
Гарантированно предоставим подробный и верный ответ на ваш запрос за 30 минут!
Позвонить нам в рабочее время можно по многоканальному телефону 8 (495) 199-72-57
Мы работаем с 09:30 утра до 18:30 вечера
Отправляя запрос в экспертный отдел центра испытаний и регистрации медицинских изделий (ООО «ЦИРМИ») вы соглашаетесь с условиями обработки персональных данных.
Подпишитесь на рассылку полезных новостей о регистрации медицинских изделий!
Skip to content
Услуги в сфере обращения медицинских изделий
- ГЛАВНАЯ
- УСЛУГИ
- Регистрация по правилам РФ
- Регистрация по правилам ЕАЭС
- Упрощенная регистрация (санкции)
- Ускоренная регистрация (COVID)
- Разработка документации
- Техническая документация
- Технические условия (ТУ)
- Эксплуатационная документация
- Файл менеджмента риска
- Валидация стерилизации
- Валидация ПО
- Валидация упаковки
- Подтверждение срока годности
- Отчет по клиническому мониторингу
- Испытания медицинских изделий
- Технические испытания
- Токсикологические исследования
- Клинические испытания
- Клинические испытания in vitro
- Испытания в целях утверждения типа СИ
- Регистрационное удостоверение
- Функция уполномоченного представителя
- Сертификация / декларирование
- Внесение изменений
- Системы менеджмента качества
- Лицензирование
- CE сертификат
- ПОЛЕЗНЫЕ МАТЕРИАЛЫ
- Публикации
- Вопрос-ответ (FAQ)
- Глоссарий
- НОВОСТИ
- FAQ
- ЦЕНЫ
- КОНТАКТЫ
- English
Регистрация медицинских изделий по национальным правилам (правилам РФ)
Регистрация медицинских изделий по национальным правилам (правилам РФ)
Регистрация медицинских изделий – сложный многоэтапный процесс, требующий наличия специфических знаний и, что немаловажно, соответствующего опыта. Именно поэтому регистрация медицинских изделий с помощью экспертов компании «КС-ПРОФ» – это гарантированный результат получения регистрационного удостоверения в максимально сжатые сроки, который достигается слаженной работой высококвалифицированных экспертов, имеющих опыт многолетней практической деятельности в сфере обращения медицинских изделий.
Отдел регистрации медицинских изделий состоит из 9 экспертов, в том числе 2 кандидатов технических и 1 кандидата биологических наук.
Что такое регистрация и почему необходимо получать регистрационное удостоверение на медицинские изделия?
В соответствии с пунктом 4 статьи 38 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 N 323-ФЗ, на территории РФ разрешается обращение медицинских изделий, зарегистрированных в порядке, установленном Правительством РФ, уполномоченным им федеральным органом исполнительной власти.
Регистрация медицинских изделий – это государственная процедура, разработанная с целью обращения на рынке только качественных, эффективных и безопасных изделий. Регистрационное удостоверение (РУ) является документом, подтверждающим соответствие медизделий установленным требованиям и подтверждающим факт их регистрации на территории России. Поэтому РУ – необходимый документ для обращения медицинского изделия на рынке. Другими словами, регистрация медицинских изделий является обязательным условием для их ввоза, использования, продажи, а также производства на территории РФ.
Регистрацию медицинских изделий на территории Российской Федерации осуществляет Федеральная служба по надзору в сфере здравоохранения РФ (Росздравнадзор). В процессе осуществления услуги по государственной регистрации, Росздравнадзор направляет регистрационное досье медицинского изделия на экспертизу качества, безопасности и эффективности в одну из подведомственных организаций: ФГБУ «ВНИИИМТ» или ФГБУ «НИК» (ранее называлось ФГБУ «ЦМИКЭЭ»).
Схема регистрации медицинских изделий
Правила государственной регистрации медицинских изделий определяются Постановлением Правительства РФ от 27 декабря 2012 г. N 1416 «Об утверждении Правил государственной регистрации медицинских изделий». Эти правила периодически пересматриваются, что создает дополнительные проблемы всем участникам рынка, поскольку уследить за изменениями производителям и дистрибьюторам медизделий довольно сложно.
Последние изменения в порядок регистрации внесены Постановлением Правительства РФ от 24 ноября 2020 г. N 1906 «О внесении изменений в Правила государственной регистрации медицинских изделий». Определенные изменения в процедуру реализации правил на практике вносят корректировки документов, регламентирующих деятельность Росздравнадзора и его экспертных организаций (методические рекомендации, административные регламенты и т.д.).
Мы следим за всеми изменениями в нормативно-правовом поле, которые учитываем при подготовке документов для наших Клиентов.
Государственная регистрация медицинских изделий в соответствии с Правилами возобновлена с 30.06.2022 г.! Росздравнадзор принимает заявления до 31.12.2022 г.!
На данный момент зарегистрировать медицинское изделие с целью его обращения на территории РФ также можно в соответствии с:
В справочных целях приводим порядок и схему регистрации по национальным правилам.

Виды продукции, подлежащие обязательной регистрации в качестве медицинских изделий
Медицинская техника:
-
Аппараты для косметологии и хирургии;
-
Диагностическое оборудование (рентгенологическое оборудование, аппараты УЗИ и т.д.);
-
Анализаторы и другое лабораторное оборудование;
-
Изделия для in vitro диагностики;
-
Технически сложные средства реабилитации (электрические инвалидные кресла, роботизированные протезы и т.д.);
-
Аппараты жизнеобеспечения (ИВЛ, диализ и т.д.);
-
Терапевтические аппараты (ультразвуковые, радиочастотной терапии и т.д.);
-
Стоматологические установки;
-
Прочая техника, используемая в медицинских целях.
Изделия медицинского назначения (имн):
-
Одежда, бахилы и другие общебольничные медицинские изделия;
-
Расходные материалы (реагенты, сменные фильтры, бумага для ЭКГ и т.д.);
-
Стандартные образцы, калибраторы для анализаторов;
-
Шовный хирургический материал;
-
Бинты и другие перевязочные средства;
-
Хирургические инструменты;
-
Прочие изделия, применяемые в медицинских целях.
Специализированное программное обеспечение:
-
Программное обеспечение для анализа изображений с диагностического оборудования;
-
Программное обеспечение для управления информационной системой медицинских учреждений;
-
Программное обеспечение для телемедицины;
-
Прочее программное обеспечение, применяемое в медицинских целях.
Документы для регистрации медицинских изделий
Для формирования регистрационного досье (комплекта документов, необходимого для регистрации медицинского изделия), потребуются следующие документы:
Для изделия отечественного производства:
-
ИНН, ОГРН, выписку из ЕГРЮЛ;
-
Нотариально оформленную доверенность на право действовать в интересах заявителя;
-
Сертификат соответствия СМК (при наличии);
-
Технические условия (ТУ) (при наличии);
-
Описание регистрируемого изделия;
-
Документы, подтверждающие наличие места производства;
-
Эксплуатационная документация, например, инструкция (при наличии);
-
Акт квалификационных испытаний (при наличии);
-
Фотографии регистрируемого изделия.
Для изделия зарубежного производства:
-
Документ о регистрации производителя как юридического лица (в стране производства);
-
Сертификат производителя (при наличии);
-
Разрешительные документы на регистрируемое изделие (при наличии);
-
Доверенность на уполномоченного представителя производителя на территории РФ;
-
Документы, подтверждающие условия производства;
-
Технический файл (при наличии);
-
Эксплуатационная документация, например, инструкция или руководство по эксплуатации (при наличии);
-
Фотографии регистрируемого изделия.
В зависимости от сложности медицинского изделия, его класса риска и функциональных характеристик перечень документов может измениться.
Сроки получения регистрационных удостоверений на медицинские изделия
Срок регистрации зависит от класса риска медицинского изделия, выбранной схемы регистрации медизделия, требуемого объема испытаний. Мы регистрируем изделия в очень сжатые сроки, поскольку осуществляем отдельные этапы процедуры параллельно там, где это возможно, что экономит ваше время и выгодно отличает нас от конкурентов.
В среднем, регистрация медицинских изделий в нашей компании осуществляется в следующие сроки:
-
2а класс и 2б класс – 8-10 месяцев;
Если часть требуемой документации у вас уже готова и некоторые из этапов регистрации уже пройдены, сроки этой услуги могут быть существенно сокращены.
Что получаете Вы, работая с нами:
-
Персонального эксперта, который осуществляет подготовку необходимой вам части или всей документации, консультирует по всем вопросам, связанным с процедурой регистрации и осуществляет контроль на всех этапах процедуры регистрации вашего изделия;
-
Сокращение затрат на регистрацию, поскольку мы помогаем вам максимально сократить ее сроки, избежать повторных обращений, провести исследования и испытания вашего изделия на максимально выгодных условиях в организациях-партнерах;
-
Прямые партнерские отношения с ведущими аккредитованными лабораториями и центрами проведения доклинических и клинических исследований, технических и токсикологических испытаний; крупнейшими учреждениями здравоохранения; медицинскими ассоциациями (следовательно, наши Клиенты не несут расходов по оплате посреднических услуг);
-
Полную прозрачность наших решений, действий и шагов, направленных на получение результата в минимальные сроки и с минимальными для вас издержками;
-
Удобную схему работы: вы можете воспользоваться нашей помощью для отдельного этапа из схемы регистрации медицинских изделий, приведенной выше или получить услугу «под ключ»;
-
Надежного помощника в смежных с регистрацией вопросах обращения медицинских изделий (лицензирование производства и технического обслуживания медтехники; разработка, внедрение и поддержание СМК; разработка изделий с нуля и отдельные технологические вопросы их производства; локализация производства на территории РФ и многие другие вопросы);
-
Конкретные результаты, а не обещания, которые раздают многие участники рынка (особенно те, которые являются просто посредниками). Именно поэтому мы предлагаем нашим клиентам схему оплаты «за результат».
Получите подробную информацию по услуге и бесплатный расчет стоимости работ!
ПОЛУЧИТЬ
ПОЛУЧИТЬ
Page load link
Go to Top
Комплексное сопровождение регистрации медицинских изделий
Наш специальный регуляторный отдел занимается сопровождением регистрации медицинских изделий. Ведущие специалисты и профессионалы нашей компании контролируют этот процесс от начала и до конца: от подготовки комплекта документов до тесного сотрудничества с экспертным сообществом. На сегодняшний день наш отдел регистрации получил более 350 авторизаций на рынке РФ и СНГ.
-
Этап 1
Запрос технического файла, разработка технических условий, формирование регистрационного досье
-
Этап 2
Технические, токсикологические
и клинические испытания -
Этап 3
Проведение экспертизы ФГУП ВНИИМТ или ФГУП ЦИМКЭ Росздравнадзора
-
Этап 4
Успешное прохождение экспертизы
-
Опытная команда
- В нашем штате опытные специалисты, которые получили более 350 авторизаций
- Наши специалисты тесно сотрудничают с РЗН
- Ежегодно наши специалисты проходят курсы повышения квалификации
-
Полная поддержка на всех этапах
- Подача досье в Росздраванадзор
- Документарная проверка регистрационного досье
- Устранение выявленных замечаний (при их наличии)
- Получение разрешения на проведение клинических испытаний
- Подача клинических испытаний в Росздравнадзор
-
Выводим препарат на рынок
- Сотрудничаем с ведущими дистрибьюторами
- Организуем поставки в крупнейшие аптечные сети
- Обеспечиваем комплексную маркетинговую поддержку
Регистрация медицинских изделий
Компания ООО «БИОТЕХ-Интер» своевременно реагирует на изменяющуюся ситуацию на рынке и с максимальной эффективностью отстаивает интересы клиентов. И информирует Вас, что с 2022 года будет осуществляться регистрация по новым правилам ЕАЭС.
Компания ООО «БИОТЕХ-Интер» предлагает регистрацию по новым правилам ЕАЭС.
ООО «БИОТЕХ-Интер» предлагает услуги по сопровождению процесса регистрации медицинских изделий отечественного и зарубежного производства в Росздравнадзоре:
— Подготовка и разработка следующих документов:
- технических файлов/технических условий
- инструкций по медицинскому применению
- эксплуатационную документацию (руководство по эксплуатации, инструкция по эксплуатации, инструкция по применению)
- сведения о нормативной документации
- файла менеджмента риска
— Организация и осуществление мониторинга технических и токсикологических испытаний, а также планирование и проведение клинических исследований, включая получение разрешения на клинические исследования в уполномоченных органах;
— Предоставление документов в Росздравнадзор;
— Проведение мониторинга экспертизы качества, эффективности и безопасности МИ;
— Сопровождение прохождения документации в Росздравнадзоре с целью получения Регистрационного удостоверения на МИ и получение Регистрационного удостоверения.
Сроки выполнения услуг по сопровождению регистрации медицинских изделий в Росздравнадзоре:
Медицинские изделия 1 класса риска
Срок подготовки документов и процедуры регистрации медицинского изделия в Росздравнадзоре – около 6 месяцев;
Медицинские изделия класса риска 2а
Срок подготовки документов и процедуры регистрации медицинского изделия в Росздравнадзоре – около 7 месяцев;
Медицинские изделия класса риска 2б
Срок подготовки документов и процедуры регистрации медицинского изделия в Росздравнадзоре – около 8 месяцев;
Медицинские изделия класса риска 3
Срок подготовки документов и процедуры регистрации медицинского изделия в Росздравнадзоре – около 10 месяцев.
Разработка комплекта документации (ТУ, ФМР, Инструкция по эксплуатации) под ключ (1 класс риска — 3 класс риска)
В случае, если часть документации у вас уже подготовлена и некоторые из этапов регистрации уже пройдены, сроки и стоимость работы существенно уменьшаются.
Постоянным клиентам предоставляются значительные скидки.
Мы оптимизируем стоимость благодаря грамотной оптимизации всей работы, а также наработанного опыта. Стоимость рассчитывается после анализа предоставленных документов.
Стоимость услуг по прохождению регистрации медицинского изделия рассчитывается индивидуально по каждому проекту с учетом объёма работ, вида работ, вариантов исполнения, класса риска изделия и наличия документов.
- Госпошлина в бюджет РФ за выдачу регистрационного удостоверения — 11 000 руб.
Госпошлина за экспертизу эффективности, качества и безопасности медицинского изделия:
- класс 1: 72 000 руб.
- класс 2а: 104 000 руб.
- класс 2б: 136 000 руб.
- класс 3: 184 000 руб.
Мы гарантируем вам прозрачность и полный отчет по всем этапам регистрации.
Вы можете прислать нам заявку через форму обратной связи на нашем сайте (внизу данной страницы) для связи с вами и предварительной оценки стоимости и сроков. Готовы обсудить с вами все вопросы регистрации.
Наши контакты:
телефон: +7(985) 178-78-61 WhatsApp; +7 (495) 661-41-18; +7 (985) 120-41-48
e-mail: Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.; Адрес электронной почты защищен от спам-ботов. Для просмотра адреса в вашем браузере должен быть включен Javascript.
Замена регистрационного удостоверения осуществляется без прохождения процедуры государственной регистрации медицинских изделий на основании заявления, представленного заявителем в Федеральную службу по надзору в сфере здравоохранения, с указанием сведений, предусмотренных Правилами, утвержденными настоящим постановлением.
Дополнительные услуги:
— Нотариально заверенный перевод иностранных документов.
— Сертификация: добровольная.
— ГОСТ Р, ISO.
Вы можете оставить заявку на сайте, чтобы мы могли предварительно подготовить для вас ответ или нужную информацию.
Регистрация медицинского изделия — особая процедура, осуществляемая с целью получения разрешения на использование этого изделия на территории Российской Федерации. Научные разработки, прежде чем они будут допущены к эксплуатации, в обязательном порядке проверяются экспертами. Процесс регистрации — важное и сложное мероприятие, выполнять которое должны грамотные специалисты. Организация «Мирэкс-Мед Групп» специализируется на оказании услуг регистрации медицинских изделий и гарантирует выдачу удостоверения, соответствующего всем требованиям, предъявляемым к данной продукции
Правильно и своевременно произведенное оформление документов на медицинское изделие позволит начать продажу продукции с подтверждением ее качества, надежности и безопасности для жизни и здоровья пользователей.
- Срок оформления – 9-12 месяцев
- Орган лицензирования – Росздравнадзор
- Государственная пошлина – 7 000 рублей
Абонентская плата за услугу от 75500 RUB/мес.
Консультация
Соблюдение сроков
Сроки оговариваем заранее и фиксируем в договоре
Работаем по России
Взаимодействие через персонального менеджера 24/7
Большой опыт
Получено и переоформлено более 200 регистрационных удостоверений
Услуги под ключ
Выполним все работы для вывода Вашей продукции на рынок
Cтоимость регистрации медицинских изделий
Процесс регистрации медицинской продукции длится, в большинстве случаев, около года (от 9 до 12 месяцев). Подготовка документации осуществляется непосредственно заявителем или его представителями. Проверку медизделия и его оценку проводят специалисты.
Длительность этапов регистрирования зависит, прежде всего, от особенностей продукции: чем выше класс опасности изделия, тем большее время займет оформление, т.к. потребуется несколько экспертиз и проверок.
Цена конкретного изделия определяется двумя факторами: размером госпошлины и стоимостью каждого вида испытания, осуществляемого в процессе процедуры регистрации. Стандартный размер государственной пошлины составляет на данный момент 7000 рублей. Минимальная стоимость экспертизы — 45000 руб., она зависит от присвоенного медизделию класса опасности (характеризует возможный риск при использовании). Более подробно указано здесь:
| Изделие первого класса риска | 45000 рублей; |
| Изделие класса риска 2a | 65000 рублей; |
| Изделие класса риска 2b | 85000 рублей; |
| Изделие третьего класса риска | 115000 рублей. |
Наше портфолио
Отзывы о нас

ООО «Мирэкс-Мед групп» неоднократно оказывала нашей компании квалифицированные услуги по регистрации мед. изделий. Очень благодарны Вам за качество работ, профессионализм и соблюдение условий договора.
ООО «Лабораторные решения» планирует продолжить сотрудничество с «Мирэкс-Мед групп» и желает Вам успехов в бизнесе и благополучия.

Приняли решение обратиться в Мирэкс-Мед Групп за регистрацией изделия медицинского назначения, который мы только собирались производить. Наша фирма законопослушная, регистрация любого изделия обязательна. Стоимость полного комплекса услуг регистрации нас вполне устроила. Работа была осуществлена четко, нам оказали помощь в подготовке и проведении испытаний, за что отдельное спасибо.

Наша компания обратилась в ООО «Мирэкс-Мед Групп» за регистрацией нескольких медицинских изделий, т.к. сами не обладаем должными знаниями в этой области. Профессиональные рекомендации и слаженная взаимная работа позволили нам получить регистрационные удостоверения на аппараты достаточно оперативно – около 10 месяцев.

ООО «ЙО ОРТО» благодарит Вас за оказание помощи в получении регистрационного удостоверения. При первичном обращении Ваши сотрудники проявили себя как настоящие профессионалы: ответили на все вопросы и разработали подробный план действий, назвали сроки и стоимость.
Виды мед оборудования, требующие обязательной сертификации

Медицинская техника
Обязательной регистрации по закону подлежат:
- хирургическая и косметологическая аппаратура;
- рентгеновские, УЗИ-аппараты и другие диагностические приборы;
- технически сложные в исполнении реабилитационные приспособления;
- разработки в области стоматологии;
- анализаторы и другое сложное лабораторное оборудование;
- высокотехнологичное терапевтическое оборудование, например использующее ультразвук;
- все виды имплантов;
- устройства для обеспечения жизнедеятельности;
- диагностические тесты для использования в in vitro диагностике;
- различные технические средства, применяемые в медицине.

Изделия медицинского назначения (имн)
Предприятиям, планирующим выпуск ИМН, положено прохождение регистрационных мероприятий, в случае, если речь идет о:
- специализированная медицинская мебель;
- все виды перевязочных средств;
- шовные материалы для хирургии;
- ортопедические изделия (ортезы);
- медицинская одежда и обувь;
- хирургические инструменты и приборы для осмотра;
- стандартные образцы (калибраторы);
- фильтры, реагенты и др. расходники;
- другие подобные изделия для использования в медучреждениях.

Специализированное программное обеспечение
Виды медицинского ПО, подлежащие регистрации:
- программное обеспечение, используемое в телемедицине;
- ПО для анализа изображений, получаемых на диагностическом оборудовании;
- ПО, контролирующее информационные системы медучреждений;
- другое ПО при вероятности его применения в медицинских целях.
Нужна помощь в выборе сертификата?
Получите профессиональную консультацию экспертов
Оставьте номер, и в течение 5 минут
мы свяжемся с вами

Штрафы за работу при отсутствии регистрационного удостоверения
Изготовление медицинских изделий в Российской Федерации контролируется государством и регламентируется законодательством. Производство этого вида продукции возможно только после регистрации и получения соответствующего разрешения. При несоблюдении правил и требований, начале производства товаров без регистрации, предусмотрены различные виды наказаний:
- должностное лицо: штраф на сумму 3 миллиона рублей с лишением свободы сроком на восемь лет (статья 235.1 УК);
- юридическое лицо: штраф 5 миллионов рублей с приостановлением работы предприятия до 90 дней (статья 6.33 КоАП).
Этапы регистрации медицинских изделий


Сертификация по правилам РФ или ЕАЭС?
Экономическая евразийская комиссия Евро-Азиатского экономического сотрудничества (ЕАЭС) собирается инициировать продление переходного периода для перерегистрации медицинских изделий, у которых имеется регистрационное удостоверение до конца 2026-го года. До конца 2021-го года у производителя будет выбор, по каким правилам произвести регистрацию МИ – по национальным либо правилам ЕАЭС. Вместе с тем МИ, зарегистрировавшееся по правилам ЕАЭС, сможет продаваться на национальном рынке до истечения срока регистрации (или бессрочно, если это предусмотрено РУ) с возможностью внесения изменений в регистрационное удостоверение.
Экономическая комиссия ЕАЭС планирует продлить перерегистрацию изделий медицинского назначения до декабря 2026 года, но до окончания 2021 года производители медицинской продукции должны принять решение о правилах регистрации: либо их изделия регистрируются по национальным правилам, либо по правилам ЕАЭС. Те медизделия, которые будут зарегистрированы по правилам Евразийского союза, смогут продаваться в своей стране до окончания времени действия регистрации или, если это предусмотрено, бессрочно (в удостоверение о регистрации будут внесены соответствующие изменения).
Исходя из вышесказанного, мы советуем всем производителям медицинских изделий приступить к процедуре регистрации своей продукции, чтобы уложиться в отведенное время.
Необходимые документы
После проведения мероприятий по регистрации, данные о медицинском изделии поступают в реестр РФ, а заявитель получает удостоверение, действительное в течение пяти лет (после чего появляется возможность заменить его на бессрочное).
Удостоверение необходимо:
- для осуществления оптовой и розничной торговли;
- для упаковки и маркировки продукции;
- при таможенных процедурах оформления иностранных товаров;
- для оформления заявок на закупки;
- для предъявления контролирующим органам.
В Российской Федерации действует система мониторинга лекарственных средств. Все операции с медикаментами заносятся в общую базу данных, где отслеживается законность реализации средства и его соответствие стандартам качества (по номеру удостоверения о регистрации и сведениям из госреестра).
| Для изделия отечественного производства | Для изделия зарубежного производства |
|---|---|
|
|
Стоит учитывать, что в зависимости от класса и функционала изделия, сложности его исполнения, безопасности и степени риска, список требуемых документов может меняться.
Почему необходимо сертифицировать мед технику?
Регистрация медицинских изделий — государственная процедура, регламентированная законодательством РФ (статья 38 закона «Об основах охраны здоровья граждан») и направленная на защиту населения от применения некачественной (небезопасной) продукции. Согласно этому закону, в стране могут реализовываться только прошедшие регистрацию медицинские изделия.
Удостоверение о регистрации — государственный документ, заверяющий соответствие изделия стандартам качества, подтверждающий регистрацию и дающий основание использовать данное изделие на всей территории государства.
Производство медицинской продукции, ее ввоз, реализация, а также использование незаконно без прохождения процедуры регистрации.
Росздравнадзор — уполномоченный орган, занимающийся надзором в здравоохранении, осуществляющий регистрирование медизделий. Эта структура принимает от заявителя документы на изделие и передает их в подведомственные экспертные учреждения: ФГБУ «ВНИИИМТ» или ФГБУ «НИК».
Что получает заказчик, работая с нами?
«Мирэкс-Мед Групп» оказывает клиентам следующие услуги по регистрации медразработок и продукции медицинского назначения:
- проверка предоставленных сопроводительных документов на товар;
- корректировка документации (при необходимости);
- формирование досье на изделие;
- осуществление сопроводительных действий при подготовке и проведении испытаний;
- комплектование пакета документов для начала процедуры регистрации;
Заказчик в обязательном порядке получает консультации на всех этапах совместной работы, помощь в решении текущих проблем.
Возможно полное сопровождение клиента при прохождении процесса регистрации (так называемая схема «под ключ»). При такой схеме заказчик предоставляет опытные образцы изделия и основную документацию. Все остальные этапы работы выполняют сотрудники нашей организации.
Мы выполняем и отдельные виды заказов: готовим базовый пакет документов, занимаемся оформлением удостоверения и т.п.
Наши специалисты готовы решить любые проблемы, возникающие в процессе экспертных проверок и при процедуре регистрации изделия.
Наши клиенты

Регистрация товаров, поступающих на рынок РФ, является обязательной процедурой, которая позволяет подтвердить их безопасность и качество для потребителей. Однако это достаточно сложный процесс, требующий глубоких знаний в области законодательства, профессиональных навыков в сфере проведения лабораторных испытаний и умения грамотно оформить всю необходимую документацию. Особое значение имеет регистрация медицинских изделий, поскольку это оказывает прямое влияние на здоровье населения.
Наша компания готова предложить грамотную поддержку в области регистрации медицинских изделий. На протяжении длительного периода времени мы осуществляем тесное взаимодействие с ведущими специалистами Росздравнадзора, которые следят за всеми обновлениями нормативной документации и в состоянии обеспечить индивидуальный подход к каждому клиенту.
Обратившись в ООО «ЕЦЭС КВОЛИТИ», вы можете рассчитывать на оперативное проведение экспертизы, получение корректных результатов и профессиональное оформление разрешительной документации. Благодаря солидному опыту работ с зарубежными партнерами, в нашей компании проводится не только регистрация медицинских изделий отечественного производства, но и регистрация иностранных товаров мед назначения.
В этой статье мы подробно расскажем, как проводится государственная регистрация медицинских изделий на территории нашей страны и в евразийском экономическом союзе. Также вы познакомитесь с основными этапами и правилами проведения данной процедуры.
Чтобы получить бесплатную консультацию по всем вопросам звоните нам по телефону:
Содержание:
- Что такое регистрации медицинских изделий?
- Порядок регистрации медицинских изделий
- Какими правилами руководствоваться при регистрации, РФ или ЕАЭС?
- Зарегистрировать продукцию медицинского назначения без СМК еще можно
- Правила регистрации медицинских изделий
- Какие медицинские изделия подлежат обязательной регистрации?
- Необходимые документы для регистрация медицинских изделий
- Сроки регистрации медицинских изделий
- Госпошлина и стоимость проведения лабораторных исследований и испытаний
- Почему компании отдают предпочтение именно нам?
- Презентации ведущих руководителей в сфере регистрации медицинских изделий
Что такое регистрации медицинских изделий?
Регистрация мед изделий и медтехники представляет особой государственную процедуру, обязательную к прохождению всеми производителями и юридическими лицами. Ее основной целью является предоставление жителям РФ высококачественной и безопасной продукции медицинского назначения.
В нашей стране допускается обращение мед товаров, которые успешно прошли регистрацию, при участии соответствующего органа власти в соответствии с постановлением Правительства РФ.
При этом под вышеуказанной техникой и изделиями подразумеваются оборудование, инструментарий, приборы и материалы, предназначенные для решения тех или иных медицинских задач. Следует учитывать, что использоваться они могут как по отдельности, так и при сочетании с аналогичной продукцией.
Кроме того, к числу товаров медицинского назначения относятся:
- Компьютерные программы, разработанные специально для проведения диагностики, профилактических процедур и лечебных мероприятий, а также реабилитации пациентов и мониторинга их состояния в послереабилитационный период;
- Изделия, предназначенные для предотвращения беременности и проведения абортов, которые обладают высокой эффективностью по сравнению с другими медицинскими препаратами.
Порядок регистрации медицинских изделий
Постановлением Правительства РФ от 27 декабря 2012 г. N 1416 устанавливаются требования к процедуре государственной регистрации продукции медицинского предназначения. Эти правила регулярно изменяются, что является проблематичным для большинства изготовителей и дистрибьюторов товаров медицинского назначения, так как отследить все нововведения бывает невозможно для многих участников рынка.
Очередные дополнения в порядок регистрации медицинских изделий в России были утверждены Постановлением Правительства РФ от 31 мая 2018 г. N 633. Существенное влияние на данную процедуру оказывают поправки, связанные с регулированием функций Росздравнадзора и подотчетных ему юридических лиц, занимающихся экспертной оценкой.
Например, не так давно были изданы Методические рекомендации, касающиеся проведения регистрации медицинских изделий. Они непосредственно связаны с экспертизой, выполняемой для определения эффективности, качества и безопасности товаров данной направленности.
Мы отслеживаем любые нововведения в юридической сфере, и принимаем их во внимание при сборе документации для наших заказчиков.
Руководствуясь желанием оказать поддержку всем участникам рынка, далее мы представим схему регистрации медицинских изделий, в рамках которой учитывается все дополнения и поправки.
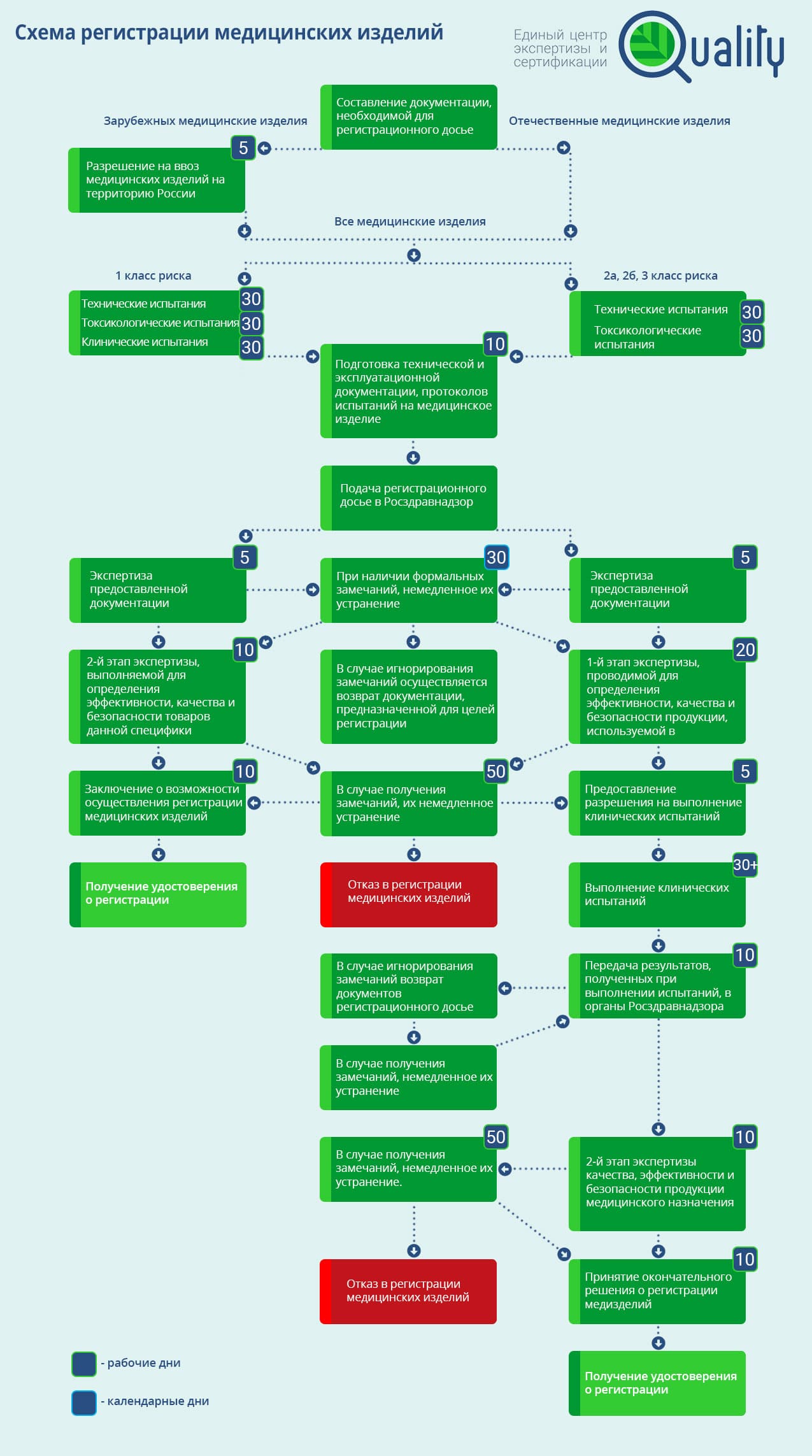
Какими правилами руководствоваться при регистрации, РФ или ЕАЭС?
В данный момент государственная регистрация медизделий пребывает в «переходном состоянии»: требования ЕАЭС вступят в законную силу с 31 декабря 2021 года. При этом основополагающим фактором считается то, что при прохождении товаром медицинской специфики вышеуказанной регистрационной процедуры, Заявитель может получить отказ в предоставлении документа, подтверждающего регистрацию. Это обусловлено завершением действия правил РФ и внедрением правил ЕАЭС.
То есть, если вам требуется регистрация медицинских изделий или услуги, мы советуем не затягивать с выполнением данной процедуры, что позволит учесть все установленные сроки перехода.
Регистрация медицинских изделий по правилам ЕАЭС >
Зарегистрировать продукцию медицинского назначения без СМК еще можно
1 сентября 2022 года обрели законную силу нормативные акты Правительства №135 и 136 от 9 февраля 2022 года, на основании которых устанавливается потребность в использовании СМК (системы менеджмента качества) при изготовлении изделий оздоровительной специфики, подлежащих финишной стерилизации, класса потенциальной опасности 2а, и других продуктов более высоких категорий риска, а также фиксируются правила подтверждения применения этой системы. Необязательным, но рекомендуемым является внедрение СМК для товаров медицинского пользования класса опасности 2а и 1, не подлежащих стерилизации.
Принимая во внимание Постановление №136, для выполнения регистрационной процедуры в отношении изделий класса потенциальной опасности 2а, подвергшихся стерилизации, и остальных продуктов категории риска 2б и 3, следует ввести систему менеджмента качества при осуществлении производственного процесса и произвести внеплановую проверку. Но, в соответствии с Постановлением №135, обойти инспекцию при участии государственных надзорных органов можно на протяжении 9 месяцев после обретения законной силы. То есть, до 1 июня 2023 года у изготовителей присутствует возможность пройти регистрационный процесс в отношении продуктов высокой потенциальной опасности и изделий 2а категории риск, прошедших финишную стерилизацию, без обязательного выполнения проверок на соответствие требованиям СМК.
Производства уже внесенных в Единый реестр товаров, в документы к которым планируется включить дополнения в период с 1 сентября 2022 года по 1 июня 2023-го, все-таки подлежат инспекции на протяжении 2-х лет после завершения регистрационной процедуры.
С 1 июня 2023 года государственные проверки производственных мощностей новых изделий высокого класса потенциальной опасности и продукции категории риска 2а, подлежащей стерилизации, будут осуществляться в обязательном порядке. Более того, за это время планируется внести дополнения или изменения в регистрационное досье. В течение 2-х лет после внесения подобных дополнений потребуется выполнить производственную проверку, которая необходима для подтверждения соответствия СМК стандарту ISO 13485.
Чтобы получить бесплатную консультацию по всем вопросам звоните нам по телефону:
Правила регистрации медицинских изделий
На территории РФ разрешается обращение товаров медицинского назначения, которые ранее были зарегистрированы соответствующим исполнительным органом. При этом регистрация медтехники и медоборудования регламентируется Федеральным законом «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323-ФЗ.
Регистрация медоборудования предполагает соблюдение определенных требований, которые устанавливаются Правительством РФ от 27.12.2012 № 1416.
В рамках правил регистрации медицинских изделий обязательным и необходимым является получение следующих услуг:
- Прохождение технических исследований (для всех медицинских товаров);
- Изделия, которые впоследствии будет контактировать с человеческим организмом, подвергаются токсикологическим испытаниям;
- Для утверждения типа средств измерений проводятся испытания (их список устанавливается Министерством здравоохранения РФ);
Прохождение клинических исследований (для всех медицинских изделий).
Какие медицинские изделия подлежат обязательной регистрации?
Оборудование медицинского назначения:
- Техника, предназначенная для хирургических и косметологических целей;
- Аппаратура, используемая при проведении диагностики (УЗИ, рентген и т.д.);
- Оборудование для in vitro диагностики;
- Аппараты, применяемые в процессе лабораторных исследований;
- Приспособления для реабилитации (роботизированные протезы, инвалидные кресла и т.п.);
- Устройства, предназначенные для терапевтических целей;
- Оборудование стоматологического назначения;
- Аппараты для поддержания жизнедеятельности;
- Изделия медицинской специфики, используемые для вживления в организм;
- Другое оборудование, применяемое в медицинской сфере.

В перечень медицинских изделий, подлежащих регистрации, также входят следующие товары:
- Инструменты, используемые в процессе выполнения оперативных вмешательств;
- Расходники (фильтры, реагенты и т.д.);
- Изделия общебольничного назначения (специальная одежда, бахилы и др.);
- Материал для выполнения хирургических швов;
- Средства для осуществления перевязок пациентам;
- Инструментарий для проведения осмотра;
- Предметы мебели, предназначенные для медицинский целей;
- Ортезы;
- Другие приспособления медицинской специфики.
Специализированные программы:
- Программы, предназначенные для целей телемедицины;
- Компьютерные программы, позволяющие выполнить анализ диагностических снимков;
- Программное обеспечение, обеспечивающее контроль информационной базы медицинских центров;
- Другие программы, используемые для решения медицинских задач.
Перечень медицинских изделий подлежащих государственной регистрации >
Необходимые документы для регистрация медицинских изделий

- ОГРН, ИНН;
- Выписку из Единого государственного реестра юридических лиц;
- Документ международного образца, который свидетельствует о наличии на предприятии действующей CMK;
- Доверенность, свидетельствующая о праве выступать в интересах заявителя (заверенная нотариусом);
- Документ, устанавливающий требования технического характера (ТУ);
- Документация, свидетельствующая о присутствии производственных мощностей;
- Свидетельство о проведении квалификационной проверки;
- Описание товара, подлежащего процедуре регистрации;
- Технические инструкции;
- Фотографии продукции медицинского назначения.
Для иностранных товаров:
- Регистрационное удостоверение изготовителя (в стране производства);
- Документация, свидетельствующая об условиях изготовления товара медицинского предназначения;
- Документы разрешительного характера на продукцию, подлежащую регистрации;
- Технические файлы;
- Доверенность на лицо, представляющее интересы производителя в России;
- Инструкция по использованию;
- Фотографии товаров медицинской сферы, подлежащей регистрации.
Сроки регистрации медицинских изделий

Если вам требуется регистрация медицинского изделия, мы готовы оказать квалифицированную помощь в данном направлении. Возможность экономии времени обеспечивается за счет того, что наши специалисты осуществляют некоторые этапы регистрации медицинских изделий в параллельном режиме. Это повышает нашу конкурентоспособность на фоне остальных компаний, оказывающих подобные услуги.
Чаще всего, процесс регистрации продукции медицинской специфики занимает следующие сроки:
- 1 класс – полгода;
- 2а класс и 2б класс – около 10 месяцев;
- 3 класс – приблизительно 1 год.
Госпошлина и стоимость проведения лабораторных исследований и испытаний

Стоимость государственной пошлины за проведение экспертизы качества эффективности и безопасности медицинского изделия определяется категорией риска, в которую входит то или иное изделие. Например, если выполняется регистрация медицинских изделий 3-го класса, то госпошлина оплачивается 115 000 рублей. Если же осуществляется регистрация медицинских изделий 2а и 2б классов — 65 000 рублей и 85 000 рублей, для 1-го класса — 45 000 рублей.
Проведение испытаний с целью государственной регистрации медицинских изделий, является одним из самых важных этапов работы, к которому можно приступить только после окончательной разработки технической и эксплуатационной документации на регистрируемое медицинское изделие.
- Стоимость токсикологических испытаний — 12 000 рублей за один материал или пигмент;
- Испытания на Электромагнитную совместимость — 50 000 рублей (только для активных медицинских изделий);
- Технические испытания — в зависимости от ГОСТов и Стандартов, на основании которых разрабатывается медицинское изделие — от 50 000 рублей;
- Стерилизация в автоклаве и паровая (для изделий, которые выпускаются нестерильными, но должны пройти стерилизацию перед использованием) — от 10 000 рублей;
- Валидация процесса стерилизации — от 50 000 рублей;
- Клинические исследования — от 50 000 рублей.
Почему компании отдают предпочтение именно нам?

Обратившись в ООО «ЕЦЭС КВОЛИТИ», каждый клиент может рассчитывать на оказание всех необходимых услуг в сфере регистрации медицинской продукции. Мы готовы обеспечить профессиональное документальное сопровождение и грамотную консультацию при возникновении любых сопутствующих вопросов.
В услуги регистрации медицинских изделий нашей компании входят:
- Проверка и внесение изменений в сопроводительную документацию;
- Квалифицированная поддержка на всех этапах лабораторных исследований;
- Создание досье на все товары оздоровительного назначения;
- Сбор документации на начальной стадии проведения экспертизы;
- Грамотная юридическая консультация в течение всего процесса регистрации.
В ходе предоставления регистрационных услуг мы занимаемся оформлением всех заключений и документов, подтверждающих безупречное качество и возможность безопасного использования продукции заказчика. При этом от заявителя требуется лишь предоставить образцы изделия и основные документы в рамках процесса регистрации.
Чтобы получить бесплатную консультацию по всем вопросам звоните нам по телефону:
Презентации ведущих руководителей в сфере регистрации медицинских изделий
- Федеральная служба по надзору в сфере здравоохранения — Антонов В.С.: «Общие требования безопасности и эффективности медицинских изделий как основа обращения медицинских изделий на территории Евразийского экономического союза»
- Федеральная служба по надзору в сфере здравоохранения — Астапенко Е.М.: «Новеллы нормативно-правового регулирования в сфере обращения медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Ахтямова Э.И,: «Внедрение системы менеджмента качества в рамках Евразийского экономического союза. Инспектирование производства медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Валеева А.А.: «Особенности проведения клинических испытаний медицинских изделий в целях регистрации в рамках Евразийского экономического союза»
- Национальный Центр Экспертизы «Войнован Д.А.: «Процедура регистрации медицинских изделий в рамках евразийского экономического союза»
- Федеральная служба по надзору в сфере здравоохранения — Дорофеев А.А.: «Практика применения проверочных листов при проведении контрольно-надзорных мероприятий в сфере обращения медицинских изделий»
- Федеральная служба по надзору в сфере здравоохранения — Живлова О.В.: «Процедура внесения изменений в документы, содержащиеся в регистрационном досье медицинского изделия»
- Федеральная служба по надзору в сфере здравоохранения — Мигеева М.А.: «Актуальные вопросы организации контрольно-надзорных мероприятий в сфере обращения медицинских изделий в свете риск-ориентированного подхода»
- ФГБУ «ВНИИИМТ» РОСЗДРАВНАДЗОРА — «Никифорова Л.Ю.: «Порядок проведения технических испытаний и исследований с целью оценки биологического действия медицинских изделий»
- ФГБУ «ВНИИИМТ» РОСЗДРАВНАДЗОРА — «Никифорова Л.Ю.: «Типичные нарушения, выявляемые при проведении экспертизы качества, эффективности и безопасности медицинских изделий»
Регистрация медицинских изделий
Факультет Медицинского Права оказывает полный спектр услуг по регистрации в России медицинских изделий всех классов риска, включая программное обеспечение. Наша компания оказывает услуги по сопровождению как процедуры первичной регистрации МИ, так и внесения изменений в документы регистрационного досье (вирд). Мы осуществляем разработку технической и эксплуатационной документации (при необходимости), а также организацию и сопровождение технических, токсикологических и клинических испытаний и исследований.
Узнать подробнее
Посмотреть прайс-лист
Наши преимущества
Медицинская специализация
Мы занимаемся только медицинским правом, хотя слово только здесь неуместно, так как медицинское право — это все-все-все и еще немножко.
Уникальность
Пожалуй, единственная общероссийская юридическая компания, предоставляющая столь широкий спектр услуг в области медицинского права.
Опыт и достижения
В нашем «портфолио» множество побед, сложнейших аналитических заключений и записок, сотни докладов и конференций, информационный портал с посещаемостью 5 тыс. человек в день.
Получите консультацию специалиста












