Печень
учитывает запросы других органов и
тканей в отношении углеводного обмена.
В мышцах углеводный обмен происходит
в соответствии с принципом самообслуживания.
Цель
мышечной клетки – наиболее эффективно
использовать поступающую глюкозу для
образования АТФ, необходимого для
осуществления механической работы –
сокращения. В состоянии покоя значительные
количества глюкозы резервируются в
форме гликогена. Цитоплазма мышечных
клеток содержит в высоких концентрациях
ферменты гликолиза, а изобилие митохондрий
обеспечивает эффективный распад
продуктов гликолиза через путь лимонной
кислоты и цепь переноса электронов.
Лишь в условиях крайнего утомления эти
аэробные процессы е справляются с
накоплением лактата.
В
мышцах идет гликогенез, мышца осуществляет
лишь немногие синтетические функции.
Ключевые ферменты глюконеогенеза в
мышцах отсутствуют, и глюконеогенез не
идет. Для востановительных синтезов в
мышце НАДФ.Н не требуется, и фосфоглюконатный
путь почти не функционирует.
Обмен
углеводов в мышцах обеспечивает создание
тканевых запасов гликогена в состоянии
покоя и использование этих запасов, а
также поступающей глюкозы при напряженной
работе; основные энергетические
потребности всех типов мышц удовлетворяются
главным образом за счет окисления
продуктов обмена жиров. Ни медленно
сокращающаяся гладкая мышечная ткань,
ни сердечная мышца не потребляют глюкозу
в значительной мере. Во время напряженной
работы сердце обеспечивает себя лактатом
для окисления.
Обмен
углеводов в мышце.
Фосфорилирование
глюкозы в мышцах происходит под дейстием
гексокиназы, в печени этот процесс
катализируется глюкокиназой. Эти
ферменты отличаются по Кm. Кm гексокиназы
значительно ниже Кm глюкокиназы.
Фермент мышц – гексокиназа участвует
во внутриклеточной регуляции, т.е. этот
фермент будет фосфорилировать глюкозу
только до тех пор, пока глюкозо-6-ф
используется в мышцах для гликолиза
или образования гликогена.
Другое
важнейшее различие между тканью печени
и мышцы состоит в отсутствии в мышцах
фермента глюкозо-6-фасфатазы.
Обмен
углеводов в мозге.
По
сравнению со всеми органами тела функций
мозга в наибольшей степени зависит от
обмена углеводов. Если в крови, поступающей
к мозгу, концентрация глюкозы становится
вдвое ниже нормальной, то в течение
нескольких секунд наступает потеря
сознания, а через несколько минут –
смерть. Для того чтобы обеспечить
освобождение достаточного количества
энергии, катаболизм глюкозы должен
осуществляться в соответствии с аэробными
механизмами; об этом свидетельствует
даже более высокая чувствительность
мозга к гипоксии, чем гипогликемии.
Метаболизм глюкозы в мозге обеспечивает
синтез нейромедиаторов, аминокислот,
липидов, компонентов нуклеиновых кислот.
Фосфоглюконатный путь функционирует
в небольшой мере, обеспечивая НАДФ.Н
для некоторых из этих синтезов. Основной
катаболизм глюкозы в ткани мозга
протекает по гликолитическому пути.
Гексокиназа
мозга имеет высокое сродство к глюкозе,
что обеспечивает эффективное использование
глюкозы мозгом. Активность ферментов
гликолиза велика.
Высокая
активность митохондриальных ферментов
цикла лимонной кислоты предотвращает
накопление лактата в тканях мозга;
большая часть пирувата окисляется до
Ац-КоА. Небольшая часть Ац-КоА используется
для образования нейромедиатора
ацетилхолина. Основное количество
Ац-КоА подвергается окислению в цикле
лимонной кислоты и дает энергию.
Метаболизм цикла Кребса используется
для синтеза аспартата и глутамата. Эти
аминокислоты обеспечивают обезвреживание
аммиака в тканях мозга.
Мозг
содержит мало гликогена (0,1% от общего
веса); этот запас расходуется очень
быстро.
Обмен
углеводов в ткани мозга.
в
условиях длительного голодания мозг
использует как источник энергии кетоновые
тела. В крайних случаях такие аминокислоты
как глутамат и аспартат превращаются
в соответствующие кетокислоты, которые
способны к окислению с образованием
энергии.
1.
Обмен углеводов в печени.
Одной
из важнейших функций печени в процессах
обмена веществ является ее участие в
поддержании постоянного уровня глюкозы
в крови (глюкостатическая функция):
глюкоза, поступающая в избытке,
превращается в резервную форму, которая
используется в период, когда пища
поступает в ограниченном количестве.
Энергетические
потребности самой печени, как и других
тканей организма, удовлетворяется за
счет внутриклеточного катаболизма
поступающей глюкозы. В печени катаболизм
глюкозы представлен 2 процессами: 1)
гликолитический путь превращения 1 моль
глюкозы в 2 моль лактата с образованием
2 моль АТФ и 2) фосфоглюконатный путь
превращения 1 моль глюкозы в 6 моль СО2 с
образованием 12 моль НАДФ.Н. Оба процесса
протекают в анаэробных условиях, обе
ферментативные системы содержатся в
растворимой части цитоплазмы, оба пути
требуют предварительного фосфорилирования
глюкозы.
Гликолиз
обеспечивает энергией клеточные реакции
фосфорилирования, синтез белка;
пентозофосфатный путь служит источником
энергии восстановления для синтеза
жирных кислот, стероидов.
При
аэробных условиях происходит сочетание
гликолиза, протекающего в цитоплазме
и цикла лимонной кислоты с окислительным
фосфорилированием в митохондриях
достигается максимальноый выход энергии
в 38 АТФ на 1 моль глюкозы. Фосфотриозы,
образующиеся в процессе гликолиза,
могут быть использованы для синтеза
α — глицерофосфата, необходимого для
синтеза жиров. Пируват, который образуется
при гликолизе, может быть использован
для синтеза аланина, аспартата и других
соединений, через стадию образования
оксалоацетата. В печени реакции гликолиза
могут протекать в обратном направлении
и тогда происходит синтез глюкозы путем
глюконеогенеза. В пентозофосфотном
пути образуются пентозы, необходимые
для синтеза НК. В отличие от гликолиза
фосфоглюконатный путь необратим и здесь
окисляется 1/3 глюкозы, 2/3 глюкозы
окисляются по гликолитическому пути.
В
печени протекают гликогенез и гликогенолиз.
Эти процессы взаимосвязаны и регулируются
как внутри – так и внеклеточными
соотношениями между поступлением и
потреблением глюкозы.
Роль
печени в обмене углеводов.
От
ЖКТ
Влияние
инсулина на обмен жиров Влияния инсулина
на обмен жиров обнаруживаются не так
отчетливо и быстро, как влияния на обмен
углеводов, но отдаленные результаты
делают их не менее важными. Особенно
драматичны последствия длительного
отсутствия инсулина, вызывающего
развитие тяжелого атеросклероза, часто
ведущего к нарушению сердечной
деятельности вследствие патологии
сердечно-сосудистой системы и инсультам.
Прежде всего обсудим быстрые влияния
инсулина на обмен жиров. Инсулин оказывает
различные влияния, направленные на
запасание жира в жировой ткани. Прежде
всего, инсулин повышает использование
глюкозы в большинстве тканей, автоматически
снижая потребление ими жиров, что
функционально обнаруживается как
сберегающий жиры эффект. Наряду с этим
инсулин обеспечивает синтез жирных
кислот. Это действие инсулина особенно
демонстративно в случае избыточного
потребления углеводов, когда они не
могут расходоваться на энергетические
нужды и становятся сырьем для синтеза
жиров. Этот синтез практически полностью
осуществляется в печени, а затем жирные
кислоты транспортируются в виде
липопротеинов в жировые ткани, где и
хранятся. Перечислим различные факторы,
повышающие синтез жирных кислот в
печени. 1. Инсулин повышает поступление
глюкозы в гепатоциты. После того, как
концентрация гликогена в печени достигает
5-6% массы печени, синтез гликогена
ингибируется. Продолжающееся поступление
глюкозы стимулирует использование ее
для синтеза жиров. Прежде всего, глюкоза
преобразуется в пируват, а пируват, в
свою очередь, — в ацетилкоэнзим А
(ацетил-КоА) — субстрат, из которого
синтезируются жирные кислоты. 2. Если
очень большое количество глюкозы
используется на энергетические нужды,
в цикле лимонной кислоты образуется
избыток цитратов и изоцитратов. Затем
эти ионы непосредственно активируют
ацетилкоэнзим А-карбоксилазу — фермент,
необходимый для карбоксилирования
ацетил-КоА и образования малонил-КоА —
первой стадии синтеза жирных кислот.
3. Большинство жирных кислот синтезируются
в печени и используются для образования
триглицеридову именно в таком виде жиры
обычно хранятся. Они поступают из печени
в кровь в виде липопротеинов. Инсулин
активирует липопротеинкиназу в стенке
капилляров жировой ткани, которая вновь
отщепляет от триглицеридов жирные
кислоты, поступающие затем в жировую
ткань, где из них синтезируются
триглицериды уже для депонирования.
Соседние файлы в папке экз
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
Введение
Жизнь связана с непрерывным расходом энергии, которая необходима для функционирования организма: с точки зрения термодинамики живые организмы относятся к открытым системам, так как для своего существования они постоянно обмениваются веществами и энергией с внешней средой. Источником энергии человека являются химические превращения органических веществ, поступающих из окружающей среды. Превращение этих веществ в простые приводит к высвобождению энергии, содержащейся в химических связях.
Потребности человека в питании достаточно однородны: вещества необходимы для обмена энергией (белки, жиры, углеводы), вещества для построения сложных белковых молекул и кислотных структур (аминокислоты, пурины, липиды, углеводы), специальные метаболические катализаторы (витамины), неорганические ионы. и универсальный биологический растворитель — вода.
Построение и обновление тканей тела, а также обеспечение энергетических затрат организма должны обеспечиваться адекватным питанием, которое должно включать в себя все необходимые для тела вещества в правильных пропорциях. Это обеспечит высокую работоспособность, что очень важно при тренировках. Нарушения обмена веществ приводят к серьезным последствиям для всего организма.
Сущность обмена веществ и энергии
Какими бы разнообразными ни были формы проявления жизни, они всегда неразрывно связаны с преобразованием энергии. Энергетический обмен — это свойство, присущее каждой живой клетке. Богатые энергией питательные вещества абсорбируются и химически преобразуются, а продукты метаболизма с более низким содержанием энергии выделяются из клетки. Согласно первому закону термодинамики энергия не исчезает и не возникает снова. Организмы должны получать энергию в доступной для них форме из окружающей среды и возвращать соответствующее количество энергии в окружающую среду в форме, менее пригодной для дальнейшего использования.
Около века назад французский физиолог Клод Бернар установил, что живой организм и окружающая среда образуют единую систему, поскольку между ними происходит непрерывный обмен веществами и энергией. Нормальное функционирование организма поддерживается за счет регулирования внутренних компонентов, что требует затрат энергии.
Использование химической энергии в организме называется энергетическим обменом: именно он служит индикатором общего состояния и физиологического состояния организма.
Метаболические процессы делятся на две группы: ассимиляция и диссимиляция. Ассимиляция — это совокупность процессов создания живой материи, диссимиляция — это распад живой материи. Диссимиляция позволяет удалить элементы ткани, чтобы заменить их новыми, а также высвободить энергию для совершения жизненных действий. Обмен веществ и, в то же время, жизнь поддерживается только тогда, когда процессы диссимиляции уравновешиваются процессами ассимиляции. Это равновесие динамически изменчиво. Напряженные действия жизни, такие как работа с мышцами, требуют высвобождения энергии в больших количествах. Следовательно, в это время преобладают процессы диссимиляции. После окончания физических нагрузок необходимо восстановить израсходованные ресурсы. Для этого метаболизм сдвинут в сторону ассимиляционных процессов.
В период роста ребенка преобладают ассимиляционные процессы. По мере старения они отстают по интенсивности от процессов диссимиляции.
Процессы ассимиляции и диссимиляции тесно связаны друг с другом. Для эффективной мобилизации запасов энергии за счет распада богатых энергией веществ (диссимиляция) требуется синтез новых молекул фермента (ассимиляция). Для реализации процессов синтеза сложных соединений в организме (ассимиляции) необходимо высвобождение энергии за счет распада богатых энергией веществ (диссимиляция).
Метаболизм часто обозначается термином метаболизм, процессы ассимиляции — анаболизмом, а процессы диссимиляции — катаболизмом. Однако следует иметь в виду, что этими терминами уместно обозначать только те метаболические процессы, которые происходят внутри организма, а не процессы взаимодействия организма с внешней средой. Та часть анаболических процессов, которая заключается в синтезе нуклеиновых кислот и белков с образованием клеточных структур и ферментов, называется пластическими процессами. Метаболические процессы, обеспечивающие снабжение клеток энергией для выполнения жизненных действий, называются энергетическими процессами. В основном они относятся к процессам катаболизма, поскольку большое значение среди них имеет расщепление богатых энергией веществ. Но в эту группу входят также процессы ресинтеза одних богатых энергией веществ за счет расщепления других.
Любой акт жизнедеятельности организма или отдельных его клеток может осуществляться только при энергетической и пластической поддержке. Энергетическая поддержка функций заключается в соответствующем усилении энергетических процессов и, следовательно, в производстве необходимой энергии. Пластическая поддержка функций включает процессы синтеза структурных белков и ферментов, которые обеспечивают эффективность структур, выполняющих функцию, и способность контролировать биохимические процессы, лежащие в основе выполнения физиологической функции. Чтобы отличить внешний метаболизм от внутреннего, последний принято называть повседневным обменом. При изучении внешнего метаболизма внешний вид и количество поступающих веществ связаны с конечными продуктами. Сущность повседневного обмена веществ заключается в разнообразных преобразованиях веществ, поступающих и выходящих в клетки. Повседневный обмен условно делится на обмен белков, углеводов, жиров и минералов.
Обмен веществ в организме проходит в несколько этапов. На первом этапе высокомолекулярные белки, липиды и полисахариды расщепляются на низкомолекулярные соединения, которые беспрепятственно проходят в кровь и лимфу через стенки желудочно-кишечного тракта. Всасывание белков происходит после их предварительного расщепления на пептиды, аминокислоты, нуклеотиды и нуклеозиды. Жиры предварительно расщепляются на жирные кислоты и глицерин, высокомолекулярные сахара — на глюкозу, фруктозу и галактозу.
Преобразование энергетических веществ в организме с момента их попадания в клетку характеризует вторую стадию — стадию повседневного обмена веществ. В процессе повседневного метаболизма ацетилкофермент — А, b — кетоглутаровая и щавелевоуксусная кислоты образуются из большинства продуктов первой стадии метаболизма. Эти вещества подвергаются окислению в цикле лимонной кислоты. В результате окислительных процессов высвобождается энергия, запасенная в высокоэнергетических связях аденозинтрифосфорной кислоты.
Завершающий этап метаболизма — выведение продуктов неполного распада с мочой, потом, выведение сальных желез. В процессе обмена веществ, клеточные структуры будут сформированы и выделяется энергия. Эти две стороны обмена действуют в единстве.
Обмен веществ и энергия в организме регулируются нервными и гуморальными путями. Регулирование, осуществляемое нервной системой, которая играет особенно большую роль в этом процессе, происходит путем прямой посылки эфферентных нервных импульсов к тканям через эндокринные железы, гормоны которых влияют на уровень метаболизма и энергии. Условные рефлексы имеют большое значение в изменении обмена веществ, обеспечивая адаптацию организма к различным условиям жизни. Индифферентные раздражители после многократного сочетания с факторами, влияющими на обмен веществ и энергию, могут условнорефлекторно изменить ее в нужном направлении.
Обмен белков и его регуляция
Белки — основная часть живой протоплазмы. В сухом остатке тканей, полученном после удаления воды, содержание белка достигает 60 — 80%. Это связано с тем, что все тканевые структуры построены из белков. Таким образом, пластическая роль в организме принадлежит в первую очередь белкам. Белки отличаются сложной структурой и высокой химической активностью. Они могут участвовать в разных биохимических реакциях. Следовательно, белки способны выполнять в организме и другие функции, помимо пластических:
- белки обеспечивают поддержание обмена веществ, воспроизводство структур, осуществляющих обменные процессы;
- белки — один из основных строительных материалов тканевых структур;
- большая группа специфических белков — ферментов — биокатализаторов биохимических реакций в организме;
- некоторые гормоны имеют белковую структуру;
- белковые структуры участвуют в обеспечении в тканях возникновения и распространения возбуждения;
- осуществлять сокращение мышц в результате взаимодействия белков миозина и актина, а также тропонина и трипомиозина;
- сложный белок — гемоглобин выполняет функцию транспорта кислорода в крови, в мышечной ткани есть аналогичный белок — миоглобин;
- в свертывании крови большое значение имеет фибриноген плазмы крови;
- белки плазмы крови транспортируют гормоны, витамины и ряд других веществ, образуя с ними комплексные соединения;
- Белки плазмы крови обеспечивают оноктическое давление (при белковом голодании оноктическое давление снижается, в результате чего происходит переход жидкой части плазмы в ткани (голодный отек));
- белки действуют как буферные системы;
- группа специфических белков (антитела и др.) Выполняет защитные функции;
- специфические белки, присутствующие в тканях, являются рецепторами гормонов и некоторых других биологически активных веществ, молекулы гормонов образуют сложные соединения с этими рецепторными белками, что необходимо гормону для влияния на метаболические процессы;
- В передаче наследственности, точнее в экспрессии генов, важную роль играют белковые соединения (нуклеопротеины);
- белки имеют определенную ценность, а также являются источником энергии (при окислении 1 г белка выделяется 5,3 ккал. Но азотистые продукты распада белка (мочевина, аммиак и т. д.) Не подвергаются дальнейшему окислению в организме. Следовательно, когда в организме окисляется 1 г белка, выделяется столько же энергии, сколько при окислении 1 г углеводов, т.е. 4,1 ккал).
Белки, входящие в состав тела, постоянно обновляются. Устаревшие элементы и конструктивные элементы разделяются и заменяются новыми. Например, у человека ежедневно вырабатывается 25 г белков печени, 20 г белков плазмы и 8 г гемоглобина. А за полгода жизни обновляется половина структурных белков человеческого тела.
Незаменимые аминокислоты синтезируются в организме из продуктов распада белков и поэтому могут отсутствовать в пище. Из 20 известных аминокислот 12 незаменимы для человека. Биологическая ценность белка также меняется в зависимости от аминокислотного состава. Наиболее ценны белки животного происхождения. Белки пшеницы, ячменя и кукурузы имеют низкую биологическую ценность.
Белки, которые попадают в пищеварительный тракт с пищей, расщепляются в тонком кишечнике до аминокислот. Освободившиеся аминокислоты всасываются в капиллярные сосуды стенок кишечника и попадают в печень с кровью через воротную вену. Некоторые аминокислоты, попадающие в печень, подвергаются дезаминированию и трансаминированию. Дезаминирование — это процесс удаления аминогруппы из аминокислот и образования конечных продуктов белкового обмена. Безазотный аминокислотный остаток может быть преобразован в углеводы или жиры, а также может быть окислен с образованием воды и углекислого газа. Конечными продуктами распада белка являются азотсодержащий аммиак, мочевина, мочевая кислота и креатинин. Их содержание в крови в сумме определяется как остаточный азот. Его нормальная концентрация в плазме крови составляет 25-35 мг%. Конечные продукты распада белка выводятся из организма с мочой и частично с потом.
Процессы дезаминирования и трансаминирования обеспечивают синтез определенных аминокислот и белков. Поскольку каждый белок в организме имеет свой собственный специфический состав аминокислот, то в зависимости от того, какие белки необходимо синтезировать в данный момент времени, запросы на разные аминокислоты также меняются. Часть аминокислот используется в печени для синтеза собственных структурных белков и ферментов. Синтез белков плазмы также происходит в печени. Другая часть аминокислот переносится кровью из печени в другие ткани для синтеза тканевых белков и ферментов и для создания клеточного резерва аминокислот. Синтез клеточных белковых структур происходит под контролем ядерной ДНК. Программа биосинтеза, удаленная из ДНК матричной РНК, переносится в цитоплазму, где осуществляется построение белков, специфичных для организма. Энергетический потенциал аминокислот высвобождается в цикле трикарбоновых кислот.
Основным показателем удовлетворения потребности организма в белках является белковый (азотный) баланс. Азотное равновесие наблюдается, когда потребление белка с пищей компенсирует накопленный, разлагающийся белок. Он характеризует жизнедеятельность здорового человека.
Учитывая, что азот содержится в основном в белках, можно рассчитать белковый (азотистый) баланс по его содержанию в переваренной пище (среднее содержание азота в белке около 16%) и в продуктах выделения (пот и моча).
При отрицательном балансе азота с мочой выводится больше азота, чем потребляется с пищей. Происходит прогрессирующее истощение, разрушение белковых структур клеток.
После болезни, а также при интенсивной мышечной работе в организме происходят интенсивные пластические процессы. Существует задержка (задержка) азота в организме, что характеризует положительный азотный баланс. Нормальная жизнедеятельность организма возможна только при азотистом равновесии или положительном азотистом балансе.
Обмен белков в организме регулируется нервными центрами, расположенными в подклубневой области промежуточного мозга. При экспериментальном повреждении у животных некоторых ядер этой части мозга увеличивается белковый обмен, его баланс становится отрицательным, в результате чего происходит резкое истощение. Нервная система влияет на метаболизм белков через гормоны щитовидной железы, передней доли гипофиза (саматотропный гормон) и других эндокринных желез.
Обмен белков играет важную роль в пластическом поддержании мышечной активности. Наряду с этим белки также участвуют в энергоснабжении мышечной работы. Однако роль белков как источника энергии незначительна по сравнению с ценностью углеводов и жиров. Основная роль белков состоит в том, что ферментные белки регулируют интенсивность энергетических процессов. Безазотные продукты распада белка (безазотный аминокислотный остаток) могут служить субстратом для окислительных процессов или использоваться в печени для синтеза гликогена и жирных кислот.
Во время интенсивной, продолжительной работы мышц расщепление белков усиливается. Это связано с мобилизацией белковых ресурсов организма. Он заключается в усиленном высвобождении свободных аминокислот из лимфоидной и мышечной тканей. Эти аминокислоты подвергаются трансаминированию в печени по нужным направлениям и используются для синтеза ферментов. Благодаря этому увеличиваются возможности адаптивных изменений энергии и других метаболических процессов.
Синтез белка требует очень значительных затрат энергии. Во время работы используются энергетические возможности мышечных клеток для выполнения сокращений. Следовательно, в это время синтез белков в мышцах подавлен. В то же время не только мышцы, но и лимфоидные ткани отдают свои аминокислотные ресурсы для синтетических процессов в «фабрике ферментов» — печени.
Накопление основного продукта распада белка — мочевины — информативный индикатор воздействия на организм длительных физических нагрузок. Чем больше объем выполняемой нагрузки, тем больше увеличивается уровень мочевины в крови.
После окончания работы по мере восстановления энергоресурсов становится возможным усиление синтеза белковых структур в мышечных клетках. Усиленный синтез различных белков мышечной клетки после работы важен не только для устранения результатов физиологического износа интенсивно работающих структур, но и для развития структурных изменений, способствующих повышению работоспособности.
Обмен углеводов и его регуляция
Содержание углеводов в живом организме не более 2% от сухого остатка массы тела. Основная часть находится в мышцах и печени в виде гликогена. Энергозатраты организма покрываются в основном за счет окисления углеводов. Они используются для синтеза глюкопротеинов, мукополисахаридов, нуклеиновых кислот, коферментов и аминокислот, а также входят в состав клеточных структур элементов.
Углеводы — важный источник энергии. Хотя АТФ является прямым донором энергии в жизненно важных процессах, его ресинтез в значительной степени является результатом распада углеводов. При полном окислении 1 г углеводов выделяется 4,1 ккал энергии, то есть в 2,3 раза меньше, чем при окислении жиров.
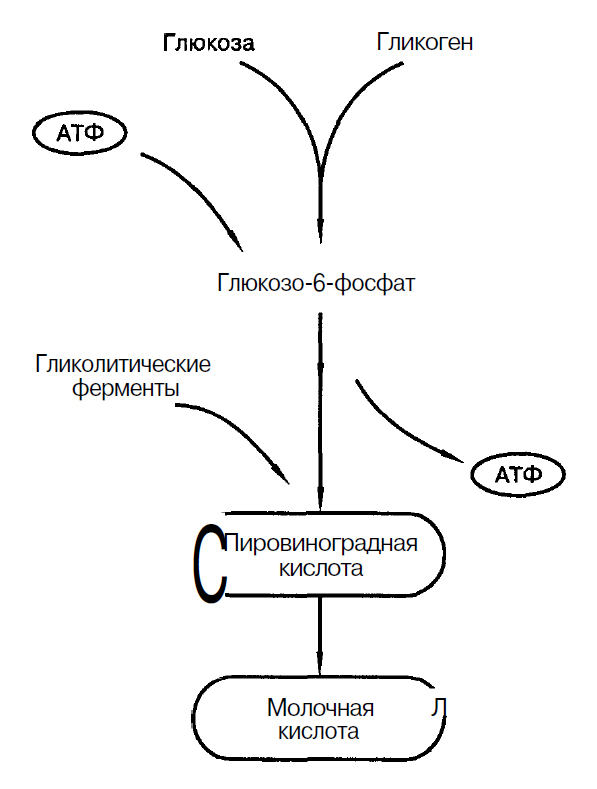
Углеводы в пище человека в основном растительного происхождения. После абсорбции моносахариды проходят через брыжеечную и воротную вены в печень, где фруктоза и галактоза превращаются в глюкозу. Глюкоза подвергается окислению, а также накапливается в виде гликогена. Гликоген составляет 5% от общей массы печени. Это важный вопрос углеводов в организме. В печени углеводы также синтезируются из жирных кислот, лактата, желатина и аминокислотных остатков, не содержащих азот. Одновременно с окислением и отложением в печени происходят процессы ферментативного образования свободной глюкозы (в присутствии глюкозо-6-фосфатозы). В отличие от печени, в мышцах нет глюкозо-6-фосфатозы. Следовательно, в них не образуется свободная глюкоза.
Глюкоза проходит в печеночные клетки свободно, без затрат энергии. Проницаемость мышечной клетки для глюкозы снижена по сравнению с клетками печени. В мышцах, как и в печени, откладывается гликоген. Его содержание в скелетных мышцах достигает 1,5-2% от общей массы этой ткани. Суммарная емкость углеводного депо тела человека массой 70 кг составляет 400-700 г. Однако мышечный гликоген не может служить регулятором уровня глюкозы в крови, но является резервным топливом для мышечной работы. Высвобождение энергии гликогена происходит во время гликогенолиза: на каждый глюкозный остаток гликогена синтезируется 3 молекулы АТФ. При обильном поступлении в организм углеводов они превращаются в жирные кислоты и откладываются в виде жира.
В процессе окисления углеводов выделяется энергия, которая используется для биосинтеза, образования тепла, а также для осуществления определенных форм жизни. В организме происходит постоянный обмен глюкозы между печенью, кровью, мышцами, мозгом и другими органами. Основным потребителем глюкозы являются скелетные мышцы. Расщепление в них углеводов осуществляется по типу анаэробных и аэробных реакций. Окислительное фосфорилирование глюкозы энергетически более выгодно, чем ее аноксическое разложение. В условиях относительного покоя мышц анаэробные процессы расщепления глюкозы (гликолиза) тормозятся аэробным метаболизмом. И только в зрелых электролитах лидируют гликолитические процессы. В клетках новообразований окислительные процессы подавляются гликолитическим расщеплением углеводов. Анаэробный распад гликогена или глюкозы заканчивается образованием молочной кислоты, большая часть которой превращается в лактат и попадает в кровь. Лактат крови может использоваться в сердечной мышце как прямой субстрат для окисления, а в мышцах покоя и печени — для ресинтеза гликогена. Продуктами аэробного распада углеводов являются вода и углекислый газ, которые по своим каналам выводятся из организма.
Многие ткани тела удовлетворяют свои потребности в энергетических веществах за счет поглощения глюкозы из крови. Нормальный уровень глюкозы в крови (80–120 мг%) поддерживается за счет регулирующего воздействия на синтез или распад гликогена в печени. Снижение уровня глюкозы в крови ниже 70 мг% (гипогликемия) нарушает снабжение тканей глюкозой. Превышение нормального уровня глюкозы в крови наблюдается после еды (алиментарная гипергликемия), при кратковременной и интенсивной мышечной работе (миогенная или рабочая гипергликемия) и во время эмоционального возбуждения (эмоциональная гипергликемия). Если содержание глюкозы в крови превышает 150-180 мг%, то в моче обнаруживается глюкоза (глюкозурия). Это способ вывести из организма лишние углеводы. Опасность для жизни представляет нарушение углеводного обмена, при котором гипергликемия является следствием нарушения проницаемости клеточных мембран для сахара при недостатке инсулина. При этом с мочой выводится не лишний сахар, а жизненно необходимый для клеток сахар.
Углеводный обмен в организме регулируется нервной системой. Это было установлено Клодом Бернаром, который после введения иглы в нижнюю часть IX желудочка мозга («инъекция сахара») наблюдал повышенное выделение углеводов из печени с последующими гипергликемией и глюкозурией. Эти наблюдения указывают на наличие в продолговатом мозге центров, регулирующих углеводный обмен. Позже выяснилось, что высшие центры, регулирующие метаболизм углеводов, расположены в подклубневой области промежуточного мозга. При раздражении этих центров наблюдаются те же явления, что и при уколе в дно IX желудочка. Условно-рефлекторные раздражители имеют большое значение в регуляции углеводного обмена. Одно из доказательств этого — повышение концентрации глюкозы в крови при возникновении эмоций (например, у спортсменов перед важными стартами).
Влияние центральной нервной системы на углеводный обмен осуществляется в основном через симпатическую иннервацию. Раздражение симпатических нервов увеличивает выработку адреналина в надпочечниках. Он вызывает расщепление гликогена в печени и скелетных мышцах и тем самым увеличивает концентрацию глюкозы в крови. Гормон поджелудочной железы глюкоген также стимулирует эти процессы. Гормон поджелудочной железы инсулин является антагонистом адреналина и глюкогена. Он напрямую влияет на углеводный обмен клеток печени, активирует синтез глюкогена и тем самым способствует его отложению. Гормоны надпочечников, щитовидной железы и гипофиза участвуют в регуляции углеводного обмена.
Углеводный обмен при мышечной активности.
В начале мышечной работы, а иногда даже в предстартовом периоде мобилизуются углеводные ресурсы организма. Результат повышенного распада гликогена печени — умеренная гипергликемия. Скорость высвобождения глюкозы из печени во время операции высокой мощности составляет 300 мг / мин. Основным потребителем глюкозы в крови во время работы является ткань головного мозга. Определенная часть глюкозы в крови всасывается сердечной мышцей. Скелетные мышцы потребляют относительно мало глюкозы в крови, поэтому предпочтительно используют собственный гликоген в энергетических процессах, распад которых начинается с самого начала работы. Только по мере того, как уровень собственного гликогена в мышцах снижается, использование глюкозы в крови увеличивается.
По мере того, как вы продолжаете работать, уровень глюкозы в крови возвращается к норме и поддерживается в пределах нормы в течение очень длительного периода. При этом происходит снижение содержания гликогена в мышцах и печени, что в конечном итоге приводит к падению концентрации глюкозы в крови, что сопровождается ухудшением работоспособности. Гипогликемию и сопутствующие ей явления можно успешно предотвратить при длительных физических нагрузках путем своевременного приема углеводных растворов. Если уровень глюкозы в крови падает до 40 мг%, резко нарушается деятельность центральной нервной системы, вплоть до потери сознания. Это состояние называется гипогликемическим шоком.
Регулирование липидного обмена
Клеточные структуры включают липиды — жиры, фосфатиды и стерины, которые являются важным пластическим материалом и источником энергии. Организм получает необходимые жиры с пищей или путем их биосинтеза из углеводов. Пищевые жиры расщепляются в пищеварительном тракте до глицерина и жирных кислот. Из них жиры, специфичные для этого вида животных, снова синтезируются в клетках стенки кишечника. Образовавшийся жир, а также жир, абсорбированный в эмульгированной форме без предварительного гидролиза, попадает в основном по лимфатическим сосудам, а затем через грудной лимфатический проток в кровоток. Около 30% жира поступает из клеток стенки кишечника непосредственно в кровоток. В крови жир переносится b и c — глобулинами. Печень задерживает жиры в крови и возвращает их в кровоток только через несколько часов. С помощью крови жиры и жирные кислоты передаются клеткам различных тканей для получения энергии и пластических целей, а также в жировую ткань для обновления накопленных жиров. Пластическая роль жиров заключается в том, что они являются важными компонентами цитоплазмы. Особенно важна роль жиров в структуре клеточных мембран. Количество цитоплазматического жира постоянно и существенно не меняется даже во время голодания. В окислительных процессах свободные жирные кислоты и глицерин расщепляются с образованием воды и углекислого газа.
Если расход энергии организмом незначителен, жир откладывается в жировых депо. Жировые запасы в организме постоянно обновляются. В условиях нормальной жизни выделение жира из депо сочетается с его отложением. При полном энергетическом балансе интенсивность этих процессов одинакова. Если процессы отложения превышают использование жира, он накапливается в организме; если их недостаточно, жировые запасы уменьшаются. Если в результате голодания у подопытных животных масса тела снижается на 33%, то объем жировой ткани уменьшается на 98%.
Жирность очень значительная и достигает 10-30% от общей массы тела. Он варьируется у людей в значительных пределах в зависимости от характера питания, физической активности, возраста, пола и конституциональных особенностей. Отложенные жиры широко используются в качестве источника энергии при мышечной активности и недоедании. При окислении 1г. жир высвобождает 9,3 ккал энергии. Из-за того, что молекула жира содержит относительно мало кислорода, последнего требуется для окисления жира больше, чем для окисления углеводов. В качестве энергетического материала жир используется в основном в состоянии покоя и при выполнении длительной малоинтенсивной физической работы.
Жировая ткань, покрывающая различные органы, защищает их от механических воздействий. Скопление жира в брюшной полости обеспечивает фиксацию внутренних органов. Подкожно-жировая клетчатка, являясь плохим проводником тепла, защищает организм от чрезмерных потерь тепла. Жир является частью секрета сальных желез, который защищает кожу от всасывания и чрезмерного увлажнения при контакте с водой.
Жир как источник энергии для работы мышц.
Использование свободных жирных кислот в качестве источника энергии для работающих мышц зависит от многих факторов. Чем больше они высвобождаются из жировой ткани и чем выше их концентрация в крови, тем больше они потребляются в мышцах в качестве субстрата для окисления. Высокая концентрация молочной кислоты и интенсивное расщепление углеводов (гликолиз) препятствуют использованию свободных жирных кислот. Как следствие, при работе на большой мощности использование свободных жирных кислот мышцами невелико.
Хорошие возможности для употребления свободных жирных кислот создаются при длительных умеренных физических нагрузках, так как не происходит накопления молочной кислоты, а интенсивность окисления углеводов снижается за счет уменьшения их запасов. Использование жиров при длительной мышечной работе достигает 60-90% от общего расхода энергоресурсов. Во время работы мышц уровень собственных триглицеридов мышечной ткани снижается, что свидетельствует об их использовании в энергетических процессах.
Липидный обмен в организме регулируется центральной нервной системой. При повреждении некоторых ядер подбузистой области промежуточного мозга нарушается жировой обмен. В этом случае либо тело становится ожирением, либо истощается.
Нервная система может напрямую влиять на жировой обмен. Если у животного перерезаны нервы, иннервирующие жировую ткань на одной стороне тела, то во время голодания запасы жира на этой стороне не уменьшаются.
Нервная система регулирует жировой обмен, воздействуя на железы внутренней секреции. Недостаточная функция передней доли гипофиза, щитовидной железы и гонад приводит к ожирению. Гормон поджелудочной железы инсулин стимулирует образование жиров из углеводов.
Обмен воды и минералов и их регулирование
Вода определяет структуру многих молекул, участвует в обеспечении химических реакций и выделении продуктов обмена, в процессах терморегуляции, определяет реологические свойства крови.
Существует три основных состояния внутриклеточной и внеклеточной воды: конституционная вода, которая является структурным элементом молекул клеток и тканей тела; связанная вода, образующая гидратные оболочки макромолекул (коллоидов); свободный, т.е. неродственный (растворитель).
На биологическую ценность воды могут влиять дополнительные компоненты: содержание микроэлементов, минеральных солей, тяжелого водорода и кристаллической воды.
Потребность организма в воде переменная, в средних широтах составляет 2,5-3,0 литра. При чрезмерном поступлении в организм воды наблюдается увеличение объема циркулирующей крови, что увеличивает нагрузку на сердце, повышенное потоотделение и мочеиспускание, потерю солей, витаминов, ослабление организма.
Основные необходимые человеку микроэлементы — это медь, цинк, фтор, йод, кобальт, бор, железо. Обычно они попадают в организм в достаточном количестве при сбалансированном питании.
Обмен энергии в теле во время упражнений
При выполнении физических упражнений организм адаптируется к физическим нагрузкам. Он основан на метаболических изменениях, происходящих во время самой мышечной активности и составляющих ее молекулярный механизм. Сразу стоит отметить, что для процессов адаптации как непосредственно в мышечной системе, так и в других органах необходимо многократное использование физических нагрузок. Именно такой принцип повторения физических нагрузок создает необходимый метаболический фон, обеспечивающий постепенное формирование биологических и функциональных изменений. В зависимости от характера, интенсивности, направления физической активности эти изменения могут приводить к перестройке структурных белков и внутриклеточных органелл.
Одноразовая физическая нагрузка не может вызвать серьезных адаптационных изменений в организме, поэтому вторым важным фактором, определяющим процесс биохимической адаптации, является регулярность физических нагрузок. Это связано с метаболическими изменениями, которые происходят в организме при физических нагрузках. При кратковременных физических упражнениях низкой интенсивности они могут ограничиваться только локальными сдвигами в энергетическом обмене или влиять на метаболизм всего организма, как в случае бега на длинные дистанции и езды на велосипеде. В последних случаях процесс восстановления метаболизма до уровня покоя занимает значительно больше времени и требует длительного периода отдыха. Любая физическая нагрузка вызывает изменение энергетического обмена, прежде всего в скелетных мышцах, а затем и во внутренних органах.
В период отдыха после физической работы происходит постепенное восстановление источников энергии (CrF, гликоген). В результате активации ферментативных систем аэробного окисления значительно усиливаются процессы ресинтеза и происходит не только восстановление, но и избыточное восстановление источников энергии. Этот паттерн называется суперкомпенсацией.
Скорость восстановления источников энергии, а также величина и продолжительность избыточного восстановления зависят от потребления кислорода. Из этого следует, что чем интенсивнее была физическая нагрузка и чем интенсивнее израсходовались источники энергии, тем быстрее будет происходить их восстановление в период отдыха после тренировки.
Восстановление до рабочего содержания различных источников энергии в период покоя происходит в разное время. В первую очередь из скелетных мышц и крови выводится молочная кислота, которая окисляется до СО или включается в синтез гликогена, затем происходит ресинтез CrF, гликогена и, наконец, белков. Различия при восстановлении и суперкомпенсация различных источников энергии в период отдыха после физических нагрузок получили название принципа гетерохронности восстановительных процессов. К этому следует добавить, что в разных органах процессы восстановления источников энергии также протекают в разное время. Сначала восстанавливается содержание гликогена в головном мозге, затем в сердечной мышце, скелетных мышцах и печени. Для ресинтеза гликогена в этих тканях используются неуглеводные субстраты и молочная кислота.
На развитие адаптации к физической нагрузке влияет регулярность ее повторения в наиболее благоприятном для организма состоянии после выполнения предыдущей нагрузки. Для получения определенного тренировочного эффекта и последующего повышения спортивных результатов следующую физическую нагрузку следует проводить в период суперкомпенсации после предыдущей. Выполнение физических нагрузок до или после фазы суперкомпенсации источников энергии не вызовет метаболических изменений в организме, направленных на развитие процесса адаптации. В первом случае возможно постепенное развитие процесса недовосстановления работоспособности и преждевременного наступления утомления. Во втором тренировочный эффект будет отсутствовать, так как метаболические изменения предыдущей физической нагрузки уже прошли.
Не следует забывать о необходимости постепенно увеличивать тренировочные нагрузки как по объему, так и по интенсивности. Если этого не сделать, то по мере адаптации организма к стрессу величина затрат энергии будет постепенно снижаться, а изменения в обмене веществ будут менее выраженными.
Различия между обученным и неподготовленным человеком с точки зрения биохимии заключаются в следующем. Можно выделить как минимум три фактора, изменение которых существенно влияет на обмен веществ в организме спортсмена. Во-первых, увеличение запасов энергоресурсов как в скелетных мышцах, так и в других органах и тканях. Во-вторых, расширение возможностей ферментного аппарата. В-третьих, совершенствование механизмов регуляции обмена веществ с участием нервной и эндокринной систем.
Также можно отметить процесс развития гипертрофии рабочих органов (скелетных и сердечных мышц). Однако этот фактор не будет иметь значения для всех видов физической активности, и его действие ограничивается в основном физическими нагрузками с силовой направленностью.
Изменения энергетического обмена при физических нагрузках при длительных тренировках приводят к увеличению запасов внутримышечных источников энергии — ХПН, гликогена и повышению активности ферментов гликолиза, цикла лимонной кислоты, окисления жирных кислот и транспорта электронов. системы. Все это открывает возможности для более быстрого и длительного пополнения запасов АТФ в организме.
Следует выделить еще два момента, которые определяют возможность ресинтеза АТФ в мышечной ткани во время тренировки. Концентрация самого АТФ в тканях тренированного организма не изменяется, но изменяется скорость обмена молекулами АТФ как в реакциях синтеза, так и в реакциях разложения. Каталитическая активность ферментов, участвующих в гидролизе АТФ при сокращении мышц и в процессах его ресинтеза, повышается. Под влиянием физических нагрузок в скелетных мышцах повышается концентрация CrP и повышается активность фермента креатинофосфокиназы, участвующего в ресинтезе АТФ. Это приводит к увеличению энергетических ресурсов в мышцах и увеличению скорости восстановления запасов АТФ и KrF.
Спортсмен может выполнять субмаксимальную физическую активность с меньшими изменениями метаболизма, чем нетренированный человек: меньшее производство молочной кислоты и меньшее снижение внутриклеточного pH.
Спортсмены наглядно продемонстрировали большую способность ферментов мобилизовать жиры из тканей для использования их в качестве энергетических субстратов. Высокая активность ферментов метаболизма жиров в скелетных мышцах позволяет окислять большое количество свободных жирных кислот, доставляемых с током крови к мышцам, а также использовать для этих целей внутримышечные триглицериды. При выполнении физических нагрузок аэробного характера у квалифицированных спортсменов более 55% затраченной энергии покрывается за счет мобилизации жиров и окисления жирных кислот.
Систематические занятия спортом приводят к выраженным и многогранным морфологическим изменениям организма. Однако сразу стоит отметить, что эти изменения тесно связаны с характером, интенсивностью и продолжительностью физических нагрузок.
Специфика биохимической адаптации к систематическим тренировкам проявляется в том, что особенности физических нагрузок отражаются на обмене веществ и служат молекулярной основой для формирования тех или иных сторон этого процесса. Влияние аэробных тренировок на формирование метаболического фона в скелетных мышцах уже было рассмотрено достаточно подробно и было установлено, что одним из важных проявлений таких тренировок следует считать значительное повышение интенсивности окислительных процессов с использованием свободных жирных кислот. как источники энергии.
Тренировка с применением силовых упражнений имеет существенные различия и приводит к наиболее выраженным морфологическим изменениям. Увеличение мышечной массы при таких тренировках свидетельствует об усилении синтеза мышечного белка. Увеличение мышечной массы и размера поперечного сечения мышечных волокон сопровождается увеличением содержания миофибриллярных белков. Под влиянием силовых тренировок увеличивается толщина двигательных нервных волокон, количество терминальных нервных ветвей, количество ядер и миофибрилл в мышечных волокнах, содержание сократительных белков — миозина и актина, а также миоглобина.
Потребность спортсмена в энергии и питательных веществах значительно различается, в первую очередь, в зависимости от вида спорта и объема выполняемой работы. Итак, если сравнивать диету гимнаста или боксера легчайшей весовой категории с диетой спортсмена — многоборца или штангиста, выступающего в супертяжелой весовой категории, то сразу заметны резкие различия в основных компонентах питания. быть раскрытым. Однако, даже не прибегая к таким контрастным сравнениям, следует учитывать, что характер питания спортсмена напрямую связан с обменными процессами, происходящими в организме при занятиях тем или иным видом спорта. Следовательно, основные различия между спортсменами в их потребностях в энергии и питательных веществах связаны со спецификой спорта.
К современным видам спорта относятся виды спорта с различным проявлением основных физических качеств — силы, скорости, выносливости, гибкости и ловкости.
Высокие результаты спортсменов связаны с разным уровнем развития этих качеств и характеризуются метаболическими изменениями в обмене веществ, что может быть использовано для формирования представления о механизмах энергообеспечения мышечной деятельности.
По характеру проявления основных физических качеств спортсмена в процессе специальной физической подготовки и по метаболическим характеристикам обмена все виды спорта можно разделить на пять групп: и т. д.). В этой группе видов спорта энергозатратность спортсменов составляет 3500-4500 ккал. На определенных этапах подготовки спортсменов, занимающихся этими видами спорта, возникает потребность в развитии мышечной силы и требуется дополнительное потребление диетического белка. Чтобы удовлетворить потребность организма в белке, например, у тяжелоатлетов, универсалов, метателей, спринтеров его содержание должно составлять 2,4-2,8 г / кг массы тела или 17-18% калорийности дневного рациона.. Для сравнения, для людей, не занимающихся спортом, этот показатель составляет 11-13%.
Потребность в жирах у представителей этих видов спор составляет 1,8-2,0 г / кг массы тела, или 30% калорийности рациона (33% для людей, не занимающихся спортом).
Углеводы обеспечивают 52-53% энергетической ценности дневного рациона. Это 9,0-11,0 г / кг массы тела, что меньше, чем у обычных людей (57%), но этого вполне достаточно для удовлетворения энергетических потребностей биосинтетических процессов в организме и обеспечения энергией для мышечной деятельности.
Циклические виды спорта (бег на средние и длинные дистанции, спортивная ходьба, велоспорт по шоссе, беговые лыжи и т. д.). Потребность в белках, жирах, углеводах у спортсменов этих видов спорта составляет 14-15%, 25% и 60-61% от общей калорийности дневного рациона, или 2,2-2,6; 1,7–1,9 и 11,0–14,0 г / кг массы тела.
Сложно-координационные виды спорта (акробатика, художественная и художественная гимнастика, прыжки в воду, катание на лыжах с трамплина, санный спорт и парусный спорт, стрельба из лука, пуля, скамейка, конный спорт и др.). В рацион спортсменов, занимающихся этими видами спорта, входят белки 2,2–2,5 г / кг массы тела, жиры 1,7–1,9 г / кг массы тела и углеводы — 8,6–9,7 г / кг массы тела.
Единоборства (вольная, классическая борьба, дзюдо, самбо, бокс, фехтование). Специфика спортивной деятельности в этих видах спорта заключается, главным образом, в быстрой перестройке двигательных действий, соответствующей изменяющейся ситуации. Спортсмены-единоборцы наиболее полно развивают силу, скорость, выносливость. Общее количество белков в суточном рационе этих спортсменов может составлять 2,4–2,8 г / кг массы тела, жиров — 1,8–2,2 г / кг массы тела, углеводов — 9,0–11,0 г / кг массы тела.
Игровые типы спотов. Особенности таких видов спорта, как баскетбол, волейбол, гандбол, теннис, хоккей с шайбой, хоккей с мячом, на траве, футбол, регби, водное поло, связаны с быстрым переключением действий в соответствии с изменяющимися условиями игры, что делает быстрое и эффективное решения при острой нехватке времени. Спортсмены, занимающиеся командными видами спорта, несут наряду с физической активностью большую нейропсихологическую нагрузку, связанную с сильным эмоциональным возбуждением.
В соответствии с потреблением энергии основные нутриенты в дневном рационе распределяются следующим образом: белки — 2,4-2,6 г / кг массы тела, жиры — 2,0-2,2 г / кг массы тела, углеводы — 9,6-10,4 г / кг. масса тела.
Заключение
Как видно из предыдущей главы, упражнения вызывают значительные изменения в обменных процессах. Систематически нагрузки, которые получает организм, вызывают изменения внутренней среды: истощаются источники энергии — при кратковременных и интенсивных нагрузках запасы гликогена в мышцах и печени, при более длительных — жиров. Силовые тренировки расходуют мышечные белки. Однако в период покоя происходит не только восстановление, но и сверхвосстановление этих веществ. Этот принцип лежит в основе спортивной тренировки.
Однако тренировки по разным направлениям приводят к разным морфологическим изменениям. Нагрузки, направленные на развитие аэробной выносливости, приводят к увеличению интенсивности окислительных процессов с использованием свободных жирных кислот в качестве источника энергии, силовые тренировки — к увеличению диаметра работающих мышц.
С учетом этих особенностей составляется ежедневный рацион спортсменов. Калорийность, а также количество белков, жиров, углеводов зависят от специфики спорта. При правильном питании, обеспечивающем организм спортсмена всеми необходимыми ему питательными веществами, повышается работоспособность, а значит, можно добиться высоких результатов.
Список литературы
- Пмендин А.И., Рогозкин В.А., Шишина Н.Н. Питание спортсменов. — М.: Физическая культура и спорт, 1987.
- Физиология человека: Учебник для институтов физической культуры / Под ред. Н.В. Зимкина. — М.: Физкультура и спорт, 1974.
- Лаптев А.П., Полиевский С.А. Гигиена: Учебник для институтов и техникумов физической культуры. — М.: Физическая культура и спорт, 1992.
- Платонов В. Н. Адаптация в спорте. — К.: Здоровье, 1987.
- Общий курс физиологии человека и животных. В 2 кн. Книга 2. Физиология висцеральных систем: Учебник для биологических и медицинских специальных вузов / Под ред. АД. Ноздрачев. — М.: Высшая школа., 1993.
- Физиология мышечной деятельности: Учебник для институтов физической культуры / Под ред. Сладкий картофель. Коца. — М.: Физическая культура и спорт, 1984.
- Фомин Н.А. Физиология человека: Учебник для студентов факультета физического воспитания педагогических институтов. — М.: Просвещение, 1984.
- Реферат на тему: Образ жизни студента и его влияние на здоровье
- Реферат на тему: Особенности психофизической подготовки студента в результате занятий спортом
- Реферат на тему: Основные методики контроля в спорте
- Реферат на тему: Принципы адаптивной физкультуры
- Реферат на тему: Заболевания позвоночника и ЛФК (С.Бубновский и В.Дикуль)
- Реферат на тему: Современное состояние здоровья и заболеваемость студентов
- Реферат на тему: Нетрадиционные виды спорта
- Реферат на тему: Физическая культура как средство сохранения и укрепления здоровья
- Реферат на тему: Классическая аэробика
- Реферат на тему: Cпортивный отбор в художественной гимнастике
- Реферат на тему: Роль физических упражнений в социализации личности студента в период обучения в ВУЗе
- Реферат на тему: Отражение здорового образа жизни в формах жизнедеятельности студентов
Аэробное окисление углеводов — окисление молекулы глюкозы в тканях организма с участием кислорода до конечных продуктов обмена с образованием 38 АТФ. Аэробный обмен (клеточное дыхание) — процесс распада и окисления питательных веществ с участием кислорода, протекающий в митохондриях с образованием АТФ. Белки — высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. [c.487]
Гормон роста оказывает влияние и на углеводный обмен в противоположность инсулину он тормозит использование глюкозы в тканях и вызывает появление типичных признаков диабета. [c.148]
Инсулин — гормон, синтезируемый -клет-ками поджелудочной железы, который регулирует углеводный обмен путем усиления проникновения глюкозы в ткани, что приводит к снижению концентрации ее в крови, а также обмен жиров и белков. При недостаточном синтезе инсулина развивается заболевание сахарный диабет . [c.490]
Характерной особенностью действия гормонов является уникальность их эффекта. Кроме того, действие одних гормонов, как правило, уравновешивается противоположным действием других. Например, как глюкагон, так и адреналин вызывают распад гликогена печени и поступление глюкозы в кровоток. Глюкокортикоиды повышают скорость образования глюкозы из других источников (гл. и, разд. Е, 7). Гормон роста способствует увеличению содержания глюкозы в крови, подавляя использование глюкозы в тканях. С другой стороны, под действием инсулина увеличивается потребление глюкозы тканями и повышается эффективность утилизации. Гормон щитовидной железы, повышающий общий уровень клеточного обмена веществ, также способствует снижению концентрации глюкозы в крови. [c.317]
У экспериментальных животных введение инсулина вызывает гипогликемию (снижение уровня глюкозы в крови), увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен. [c.269]
Механизм развития гипергликемии после введения глюкокортикоидов включает, кроме того, снижение синтеза гликогена в мышцах, торможение окисления глюкозы в тканях и усиление распада жиров (соответственно сохранение запасов глюкозы, так как в качестве источника энергии используются свободные жирные кислоты). [c.277]
Окисление глюкозы в тканях до конечных продуктов обмена может быть схематически представлено так [c.249]
Механизм окисления глюкозы в тканях можн) в этом случае изобразить с помощью следующей схемы, приведенной на стр. 259 (см. также схему на стр. 256). [c.258]
Количественное определение глюкозы в тканях [c.48]
При инсулиновой недостаточности помимо нарушений углеводного обмена наступают расстройства жирового и белкового обмена нарушается образование жирных кислот (из глюкозы) и биосинтез белков, усиливается образование глюкозы из аминокислот. Создается впечатление, что при инсулиновой недостаточности для проникновения глюкозы в ткани нужны более высокие, чем в норме, ее концентрации в крови, и чтобы все же обеспечить ее поступление в ткани, организм разными путями поднимает концентрацию глюкозы. [c.204]
Моносахариды пищи представлены в основном глюкозой и фруктозой, которые содержатся во многих фруктах, меде и называются сахарами. В организм они поступают в свободном виде либо образуются в процессе пищеварения из ди- и полисахаридов пищи. Поступление в организм большого количества свободной глюкозы и быстрое ее всасывание в кровь (уже через 15—20 мин после приема пищи она обнаруживается в крови) приводит к гипергликемии крови, что активирует функцию поджелудочной железы, которая выделяет гормон инсулин, обеспечивающий поступление глюкозы в ткани, где она используется для синтеза гликогена, а при значительном избытке — и для синтеза жиров. После действия инсулина уровень глюкозы в крови снижается, что может привести к гипогликемии и общей слабости. Систематическая активация поджелудочной железы может способствовать развитию заболевания сахарным диабетом. Поэтому количество моносахаридов в питании людей, особенно в пожилом возрасте, должно быть ограничено и не превышать 25—35 % общего количества потребляемых углеводов. [c.448]
Усиление поступления глюкозы в ткани [c.145]
При значительном поступлении углеводов с пищей или интенсивном распаде гликогена в печени уровень глюкозы в крови может превышать верхнюю границу нормы и достигать 10 ммоль л и более, что характеризуется как состояние гипергликемии. Гипергликемия может возникать и при снижении использования глюкозы тканями, что наблюдается при тяжелом заболевании — сахарном диабете. Связано это заболевание со снижением выработки гормона инсулина в поджелудочной железе (гипофункция), который усиливает проникновение глюкозы в ткани, либо с потерей чув- [c.166]
Усиливается синтез гликогена под воздействием гормона поджелудочной железы — инсулина, который регулирует поступление глюкозы в ткани, а ингибируется адреналином, так как он угнетает активность фермента гликогенсинтетазы. Уровень гликогена в печени и других тканях может увеличиваться только до определенного предела, поскольку высокие концентрации его в тканях угнетают активность гликогенсинтетазы. [c.169]
Снижение концентрации инсулина при физических нагрузках уменьшает поступление глюкозы в ткани и способствует увеличению ее уровня в крови, а повышение концентрации гормонов — антагонистов инсулина (глюкагона, адреналина, кортизола, соматотропина) увеличивает уровень глюкозы за счет мобилизации ее из печени или активации глюконеогенеза. Изменение соотношения этих гормонов влияет на метаболические процессы в работающих мышцах и других тканях. [c.273]
IV. ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ АКТИВНОСТИ И КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ ГЛЮКОЗЫ В ТКАНЯХ [c.43]
При вычислении количества гликогена в ткани из суммарной величины содержания общих углеводов, выраженной в мг% глюкозы (формула (13)), вычитается величина содержания глюкозы в ткани, а разница умножается на коэффициент перевода глюкозы в гликоген (0,9). [c.61]
Глюкоза, поступающая из крови в органы, подвергается в них превращениям, приводящим ее к распаду с освобождением потенциальной энергии. Превращения глюкозы в тканях, независимо от того происходит ли этот распад после предварительного образования из нее гликогена, или же без этого, начинаются с процесса ее фосфорилирования, приводящего к образованию глюкозо-6-фосфорной кислоты. Глюкозо-6-фосфорная кислота, а не глюкоза является исходным материалом для дальнейших превраще- [c.276]
Действие инсулина в организме заключается не только в том, что он стимулирует синтез гликогена в печени оно многогранно. Экспериментальные данные показывают, что при недостатке инсулина снижается проницаемость клеток гю отношению к глюкозе. Ткани и органы в результате недостатка инсулина меньше поглощают глюкозу из крови, и это в известной мере приводит к гипергликемии и глюкозурии. Имеются также данные, указывающие, что инсулин устраняет тормозящее действие некоторых веществ (Р-липопротеидов) на активность глюкокиназы, фермента, катализирующего реакцию фосфорилирования глюкозы. Таким образом, при недостатке инсулина интенсивность процесса фосфорилирования глюкозы в тканях организма понижена. Так как использование глюкозы в тканях и органах начинается с момента ее фосфорилирования, то при сахарном диабете условия для использования глюкозы оказываются неблагоприятными. [c.301]
Размер. Этот параметр важен по крайней мере в трех аспектах. Во-первых, очевидно, что сенсор большого размера мало приемлем для пациентов. Во-вторых, при введении большие сенсоры неминуемо приводят к большему повреждению ткани, чем небольшие, и, помимо кровотечения, они могут изменять соотношение содержания глюкозы в ткани и крови из-за локальных изменений скорости потока крови и мышечной проницаемости. И, в-третьих, тонкие сенсоры игольчатого типа, видимо, вызывают меньшую реакцию ткани, чем большие плоские устройства [60]. [c.299]
СТГ обладает широким спектром биологического действия. Он влияет на все клетки организма, определяя интенсивность обмена углеводов, белков, липидов и минеральных веществ. Он усиливает биосинтез белка, ДНК, РНК и гликогена и в то же время способствует мобилизации жиров из депо и распаду высших жирных кислот и глюкозы в тканях. Помимо активации процессов ассимиляции, сопровождающихся увеличением размеров тела, ростом скелета, СТГ координирует и регулирует скорость протекания обменных процессов. Кроме того, СТГ человека и приматов (но не других животных) обладает измеримой лактогенной активностью. Предполагают, что многие биологические эффекты этого гормона осуществляются через особый белковый фактор, образующийся в печени под влиянием гормона. Этот фактор был назван сульфирующим или тимидиловым, поскольку он стимулирует включение сульфата в хрящи, тимидина—в ДНК, уридина—в РНК и пролина—в коллаген. По своей природе этот фактор оказался пептидом с мол. массой 8000. Учитывая его биологическую роль, ему дали наименование соматомедин , т.е. медиатор действия СТГ в организме. [c.259]
Среди гормонов передней доли гипофиза, структура и функция которых выяснены в последнее десятилетие, следует отметить липотропины, в частности 3- и у-ЛТГ. Наиболее подробно изучена первичная структура 3-липо-тропина овцы и свиньи, молекулы которого состоят из 91 аминокислотного остатка и имеют существенные видовые различия в последовательности аминокислот. К биологическим свойствам 3-липотропина относятся жиромобилизующее действие, кортикотропная, меланоцитстимулирующая и ги-покальциемическая активность и, кроме того, инсулиноподобный эффект, выражающийся в повышении скорости утилизации глюкозы в тканях. Предполагают, что липотропный эффект осуществляется через систему [c.261]
При недостаточной секреции (точнее, недостаточном синтезе) инсулина развивается специфическое заболевание—диабет (см. главу 10). Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия (увеличение уровня глюкозы в крови) и гликозурия (выделение глюкозы с мочой, в которой в норме она отсутствует). К расстройствам обмена относят также усиленный распад гликогена в печени и мышцах, замедление биосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержания холестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). После введения больным инсулина все перечисленные нарушения, как правило, исчезают, однако действие гормона ограничено во времени, поэтому необходимо вводить его постоянно. Клинические симптомы и метаболические нарушения при сахарном диабете могут быть объяснены не только отсутствием синтеза инсулина. Получены доказательства, что при второй форме сахарного диабета, так называемой инсулинрезистентной, имеют место и молекулярные дефекты в частности, нарушение структуры инсулина или нарушение ферментативного превращения проинсулина в инсулин. В основе развития этой формы диабета часто лежит потеря рецепторами клеток-мишеней способности соединяться с молекулой инсулина, синтез которого нарушен, или синтез мутантного рецептора (см. далее). [c.269]
Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО, и Н,0 при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За [c.633]
Инсулин способствует синтезу гликогена в печени и мышцах и усиливает окислительный распад глюкозы в тканях, активируя гексокиназную реакцию, т. е. образование глюко-зо-6-фосфата 2 (см. стр. 164). Инсулин обеспечивает переход глюкозы внутрь клетки, повышая проницаемость клеточной мембраны. [c.94]
Ход определения. Ткань обрабатывается кадмиевым реактивом с таким расчетом, чтобы 0,8 мл реактива соответствовали 0,1 г ткани. Через 20 мин. к смеси добавляется 1,1 н. NaOH (0,1 мл на 0,8 мл кадмиевого реактива). При этом образуется гидрат окиси кадмия, который является хорошим осадителем не только белков, но и веществ, обусловливающих так называемую остаточную редукцию. Не рекомендуется определять содержание глюкозы в печени горячим способом, где осаждение ведется при нагревании, так как извлекаемый частично при этом гликоген переходит в фильтрат и, гидролизуясь, дает глюкозу, увеличивая,. таким образом, величину содержания глюкозы в ткани. [c.49]
В норме импульсы, идущие от центральной нервной системы, поддерживают секрецию инсулина, глюкагона, адреналина и адренокортикотропного гормона на таком уровне, при котором содержание сахара в крови колеблется в довольно узких пределах — от 80 до 120 мг%. Инсулин повышает проницаемость клеточной мембраны для глюкозы, спо-собствлет синтезу гликогена в печени и в мышцах, усиливает окислительный распад глюкозы в тканях и тем самым вызывает снижение содержания сахара в крови (см. стр. 94). [c.176]
Физиологич. роль и. состоит гл. обр. в регулировании обмена глюкозы и поддержании ее нормального уровня в крови. При недостатке И., в частности у людей, страдающих диабетом, нарушаются процессы гликогенообразования и нормального потребления глюкозы в тканях. В результате в крови резко возрастает концентрация глюкозы (гипергликемия) и значительно усиливается выведение глюкозы с мочой (глюкозурия). Введение больному диабетом И. хотя и не излечивает его, но устраняет все эти симптомы, уровень сахара в крови возвращается к норме. При введении чрезмерных количеств И. уровень сахара в крови падает ниже нормы, что может привести к ги-погликемич. коме и дан е смерти. И. вводят в организм больного путем инъекции внутримышечно или подкожно. [c.140]
Процесс новообразования глюкозы в тканях организма из веществ неуглеводной природы называется глюконеогенезом. Глюкоза может синтезироваться из пировиноградной и молочной кислот, а также из ацетил-КоА, глицерина и аминокислот (рис. 66). Все они, кроме глицерина, проходят через стадию образования пировиноградной кислоты. Многие реакции глюконеогенеза представляют собой обращение соответствующих реакций, имеющих место в процессе гликолиза. Однако имеются дополнительные обходные реакции, например образование фосфоенолпировиноград-ной и пировиноградной кислот. [c.178]
Нами установлено (Гуленко, Курский, 1969 Гуленко и др., 1972), что под влиянием интрацистериально введенного 5-ОТ (0.1 мг/кг) в головном мозгу кролика в 3.1 раза повышалось содержание глюкозы, менее выраженно увеличивалось содержание гликогена и снижался уровень молочной кислоты. В этих условиях повышалась интенсивность включения ацетата в глюкозу мозга (в расчете на 1 г ткапи), но удельная радиоактивность ее при этом снижалась. Это свидетельствует о том, что под влиянием 5-ОТ наблюдалось не только усиление синтеза глюкозы в мозгу, но и ее поступление в мозг из других органов, за счет чего и отмечалось понижение удельной радиоактивности глюкозы в ткани мозга. [c.180]
В определяемую величину Х входит не только глюкоза гликогена, но и глюкоза, содержащаяся в тканях, количество которой определяется отдельно и вычитается из общего количества глюкозы. Для определения содержания глюкозы в ткани печени и мышцы применяется метод Фужита и Иватаке (см. стр. 49—50). [c.61]
Инсулин. Большую роль в углеводном обмене и в регуляции содержания сахара в крови играет гормон инсулин. В противоположность действию других гормонов он понижает концентрацию сахара в крови, усиливая превращение глюкозы в гликоген как в печени, так и в мышцах, способствуя надлежащему окислению глюкозы в тканях, а также недо-пуская расщепления гликогена печени с образованием глюкозы. Инсулин действует на процесс фосфорили-рования глюкозы с образованием глюкозо-6-фосфата, являющегося первой ступенью глюкогенезиса, или образования гликогена. В отсутствие достаточного поступления инсулина превращение внеклеточной глюкозы во внутриклеточный глюкозо-6-фос-фат задерживается. [c.364]
Авторы [5] разработали и испытали на собаках глюкозооксидазный ферментный электрод, основанный на принципе регистрации расхода кислорода. Сенсор состоял из двух кислородных электродов, покрытых полипропиленовой мембраной и помещенных в круглый (15 мм в диаметре) пластиковый корпус. Фермент иммобилизовали на одном из электродов уменьшение тока этого электрода сравнивали с сигналом другого, контрольного, электрода. В диапазоне 0-20 ммоль/л соотношение между разностным током и концентрацией глюкозы было нелинейным, причем сигнал существенно уменьшался при понижении давления кислорода. Электроды, имплантированные в подкожную ткань собак, регистрировали уровни глюкозы, соответствовавшие приблизительно половине уровня глюкозы в крови. Сконструировали также имплантируемую систему с замкнутым контуром, состоящую из сенсора и воз-вратно-ноступательного инсулинового насоса, но она оказалась не в состоянии поддерживать нормальную гликемию у собак, больных диабетом. По мнению авторов, это связано с занижением сенсором истинного содержания глюкозы в ткани из-за низкого /7О2 несмотря на дифференциальный режим его работы. [c.300]
В статье мы расскажем:
- Что такое глюкоза и зачем она нужна
- Превращения глюкозы в организме
- Гормональная регуляция уровня глюкозы в крови
- Сколько необходимо глюкозы в день
- Какая норма глюкозы в крови
- В каких продуктах содержится глюкоза
- Симптомы нехватки глюкозы
- В чем опасность высокого уровня глюкозы в крови
Что такое глюкоза и зачем она нужна
Глюкоза — главный источник энергии, топливо для нормальной работы всех органов и систем организма, важнейший компонент метаболических процессов.
У глюкозы много названий — простой сахар, виноградный сахар, моносахарид. Но прежде всего, глюкоза — это углевод.
Углеводы — наиболее распространённый класс органических соединений природы. Они выполняют много функций, но главная из них — источник энергии.
Какие бывают углеводы?
-
«Простые»:
- Моносахариды — самая простая форма углеводов, состоят из 1 молекулы и не могут быть разделены на более мелкие части. Примеры моносахаридов — глюкоза, галактоза, фруктоза.
- Олигосахариды — углеводы, которые содержат 2-10 одинаковых или разных молекул моносахаридов. Например: сахароза (“пищевой сахар”, содержится в сахарной свекле и тростнике, моркови, ананасах, сорго), мальтоза (в солоде, проростках злаков), лактоза (молочный сахар, содержится в молоке).
-
«Сложные»:
- Полисахариды — углеводы, которые содержат более 10 молекул моносахаридов. Например, крахмал (содержится в злаках, картофеле, бобовых, овощах), целлюлоза (в отрубях, кожуре овощей), лигнин (злаки, лежалые овощи), гликоген (“животный крахмал”, синтезируется в печени, практически не поступает из пищи), пектин (в ягодах и фруктах), инулин (в корнях георгинов, артишоков, одуванчиков).

От типа углеводов зависит:
-
нужны ли ферменты для их усвоения;
-
с какой скоростью они всасываются — поступают в кровь. Отсюда деление на “быстрые” и “медленные” углеводы;
-
кто потребляет углевод — органы и системы или кишечная микрофлора;
-
уровень выброса инсулина в ответ на потребление углеводов;
-
метаболические особенности, связанные с потреблением углеводов.
Для глюкозы, как моносахарида, характерны следующие особенности:
- сладкий вкус;
- для переваривания глюкозы в чистом виде не требуются ферменты;
- всасывание глюкозы происходит в ротовой полости и тонком кишечнике;
- быстрая скорость всасывания;
- вызывает резкий подъём инсулина;
- является источником энергии для органов и тканей;
- после потребления глюкозы быстро наступает голод;
- излишек глюкозы откладывается в жир;
- отличается высоким гликемическим индексом.
Углеводы, попадая с пищей в организм, вызывают повышение уровней инсулина и глюкозы в крови. Для их оценки существует несколько индексов.
Гликемический индекс (ГИ) — показатель, по которому оценивается скорость попадания глюкозы в кровь. Чем он выше, тем быстрее глюкоза попадёт в кровь, а значит, тем быстрее в крови повысится уровень глюкозы и инсулина. Шкала гликемических индексов строится относительно глюкозы – ее ГИ равен 100.
Гликемическая нагрузка (ГН) — оценивает не скорость повышения уровня глюкозы в крови, а число единиц, на которое поднимется ее уровень после употребления определенного количества конкретного продукта. Для расчёта ГН используется количество углеводов в продукте, вес продукта и его ГИ.
Например, ГИ у яблока — 38, в 100 гр. яблока содержится 13 гр. углеводов, а значит у яблока ГН=38*13/100=5, т.е. уровень глюкозы после съеденных 100 гр. яблок повысится на 5 единиц. Это наглядно демонстрирует, что ГИ не соответствует ГН, и продукты с высоким уровнем ГИ могут повышать уровень глюкозы незначительно, если содержат небольшое количество углеводов на 100 гр.
Инсулиновый индекс — обозначает скорость выброса инсулина в ответ на поступление пищи, рассматривается совместно с ГИ и не всегда ему соответствует. Любой приём пищи провоцирует выброс инсулина, не только углеводной. Наименьший — ИИ у продуктов, богатых жирами.
Учитывать все эти показатели — ГИ, ГН и ИИ важно тем, кто имеет метаболические нарушения — инсулинорезистентность, преддиабет или диабет. Здоровому человеку нет необходимости в расчёте этих индексов и достаточно просто придерживаться принципов полноценного питания.
Функции глюкозы
Все углеводы при переваривании расщепляются до моносахаридов — глюкозы, галактозы или фруктозы. Глюкоза — единственный источник энергии, который могут использовать абсолютно все клетки, это — её основная функция. Кроме энергетической, биологическая роль глюкозы обширна. Некоторые из ее функций:
-
Участвует в обменных процессах, выступает наиболее усвояемым энергоресурсом.
-
Поддерживает работоспособность организма.
-
Питает клетки головного мозга, улучшает память, обучаемость.
-
Стимулирует работу сердца.
-
Быстро утоляет чувство голода.
-
Снимает стресс, корректирует психическое состояние.
-
Ускоряет восстановление мышечной ткани.
-
Помогает печени в нейтрализации токсических веществ.
Необходимое количество глюкозы организм по умолчанию получит, если в рационе присутствует достаточное количество углеводной пищи, например, основы здорового рациона — овощи и крупы. Если даже в какой-то момент углеводной пищи окажется недостаточно для удовлетворения возросших потребностей организма, на помощь придёт печень и ее способность синтезировать глюкозу из неуглеводных источников.
Избыток сахаров в питании не даёт «глюкозу для мозга», как иногда можно услышать, а наносит серьёзный вред здоровью. Потребление слишком большого количества глюкозы опасно для всех, но особенно в группе риска дети, люди в преклонном возрасте, больные с нарушенным обменом веществ.
Некоторые из негативных последствий избытка глюкозы в рационе приводят к:
- ожирению;
- развитию тромбофлебита;
- перегрузке поджелудочной железы;
- возникновению аллергических реакций;
- возрастанию холестерина;
- появлению воспалительных, сердечных заболеваний, расстройству кровообращения;
- артериальной гипертензии;
- повреждению сетчатки глаза;
- сахарному диабету;
- эндотелиальной дисфункции.
Количество поступившего моносахарида в организм должно в полной мере компенсироваться расходом калорий на энергетические нужды.
Превращения глюкозы в организме
Глюкоза попадает в организм с потреблением углеводов из пищи. Далее, частично в ротовой полости, и в основном в тонком кишечнике, происходит всасывание глюкозы — ее поступление в кровь из пищеварительной системы.
Всасывание глюкозы
Всасывание любых веществ происходит с помощью пассивного или активного транспорта.
Пассивный транспорт — перенос веществ из области высокой концентрации в область низкой концентрации без затрат энергии. Может происходить в виде:
-
Свободной диффузии, когда вещества самостоятельно перемещаются через мембрану клеток.
-
Облегчённой диффузии, когда перенос веществ через мембрану происходит с помощью белков-переносчиков.

Активный транспорт — это перенос веществ специальными переносчиками из области низкой концентрации в область высокой концентрации, с использованием свободной энергии организма. В зависимости от типа используемой энергии, существует:
-
Первичный активный транспорт, при котором используется энергия АТФ — универсальный энергоноситель в клетке.
-
Вторичный активный транспорт, при котором используется энергия, запасённая в клетке.
Каким способом всасывается глюкоза?
- при высокой концентрации глюкозы и после приема пищи глюкоза всасываются путем облегченной диффузии;
- при низких концентрациях глюкозы ее всасывание протекает путем вторичного активного транспорта с помощью натрия, выступающего в роли переносчика.
Свыше 90% всосавшейся глюкозы через воротную вену доставляется в печень, а остальная часть через общий кровоток транспортируется в другие ткани. Однако при обильном потреблении углеводов глюкоза может сразу же транспортироваться к различным органам и тканям, минуя печень.
Органы и ткани, использующие глюкозу, бывают:
-
Инсулинонезависимыми, транспорт глюкозы в которые осуществляется при помощи белков-переносчиков, без участия инсулина — гормона поджелудочной железы, ответственного за регуляцию уровня глюкозы в крови. К ним относятся мозг, почки, слизистая кишечника, эритроциты, половые железы, плацента, хрусталик глаза. Поступление глюкозы к ним не меняется в зависимости от уровня инсулина.
-
Инсулинозависимыми, транспорт глюкозы в которые осуществляется под действием инсулина. К ним относятся мышцы (скелетные и сердца), жировая ткань. При снижении уровня инсулина или инсулинорезистентности, поступление глюкозы к ним нарушается, они остаются без энергии, “голодают”, а сама глюкоза остаётся в крови.
Поступив в клетку органов и тканей, глюкоза первым делом превращается в глюкозо-6-фосфат, который в отличие от глюкозы не может проникать через мембрану клетки. То есть эта форма глюкозы нужна для того, чтобы “запереть” глюкозу в клетке. Глюкозо-6-фосфат идет на биосинтез гликогена, вступает в реакции гликолиза или расщепляется до глюкозы.
Гликолиз
Все процессы получения энергии живыми организмами происходят в результате окислительно-восстановительных реакций, при которых происходит перенос электрона с одной молекулы (восстановитель, донор электронов) на другую (окислитель, акцептор электронов). При этом роль окислителя играют либо органические молекулы, либо кислород.
Гликолиз – это последовательность реакций, связанных с окислением глюкозы, приводящих к ее превращению в пируват (пировиноградную кислоту, важный элемент для метаболических реакций) с одновременным образованием АТФ. При этом молекула глюкозы расщепляется на 2 молекулы пирувата, образуя 2 молекулы АТФ и 2 молекулы НАДФ (кофермент нескольких ферментов).
Гликолиз бывает:
- Аэробный, происходит при участии кислорода. В этом случае пируват и НАДФ достигают митохондрий, где полностью окисляются до углекислого газа и воды.
- Анаэробный, протекает в условиях без поступления кислорода. В этом случае из пирувата и НАДФ образуются лактат (молочная кислота) или этиловый спирт. Это единственный путь в условиях без кислорода, позволяющий клеткам получать энергию. Анаэробный гликолиз происходит в мышцах при интенсивных нагрузках, когда кровеносная система не успевает снабжать мышцы достаточным количеством кислорода.
Гликоген
Если глюкоза поступает в организм в избыточном количестве, она трансформируется в гликоген в печени и мышцах. У взрослого человека его количество не может превышать 450 гр, треть из которых хранится в печени, остальная часть — в мышцах.
Гликоген в печени используется как резервный источник, запас глюкозы на случай снижения ее уровня между приёмами пищи. Через 10-18 часов без поступления глюкозы с пищей, запасы гликогена в печени истощаются, а через 24 часа полностью исчерпываются. Мышечный гликоген — источник энергии при мышечной работе.
Если запасы гликогена и так достаточно велики, глюкоза начинает превращаться в жир.
Глюконеогенез
Некоторые ткани и органы, такие как мозг и эритроциты, зависят от постоянного снабжения глюкозой. На этот случай печень может синтезировать глюкозу из других моносахаридов, а при истощении запасов гликогена и полном отсутствии углеводов в пище, например, при голодании или безуглеводных диетах, запускается процесс синтеза глюкозы из неуглеводных соединений — глюконеогенез. Исходными соединениями для него могут быть аминокислоты (в первую очередь — из мышечной ткани), лактат, пируват, глицерины и жирные кислоты. Больше всего глюкозы при глюконеогенезе производится из лактата и аминокислот. Благодаря этому процессу ткани могут обходиться без внешнего источника глюкозы несколько недель.
Гормональная регуляция уровня глюкозы в крови
Колебания концентрации глюкозы в крови, отличные от нормальных значений, воспринимаются рецепторами гипоталамуса — области мозга, которая регулирует постоянство внутренней среды организма. Благодаря влиянию гипоталамуса на вегетативную нервную систему, происходит срочное повышение или снижение выработки гормонов, отвечающих за регуляцию уровня глюкозы в крови.
Уровень глюкозы в крови понижается при помощи одного гормона — инсулина. Повышение уровня глюкозы в крови возникает под действием нескольких гормонов: гормона поджелудочной железы глюкагона; гормонов надпочечников; гормонов роста гипофиза и гормонов щитовидной железы.
Инсулин
Инсулин играет ключевую роль в регуляции углеводного метаболизма. Он обеспечивает стимуляцию захвата глюкозы клетками и ее поступление в клетку, активирует ее транспорт через клеточные мембраны, ускоряет окисление глюкозы, усиливает синтез гликогена, замедляет глюконеогенез.
Последствия нарушения чувствительности к инсулину:
- разрушение мышечной ткани;
- снижение уровня энергии;
- хроническое воспаление;
- увеличение массы висцерального жира;
- метаболический синдром;
- сахарный диабет
- сердечно-сосудистые заболевания.
Гормоны, ответственные за повышение уровня глюкозы
Повышение уровня глюкозы в крови возникает под действием нескольких гормонов. Глюкагон — антагонист инсулина, продуцируется поджелудочной железой, активирует все процессы, ведущие к росту концентрации глюкозы в крови, ускоряет распад гликогена и глюконеогенез в печени.

Адреналин, гормон надпочечников, усиливает мобилизацию гликогена.
Соматотропин, гормон роста, увеличивает секрецию и глюкагона и инсулина, способствует увеличению депонирования глюкозы и усилению ее утилизации.
Кортизол, гормон стресса, ускоряет глюконеогенез и мобилизацию гликогена.
Сколько необходимо глюкозы в день
В среднем расход глюкозы в организме взрослого человека составляет 10 г/час.
Основный потребители глюкозы:
-
Головной мозг, на обеспечение его работы нужно около 60% от общего количества глюкозы.
-
Эритроциты забирают еще 10-15% от всей глюкозы.
-
Мышцы и жировая ткань, их потребности непостоянны и зависят от активности.
В норме печень выделяет как раз то количество глюкозы, которое покрывает основные запросы организма (10 г/ч), однако под действием глюкагона или адреналина на короткое время печень может в несколько раз увеличить выход глюкозы. Около 30% глюкозы печень производит за счет распада гликогена, а 70% — глюконеогенеза. Печень вырабатывает глюкозу со скоростью, равной ее утилизации во всем организме.
Вычислить конкретно уровень потребления глюкозы сложно и прежде всего нужно отталкиваться от количества углеводов. Согласно нормам физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации, из углеводов рекомендуется получать не более 60% от энергетической суточной потребности, при этом простые сахара должно приходиться не более 10% от общей калорийности.
Если ваша дневная норма энергии составляет 2000 ккал, то ваша норма углеводов — не более 300 гр, при этом добавленного сахара не рекомендуется употреблять более 25 гр.. Если разбить это количество по типам углеводов, то примерная норма в день: 210 гр. на сложные углеводы, 40 гр. на клетчатку, 25 гр. на фруктозу, 25 гр. на добавленный сахар. Эти цифры примерные и зависят от потребностей конкретного человека и особенностей его организма.
Точечные советы по питанию, которые
повысят уровень твоей энергии на 10 из 10
От ТОПовых нутрициологов МИИН
Получить советы

Какая норма глюкозы в крови?
Глюкоза — единственный источник энергии, который могут использовать абсолютно все клетки и который доступен для тканей в практически постоянной концентрации в виде “сахара крови”. Постоянный уровень глюкозы в крови нужен для обеспечения разнообразных потребностей организма. Наиболее высокой чувствительностью к снижению уровня глюкозы отличается головной мозг. Согласно установленным в 1999 году в ВОЗ нормативам, нормальное значение уровня глюкозы в крови колеблется в пределе от 3,3 ммоль/л до 5,5 ммоль/л. Причем на данный момент в качестве нормы принимается и верхнее значение 5,9 ммоль/л. При этом здоровым оптимумом считается уровень не выше 4,7-4,9 ммоль/л. Если есть подозрения в нарушениях углеводного обмена, то помимо уровня глюкозы в крови нужно опираться и на другие показатели. В первую очередь — гликированный гемоглобин, инсулин и индекс НОМА.
Уровень глюкозы в крови меняется в течение дня и зависит от многих факторов. В первую очередь — от приёмов пищи и от состояния здоровья.
В промежутках между приемами пищи концентрация глюкозы в крови составляет около 5 ммоль/л (0,9 мг/л). Сразу после приема пищи концентрация глюкозы поднимается до 7-8 ммоль/л, а при достаточно длительном голодании снижается до 4 ммоль/л.
Экспериментальные тесты на переносимость принятой глюкозы показывают, что у здоровых людей после приёма 100 гр. легкорасщепляемых углеводов уровень сахара в крови повышается, а через 2-3 часа вновь снижается до исходного уровня. У больных сахарным диабетом уровень глюкозы после приема пищи повышается сильнее, а снижается гораздо медленнее.
В каких продуктах содержится глюкоза
Источник глюкозы в продуктах питания — углеводы, глюкоза есть в любой углеводной пище. Если придерживаться деления на “быстрые” и “медленные” углеводы, которое демонстрирует скорость всасывания глюкозы, то источники можно поделить на 2 части:
Источники “медленных” углеводов: крупы, бобовые, овощи, фрукты, хлеб из ржаной или цельнозерновой муки — все те продукты, которые помимо углеводов содержат клетчатку, витамины, микроэлементы, растительный белок. Их усвоение организмом происходит постепенно, не приводит к быстрому скачку глюкозы в крови и тем самым не перегружает поджелудочную железу.
“Быстрые” углеводы содержатся в выпечке, сладостях, кондитерских изделиях, сладких соках и газировке. Они мгновенно насыщают кровь глюкозой, что заставляет поджелудочную железу выделять слишком много инсулина разом — впоследствии это может стать причиной нечувствительности клеток к нему.

Больше всего углеводов содержат хлеб, приготовленный из муки первого и высшего сорта, любые сладости промышленного производства, очень много глюкозы – 99,9 г на каждые 100 г – находится в сахаре. Но как известно, мало съесть продукт, нужно его усвоить.
Существуют способы, повышающие и снижающие степень усвоения углеводов.
Улучшает усвоение углеводов:
- высокая степень измельчения продуктов (пюре, крем-супы и т.д.);
- высокая длительная термическая обработка (разваренные овощи, макаронные изделия);
- удаление клетчатки (сок).
Замедляет усвоение углеводов:
- употребление совместно с продуктами, богатыми клетчаткой и/или жирами;
- приготовление пищи до состояния al dente;
- употребление в пищу крахмалистых продуктов в охлаждённом виде, благоадаря резистентному крахмалу.
Симптомы нехватки глюкозы
Недостаток глюкозы называется “гипогликемия”. Это не самостоятельное заболевание, а состояние, характеризующееся снижением уровня сахара в крови ниже нормальных значений. Для мужчин — ниже 2,5–2,8 ммоль/л, для женщин — ниже 1,9–2,2 ммоль/л.
У здорового человека причинами гипогликемии могут быть беременность, интенсивные физические нагрузки, длительное голодание. Уровень глюкозы в этом случае быстро восполняется за счет резервов организма или после приёма пищи и не несёт никаких негативных последствий Однако, такие случаи гипогликемии крайне редки. Чаще всего гипогликемия развивается при различных заболеваниях и патологических состояниях.
Симптомы нехватки глюкозы зависят от ее тяжести и истинной причины. Некоторые из симптомов:
-
резкое и сильное чувство голода;
-
мышечная дрожь;
-
потливость;
-
учащение сердцебиения;
-
повышение артериального давления;
-
беспокойство;
-
двигательное возбуждение;
-
подавленное настроение или, наоборот, чувство эйфории;
-
покалывания губ, языка, кончиков пальцев;
-
ухудшение концентрации внимания, координации движений;
-
невнятная речь;
-
сонливость.
Основные причины гипогликемии:
- погрешности инсулинотерапии при диабете — пропуск приемов пищи, употребление алкоголя, излишняя физическая активность, передозировка инсулина или другими лекарствами ;
- эндокринные расстройства, результатом которых является дефицит гормонов кортизол, тироксин, соматотропин; гипотиреоз и т.д.;
- операции на органах ЖКТ, в результате которых нарушается расщепление и всасывание углеводов:
- нарушения в работе ферментов, участвующих в обмене углеводов (гликогена, фруктозы, галактозы) и последующее нарушение превращения глюкозы из других углеводов или затруднение ее высвобождения из гликогена.
В чем опасность высокого уровня глюкозы в крови
Повышенное содержание глюкозы в крови называется “гипергликемия” и характеризуется увеличением концентрации глюкозы в крови более 6,1 ммоль/л. Причинами этого состояния могут быть стресс, высокоуглеводная диета, прием лекарств, а также болезни эндокринной системы и внутренних органов.
Симптомы гипергликемии могут отличаться в зависимости от ее причины.
Гипергликемию можно заподозрить по следующим признакам:
-
Сухость во рту.
-
Обильное мочеиспускание.
-
Мышечная слабость.
Гипергликемия может быть вызвана физиологическими и патологическими факторами.
К физиологическим можно отнести стресс, избыток углеводов в питании, беременность. В этих случаях уровень сахара нормализуется самостоятельно и его коррекция не требует никакого вмешательства. Постоянно высокая концентрация глюкозы пагубно действует на стенки кровеносных сосудов, может в будущем стать причиной сахарного диабета. Соблюдение принципов полноценного питания — отличный способ профилактики гипергликемии и ее последствий.
Патологическая гипергликемия может быть обусловлена проблемами с эндокринной системой (диабет, преддиабет, инсулинорезистентность), заболеваниями ЦНС и метаболическими нарушениями. Для нормализации уровня сахара в крови при патологических причинах используются диета, лекарственные препараты (инсулин, сахароснижающие средства), лечение основного заболевания.
Самые распространенные патологические причины гипергликемии:
- сахарный диабет, при котором происходит или снижение выработки инсулина (сахарный диабет 1 типа) или избыток выработки инсулина и развитие резистентности к нему (сахарный диабет 2 типа);
- другие заболевания эндокринной системы, сопровождающиеся усиленной выработкой гормонов, повышающих концентрацию глюкозы путем влияния на различные этапы углеводного метаболизма;
- судорожные состояния;
- органические поражения ЦНС;
- печеночная недостаточность;
- тяжелые заболевания поджелудочной железы;
- прием лекарственных препаратов, влияющих на уровень сахара в крови.
Выводы
-
Глюкоза — важнейший источник энергии, необходимый для бесперебойного функционирования организма.
-
Всасывание и усвоение углеводов — сложный процесс. зависящий от множества факторов.
-
Организм защищает себя от снижения поступления глюкозы, используя различные механизмы — создаёт запасы глюкозы, синтезирует глюкозу из других сахаров и неуглеводных соединений.
-
За гормональную регуляцию уровня глюкозы отвечают различные гормоны, при этом за снижение уровня отвечает один инсулин. а за повышение — целая группа разных гормонов.
-
Углеводы — важнейший источник энергии, необходимой для бесперебойной работы всех систем организма. Полноценный рацион, содержащий достаточное количество углеводов, полезных жиров, белков и клетчатки — основа здоровья и достаточного уровня энергии.
-
Гипогликемия и гипергликемия могут быть у здоровых людей, и тогда их коррекция не требует специальных действия. Если эти состояния — последствия заболеваний, то необходимо обязательно контролировать уровень глюкозы в крови в соответствии с рекомендациями врача.
The differences in glucose utilization do not correlate with the distribution of glycolytic enzymes between the PCT and PST (106), suggesting that a metabolic regulation mechanism other than that by glycolytic enzymes may determine the ability of each segment to utilize glucose.
From: Seldin and Giebisch’s The Kidney (Fourth Edition), 2008
Energy Metabolism in the Brain
Gerald A. Dienel, in From Molecules to Networks (Third Edition), 2014
Glucose (Glc) utilization. The cerebral metabolic rate (CMR) of glucose (CMRglc) denotes the overall rate of glucose consumption by all pathways. Under normal steady-state conditions, the rate of any step in the glycolytic pathway equals glucose utilization, whereas the rate of the steps in the TCA cycle are twice those of glycolysis due to formation of 2 pyruvate per glucose. CMRglc is generally assayed at the hexokinase step with radiolabeled deoxyglucose (DG); the rate of phosphorylation of DG is converted to rate of glucose utilization by taking into account the kinetic differences for transport and phosphorylation between DG and glucose; approximately two glucose are utilized per deoxyglucose (Sokoloff et al., 1977).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123971791000038
Diabetes
M.J. Rosenthal, in Encyclopedia of Gerontology (Second Edition), 2007
Exercise
Glucose utilization for healthy elderly relates closely to fitness as measured by maximal aerobic capacity, but evidence varies as to whether exercise improves diabetic control in older diabetics. Four months of aerobic exercise can improve muscle oxidative capacity similarly in young and old, but insulin sensitivity is less likely to improve in older people and benefits take longer and require more frequent training. Others found that exercise may reverse the metabolic syndrome for some elderly hypertensives, improves insulin resistance without weight change, reduces cardiovascular disease, and may decrease total mortality as much as 44%. However, it appears that benefits from exercise are transient and may disappear shortly after stopping. Effects of exercise on insulin sensitivity have been proposed to be due to number of glucose transporters, changes in capillary density, and increases in the number of red glycolytic fibers. Age effects are unclear. Increasing lean body mass by resistance exercise may also improve glycemia especially among frail diabetics.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0123708702000536
Developmental Physiology of Carbohydrate Metabolism and the Pancreas
Kathryn Beardsall, Amanda L. Ogilvy-Stuart, in Maternal-Fetal and Neonatal Endocrinology, 2020
34.4.2.2 Glucose Utilization
Glucose utilization rates in the newborn can far exceed the levels found in adults, as demonstrated by the effect of increasing dextrose or insulin infusion. The mean glucose oxidation rate in the term newborn has been estimated to be 6 mg/kg/min (3.8–9.7 mg/kg/min) compared with an adult rate of 3 mg/kg/min.79–81 In preterm infants, glucose oxidation rates have also been reported to be high, ranging from 2.9 to 7.9 mg/kg/min82 or 4.3 to 8.5 mg/kg/min.81 In addition, there is a switch during the 1st week of life from the percentage of total energy expenditure utilized for oxidative versus nonoxidative glucose metabolism, with an increase in nonoxidative disposal marking the change from a catabolic to an anabolic state.75 Insulin stimulates nonoxidative glucose disposal through lipogenesis, glycogenesis, and protein synthesis, impacting on growth both directly and indirectly through the regulation of IGF-I and IGF binding protein one (IGFBP-1).83–85
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128148235000349
Hypoglycemia in the Infant and Child
DAVID R. LANGDON MD, … MARK A. SPERLING MD, in Pediatric Endocrinology (Third Edition), 2008
CHANGES IN GLUCOSE PRODUCTION
Glucose utilization rates per kilogram of body weight are markedly higher in infants than in adults because of their larger brain size relative to body weight. As a result, normal infants and children may develop hypoglycemia after 24 to 36 hours of fasting, whereas normal adults can fast for 48 to 72 hours without hypoglycemia. Stable isotope measurements of glucose turnover rates indicate that the brains of infants and children use glucose at rates of 4 to 6 mg/kg/min, equivalent to almost all of endogenous glucose production during fasting.2
The rate of glucose production by the liver is remarkably correlated with estimated brain weight at all ages. Because brain growth is nearly complete as the body weight reaches 40 kg (at 11-12 years of age), little additional glucose production is needed as an adult body mass is achieved (Figure 11-1).12 Because the greater proportion of brain growth occurs in the first 2 years of life, hypoglycemia occurring during this time may cause significant and permanent neurologic damage. Although hypoglycemia occurring after the first 2 years of life has less likelihood of causing brain damage, its investigation and treatment continue to be crucial.
From the studies of Bier and co-workers it is clear that the glucose requirement per unit of body mass in infants is greater than that of adults, yet the muscle bulk of young children is substantially smaller relative to body mass than that of adults.2 Because gluconeogenic precursors are derived primarily from muscle, the ability of children to maintain glucose levels through gluconeogenesis while fasting is limited by their smaller muscle mass.
The ability of the infant and child to maintain glucose above 70 mg/dL during a prolonged fast gradually improves with age. Infants from 1 week to 1 year of age should be able to tolerate 15 to 18 hours of fasting. By 1 year of age, a normal child should be able to fast up to 24 hours.13,14 By 5 years of age, a fast of up to 36 hours may be tolerated. Hypoglycemia induced by fasting of shorter duration should alert the clinician to the possibility of an underlying disorder.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781416040903500168
Metabolic and Bioenergetic Drivers of Neurodegenerative Disease: Neurodegenerative Disease Research and Commonalities with Metabolic Diseases
Russell H. Swerdlow, in International Review of Neurobiology, 2020
3.3 Other relevant metabolism features
Glucose utilization is altered in AD brains. This is evident on fluoro-deoxyglucose positron emission tomography (FDG PET) studies (Mosconi et al., 2009). FDG PET is accomplished by injecting an individual with radiolabelled FDG. FDG accesses the brain through the circulation, with more metabolically active brain regions taking up greater amounts of FDG. The FDG undergoes phosphorylation, which traps it within cells. The deoxyglucose modification blocks further passage through glycolysis and imaging the brain via PET reveals which brain areas took up the most glucose and by extension were most metabolically active. In AD, certain relatively posterior brain regions, including the posterior temporal, parietal, posterior cingulate and precuneal cortices, show diminished glucose uptake.
Direct molecular surveys of AD autopsy brains show reductions in insulin-initiated signaling pathway activity. This pattern suggests a likely state of brain insulin resistance, leading some to classify AD as a form of diabetes mellitus (DM) (Steen et al., 2005).
Even though AD brain insulin resistance can occur in the absence of obvious systemic insulin resistance, epidemiological studies suggest a connection between central nervous system (CNS) and peripheral insulin resistance (Morris et al., 2014). The meaning of this association is unclear. It could indicate DM or peripheral insulin resistance contributes to AD. Alternatively, this association could reflect a common underlying physiologic state. To this point, a systemic mitochondrial lesion in AD could account for the concomitant presence of CNS and systemic insulin resistance phenotypes (Morris et al., 2014).
Genome wide association (GWAS) studies implicate lipid homeostasis in the evolution of AD. The APOE gene, which encodes the cholesterol/lipid transporting protein apolipoprotein E, contains amino acid-altering genetic variants. These variants constitute the best studied and most powerful determinant of sporadic AD risk (Corder et al., 1993). One copy of the APOE4 variant increases the AD odds ratio about 3.5 times over baseline risk, and the APOE2 variant decreases AD risk. The AD research field remains uncertain over why APOE variants so profoundly influence AD odds ratios, but within the context of the GWAS studies it certainly is possible that the impact of APOE derives from differences in how the various apolipoprotein E forms influence lipid homeostasis. While the aggregate of these genetic data do not directly implicate a role for mitochondria, because mitochondria and lipid metabolism are connected, it seems reasonable to postulate genetic data implicating lipid homeostasis indirectly implicate a role for mitochondria in AD.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0074774220300088
Metabolic and Bioenergetic Drivers of Neurodegenerative Disease: Neurodegenerative Disease Research and Commonalities with Metabolic Diseases
Dimitrios Kapogiannis, Konstantinos I. Avgerinos, in International Review of Neurobiology, 2020
2.1.3 The role of insulin in aging
Glucose utilization in the brain has been considered to be largely independent of the action of insulin (Banks et al., 2012). However, the fact that insulin-sensitive GLUT-4 is expressed in the brain increases the likelihood that glucose metabolism in the brain is at least partially regulated by insulin (Szablewski, 2017). An in vitro study has shown that direct infusion of insulin into neuronal cultures promotes translocation of the insulin-insensitive GLUT-3 to the plasma membrane, although it does not promote its fusion to the membrane (Uemura and Greenlee, 2006). However, once the neuron is depolarized, GLUT-3 fuses with the membrane. Moreover, neurons pretreated with insulin express higher levels of GLUT-3 at their membranes (Uemura and Greenlee, 2006), suggesting that insulin may indirectly facilitate glucose uptake through additional GLUTs besides GLUT-4. In the rat brain, GLUT-4 immunoreactive cells co-localize with neurons expressing GLUT-3 (Apelt et al., 1999). This physical proximity of GLUT-3- and GLUT-4-expressing cells further suggests that insulin plays an important role in regulating brain glucose. Finally, there is evidence that GLUT-8, which is expressed by hippocampal and other rat brain neurons, is also insulin-sensitive, but that insulin modulates its function at the subcellular level (i.e., transfer of glucose from intracellular organelles to the cytoplasm) (McEwen and Reagan, 2004). The finding that insulin partially regulates brain glucose uptake through these mechanisms has provided rationale for testing intranasal insulin to treat neurological conditions (Avgerinos et al., 2018).
Aging is associated with chronic hyperinsulinemia combined with reduced expression of insulin receptors and altered insulin signaling cascades (i.e., insulin resistance) in the brain (Steculorum et al., 2014; Zhao et al., 2004). Since glucose transportation in the brain is partially modulated by insulin, it is plausible that insulin resistance may contribute to the altered brain glucose metabolism associated with aging. Interestingly, in aged individuals without cognitive impairment, peripheral insulin resistance (measured by Homeostatic Assessment of Insulin Resistance, HOMA-IR) has been associated with reduced brain glucose metabolism in a regional pattern similar to that of AD (Baker et al., 2011; Willette et al., 2015a).
In the absence of biomarkers for central insulin resistance, earlier investigations have correlated peripheral insulin resistance measures (such as HOMA-IR) with brain function, under the assumption that central and peripheral insulin resistance partly overlap. This has changed since the development of methodologies to derive neuronal-enriched extracellular vesicles (NEVs) from peripheral blood and the introduction of NEV biomarkers. The NEV biomarkers, such as phosphorylated forms of insulin receptor substrate 1 (IRS-1) and downstream mediators, may reflect neuronal insulin signaling. Studies have shown that these biomarkers can differentiate between cognitively normal individuals (with and without diabetes) and individuals with AD (Kapogiannis et al., 2015). They also predict preclinical AD (Kapogiannis et al., 2019) and are associated with gray matter atrophy in AD (Mullins et al., 2017b). Furthermore, they differ between drug-naïve individuals with schizophrenia and control subjects (Goetzl et al., 2019). Importantly, NEVs show a priori-hypothesized and pathway-specific responses to experimental interventions targeting neuronal glucose metabolism, such as (i) dietary protein restriction in cancer (Eitan et al., 2017), (ii) exenatide in Parkinson’s disease (PD) (Athauda et al., 2019), and (iii) intranasal insulin in AD (Mustapic et al., 2019). The NEV biomarkers contain signaling molecules related to multiple cellular pathways and may provide a “window to the brain” with a simple blood draw (Mustapic et al., 2017).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0074774220300465
Molecular medicine of diabetes mellitus
Dhavendra Kumar, in Clinical Molecular Medicine, 2020
15.2.1 Glucose utilization
The glucose utilization is either insulin dependent or independent. The brain is the major noninsulin-dependent consumer of glucose and requires uninterrupted supply of this substrate. On average a healthy person weighing 70 kg has a daily requirement of 100 g. Glucose is oxidized to carbon dioxide and water. Tissues such as muscle and fat have insulin-responsive glucose transporters (GLUTs) and absorb glucose in response to postprandial peaks in glucose and insulin. During the resting phase, energy requirements are largely met by fatty-acid oxidation. Glucose taken up by muscle is stored as glycogen or metabolized to lactate or carbon dioxide and water. Fat uses glucose as a substrate for triglyceride synthesis; lipolysis releases fatty acids from triglyceride together with glycerol, a substrate for hepatic gluconeogenesis.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128093566000150
Pathophysiology of Insulin Action in Humans
Stefano Del Prato, in The Metabolic Syndrome at the Beginning of the XXI Century, 2005
Muscle perfusion
Muscle glucose utilization in response to insulin is the results of activation of the biological processes regulated by insulin but it must reflect blood perfusion as well. Inappropriate perfusion, indeed, may cause less insulin and less glucose to reach the target tissue. This may be secondary to capillary rarefaction83 so that more muscle unit will be dependent on capillary supply or reflect the inability of insulin to stimulate vasodilation84 and/or capillary and tissue recruitment85-87. Of interest, a more direct effect of insulin on the capillary function may be relevant with respect to the pathogenesis of some aspects of the Metabolic Syndrome as discussed below. Capillary rarefaction and/or reduced recruitment may also be coupled with a shift in the ratio between type I (oxidative) and type II (glycolytic) muscle fibers83.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9788481748925500115
Cell Glucose Transport and Glucose Handling During Fetal and Neonatal Development
Rebecca A. Simmons, in Fetal and Neonatal Physiology (Fifth Edition), 2017
Brain
Brain glucose utilization accounts for approximately 80% of whole body glucose disposal in humans.126 Furthermore, heterogeneity exists in glucose utilization among different regions of the brain. Circulating glucose crosses the blood-brain barrier and enters brain parenchyma cells via facilitative GLUTs. Most studies of GLUT expression in the nervous system of the developing animal have been performed in the rat. Before the formation of the blood-brain barrier, GLUT1 is abundant in the germinal neuroepithelium, which gives rise to both neurons and neuroglia.127 Just before birth, GLUT1 is abundant in the brain vasculature, meninges, ependyma, and choroid plexus. After birth, GLUT1 is also found in glial cells.127 GLUT1 is developmentally regulated in rat and rabbit brain.39-41 Its expression is highest in adult brain, followed by fetal and neonatal brain, respectively.
Few localization studies have been done in the human fetus. One report has demonstrated that the localization of GLUT1 in the midgestation to late-gestation human fetus is similar to the rat, that is, it is primarily located in the microvascular endothelial cells that constitute the blood-brain barrier.82 However, a more recent study suggested a much wider distribution of GLUT1 in the developing brain.128 From 10 to 21 weeks of gestation, GLUT1 is expressed in all regions of the fetal brain and is primarily present in the endothelial cells of the brain capillaries, in the epithelial cells of the choroid plexus, and in neurons.128 GLUT 2 is not expressed until midgestation (21 weeks), and at that time it is highly expressed in the granular layer of the cerebellum.128 No study to date has been able to detect GLUT3 or GLUT4 in human fetal brain.
In the rodent, after birth, GLUT3 is found in the cerebellum in neurofilament-positive cellular transverse fibers, cell bodies of Purkinje cells, and other neuronal elements in close proximity to the Purkinje layer.82 This region-specific pattern of GLUT3 expression may reflect the differing glucose needs of anatomically distinct regions of the brain. Localization of GLUT3 is similar to the distribution of glucose utilization, which during early infancy is mainly infratentorial, and later in development occurs in supratentorial structures as well.129,130
Regulation of glucose transport in the fetal brain is uniquely different from that in the adult. Before birth, low levels of glucose (in vivo or in vitro) fail to up-regulate glucose transport in whole fetal rat brain71 or isolated glial cells. However, after birth, hypoglycemia induces a marked increase in GLUT1 expression131 in whole rat brain isolated glial cells. Furthermore, glucose transport in the fetal brain does not respond to insulin or IGF-I,47 two hormones that increase GLUT1 expression in glial cells of older animals.132,133 The mechanisms underlying these differences in regulation of glucose transport that occur with maturation are unknown.
Hypoxia during gestation induces a marked increase in both GLUT1 and GLUT3 levels in fetal rat brain.72 Hypothyroidism decreases protein levels of GLUT1, but not GLUT3 in postnatal rat brain.134
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323352147000433
Blood-Central Nervous System Barriers in Morphine Dependence and Withdrawal
HARI SHANKER SHARMA, … PRASANTA KUMAR DEY, in Blood-Spinal Cord and Brain Barriers in Health and Disease, 2004
XI. Regional Cerebral Glucose Utilization in Opioid Withdrawal
Changes in regional cerebral glucose utilization (rCGU) as a measure of metabolic activity have been examined in morphine or other μ receptor agonist opioid-induced withdrawal (Adams and Wooten, 1994). An increased rCGU occurs in limbic and brain stem regions during opioid withdrawal that often correlates with behavioral activity. This effect is quite similar irrespective of withdrawal is either precipitated or results from abstinence. It seems likely that changes in rCGU are mediated by both central and peripheral opioid receptors. However, studies using another μ opioid agonist, sufentanil, suggest that changes in rCGU following withdrawal are mainly mediated via central opioid receptors (Adams and Wooten, 1994). Thus icv administration of sufentanil induced rCGU changes that are highly correlated with the behavioral activity. The opioid agonist sufentanil did not induce ventricular dilatation or damage after its icv administration (Adams and Wooten, 1994). These observations suggest that opioid withdrawal is capable of inducing cerebral metabolic activity through central opioid receptors.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780126390117500206
Дается определение одного из анаэробных путей ресинтеза АТФ в мышечных волокнах – гликолиза. Описаны количественные критерии гликолиза в мышечных волокнах : максимальная мощность, время развертывания, время работы с максимальной мощностью. Дается характеристика ключевым ферментам гликолиза, протекающего в мышечных волокнах: фосфорилазе и фосфофруктокиназе.
Гликолиз в мышечных волокнах
Определение
Под гликолизом понимается процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты (Н.И.Волков с соавт. 2000).
Однако, как указывает С.С. Михайлов (2009) основной углевод мышечных волокон — гликоген. Свободная глюкоза в саркоплазме содержится в очень малой концентрации — имеются лишь ее следы. Поэтому в мышечных волокнах гликолиз протекает в виде распада гликогена. А.Дж. Мак-Комас (2001) по этому поводу пишет так: «Хотя мышечные волокна способны окислять глюкозу, поступающую из кровотока через интерстициальную жидкость, во время сокращений основное количество окисляемой глюкозы обеспечивается гидролизом гликогена«. С. 231.
Гликолиз, протекающий в мышечных волокнах (гликолитический ресинтез АТФ, лактатный ресинтез АТФ) – анаэробный распад гликогена мышц до молочной кислоты (лактата).
Источником энергии, необходимой для ресинтеза АТФ является мышечный гликоген, который находится в саркоплазме мышечных волокон. Концентрация гликогена в саркоплазме составляет 0,5-2% от массы мышцы (С.С. Михайлов, 2009). Также может быть использована глюкоза, поступающая из крови (Н.И. Волков с соавт., 2000), рис.1.
Гликолиз – основной механизм энергообеспечения при работе субмаксимальной мощности длительностью 2-3 мин. Поэтому видами спорта, в которых гликолиз является основным механизмом обеспечения являются: бег на 800 – 1500 м; бег на коньках на 1500 м; плавание на 200 м и др.
Ключевыми ферментами гликолиза являются: фосфорилаза и фосфофруктокиназа. Эти ферменты регулируют скорость протекания гликолиза.
Количественные критерии гликолиза в мышечных волокнах
Максимальная мощность
Максимальная мощность гликолиза составляет 750-850 кал/мин кг. Этот показатель в два раза превышает мощность тканевого дыхания. Высокие значения максимальной мощности объясняются большим количеством гликогена, содержащегося в мышечных волокнах, наличием механизмов активации ключевых ферментов гликолиза, благодаря которым скорость гликолиза возрастает в 2000 раз, отсутствием потребности в кислороде.
Время развертывания гликолиза
Время развертывания гликолиза составляет 20-30 с. Достаточно небольшое время развертывания гликолиза объясняется тем, что все участники этой реакции, а именно гликоген и ключевые ферменты находятся в саркоплазме. Кроме того, ключевой фермент гликолиза – фосфорилаза, активируется стрессовым гормоном адреналином, который выделяется в кровь непосредственно перед началом физической нагрузки. Также фермент фосфорилаза активируется ионами кальция, концентрация которых в саркоплазме повышается более чем в 1000 раз при развитии потенциала действия.
Время работы с максимальной мощностью
Время работы с максимальной мощностью гликолиза составляет всего 2-3 минуты. Это связано с тем, что, во-первых, гликолиз протекает с высокой скоростью, что приводит к быстрому исчерпанию гликогена мышц. Во-вторых, в процессе гликолиза в саркоплазме повышается концентрация молочной кислоты, которая быстро диссоциирует. В результате в мышечных волокнах накапливается лактат и протоны водорода. В-третьих, в настоящее время установлено, что основным поставщиком протонов водорода является гидролиз АТФ , а не гликолиз, как думали раньше. Эта реакция при работе субмаксимальной мощности протекает очень активно. Накопление протонов водорода в результате гидролиза АТФ и гликолиза вызывает сдвиг рН саркоплазмы в кислую сторону и снижает активность ключевых ферментов гликолиза. При значении рН саркоплазмы равном 6,4 расщепление гликогена прекращается. Это вызывает резкое снижение уровня АТФ и развитие утомления (Н.И. Волков с соавт., 2000).
В покое до физической нагрузки концентрация лактата в крови составляет 1-2 ммоль/л. После физической нагрузки субмаксимальной мощности концентрация лактата в крови резко возрастает и может достигать 18-20 ммоль/л.
Если физическая активность продолжается более 20 минут, запасы гликогена в мышечных волокнах истощаются. Основным источником АТФ в мышцах становится окисление жирных кислот в митохондриях мышечных волокон. Именно по этой причине считается, что для профилактики борьбы с ожирением нужны длительные циклические нагрузки аэробного характера.
Экономичность гликолиза
Гликолиз характеризуется низкой экономичностью. Распад до молочной кислоты одного остатка глюкозы дает только три молекулы АТФ, в то время как при аэробном окислении гликогена до воды и углекислого газа образуется 39 молекул АТФ в расчете на один остаток глюкозы.
Следует отметить, что гликолиз активно протекает в мышечных волокнах IIА и IIB типа.
Литература
- Мак-Комас, А. Дж. Скелетные мышцы.- Киев: Олимпийская литература, 2001.- 407 с.
- Михайлов, С. С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
- Самсонова, А. В. Гипертрофия скелетных мышц человека: Учеб. пособие. 5-е изд. /А.В. Самсонова. – СПб: Кинетика, 2018.– 159 с.
- Самсонова, А. В. Гормоны и гипертрофия скелетных мышц человека: Учеб. пособие. – СПб: Кинетика, 2019.– 204 c.: ил.
- Уилмор Дж., Костилл Д. Л. Физиология спорта и двигательной активности.- Киев: Олимпийская литература, 1997.- 504 с.
С уважением, А.В. Самсонова
Похожие записи:
Сила тяжести
Дано определение силы тяжести. Показано, что сила тяжести является частным случаем силы гравитации. Описаны факторы, определяющие силу тяжести:…
Сила
Дано определение силы в механике. Описаны факторы, определяющие действие на тело силы: направление, точка приложения и численное значение.
Звенья тела человека как рычаги
Дано описание опорно-двигательного аппарата (ОДА) человека как системы рычагов. Приведен пример расчета силы двуглавой мышцы плеча…
Метаболический стресс. Накопление лактата в мышцах
Описан механизм влияния метаболического стресса (накопления лактата) на гипертрофию мышечных волокон. Показано, что накопление лактата приводит к…
Механическое повреждение мышечных волокон
Описаны механизмы механического повреждения мышечных волокон при силовой тренировке, приводящие к гипертрофии скелетных мышц. Показано, что…
Механическое напряжение (механотрансдукция) в скелетных мышцах
Описаны процессы передачи механического напряжения в скелетных мышцах. Показано, что механическое напряжение, возникающее вследствие сокращения скелетных…
О глюкозе в организме
В отличие от остальных граждан, диабетики часто лучше осведомлены о процессах метаболизма, происходящих в организме человека. Именно поэтому, как ни парадоксально это звучит, больной диабетом человек может прожить более долгую и здоровую жизнь. Просто потому, что лучше следит за своим здоровьем. Знания дают возможности!
Сегодня мы попробуем разобраться в теме, которую знает далеко не каждый диабетик: как наш организм расходует глюкозу?
Конечно же, материал является весьма упрощенным. Если полностью описывать все происходящие процессы обмена веществ, получится очень толстый том. А то и не один.
Что чаще всего мы знаем
Обычный человек, не столкнувшийся с сахарным диабетом, чаще всего имеет крайне скудное представление об обменных процессах в его организме. Ему это просто не нужно, так как организм все делает сам.
Диабетик знает немного больше. Чаще всего знания диабетика ограничиваются следующим:
- После еды происходит постепенный процесс усвоения пищи, при этом часть превращается в глюкозу (углеводы)
- Получившаяся из углеводов глюкоза поступает в кровь, из-за чего поднимается ее концентрация. Высокая концентрация глюкозы в крови (гипергликемия) не полезна для организма, ее надо купировать вводом инсулина. Часто лучше заблаговременно, так как инсулин всасывается не мгновенно.
- Если инсулина введено больше, чем следует, происходит падение уровня глюкозы в крови — гипогликемия. Это очень опасное состояние, при глубокой гипе можно впасть в кому и умереть. Поэтому такие состояния надо срочно купировать, употребляя быстроусвояемые углеводы.
Но достаточно ли этой информации для понимания процессов, происходящих в организме? Я думаю, что нет.
Стратегические запасы
Для начала поговорим о запасах, которые умеет делать организм.
Когда мы поели и уровень глюкозы в крови достаточно высок, организм старается максимально использовать ее для пополнения внутренних запасов. С помощью специальных ферментов молекулы глюкозы сцепляются в длинные цепочки — молекулы гликогена, так называемого животного крахмала. Инсулин в этом процессе участвует только косвенно, обеспечивая транспорт молекул глюкозы.
Гликоген может запасаться в печени, составляя до 5% массы этого органа, а также в мышцах — до 1% массы. При этом если гликоген, запасенный в печени, в дальнейшем может использоваться для регуляции концентрации глюкозы в крови, то мышцы являются “жадинами” и используют запасы только для собственных нужд.
Синтез гликогеновых запасов происходит только при гипергликемии. Умеренная гипергликемия после приема пищи — нормальное состояние для организма, именно в этом состоянии он делает стратегические запасы.
Кроме гликогеновых запасов, наш организм умеет делать и другие — жировые, и этот процесс также является инсулинозависимым. Энергетически они примерно в 2 раза эффективнее гликогеновых (при утилизации 1 грамма жира получается примерно в 2 раза больше энергии по сравнении с 1 граммом гликогена). Однако если для извлечения энергии из жира организму приходится постараться и процесс этот небыстрый, то гликоген представляет собой легкодоступную энергию. Сначала организм расходует гликогеновые депо, и только потом принимается за жир, именно поэтому последний всегда не спешит убираться с наших боков, животов и поп, даже несмотря на тренировки и проклятия.
Откуда берется глюкоза?
Разобравшись с запасами, давайте обсудим, откуда в нашей крови может взяться глюкоза. Только ли из усвоенной пищи? Отнюдь нет!
При падении уровня глюкозы запускаются механизмы расщепления ранее накопленных запасов. Ферменты, названия которых мы не будем произносить всуе, отрывают молекулы глюкозы от длинных цепочек гликогена, ранее запасенного в печени, и отправляют в кровь. Так организм регулирует уровень глюкозы в крови, не допуская гипогликемии.
Но что случится, если гипа все-таки случилась? “Испугавшись”, организм приступает к “защитным мерам” — начинает расщеплять гликоген быстрее, пытаясь компенсировать гипу. Именно поэтому после глубокой гипогликемии возможны резкие скачки уровня глюкозы в крови, которые с трудом удается компенсировать. На диабетическом сленге такой рост сахара называется “откатом”.
Конечно же, организм умеет извлекать глюкозу и из жировых запасов, но этот процесс не быстрый и случается только тогда, когда запасы гликогена истощены, то есть после 6-10 часов голодания или серьезной нагрузки.
Есть тут и еще один момент, не очень приятный: при использовании организмом жировых запасов они расщепляются на глицерин и свободные жирные кислоты, а часть жирных кислот в свою очередь окисляется в печени до кетоновых тел. Чем интенсивнее этот процесс — тем больше будет в крови кетоновых тел, что может грозить кетоацидозом при голодании или серьезном недостатке инсулина!
Потребители глюкозы
А теперь о самом интересном: каким же именно органам в нашем организме необходима глюкоза.
Головной мозг
Самым требовательным к уровню глюкозы в крови является головной мозг, и это так по целому ряду причин:
- собственные запасы глюкозы в ткани мозга чрезвычайно малы по сравнению с интенсивностью ее потребления;
- мозг насыщен капиллярами — крошечными кровеносными сосудами, именно эти сосуды сильно страдают при скачках концентрации сахара. Не стоит “убивать” свой мозг и его кровеносную систему;
- при сильной гипогликемии мозг просто отключится, вы уйдете в кому и станете абсолютно беспомощными. Высока вероятность умереть. Поэтому допускать такого нельзя.
Наш головной мозг постоянно потребляет глюкозу, причем делает это вне зависимости от наличия инсулина. Мозг человека весом 70 килограммов потребляет в сутки примерно 100 граммов глюкозы. В состоянии сна и отдыха мозг потребляет меньше — где-то 3-4 грамма в час. При приложении умственных усилий мозг потребляет заметно больше, до 6 граммов глюкозы в час.
Клетки крови
Глюкоза также очень нужна клеткам нашей крови — эритроцитам. Именно они отвечают за снабжение тканей организма кислородом, без них никак! Как и у мозга, своих запасов у эритроцитов нет; они потребляют глюкозу из плазмы крови и делают это вне зависимости от наличия инсулина.
В сутки клетки крови человека весом в 70 килограмм потребляют примерно 30 граммов глюкозы.
Мышцы
Мышцы — один из основных потребителей глюкозы, причем потребление глюкозы мышцами инсулинозависимо. Инсулин отвечает за доставку глюкозы, обеспечивая проницаемость клеточных мембран.
Потребление глюкозы мышцами сильно зависит от физической нагрузки. В сутки мышцы человека весом в 70 килограммов при отсутствии серьезной нагрузки потребляют порядка 35 грамм глюкозы.
В отличие от мозга, у мышц есть собственные запасы, которыми они могут пользоваться при проблемах с поступлением глюкозы. Поэтому, в отличие от мозга, некоторое время они могут провести на “подножном корму”.
Кроме этого, есть и другой механизм питания мышц в отсутствии глюкозы — кетоновыми телами, образующимися при распаде жиров. Однако это уже другая и совсем не полезная для организма история.
Другие органы
Конечно же, практически все другие органы используют глюкозу, им ведь тоже надо функционировать. При этом почти все эти траты зависят от наличия инсулина, являющегося транспортным агентом.
Чуть раньше мы уже разобрались с печенью: она прилежно запасает лишнюю в данный момент глюкозу в виде гликогена. Тем же самым в условиях избытка глюкозы занимаются и мышцы.
Немало глюкозы откладывается про запас и в виде жира.
Некоторое количество глюкозы уходит на питание других органов, обеспечивающих наше пищеварение, секрецию гормонов и ферментов.
Вместо эпилога
Вместо эпилога сделаем некоторые выводы, которые, я надеюсь, помогут людям сбалансировать свой обмен веществ.
- Организм является сложной саморегулируемой системой. У него есть множество механизмов поддержания постоянства внутренней среды (гомеостаза). У больных диабетом одна из этих систем сломана. У первотипников — производство инсулина, у второтипников — действие инсулина в тканях.
- Умеренные колебания уровня глюкозы в крови — норма для организма. При гипергликемии организм делает стратегические запасы, а при недостатке глюкозы — тратит ранее заготовленное. Главное, чтобы эти процессы были сбалансированы.
- Самым главным, важным и капризным потребителем глюкозы является наш мозг. Он потребляет глюкозу инсулинонезависимо, и это хорошая новость. Но плохая новость в том, что как низкий, так и слишком высокий уровень глюкозы губителен для мозга. Если вы больны диабетом — необходимо добиваться как можно более полной компенсации.
- Не стоит голодать, так как организм, исчерпав запасы гликогена, начинает массово добывать глюкозу из жировых запасов, при этом в кровь выделяются кетоновые тела. Диабетикам стоит следить за своими сахарами и своевременным введением инсулина в необходимых количествах, иначе, как и при голодании, в крови резко начинает расти концентрация кетоновых тел. А излишняя концентрация кетоновых тел — это кетоацидоз, смертельно опасное состояние.
Источник
Функции глюкозы в организме человека: основные источники, норма в крови
- Что такое глюкоза и зачем она нужна
- Превращения глюкозы в организме
- Гормональная регуляция уровня глюкозы в крови
- Сколько необходимо глюкозы в день
- Какая норма глюкозы в крови
- В каких продуктах содержится глюкоза
- Симптомы нехватки глюкозы
- В чем опасность высокого уровня глюкозы в крови
Что такое глюкоза и зачем она нужна
Глюкоза — главный источник энергии, топливо для нормальной работы всех органов и систем организма, важнейший компонент метаболических процессов.
У глюкозы много названий — простой сахар, виноградный сахар, моносахарид. Но прежде всего, глюкоза — это углевод.
Углеводы — наиболее распространённый класс органических соединений природы. Они выполняют много функций, но главная из них — источник энергии.
Какие бывают углеводы?
- Моносахариды — самая простая форма углеводов, состоят из 1 молекулы и не могут быть разделены на более мелкие части. Примеры моносахаридов — глюкоза, галактоза, фруктоза.
- Олигосахариды — углеводы, которые содержат 2-10 одинаковых или разных молекул моносахаридов. Например: сахароза (“пищевой сахар”, содержится в сахарной свекле и тростнике, моркови, ананасах, сорго), мальтоза (в солоде, проростках злаков), лактоза (молочный сахар, содержится в молоке).
- Полисахариды — углеводы, которые содержат более 10 молекул моносахаридов. Например, крахмал (содержится в злаках, картофеле, бобовых, овощах), целлюлоза (в отрубях, кожуре овощей), лигнин (злаки, лежалые овощи), гликоген (“животный крахмал”, синтезируется в печени, практически не поступает из пищи), пектин (в ягодах и фруктах), инулин (в корнях георгинов, артишоков, одуванчиков).
От типа углеводов зависит:
нужны ли ферменты для их усвоения;
с какой скоростью они всасываются — поступают в кровь. Отсюда деление на “быстрые” и “медленные” углеводы;
кто потребляет углевод — органы и системы или кишечная микрофлора;
уровень выброса инсулина в ответ на потребление углеводов;
метаболические особенности, связанные с потреблением углеводов.
Для глюкозы, как моносахарида, характерны следующие особенности:
- сладкий вкус;
- для переваривания глюкозы в чистом виде не требуются ферменты;
- всасывание глюкозы происходит в ротовой полости и тонком кишечнике;
- быстрая скорость всасывания;
- вызывает резкий подъём инсулина;
- является источником энергии для органов и тканей;
- после потребления глюкозы быстро наступает голод;
- излишек глюкозы откладывается в жир;
- отличается высоким гликемическим индексом.
Углеводы, попадая с пищей в организм, вызывают повышение уровней инсулина и глюкозы в крови. Для их оценки существует несколько индексов.
Гликемический индекс (ГИ) — показатель, по которому оценивается скорость попадания глюкозы в кровь. Чем он выше, тем быстрее глюкоза попадёт в кровь, а значит, тем быстрее в крови повысится уровень глюкозы и инсулина. Шкала гликемических индексов строится относительно глюкозы – ее ГИ равен 100.
Гликемическая нагрузка (ГН) — оценивает не скорость повышения уровня глюкозы в крови, а число единиц, на которое поднимется ее уровень после употребления определенного количества конкретного продукта. Для расчёта ГН используется количество углеводов в продукте, вес продукта и его ГИ.
Например, ГИ у яблока — 38, в 100 гр. яблока содержится 13 гр. углеводов, а значит у яблока ГН=38*13/100=5, т.е. уровень глюкозы после съеденных 100 гр. яблок повысится на 5 единиц. Это наглядно демонстрирует, что ГИ не соответствует ГН, и продукты с высоким уровнем ГИ могут повышать уровень глюкозы незначительно, если содержат небольшое количество углеводов на 100 гр.
Инсулиновый индекс — обозначает скорость выброса инсулина в ответ на поступление пищи, рассматривается совместно с ГИ и не всегда ему соответствует. Любой приём пищи провоцирует выброс инсулина, не только углеводной. Наименьший — ИИ у продуктов, богатых жирами.
Учитывать все эти показатели — ГИ, ГН и ИИ важно тем, кто имеет метаболические нарушения — инсулинорезистентность, преддиабет или диабет. Здоровому человеку нет необходимости в расчёте этих индексов и достаточно просто придерживаться принципов полноценного питания.
Функции глюкозы
Все углеводы при переваривании расщепляются до моносахаридов — глюкозы, галактозы или фруктозы. Глюкоза — единственный источник энергии, который могут использовать абсолютно все клетки, это — её основная функция. Кроме энергетической, биологическая роль глюкозы обширна. Некоторые из ее функций:
Участвует в обменных процессах, выступает наиболее усвояемым энергоресурсом.
Поддерживает работоспособность организма.
Питает клетки головного мозга, улучшает память, обучаемость.
Стимулирует работу сердца.
Быстро утоляет чувство голода.
Снимает стресс, корректирует психическое состояние.
Ускоряет восстановление мышечной ткани.
Помогает печени в нейтрализации токсических веществ.
Необходимое количество глюкозы организм по умолчанию получит, если в рационе присутствует достаточное количество углеводной пищи, например, основы здорового рациона — овощи и крупы. Если даже в какой-то момент углеводной пищи окажется недостаточно для удовлетворения возросших потребностей организма, на помощь придёт печень и ее способность синтезировать глюкозу из неуглеводных источников.
Избыток сахаров в питании не даёт «глюкозу для мозга», как иногда можно услышать, а наносит серьёзный вред здоровью. Потребление слишком большого количества глюкозы опасно для всех, но особенно в группе риска дети, люди в преклонном возрасте, больные с нарушенным обменом веществ.
Некоторые из негативных последствий избытка глюкозы в рационе приводят к:
- ожирению;
- развитию тромбофлебита;
- перегрузке поджелудочной железы;
- возникновению аллергических реакций;
- возрастанию холестерина;
- появлению воспалительных, сердечных заболеваний, расстройству кровообращения;
- артериальной гипертензии;
- повреждению сетчатки глаза;
- сахарному диабету;
- эндотелиальной дисфункции.
Количество поступившего моносахарида в организм должно в полной мере компенсироваться расходом калорий на энергетические нужды.
Превращения глюкозы в организме
Глюкоза попадает в организм с потреблением углеводов из пищи. Далее, частично в ротовой полости, и в основном в тонком кишечнике, происходит всасывание глюкозы — ее поступление в кровь из пищеварительной системы.
Всасывание глюкозы
Всасывание любых веществ происходит с помощью пассивного или активного транспорта.
Пассивный транспорт — перенос веществ из области высокой концентрации в область низкой концентрации без затрат энергии. Может происходить в виде:
Свободной диффузии, когда вещества самостоятельно перемещаются через мембрану клеток.
Облегчённой диффузии, когда перенос веществ через мембрану происходит с помощью белков-переносчиков.
Активный транспорт — это перенос веществ специальными переносчиками из области низкой концентрации в область высокой концентрации, с использованием свободной энергии организма. В зависимости от типа используемой энергии, существует:
Первичный активный транспорт, при котором используется энергия АТФ — универсальный энергоноситель в клетке.
Вторичный активный транспорт, при котором используется энергия, запасённая в клетке.
Каким способом всасывается глюкоза?
- при высокой концентрации глюкозы и после приема пищи глюкоза всасываются путем облегченной диффузии;
- при низких концентрациях глюкозы ее всасывание протекает путем вторичного активного транспорта с помощью натрия, выступающего в роли переносчика.
Свыше 90% всосавшейся глюкозы через воротную вену доставляется в печень, а остальная часть через общий кровоток транспортируется в другие ткани. Однако при обильном потреблении углеводов глюкоза может сразу же транспортироваться к различным органам и тканям, минуя печень.
Органы и ткани, использующие глюкозу, бывают:
Инсулинонезависимыми, транспорт глюкозы в которые осуществляется при помощи белков-переносчиков, без участия инсулина — гормона поджелудочной железы, ответственного за регуляцию уровня глюкозы в крови. К ним относятся мозг, почки, слизистая кишечника, эритроциты, половые железы, плацента, хрусталик глаза. Поступление глюкозы к ним не меняется в зависимости от уровня инсулина.
Инсулинозависимыми, транспорт глюкозы в которые осуществляется под действием инсулина. К ним относятся мышцы (скелетные и сердца), жировая ткань. При снижении уровня инсулина или инсулинорезистентности, поступление глюкозы к ним нарушается, они остаются без энергии, “голодают”, а сама глюкоза остаётся в крови.
Поступив в клетку органов и тканей, глюкоза первым делом превращается в глюкозо-6-фосфат, который в отличие от глюкозы не может проникать через мембрану клетки. То есть эта форма глюкозы нужна для того, чтобы “запереть” глюкозу в клетке. Глюкозо-6-фосфат идет на биосинтез гликогена, вступает в реакции гликолиза или расщепляется до глюкозы.
Гликолиз
Все процессы получения энергии живыми организмами происходят в результате окислительно-восстановительных реакций, при которых происходит перенос электрона с одной молекулы (восстановитель, донор электронов) на другую (окислитель, акцептор электронов). При этом роль окислителя играют либо органические молекулы, либо кислород.
Гликолиз – это последовательность реакций, связанных с окислением глюкозы, приводящих к ее превращению в пируват (пировиноградную кислоту, важный элемент для метаболических реакций) с одновременным образованием АТФ. При этом молекула глюкозы расщепляется на 2 молекулы пирувата, образуя 2 молекулы АТФ и 2 молекулы НАДФ (кофермент нескольких ферментов).
- Аэробный, происходит при участии кислорода. В этом случае пируват и НАДФ достигают митохондрий, где полностью окисляются до углекислого газа и воды.
- Анаэробный, протекает в условиях без поступления кислорода. В этом случае из пирувата и НАДФ образуются лактат (молочная кислота) или этиловый спирт. Это единственный путь в условиях без кислорода, позволяющий клеткам получать энергию. Анаэробный гликолиз происходит в мышцах при интенсивных нагрузках, когда кровеносная система не успевает снабжать мышцы достаточным количеством кислорода.
Гликоген
Если глюкоза поступает в организм в избыточном количестве, она трансформируется в гликоген в печени и мышцах. У взрослого человека его количество не может превышать 450 гр, треть из которых хранится в печени, остальная часть — в мышцах.
Гликоген в печени используется как резервный источник, запас глюкозы на случай снижения ее уровня между приёмами пищи. Через 10-18 часов без поступления глюкозы с пищей, запасы гликогена в печени истощаются, а через 24 часа полностью исчерпываются. Мышечный гликоген — источник энергии при мышечной работе.
Если запасы гликогена и так достаточно велики, глюкоза начинает превращаться в жир.
Глюконеогенез
Некоторые ткани и органы, такие как мозг и эритроциты, зависят от постоянного снабжения глюкозой. На этот случай печень может синтезировать глюкозу из других моносахаридов, а при истощении запасов гликогена и полном отсутствии углеводов в пище, например, при голодании или безуглеводных диетах, запускается процесс синтеза глюкозы из неуглеводных соединений — глюконеогенез. Исходными соединениями для него могут быть аминокислоты (в первую очередь — из мышечной ткани), лактат, пируват, глицерины и жирные кислоты. Больше всего глюкозы при глюконеогенезе производится из лактата и аминокислот. Благодаря этому процессу ткани могут обходиться без внешнего источника глюкозы несколько недель.
Гормональная регуляция уровня глюкозы в крови
Колебания концентрации глюкозы в крови, отличные от нормальных значений, воспринимаются рецепторами гипоталамуса — области мозга, которая регулирует постоянство внутренней среды организма. Благодаря влиянию гипоталамуса на вегетативную нервную систему, происходит срочное повышение или снижение выработки гормонов, отвечающих за регуляцию уровня глюкозы в крови.
Уровень глюкозы в крови понижается при помощи одного гормона — инсулина. Повышение уровня глюкозы в крови возникает под действием нескольких гормонов: гормона поджелудочной железы глюкагона; гормонов надпочечников; гормонов роста гипофиза и гормонов щитовидной железы.
Инсулин
Инсулин играет ключевую роль в регуляции углеводного метаболизма. Он обеспечивает стимуляцию захвата глюкозы клетками и ее поступление в клетку, активирует ее транспорт через клеточные мембраны, ускоряет окисление глюкозы, усиливает синтез гликогена, замедляет глюконеогенез.
Последствия нарушения чувствительности к инсулину:
- разрушение мышечной ткани;
- снижение уровня энергии;
- хроническое воспаление;
- увеличение массы висцерального жира;
- метаболический синдром;
- сахарный диабет
- сердечно-сосудистые заболевания.
Гормоны, ответственные за повышение уровня глюкозы
Повышение уровня глюкозы в крови возникает под действием нескольких гормонов. Глюкагон — антагонист инсулина, продуцируется поджелудочной железой, активирует все процессы, ведущие к росту концентрации глюкозы в крови, ускоряет распад гликогена и глюконеогенез в печени.
Адреналин, гормон надпочечников, усиливает мобилизацию гликогена.
Соматотропин, гормон роста, увеличивает секрецию и глюкагона и инсулина, способствует увеличению депонирования глюкозы и усилению ее утилизации.
Кортизол, гормон стресса, ускоряет глюконеогенез и мобилизацию гликогена.
Сколько необходимо глюкозы в день
В среднем расход глюкозы в организме взрослого человека составляет 10 г/час.
Основный потребители глюкозы:
Головной мозг, на обеспечение его работы нужно около 60% от общего количества глюкозы.
Эритроциты забирают еще 10-15% от всей глюкозы.
Мышцы и жировая ткань, их потребности непостоянны и зависят от активности.
В норме печень выделяет как раз то количество глюкозы, которое покрывает основные запросы организма (10 г/ч), однако под действием глюкагона или адреналина на короткое время печень может в несколько раз увеличить выход глюкозы. Около 30% глюкозы печень производит за счет распада гликогена, а 70% — глюконеогенеза. Печень вырабатывает глюкозу со скоростью, равной ее утилизации во всем организме.
Вычислить конкретно уровень потребления глюкозы сложно и прежде всего нужно отталкиваться от количества углеводов. Согласно нормам физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации, из углеводов рекомендуется получать не более 60% от энергетической суточной потребности, при этом простые сахара должно приходиться не более 10% от общей калорийности.
Если ваша дневная норма энергии составляет 2000 ккал, то ваша норма углеводов — не более 300 гр, при этом добавленного сахара не рекомендуется употреблять более 25 гр.. Если разбить это количество по типам углеводов, то примерная норма в день: 210 гр. на сложные углеводы, 40 гр. на клетчатку, 25 гр. на фруктозу, 25 гр. на добавленный сахар. Эти цифры примерные и зависят от потребностей конкретного человека и особенностей его организма.



Какая норма глюкозы в крови?
Глюкоза — единственный источник энергии, который могут использовать абсолютно все клетки и который доступен для тканей в практически постоянной концентрации в виде “сахара крови”. Постоянный уровень глюкозы в крови нужен для обеспечения разнообразных потребностей организма. Наиболее высокой чувствительностью к снижению уровня глюкозы отличается головной мозг. Согласно установленным в 1999 году в ВОЗ нормативам, нормальное значение уровня глюкозы в крови колеблется в пределе от 3,3 ммоль/л до 5,5 ммоль/л. Причем на данный момент в качестве нормы принимается и верхнее значение 5,9 ммоль/л. При этом здоровым оптимумом считается уровень не выше 4,7-4,9 ммоль/л. Если есть подозрения в нарушениях углеводного обмена, то помимо уровня глюкозы в крови нужно опираться и на другие показатели. В первую очередь — гликированный гемоглобин, инсулин и индекс НОМА.
Уровень глюкозы в крови меняется в течение дня и зависит от многих факторов. В первую очередь — от приёмов пищи и от состояния здоровья.
В промежутках между приемами пищи концентрация глюкозы в крови составляет около 5 ммоль/л (0,9 мг/л). Сразу после приема пищи концентрация глюкозы поднимается до 7-8 ммоль/л, а при достаточно длительном голодании снижается до 4 ммоль/л.
Экспериментальные тесты на переносимость принятой глюкозы показывают, что у здоровых людей после приёма 100 гр. легкорасщепляемых углеводов уровень сахара в крови повышается, а через 2-3 часа вновь снижается до исходного уровня. У больных сахарным диабетом уровень глюкозы после приема пищи повышается сильнее, а снижается гораздо медленнее.
В каких продуктах содержится глюкоза
Источник глюкозы в продуктах питания — углеводы, глюкоза есть в любой углеводной пище. Если придерживаться деления на “быстрые” и “медленные” углеводы, которое демонстрирует скорость всасывания глюкозы, то источники можно поделить на 2 части:
Источники “медленных” углеводов: крупы, бобовые, овощи, фрукты, хлеб из ржаной или цельнозерновой муки — все те продукты, которые помимо углеводов содержат клетчатку, витамины, микроэлементы, растительный белок. Их усвоение организмом происходит постепенно, не приводит к быстрому скачку глюкозы в крови и тем самым не перегружает поджелудочную железу.
“Быстрые” углеводы содержатся в выпечке, сладостях, кондитерских изделиях, сладких соках и газировке. Они мгновенно насыщают кровь глюкозой, что заставляет поджелудочную железу выделять слишком много инсулина разом — впоследствии это может стать причиной нечувствительности клеток к нему.
Больше всего углеводов содержат хлеб, приготовленный из муки первого и высшего сорта, любые сладости промышленного производства, очень много глюкозы – 99,9 г на каждые 100 г – находится в сахаре. Но как известно, мало съесть продукт, нужно его усвоить.
Существуют способы, повышающие и снижающие степень усвоения углеводов.
Улучшает усвоение углеводов:
- высокая степень измельчения продуктов (пюре, крем-супы и т.д.);
- высокая длительная термическая обработка (разваренные овощи, макаронные изделия);
- удаление клетчатки (сок).
Замедляет усвоение углеводов:
- употребление совместно с продуктами, богатыми клетчаткой и/или жирами;
- приготовление пищи до состояния al dente;
- употребление в пищу крахмалистых продуктов в охлаждённом виде, благоадаря резистентному крахмалу.
Симптомы нехватки глюкозы
Недостаток глюкозы называется “гипогликемия”. Это не самостоятельное заболевание, а состояние, характеризующееся снижением уровня сахара в крови ниже нормальных значений. Для мужчин — ниже 2,5–2,8 ммоль/л, для женщин — ниже 1,9–2,2 ммоль/л.
У здорового человека причинами гипогликемии могут быть беременность, интенсивные физические нагрузки, длительное голодание. Уровень глюкозы в этом случае быстро восполняется за счет резервов организма или после приёма пищи и не несёт никаких негативных последствий Однако, такие случаи гипогликемии крайне редки. Чаще всего гипогликемия развивается при различных заболеваниях и патологических состояниях.
Симптомы нехватки глюкозы зависят от ее тяжести и истинной причины. Некоторые из симптомов:
резкое и сильное чувство голода;
повышение артериального давления;
подавленное настроение или, наоборот, чувство эйфории;
покалывания губ, языка, кончиков пальцев;
ухудшение концентрации внимания, координации движений;
Основные причины гипогликемии:
- погрешности инсулинотерапии при диабете — пропуск приемов пищи, употребление алкоголя, излишняя физическая активность, передозировка инсулина или другими лекарствами ;
- эндокринные расстройства, результатом которых является дефицит гормонов кортизол, тироксин, соматотропин; гипотиреоз и т.д.;
- операции на органах ЖКТ, в результате которых нарушается расщепление и всасывание углеводов:
- нарушения в работе ферментов, участвующих в обмене углеводов (гликогена, фруктозы, галактозы) и последующее нарушение превращения глюкозы из других углеводов или затруднение ее высвобождения из гликогена.
В чем опасность высокого уровня глюкозы в крови
Повышенное содержание глюкозы в крови называется “гипергликемия” и характеризуется увеличением концентрации глюкозы в крови более 6,1 ммоль/л. Причинами этого состояния могут быть стресс, высокоуглеводная диета, прием лекарств, а также болезни эндокринной системы и внутренних органов.
Симптомы гипергликемии могут отличаться в зависимости от ее причины.
Гипергликемию можно заподозрить по следующим признакам:
Гипергликемия может быть вызвана физиологическими и патологическими факторами.
К физиологическим можно отнести стресс, избыток углеводов в питании, беременность. В этих случаях уровень сахара нормализуется самостоятельно и его коррекция не требует никакого вмешательства. Постоянно высокая концентрация глюкозы пагубно действует на стенки кровеносных сосудов, может в будущем стать причиной сахарного диабета. Соблюдение принципов полноценного питания — отличный способ профилактики гипергликемии и ее последствий.
Патологическая гипергликемия может быть обусловлена проблемами с эндокринной системой (диабет, преддиабет, инсулинорезистентность), заболеваниями ЦНС и метаболическими нарушениями. Для нормализации уровня сахара в крови при патологических причинах используются диета, лекарственные препараты (инсулин, сахароснижающие средства), лечение основного заболевания.
Самые распространенные патологические причины гипергликемии:
- сахарный диабет, при котором происходит или снижение выработки инсулина (сахарный диабет 1 типа) или избыток выработки инсулина и развитие резистентности к нему (сахарный диабет 2 типа);
- другие заболевания эндокринной системы, сопровождающиеся усиленной выработкой гормонов, повышающих концентрацию глюкозы путем влияния на различные этапы углеводного метаболизма;
- судорожные состояния;
- органические поражения ЦНС;
- печеночная недостаточность;
- тяжелые заболевания поджелудочной железы;
- прием лекарственных препаратов, влияющих на уровень сахара в крови.
Выводы
Глюкоза — важнейший источник энергии, необходимый для бесперебойного функционирования организма.
Всасывание и усвоение углеводов — сложный процесс. зависящий от множества факторов.
Организм защищает себя от снижения поступления глюкозы, используя различные механизмы — создаёт запасы глюкозы, синтезирует глюкозу из других сахаров и неуглеводных соединений.
За гормональную регуляцию уровня глюкозы отвечают различные гормоны, при этом за снижение уровня отвечает один инсулин. а за повышение — целая группа разных гормонов.
Углеводы — важнейший источник энергии, необходимой для бесперебойной работы всех систем организма. Полноценный рацион, содержащий достаточное количество углеводов, полезных жиров, белков и клетчатки — основа здоровья и достаточного уровня энергии.
Гипогликемия и гипергликемия могут быть у здоровых людей, и тогда их коррекция не требует специальных действия. Если эти состояния — последствия заболеваний, то необходимо обязательно контролировать уровень глюкозы в крови в соответствии с рекомендациями врача.
Автономная некоммерческая организация нутрициологов и коучей по здоровью
109457, Россия, г. Москва, ул Жигулевская, д 1/24, корп 1, оф6, info@dietolognata.ru
cource@miin.ru — по
вопросам обучения
hr@miin.ru — по вопросам
трудоустройства и вакансий
Настоящая Политика конфиденциальности персональных данных (далее — Политика конфиденциальности) действует в отношении всей информации, которую данный сайт, на котором размещен текст этой Политики конфиденциальности, может получить о Пользователе, а также любых программ и продуктов, размещенных на нем.
1. Определение терминов
1.1 В настоящей Политике конфиденциальности используются следующие термины:
1.1.1. «Администрация сайта» – уполномоченные сотрудники на управления сайтом, действующие от его имени, которые организуют и (или) осуществляет обработку персональных данных, а также определяет цели обработки персональных данных, состав персональных данных, подлежащих обработке, действия (операции), совершаемые с персональными данными.
1.1.2. «Персональные данные» — любая информация, относящаяся к прямо или косвенно определенному или определяемому физическому лицу (субъекту персональных данных).
1.1.3. «Обработка персональных данных» — любое действие (операция) или совокупность действий (операций), совершаемых с использованием средств автоматизации или без использования таких средств с персональными данными, включая сбор, запись, систематизацию, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передачу (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение персональных данных.
1.1.4. «Конфиденциальность персональных данных» — обязательное для соблюдения Администрацией сайта требование не допускать их умышленного распространения без согласия субъекта персональных данных или наличия иного законного основания.
1.1.5. «Пользователь сайта (далее Пользователь)» – лицо, имеющее доступ к сайту, посредством сети Интернет и использующее данный сайт для своих целей.
1.1.6. «Cookies» — небольшой фрагмент данных, отправленный веб-сервером и хранимый на компьютере пользователя, который веб-клиент или веб-браузер каждый раз пересылает веб-серверу в HTTP-запросе при попытке открыть страницу соответствующего сайта.
1.1.7. «IP-адрес» — уникальный сетевой адрес узла в компьютерной сети, построенной по протоколу IP.
2. Общие положения
2.1. Использование Пользователем сайта означает согласие с настоящей Политикой конфиденциальности и условиями обработки персональных данных Пользователя.
2.2. В случае несогласия с условиями Политики конфиденциальности Пользователь должен прекратить использование сайта.
2.3.Настоящая Политика конфиденциальности применяется только к данному сайту. Администрация сайта не контролирует и не несет ответственность за сайты третьих лиц, на которые Пользователь может перейти по ссылкам, доступным на данном сайте.
2.4. Администрация сайта не проверяет достоверность персональных данных, предоставляемых Пользователем сайта.
3. Предмет политики конфиденциальности
3.1. Настоящая Политика конфиденциальности устанавливает обязательства Администрации сайта по умышленному неразглашению персональных данных, которые Пользователь предоставляет по разнообразным запросам Администрации сайта (например, при регистрации на сайте, оформлении заказа, подписки на уведомления и т.п).
3.2. Персональные данные, разрешённые к обработке в рамках настоящей Политики конфиденциальности, предоставляются Пользователем путём заполнения специальных форм на Сайте и обычно включают в себя следующую информацию:
3.2.2. Контактный телефон Пользователя;
3.2.3. Адрес электронной почты (e-mail);
3.3. Администрация сайта также принимает усилия по защите Персональных данных, которые автоматически передаются в процессе посещения страниц сайта: IP адрес; информация из cookies; информация о браузере (или иной программе, которая осуществляет доступ к сайту); время доступа; посещенные адреса страниц; реферер (адрес предыдущей страницы) и т.п.
3.3.1. Отключение cookies может повлечь невозможность доступа к сайту.
3.3.2. Сайт осуществляет сбор статистики об IP-адресах своих посетителей. Данная информация используется с целью выявления и решения технических проблем, для контроля корректности проводимых операций.
3.4. Любая иная персональная информация не оговоренная выше (история покупок, используемые браузеры и операционные системы и т.д.) не подлежит умышленному разглашению, за исключением случаев, предусмотренных в п.п. 5.2. и 5.3. настоящей Политики конфиденциальности.
4. Цели сбора персональной информации пользователя
4.1. Персональные данные Пользователя Администрация сайта может использовать в целях:
4.1.1. Установления с Пользователем обратной связи, включая направление уведомлений, запросов, касающихся использования сайта, оказания услуг, обработка запросов и заявок от Пользователя.
4.1.2. Подтверждения достоверности и полноты персональных данных, предоставленных Пользователем.
4.1.3. Уведомления Пользователя сайта о состоянии Заказа.
4.1.4. Предоставления Пользователю эффективной клиентской и технической поддержки при возникновении проблем связанных с использованием сайта.
5. Способы и сроки обработки персональной информации
5.1. Обработка персональных данных Пользователя осуществляется без ограничения срока, любым законным способом, в том числе в информационных системах персональных данных с использованием средств автоматизации или без использования таких средств.
5.2. Пользователь соглашается с тем, что Администрация сайта вправе передавать персональные данные третьим лицам, в частности, курьерским службам, организациями почтовой связи, операторам электросвязи, исключительно в целях выполнения заявок Пользователя.
5.3. Персональные данные Пользователя могут быть переданы уполномоченным органам государственной власти только по основаниям и в порядке, установленным действующим законодательством.
6. Обязательства сторон
6.1. Пользователь обязуется:
6.1.1. Предоставить корректную и правдивую информацию о персональных данных, необходимую для пользования сайтом.
6.1.2. Обновить или дополнить предоставленную информацию о персональных данных в случае изменения данной информации.
6.1.3. Принимать меры для защиты доступа к своим конфиденциальным данным, хранящимся на сайте.
6.2. Администрация сайта обязуется:
6.2.1. Использовать полученную информацию исключительно для целей, указанных в п. 4 настоящей Политики конфиденциальности.
6.2.2. Не разглашать персональных данных Пользователя, за исключением п.п. 5.2. и 5.3. настоящей Политики Конфиденциальности.
6.2.3. Осуществить блокирование персональных данных, относящихся к соответствующему Пользователю, с момента обращения или запроса Пользователя или его законного представителя либо уполномоченного органа по защите прав субъектов персональных данных на период проверки, в случае выявления неправомерных действий.
7. Ответственность сторон
7.1. Администрация сайта несёт ответственность за умышленное разглашение Персональных данных Пользователя в соответствии с действующим законодательством, за исключением случаев, предусмотренных п.п. 5.2., 5.3. и 7.2. настоящей Политики Конфиденциальности.
7.2. В случае утраты или разглашения Персональных данных Администрация сайта не несёт ответственность, если данная конфиденциальная информация:
7.2.1. Стала публичным достоянием до её утраты или разглашения.
7.2.2. Была получена от третьей стороны до момента её получения Администрацией сайта.
7.2.3. Была получена третьими лицами путем несанкционированного доступа к файлам сайта.
7.2.4. Была разглашена с согласия Пользователя.
7.3. Пользователь несет ответственность за правомерность, корректность и правдивость предоставленной Персональных данных в соответствии с действующим законодательством.
8. Разрешение споров
8.1. До обращения в суд с иском по спорам, возникающим из отношений между Пользователем сайта и Администрацией сайта, обязательным является предъявление претензии (письменного предложения о добровольном урегулировании спора).
8.2 .Получатель претензии в течение 30 календарных дней со дня получения претензии, письменно уведомляет заявителя претензии о результатах рассмотрения претензии.
8.3. При недостижении соглашения спор будет передан на рассмотрение в судебный орган в соответствии с действующим законодательством.
8.4. К настоящей Политике конфиденциальности и отношениям между Пользователем и Администрацией сайта применяется действующее законодательство.
9. Дополнительные условия
9.1. Администрация сайта вправе вносить изменения в настоящую Политику конфиденциальности без согласия Пользователя.
9.2. Новая Политика конфиденциальности вступает в силу с момента ее размещения на Сайте, если иное не предусмотрено новой редакцией Политики конфиденциальности.
Источник