ПРАКТИКА
Прохождение
электрического тока через электролиты.
Законы электролиза Фарадея.
При
прохождении тока через некоторые
растворы, например, через раствор серной
кислоты, происходит разложение воды на
составные части – водород и кислород,
которые выделяются на пластинах,
соединенных соответственно с отрицательным
и положительным полюсами батареи. Такого
рода растворы, разлагающиеся химически
при прохождении через них тока, называются
электролитами, а сам процесс разложения
вещества электрическим током –
электролизом. Проводники, погруженные
в электролит для подведения к нему тока
называются электродами: положительный
электрод – анод, отрицательный электрод
– катод. Продукты разложения электролита,
например, водород и кислород, в опыте,
выделяются на электродах все время,
пока идет ток. Массу выделившегося
вещества можно измерить. Если подобрать
такой раствор, при котором выделяющееся
вещество оседает в виде твердого осадка
на электроде, то эту массу можно измерить
без затруднений. Например, если пропускать
ток через раствор медного купороса, то
на катоде оседает медь. Это явление
можно легко наблюдать, если катод сделать
из угля – на черной поверхности угля
будет заметен красноватый слой
выделившейся меди. Взвешивая катод до
и после опыта, можно определить массу
осадившегося металла. Измерения
показывают, что масса вещества,
выделившегося на электродах, зависит
от силы тока и времени электролиза.
Замыкая цепь на разные промежутки
времени, можно убедиться в том, что масса
выделившегося вещества пропорциональна
времени прохождения тока. Также масса
выделившегося вещества пропорциональна
силе тока. Таким образом, получается,
что масса выделившегося вещества
пропорциональна произведению силы тока
и времени электролиза. Все это позволило
Фарадею сформулировать важный закон,
который носит его имя: масса вещества,
выделившегося на электроде, пропорциональна
заряду, или количеству электричества,
прошедшему через электролит. Это первый
закон Фарадея. Если m – масса выделившегося
вещества, I – сила тока, t – время
электролиза, q – полный заряд, прошедший
через ванну за время t, то первый закон
Фарадея можно записать так:
m
= Kq
= KIt,
где K – коэффициент пропорциональности.
Полагая
в этой формуле заряд q = 1, получим, что
коэффициент K равен массе вещества,
выделяемого зарядом в 1 Кл, или иначе
массе вещества, выделяемого током 1А за
1 с. Исследования Фарадея показали, что
величина K является характерной для
каждого вещества. Величина K называется
электрохимическим эквивалентом данного
вещества. Таким образом, получаем, что
электрохимическим эквивалентом вещества,
называется масса этого вещества,
выделяемая при электролизе одним кулоном
протекшего через раствор электричества.
Электрохимические
эквиваленты различных веществ существенно
отличны один от другого. Ответ на вопрос
– от каких свойств вещества зависит
его химический эквивалент, дает следующий
важный закон, который также был установлен
Фарадеем на опыте (второй закон Фарадея):
электрохимические эквиваленты различных
веществ пропорциональны их молярным
массам и обратно пропорциональны числам,
выражающим их химическую валентность.
Уяснить этот закон можно с помощью
следующего примера: Молярная масса
серебра равна 0,1079 кг/моль, его валентность
– 1. Молярная масса цинка равна 0,0654
кг/моль, его валентность – 2. Поэтому по
второму закону Фарадея электрохимические
эквиваленты серебра и цинка должны
относиться как:
= 3,30
Если
по прежнему обозначить через K [кг/Кл]
электрохимический эквивалент вещества,
через M [кг/моль] – его молярную массу,
а через n – валентность (n = 1, 2, …), то
второй закон Фарадея можно переписать
в виде:
K
=
Здесь
через 1/F обозначен коэффициент
пропорциональности, который является
универсальной постоянной, т. е. имеет
одинаковое значение для всех веществ.
Величина F называется постоянной Фарадея.
Ее значение, найденное экспериментально
равно: F = 96484 Кл/моль. Отношение молярной
массы какого-либо вещества к его
валентности M/n называют химическим
эквивалентом данного вещества. Это
отношение показывает, какая масса
данного вещества необходима для замещения
одного моля водорода в химических
соединениях. У одновалентных веществ
химический эквивалент численно равен
молярной массе. Пользуясь этим понятием,
можно выразить второй закон Фарадея
следующим образом: электрохимические
эквиваленты веществ пропорциональны
их химическим эквивалентам. Теперь
можно выразить оба закона Фарадея в
виде одной формулы: m
=

=

где m
– масса вещества, выделяющегося при
прохождении через электролит количества
электричества q. Это объединенный закон
Фарадея. Эта формула имеет простой
физический смысл. Положим в ней m = M/n, т.
е. возьмем массу одного химического
эквивалента данного вещества. Тогда
получи F = q. Это значит, что постоянная
Фарадея численно равна заряду q, который
необходимо пропустить через любой
электролит, чтобы выделить на электродах
вещество в количестве, равном одному
химическому эквиваленту. Электролиз
находит техническое применение в таких
процессах как электролитический метод
получения чистых металлов, гальваностегия,
гальванопластика.
Задание:
Зная, что химический эквивалент водорода
равен 1,045∙10-8
кг/Кл, вычислите электрохимический
эквивалент хлора. Валентность хлора
равна 1, относительные атомные массы
хлора и водорода равны 35,45 и 1,008.
Практическая
работа №3:
-
Серебрение
пластинок производится при плотности
тока j
= 0,5 А/дм2,
при этом за время t
= 5 ч выделяется масса m
= 2 кг серебра. Найти площадь пластинок.
Электрохимический эквивалент серебра
K
= 1,118×10-6
кг/Кл.
Указания:
-
Записать
«Дано» -
Записать
численные значения и единицы измерения
всех физических величин, перевести
дольные и кратные значения величин в
целые. -
Использовать
формулу первого закона Фарадея. -
Использовать
формулу для связи силы тока, плотности
тока с площадью пластин: I
= j×S -
Скомбинировать
две вышеприведенные формулы, выразить
неизвестную площадь пластин через
известные величины, подставить численные
значения и вычислить. -
Электролитическая
ванна для получения алюминия рассчитана
на 25000 А. Электролиз алюминия производится
при рабочем напряжении 4,8 В на ванне.
Выход по току (КПД) равен 86%. Электрохимический
эквивалент K
= 0,335 г/А×ч. Сколько алюминия производится
за сутки? Каков расход электроэнергии
на 1 кг алюминия?
Указания:
-
Записать
«Дано» -
Записать
численные значения и единицы измерения
всех физических величин, перевести
дольные и кратные значения величин в
целые. -
Использовать
формулу первого закона Фарадея с учетом
КПД: m
= ηKIt,
η — КПД -
Использовать
формулу для работы тока A
= UIt,
так как она равна потребляемой
электроэнергии. -
Расход
электроэнергии найти, используя
формулу: γ =
,
где γ – расход электроэнергии. -
Сделать
проверку размерности полученных
величин. -
Под
каким напряжением следует проводить
электролиз воды на установке с КПД 80%,
чтобы при затратах электроэнергии не
более 965 кДж выделившийся кислород
находился в объеме 1л под давлением 200
кПа при температуре 300К? Постоянная
Фарадея, валентность кислорода и
молярная газовая постоянная равны
соответственно 96500 Кл/моль; 2; 8,31
Дж/(моль×К).
Указания:
-
Записать
«Дано» -
Записать
численные значения и единицы измерения
всех физических величин, перевести
дольные и кратные значения величин в
целые. -
Искомое
напряжение найти, выразив его из
формулы: Eполезная
= qU,
где Eполезная
– электроэнергия (полезная), идущая
непосредственно на выделение кислорода. -
Исходя
из того, что КПД определяется по формуле:
η =
,
выразить из этой формулы Eполезная. -
Найти
величину заряда из объединенного
закона Фарадея: m
=
, выразив из него q. -
Подставив
формулы из пунктов d
и e
в формулу для напряжения (пункт с),
получить формулу для напряжения. В
этой формуле помимо напряжения остается
неизвестной масса выделившегося
кислорода. -
Массу
выделившегося кислорода найти, выразив
ее из уравнения Менделеева-Клапейрона:
pV
=
RT,
M
= 32×10-3
кг/моль – молярная масса кислорода. -
Подставив
формулу для массы m
в полученную в пункте f
формулу для напряжения, получить
конечную формулу, подставить численные
значения и вычислить. -
Сделать
проверку размерности полученных
величин. -
При
никелировании изделия в течение 1 часа
отложился слой никеля толщиной l
= 0,01 мм. Определить плотность тока j,
если атомная масса никеля A
= 0,0587 кг/моль, валентность n
= 2, плотность никеля ρ
= 8,9×103
кг/м3.
Указания:
-
Записать
«Дано» -
Записать
численные значения и единицы измерения
всех физических величин, перевести
дольные и кратные значения величин в
целые. -
Использовать
объединенный закон Фарадея: m
=
-
Использовать
формулы для массы: m
= ρ×V
= ρ×l×S,
для силы тока: I
= j×S,
где S
– площадь покрытия никелем. -
Подставить
формулы из пункта d
в формулу из пункта c. -
Выразить
плотность тока, подставить численные
значения и вычислить. -
Сделать
проверку размерности полученных
величин. -
При
электролизе раствора серной кислоты
затрачивается мощность 37 Вт. Определить
сопротивление электролита, если за
время 50 мин выделилось 0,3 г водорода.
КПД установки 80%. Постоянная Фарадея
96,5×103
Кл/моль. Атомная масса и валентность
водорода равны соответственно 1,0×10-3
кг/моль и 1.
Указания:
-
Записать
«Дано» -
Записать
численные значения и единицы измерения
всех физических величин, перевести
дольные и кратные значения величин в
целые. -
Использовать
объединенный закон Фарадея: m
=
,
где η – КПД установки. -
Использовать
формулы — закона Ома: I
=
,
мощности: P
= U×I -
Выразить
из объединенного закона Фарадея силу
тока. -
Скомбинировав
формулы пункта d,выразить
искомое сопротивление электролита. -
Подставить
формулу из пункта e
в формулу для сопротивления из пункта
f.
-
Подставить
численные значения и вычислить. -
Сделать
проверку размерности полученных
величин.
Контрольные
вопросы:
-
Сформулируйте
первый закон Фарадея. -
Сформулируйте
второй закон Фарадея. -
Сформулируйте
объединенный закон Фарадея. -
Что
такое химический эквивалент данного
вещества? -
Что
такое постоянная Фарадея? -
Укажите
численное значение и единицу измерения
постоянной Фарадея. -
Какой
из электродов называется анодом, а
какой катодом? -
Каким
образом можно измерить массу выделившегося
вещества. -
Укажите,
при каких технологических процессах
применяется электролиз и кратко поясните
в чем заключается каждый из этих
процессов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Расчет массы меди, выделившейся на катоде при электролизе её соли
Вычисление массы меди, зная выход по току и напряжение электролизера
Задача 115.
При электролизе водного раствора Cu2Cl2 с использованием графитовых электродов израсходовано 1000 кВт•час электроэнергии. Составить схему электролиза и вычислить количество полученной меди, если выход по току составляет 90%, напряжение электролизера 7 В.
Дано:
k(Cu) = 6,588 • 10-7 кг/Кл;
U = 7 B;
W = 1000 кВт•час = 3600000000 Вт•с = 3,6 • 109 В•А•с;
h = 90% или 0,9;
m(Cu) = ?
Решение:
Масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
К.п.д. установки (h) равно:
h = I•U•t/W = Uq/W,
где q-заряд, прошедший через ванну; U — напряжение электролизера; W — количество, израсходованной электроэнергии . Масса выделившейся меди m = kq.
Отсюда
m = (k•W•h)/U.
Тогда
m(Cu) = [(6,588 • 10-7 кг/Кл)•(3,6 • 109 В•А•с)•0,9]/7 B = 304,93 кг.
Ответ: m(Cu) = 304,93 кг.
Масса меди на катоде при при электролизе раствора CuSO4
Пример 116.
Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1,5 ч при силе тока 3 А?
Решение:
Масу меди рассчитаем по формуле Фарадея:
m(А) = МЭ(А)It/F, где
m — масса вещества, окисленного или восстановленного на электроде, г; MЭ(А) — эквивалентная масса вещества; I — сила тока, А; t — продолжительность электролиза, с; F — число Фарадея равно 96500 Кл/моль. Эквивалентная масса меди в CuSO4 равна:
63,54//2 = 31,77 г/моль.
Массу меди рассчитаем, подставив в формулу соответствующие значения МЭ(Cu) = 31,77; I = 3 А; t = 70 • 60 = 4200 с; = 96500 Кл/моль:
m(Cu) = МЭ(Cu)It/F = (31,77 • 3• 4200)/96500 = 4,148 г.
Ответ: m(Cu) = 4,148 г.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t
Задача 117.
Какой заряд проходит через раствор сульфата меди (CuSO4) за время t = 20с, если ток за это время равномерно возрастает от I1 = 0 до I2 = 3А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди k = 3,3 • 10-7 кг/Кл.
Решение:
1. Рассчитаем средний ток, получим:
I = (I1 + I2)/2.
2. Рассчитаем заряд, протекший через раствор, получим:
q = (I1 + I2)t/2 = (0 + 3)20/2 = 30 Кл.
3.Рассчитаем массу меди, выделившейся на катоде, получим:
m(Cu) = k(I1 + I2)t/2 = [(3,3 • 10-7 кг/Кл) • 20 c]/2 = 0,0000099 кг или 9,9 мг.
Ответ: m(Cu) = 9,9 мг.
Знакомство с явлением
Соединим с источником тока последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены угольные электроды. Химически чистая вода почти не проводит ток.
Если же в воде растворить соль (например CuSO4, CuCl2), то лампочка загорится, а на катоде из раствора выделится медь.
Принцип работы конденсатора
Подключение прибора к постоянному источнику приводит к тому, что в начальный момент происходит аккумуляция в обкладках из-за электростатической индукции, а сопротивление в этот момент приравнивается нулю. Электрическая индукция провоцирует поле к притяжению разноимённых зарядов на разные обкладки, расположенные друг напротив друга.
Вам это будет интересно Световые датчики для освещения
Такое свойство получило название ёмкость, которая характерна для всех типов материалов, в том числе и диэлектриков, однако в случае с проводниками она существенно больше. Именно поэтому обкладки изготавливаются из проводника. Увеличение ёмкости способствует накоплению большего количества зарядок на обкладках.
Важно! Когда аккумулируются заряды, происходят ослабление поля и наращивание двухполюсника.
Происходит это из-за уменьшения места в обкладках, воздействия одноимённых зарядов друг на друга. Одновременно с этим напряжение приравнивается к источнику тока. Прекращение электричества в цепи происходит после того, когда обкладки полностью заполнятся электричеством. Из-за этого пропадает индукция и остаётся только поле, удерживающее и не пропускающее заряды.
Электротоку будет некуда деться, а на двухполюснике напряжение приравнивается к ЭДС. Когда ЭДС повышается, поле сильнее воздействует на диэлектрик из-за отсутствия места в обкладках. Если внутреннее конденсаторное напряжение будет выше предельных значений, тогда пробьёт диэлектрик.
Конденсатор преобразуется в проводник, и происходит освобождение зарядов, из-за чего электроток начинает идти. Чтобы применять двухполюсник при высоком напряжении повышают размер диэлектрика и наращивают расстояние, имеющееся между обкладками на фоне снижения ёмкости. Диэлектрик располагается между обкладками и не даёт проходить постоянному, выполняя в отношении него барьерную функцию.
Обратите внимание! Именно постоянное напряжение способно формировать электростатическую индукцию, но только в случае замыкания в момент зарядки конденсатора. Благодаря этому механизму сохраняется энергия до момента подсоединения к нему потребителю.
Конденсатор в цепи постоянного тока
Чтобы понять, как работает накопитель в цепи постоянного тока, надо добавить в схему лампочку, которая станет загораться только при зарядке, в процессе которой от электротока остаётся напряжение, как бы догоняющее его из-за плавного нарастания. Заряды электричества затрачивают какое-то время для перемещения к обкладкам, именно это и есть время зарядки, продолжительность которого определяется частотой и ёмкостью напряжения. Когда зарядка завершается, лампочка тухнет, и постоянный электроток перестаёт проходить через пассивный электронный компонент.
Конденсатор в цепи переменного тока
Если у источника изменить полярность, то это приведёт к разрядке конденсатора в цепи переменного тока и его повторной зарядке. Формируется постоянная электростатическая индукция при переменном. Всегда при изменении электричеством своего направления запускается механизм зарядки и разрядки, из-за чего он и пропускает переменный. Увеличение частоты приводит к снижению ёмкостного сопротивления двухполюсника.
Вам это будет интересно Схема соединений Э4
Электролитическая диссоциация
По способности проводить электрический ток в водном растворе и расплаве все вещества делятся на электролиты и неэлектролиты.
Электролитическая диссоциация – явление расщепления нейтральных молекул кислот, солей и щелочей при их растворении на положительные и отрицательные ионы.
Интенсивность электролитической диссоциации зависит:
- От температуры раствора.
- От концентрации раствора.
- От рода раствора (его диэлектрической проницаемости).
Электрический ток в растворах и (или расплавах) электролитов представляет собой упорядоченное перемещение ионов обоих знаков в противоположных направлениях.
На вольт-амперной характеристике график смещен вследствие явления поляризации.
Справедлив закон Ома при неизменной концентрации раствора и температуры.
О реальном конденсаторе
Реальный конденсатор имеет одновременно два сопротивления: активное и емкостное.
Их следует считать включенными последовательно.
Напряжение приложенное генератором к активному сопротивлению и ток идущий по активному сопротивлению совпадают по фазе.
Напряжение приложенное генератором к емкостному сопротивлению и ток идущий по емкостному сопротивлению сдвинуты по фазе на 90 0 . Результирующее напряжение приложенное генератором к конденсатору можно определить по правилу параллелограмма.
На активном сопротивлении напряжение U акт и ток I совпадают по фазе. На емкостном сопротивлении напряжение U c отстает от тока I на 90 0 . Результирующее напряжение приложенное генератором к конденсатору определяется по правилу параллелограмма. Это результирующее напряжение отстает от тока I на какой то угол φ всегда меньший 90 0 .
Закон электролиза Фарадея
Масса вещества, выделившегося на электроде за время Dt при прохождении электрического тока, пропорциональна силе тока и времени:
k – электрохимический эквивалент вещества ().
Сопротивление электролита уменьшается с ростом температуры, т. к. увеличивается количество ионов вследствие электролитической диссоциации.
Закон Фарадея позволяет определить заряд электрона:
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в 1881 г.
Тема: Электрический ток в жидкостях. Законы электролиза
Автор: , учитель высшей категории ГБОУ СОШ № 35 города Севастополя
Тема:
Электрический ток в жидкостях. Законы электролиза.
Цель:
1. Определить характер проводимости электролитов и законы протекания тока в них.
2. Отработать навыки установления причинно-следственных связей, умения анализировать результаты экспериментов.
3. Формировать культуру научной речи с использованием соответствующей терминологии, навыки работы в группе.
Тип урока:
изучение нового материала.
Форма проведения:
традиционный урок с элементами проблемной деловой игры.
Оборудование:
видеоаппаратура, мультимедийная техника, 5 установок для демонстрации электролиза (растворы соли, сахара, лимонной кислоты, соды, медного купороса), лабораторный амперметр, лабораторные лампочки на стойке, соединительные провода.
План урока:
1. Организационный момент (установление психологического контакта с аудиторией).
2. Актуализация материала и мотивация к изучению новой темы.
3. Изучение нового материала с поэтапным введением элементов деловой игры.
4. Закрепление изученного материала как заключительный этап деловой игры.
5. Домашнее задание.
6. Рефлексия.
На вспомогательной доске написаны вопросы к уроку:
1. Какие жидкости проводят электрический ток?
2. Почему электролиты проводят электрический ток?
3. Что представляет собой электрический ток в электролитах?
4. Что происходит в результате протекания тока через электролит?
5. Что влияет на результаты электролиза?
Ход урока:
1. Организационный момент (установление психологического контакта с аудиторией).
Здравствуйте! Сегодня мы с вами оказались в необычной ситуации, и поэтому для снятия напряжения и волнения я предлагаю вам начать урок с игры.
2. Актуализация материала и мотивация к изучению новой темы.
Поскольку мы изучаем большую тему «Электрический ток в различных средах», то наверняка вы помните, что есть вещества, которые проводят электрический ток, и вещества, которые не проводят его. Сейчас я буду перечислять различные вещества, а вы, в зависимости от того, проводят эти вещества ток или нет, будете либо сжимать руку в кулак, либо открывать ладонь. Итак: стекло, серебро, медь, пластмасса, железо, дерево, резина, алюминий, вода, сахар
…
Учащиеся начинают сомневаться, как ответить на вопрос о воде или сахаре.
Чтобы ответить на этот вопрос, давайте проверим на практике, проводит вода электрический ток или нет.
Фронтально проводится эксперимент по проводимости чистой воды, по проводимости сухой соли, и, наконец, по проводимости раствора соли. Учащиеся убеждаются, что чистая вода не проводит электрический ток, а раствор соли является проводником.
Итак, мы с вами увидели, что одни жидкости проводят электрический ток, а другие – нет. Поэтому темой нашего сегодняшнего урока как раз и будет изучение электрического тока в жидкостях.
На доске высвечивается слайд №2
и объявляются задачи урока. Ученики записывают тему урока в тетради.
3. Изучение нового материала с поэтапным введением элементов деловой игры.
Весь урок мы будем работать как экспертная группа по изучению проводящих свойств жидкости. Вы разделены на три рабочих отдела, каждый из которых будет выполнять свои эксперименты, и находить ответы на поставленные вашему отделу вопросы. В работе отдела прошу вас учитывать мнение каждого участника и выбрать одного человека, который будет выступать в роли руководителя отдела.
Первое исследование будет посвящено определению жидкостей, которые проводят и не проводят электрический ток. Каждая группа проводит свой эксперимент по предоставленному плану и должна дать ответ, какие из представленных жидкостей являются проводниками.
1-ый отдел проводит опыты с лимонной кислотой
2-ой отдел проводит опыт с раствором сахара
3-ий отдел проводит опыт с раствором щелочи
А я вместе с вами проведу эксперимент с раствором медного купороса — соли меди.
После проведения опытов обобщаются их результаты. На доске высвечивается слайд №3
. Учащиеся записывают в тетради определение электролитов. Учитель обращает внимание на то, что получен ответ на первый вопрос урока.
Итак, почему же электролиты обладают свойством проводимости, и что произошло с веществами после растворения в воде? Вспомните, какие необходимы условия для протекания электрического тока?
Учащиеся отвечают, что для существования электрического тока необходимо выполнение двух условий: наличие свободных заряженных частиц и наличие электрического поля.
Откуда же в электролите появляются свободные заряженные частицы? Рассмотрим процесс растворения подробнее.
На дополнительной доске заготовлен рисунок с изображением электролитической ванны с электродами. В качестве молекул вещества используются магниты двух цветов.
Когда молекулы электролита попадают в воду, на них начинают действовать полярные молекулы воды (диполи воды). Они нарушают связи ионов молекулы и «разрывают» ее. В результате образуются два вида ионов: положительные и отрицательные. Таким образом, при растворении солей, кислот, щелочей в воде происходит распад их молекул на ионы. Этот процесс носит название электролитической диссоциации
Высвечивается слайд №4
Очевидно, что в растворе остаются и нераспавшиеся молекулы, кроме того, часть ионов снова объединяются, поэтому в растворе устанавливается динамическое равновесие. Чем выше концентрация соли в растворе, тем больше свободных ионов в нем образуется.
Высвечивается слайд №5
. Обращается внимание на то, что получен ответ на второй вопрос исследования. Далее продолжается работа с механической моделью электролиза.
Итак, первое условие существования электрического тока выполнено — свободные заряды появились. Выполним второе условие — создадим электрическое поле, подключим электроды к источнику тока.
На рисунке в механической модели учитель указывает положение анода и катода.
Положительные ионы начнут направленное движение к катоду, а отрицательные – к аноду.
Учитель распределяет на механической модели магниты в соответствии с движением ионов.
В результате на каждом из электродов скапливается один вид ионов, и они могут вступать в реакцию с электродами (отбирая или отдавая им «недостающие или» «лишние»электроны). При этом на электродах выделяются чистые вещества.
Высвечивается слайд №6
. Дается определение электролиза.
Особенно широко электролиз применяется для выделения чистого металла из его соли. Например, выделение чистой меди из раствора медного купороса:
диссоциация:
CuSO4↔Cu2+ + SO42-
электролиз:
катод:
Cu2++ 2e—→Cu
Аналогично можно выделять чистые металлы из солей алюминия, серебра, хрома, никеля, цинка и т. д. Только количество выделившегося металла будет разным, т. к. ионы разных веществ имеют разную массу.
Обращается внимание на то, что получен ответ на третий вопрос.
А теперь мы продолжим работу экспертных отделов. Я предлагаю вам видеозапись проведения эксперимента по электролизу меди из медного купороса в различных условиях опыта. Ваша задача – внимательно просмотреть ее и ответить на поставленный вопрос: от чего зависит масса выделившегося на электроде вещества?
Для каждого отдела вопрос конкретизирован:
1) как зависит масса выделившегося вещества от силы тока?
2) как зависит масса выделившегося вещества от времени протекания тока?
3) зависит ли масса выделившегося вещества от вида вещества (типа его молекул)?
Идет просмотр видеосюжета, обсуждение в отделах и сообщение результатов исследования.
Итак, масса выделившегося вещества прямо пропорциональна силе тока, протекающего через электролит, промежутку времени, в течение которого проходил электролиз, и коэффициенту пропорциональности, характеризующему электрохимические особенности каждого вещества:
Учащимся предлагается определить физический смысл электрохимического эквивалента k. Для этого он выражается из математической формулы закона электролиза:
Электрохимический эквивалент указан в таблицах сборников для решения задач (предлагается открыть страницу сборника задач и просмотреть таблицу электрохимических эквивалентов
).
Получить полный текст
В ходе нашей работы мы пришли к выводу, что на значение электрохимического эквивалента влияют характеристики вещества. Как вы думаете, какие именно характеристики влияют на значение k
? Чем именно отличаются вещества друг от друга?
Учащиеся, направляемые учителем, приходят к выводу, что главное отличие заключается в относительной молекулярной массе вещества: чем больше масса молекулы (соответственно и иона), тем большая масса в итоге выделяется на электроде. Также отличие может заключаться и в валентности вещества – чем больше валентность, тем больше электронов присоединит ион.
В тетрадях записывается математическое выражение второго закона электролиза и высвечивается слайд №8
:
Электрохимический эквивалент вещества прямо пропорционален его молярной массе и обратно пропорционален его валентности.
Обращается внимание на то, что получен ответ на четвертый вопрос исследования.
4. Закрепление изученного материала как заключительный этап деловой игры.
Заключительным этапом работы экспертных отделов будет прогнозирование результатов эксперимента при различных условиях опыта.
Высвечивается слайд №9
с общей задачей, но у каждого отдела свои условия проведения опыта: электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющееся на катоде за один и тот же промежуток времени, если …
1-ый отдел — … если увеличить напряжение на электродах?
2-ой отдел — … если увеличить концентрацию раствора?
3-ий отдел — … если нагреть раствор электролита?
По мере того, как учащиеся отвечают на поставленные вопросы, высвечиваются слайды №№10,11,12
. Обращается внимание на то, что получен ответ на пятый вопрос исследования.
5. Домашнее задание.
Экспертная группа справилась с заданием и ответила на все вопросы исследования. На протяжении всего урока проходил электролиз меди из медного купороса, и я предлагаю вам посмотреть результат этого эксперимента.
Учитель демонстрирует угольный электрод с рыжим налётом меди как результат выделения чистого вещества при протекании электрического тока через электролит. После этого учитель проводит подведение итогов урока и задает задание на дом. Высвечивается слайд №13
.
Осталось только показать вам, насколько широкое применение в современной технике получили изученные нами явления.
Высвечивается слайд №14
. ( рафинирование металлов — очищение от примесей; гальванопластика; гальваностегия; электрометаллургия — получение металлов из руд)
Но это уже тема совсем другого урока.
6. Рефлексия.
Наш урок завершается. У вас на столах лежат полоски цветной бумаги. Я предлагаю вам создать букет ваших впечатлений по итогам урока – вставить в вазы полоски бумаги, которые соответствуют вашему впечатлению от урока. Если вам было интересно – опустите полоску оранжевой бумаги в эту вазу; если скучно, то выберите зеленую полоску. Если урок был вам непонятен, то опустите в вазу полоску синей бумаги. Ярких вам букетов после каждого урока.
НАШ УРОК ОКОНЧЕН. ДО СВИДАНИЯ!
Задание для первого отдела
1. Проверить проводимость раствора лимонной кислоты.
Для этого насыпьте кислоту в стакан с водой и хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от силы тока, протекающего через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить напряжение на электродах
?
Задание для второго отдела
1. Проверить проводимость раствора сахара в воде.
Для этого насыпьте сахар в стакан с водой, хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от промежутка времени протекания тока через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить концентрацию раствора
?
Задание для третьего отдела
1. Проверить проводимость раствора щелочи.
Для этого приготовьте щелочной раствор в стакане, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос зависит ли масса выделившегося на катоде вещества от его вида? Почему?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если нагреть раствор электролита
?
Задание для первого отдела
1. Проверить проводимость раствора лимонной кислоты.
Для этого насыпьте кислоту в стакан с водой и хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от силы тока, протекающего через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить напряжение на электродах
?
Задание для второго отдела
1. Проверить проводимость раствора сахара в воде.
Для этого насыпьте сахар в стакан с водой, хорошо размешайте, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос как зависит масса выделившегося на катоде вещества от промежутка времени протекания тока через электролит?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если увеличить концентрацию раствора
?
Задание для третьего отдела
1. Проверить проводимость раствора щелочи.
Для этого приготовьте щелочной раствор в стакане, вставьте в стакан электроды, включите источник тока в сеть и замкните ключ. Сделайте вывод о проводимости тока данным раствором.
2. Просмотреть видеосюжет и ответить на вопрос зависит ли масса выделившегося на катоде вещества от его вида? Почему?
3. Электрический ток пропускают через электролитическую ванну, наполненную раствором медного купороса. Как изменится количество меди, выделяющейся на катоде за один и тот же промежуток времени, если нагреть раствор электролита
?
Применение электролиза
Рафинирование (очистка) металлов
Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом – тонкая пластинка из чистого металла, а электролитом – раствор соли данного металла, например при рафинировании меди – раствор медного купороса.
При определенных условиях на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия
Некоторые металлы, например алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным подом, а анодом – угольные стержни. Температура руды (около 9000 С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через отверстие выпускают в форму для отливки.
Гальваностегия
Электролитический способ покрытия металлических изделий слоем благородных металлов не поддающихся окислению.
Гальванопластика
Используется для воспроизведения формы рельефных предметов (медалей, монет, точных копий художественных изделий).
Решить можно так:
в), е) При увеличении напряжения на электродах или
их сближении плотность тока j возрастает из-за уве-
личения напряженности электрического поля, следо-
вательно, m увеличивается.
г) Если долить электролит той же концентрации, то
повысится уровень электролита, увеличатся площади
погруженных частей электродов, возрастет сила тока
и, как следствие, увеличатся заряд Q и масса m.
д), и) При увеличении концентрации раствора или его
нагревании возрастает концентрация ионов n+ и n_,
что согласно (1) и (2) ведет к увеличениюу, j, Q и m.
ж), з) Если уменьшить погруженную часть электро-
дов, уменьшится площадь поверхности, через кото-
рую протекает ток, поэтому уменьшится сила тока и,
следовательно, уменьшатся Q и m.
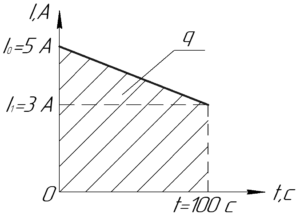
Условие задачи:
Определить массу меди, выделившейся из раствора медного купороса за 100 с, если сила тока, протекающего через электролит, менялась по закону (I=5-0,02t) (А).
Задача №7.3.25 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(t=100) с, (I=5-0,02t) А, (m-?)
Решение задачи:
[m = frac{1}{F}frac{M}{n}It;;;;(1)]
Здесь (F) – число Фарадея, равное 96600 Кл/моль; (M) – молярная масса меди, равная 0,064 кг/моль; (n) – валентность меди, равная 2.
Произведение тока (I) на время (t) равно заряду (q), протекшему через электролит, поэтому можем представить формулу (1) в виде:
[m = frac{1}{F}frac{M}{n}q]
Заряд (q) можно найти, если построить график данной в условии линейной функции. Очевидно, что начальный ток (I_0) (то есть ток в момент времени (t=0) с) равен 5 А, а конечный (I_1) (то есть ток в момент времени (t=100) с):
[I_1 = 5 – 0,02 cdot 100 = 3;А]
Если теперь построить график этой линейной функции (а мы это можем сделать, поскольку знаем координат двух точек), то заряд (q) равен площади фигуры под графиком функции (смотрите рисунок). Эта фигура является трапецией, поэтому:
[q = frac{1}{2}({I_0} + {I_1})t]
Посчитаем численное значение (q):
[q = frac{1}{2} cdot (5 + 3) cdot 100 = 400;Кл]
В итоге масса (m) равна:
[m = frac{1}{{96600}} cdot frac{{0,064}}{2} cdot 400 = 1,33 cdot {10^{ – 4}};кг = 0,133;г]
Ответ: 0,133 г.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
7.3.24 Через раствор медного купороса пропускают ток, изменяющийся по линейному во времени закону
7.3.26 Электрохимический эквивалент меди 3,3×10^(-7) кг/Кл. Сколько меди выделится на электроде
7.3.27 К источнику с ЭДС 200 В и внутренним сопротивлением 2 Ом подсоединены последовательно



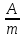 ,
,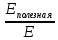 ,
,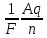
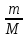 RT,
RT,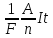
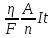 ,
,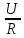 ,
,















