Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
- К каким производствам применима эта процедура?
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Стоимость получения сертификата
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
|
Этап сертификационной процедуры |
Максимальная допустимая продолжительность |
|
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции |
10 рабочих дней |
|
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку |
3 рабочих дня |
|
Инспектирование и анализ лекарственного средства |
160 рабочих дней |
|
Принятие решения о выдаче заключения по результатам инспекционного отчета |
10 рабочих дней |
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
По состоянию на конец прошлого года российские производители лекарственных средств для ветеринарного применения имели 12 действующих заключений о соответствии требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), выданных Россельхознадзором. В этой статье представлена информация об отечественных производителях ветеринарных препаратов, получавших GMP-заключения по результатам проверок, выполненных российским регулятором.
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
Соответствие требованиям GMP некоторых из этих производителей подтверждено не только Россельхознадзором, но и компетентными органами других стран, что дает возможность выхода на иностранные рынки, позволяет расширить географию поставок продукции. В статье также затрагиваются вопросы, связанные с требованиями Правил GMP Евразийского экономического союза (Правила GMP ЕАЭС) и GMP Европейского Союза (EU GMP).
GMP отечественных производителей ветеринарных препаратов
В соответствии с п. 18. Постановления Правительства Российской Федерации от 03.12.2015 №1314 «Об определении соответствия производителей лекарственных средств требованиям Правил надлежащей производственной практики», организация и проведение инспектирования производителей осуществляются уполномоченным органом в рамках лицензионного контроля за осуществлением деятельности по производству лекарственных средств [1].
Говоря о GMP-инспекциях российских производителей, Данил Рудняев, заместитель директора, руководитель Органа инспекции подведомственного Россельхознадзору ФГБУ «ВГНКИ» рассказал во время интервью федеральному отраслевому изданию «Ветеринария и жизнь» о том, как это выглядит на практике: «При проведении лицензионного контроля проводится проверка представителями Россельхознадзора совместно с представителями ФГБУ «ВГНКИ», и в случае положительного исхода данной проверки производитель может подать заявление в Россельхознадзор об оформлении ему заключения о соответствии требованиям Правил GMP» [2].
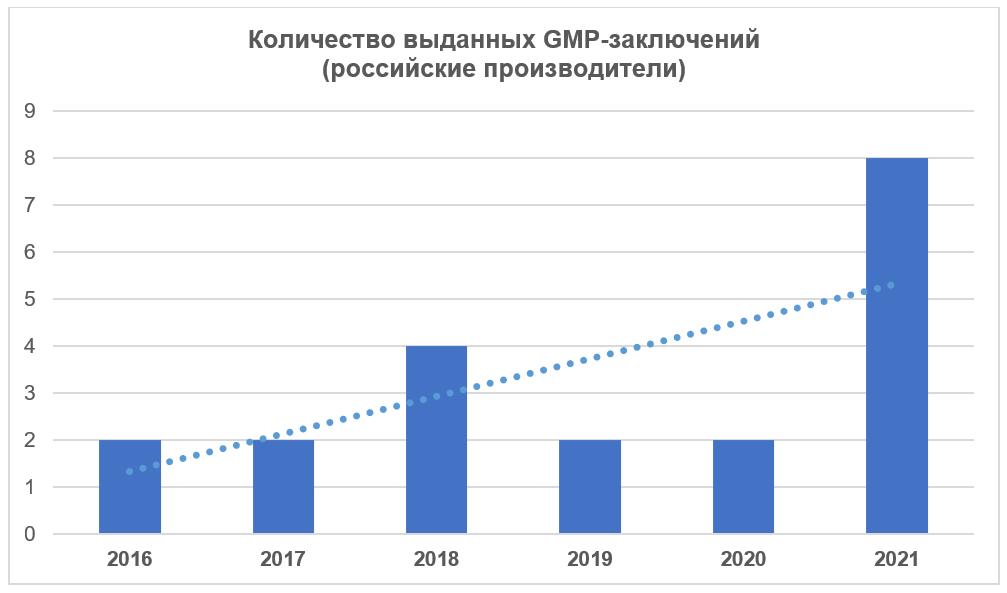
Согласно реестру выданных заключений, опубликованному на сайте Россельхознадзора 28.12.2021 г., в 2021 году российским производителям было выдано 8 GMP-заключений, что значительно больше, чем выдавалось в предыдущие годы [3].
Суммарно за 2016 – 2021 годы Россельхознадзор выдал отечественным производителям 20 заключений о соответствии требованиям Правил GMP.
1 марта 2022 года вступают в силу изменения в Федеральный закон от 04.05.2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» (в редакции Федерального закона от 11.06.2021 № 170-ФЗ). Для производителей лекарственных средств предусмотрена новая процедура лицензионного контроля «Периодическое подтверждение соответствия лицензионным требованиям», которая заменяет плановые проверки. Подать заявление для прохождения подтверждения соответствия лицензионным требованиям в первую очередь необходимо тем производителям лекарственных средств для ветеринарного применения, у которых прошло более трех лет с момента предоставления лицензии либо с даты проведения последней плановой проверки соблюдения лицензионных требований. Также по результатам периодического подтверждения соответствия возможно получение заключения о соответствии требованиям Правил GMP [4].
Российские производители препаратов для животных
ООО «НПП «АВИВАК»
Производственная площадка предприятия расположена в деревне Горбунки Ломоносовского района Ленинградской области.
Предприятие четверть века работает на рынке промышленного птицеводства, успешно решая вопросы ветеринарного обеспечения и эпизоотического благополучия более трети птицехозяйств России, стран СНГ и зарубежья. В настоящее время НПП «АВИВАК» производит более 60 наименований инактивированных и живых вакцин против большинства инфекционных болезней птиц, а также широкий спектр диагностических тест-систем. Гордостью предприятия являются научные разработки в области профилактики бактериальных болезней птиц: инактивированные вакцины против колибактериоза – «АВИВАК-КОЛИВАК», сальмонеллеза – «АВИВАК-САЛЬМОВАК», пастереллеза – «АВИВАК-ПАСТОВАК» и респираторного микоплазмоза – «АВИВАК-РМ» [5].
В 2021 году площадка получила GMP-сертификат, выданный Агентством по безопасности продуктов питания Министерства сельского хозяйства и продовольствия Болгарии [6].
В прошлом году Райффайзенбанк подписал инвестиционное соглашение с «НПП «АВИВАК» на сумму 200 млн рублей и на 90 млн рублей с Райффайзен-Лизинг. Данные средства пойдут на осуществление планов по дооснащению и запуску в эксплуатацию цеха инактивированных вакцин. Запуск нового цеха позволит увеличить объем производимой продукции для внутреннего рынка и зарубежных партнеров. В 2023 году на новой площадке будет запущен цех по производству препаратов для профилактики инфекционных болезней птиц. Общий объем инвестиций в проект составил более 400 млн рублей, из которых собственные средства компании – более 100 млн рублей [7].
ООО «НВЦ Агроветзащита С-П.»
Производственная площадка компании расположена в городе Сергиев Посад Московской области.
В 2021 году компании исполнилось 28 лет. «НВЦ Агроветзащита С-П.» (АВЗ) производит более 430 продуктов для домашних питомцев, продуктивных животных, птиц, рыб и рептилий. На сегодняшний день АВЗ экспортирует более 330 наименований продукции собственного производства в 26 стран мира [8].
В 2018 году площадка получила GMP-сертификат, выданный Национальным санитарно-ветеринарным органом власти по безопасности продуктов питания Румынии [9]; в 2019 году – GMP-сертификат, выданный Агентством по безопасности продуктов питания Министерства сельского хозяйства и продовольствия Болгарии [10].
Наличие двух лицензий на производство лекарственных средств, европейских GMP-сертификатов, сертификатов ИСО позволяют компании производить не только препараты для животных, но и для людей. Производственные мощности, наличие аккредитованной лаборатории, соблюдение стандартов GMP, высококвалифицированный персонал и огромный опыт работы делают АВЗ привлекательным партнером в области организации контрактного производства широкого спектра продукции. Также компания АВЗ является единственной компанией в РФ, производящей индол-3-карбинол по собственной запатентованной технологии синтеза [11].
ООО «Апиценна»
Производственная площадка компании расположена в городе Балашиха Московской области.
Компания «Апи-Сан», а ныне «Апиценна» вышла на рынок разработки и производства ветеринарных препаратов в 1991 году. За годы исследований и работ ассортимент продукции компании постоянно пополнялся и в данный момент насчитывает боле 200 наименований, что позволяет ей охватить практически весь спектр проблем, связанных с заболеванием животных. В 2016 году торговая марка «Празицид» была удостоена национальной премии Товар Года в категории «Антигельминтные препараты для домашних животных». В настоящее время компания «Апиценна» работает на территории всей России и еще 8 стран: Украины, Беларуси, Узбекистана, Грузии, Казахстана, Молдавии, Армении, Киргизии [12].
В ноябре 2021 года в рамках сессии по цифровизации на Ежегодной конференции ISPE ЕАЭС руководитель группы валидации компании «Апиценна» Александр Белинский рассказал о возможностях и преимуществах цифровизации при моделировании бизнес-процессов (с точки зрения консолидации требований GMP в части целостности данных), приведя пример с приемкой и передачей сырья и материалов в производство, выпуска серии готовой продукции [13].
ООО «Белфармаком»
Площадка расположена в поселке Северный Белгородской области.
Производственный комплекс «Белфармаком» находится в промышленном парке «Северный» Белгородского района на территории 2000 м². Портфель продукции компании на сегодняшний день составляет семнадцать продуктов, среди которых противомикробные средства, противококцидиозный препарат – «Кокцидикс», средства регулирующие метаболические процессы, жидкий подкислитель – «Комплисид», подкислитель в виде порошка «Проформикс», дезинфицирующее средство с моющими свойствами – «Чистобел», антисептический препарат «Септофарм». «Белфармаком» экспортирует свою продукцию в Беларусь, Казахстан, Азербайджан, Оман, Ирак, Египет [14].
ООО «Научно-производственная фирма «ВИК»
Площадка «Научно-производственная фирма «ВИК» (НПФ ВИК) расположена в поселке Северный Белгородской области.
Компания основана в 1990 году. За более чем 30 лет успешной работы «Группой компаний ВИК» (ГК ВИК) запущены: 2 производственных комплекса, 3 аккредитованные научно-исследовательские лаборатории, 7 региональных распределительных центров, современный диагностический центр «ЭПСИЛОН-БИО». Кроме того, налажена реализация продукции через 21 офис в центральных городах России, Беларуси и Казахстана. Поставки ведутся в более чем 40 стран мира, включая Нидерланды, Китай, Тайвань, Сингапур, страны Ближнего Востока, СНГ и в другие. В ассортименте более 250 видов продукции: ветеринарные препараты, кормовые добавки, косметические средства для ухода за животными, средства гигиены и санитарии. Компания получила более 50 дипломов и 20 медалей в области разработки и производства ветеринарных препаратов, а 10 продуктов собственного производства выпускаются по патентам и являются инновационными [15].
В 2021 году площадка НПФ ВИК получила сертификат соответствия производителя правилам надлежащей производственной практики EuroGMP [16].
В прошлом году площадка НПФ ВИК получила лицензию на производство и реализацию нестерильных лекарственных препаратов в форме таблеток. Сумма инвестиций составила свыше 140 млн рублей. Производительность нового таблеточного цеха в Белгороде в четыре раза превосходит мощности подобной линии ВИК в Витебске. Это позволит удовлетворять потребности российского рынка и осуществлять поставки в страны дальнего зарубежья. Поставки в ЕС начнутся уже с 2022 года. Линейка выпускаемых таблеток будет представлена ветеринарными препаратами для лечения и профилактики заболеваний сельскохозяйственных животных, а также животных-компаньонов [17].
Впервые российский производитель ветеринарных фармацевтических препаратов был включен в мировой рейтинг The Pharma 1000 Top Global Pharmaceutical Company Report. ГК ВИК заняла 21 место среди производителей ветеринарной фармацевтики в мире, а также 16 место среди всех фармацевтических компаний Восточной Европы. Данные для включения в рейтинг подсчитываются на основе финансовых показателей организаций. Ежегодное исследование и рейтинг подготовлены глобальным инвестиционным банком Torreya, который специализируется на работе с биотехнологическим, фармацевтическим и медико-биологическим секторами [18].
В статье «GDP как инструмент повышения качества операционной деятельности», вошедшей в Сборник практических статей GDP Review 2, Семен Жирнов, директор по логистике ГК ВИК и Мария Масленникова, менеджер по качеству ГК ВИК рассказали об имплементации системы менеджмента качества в «Торговом доме ВИК»: «Проанализировав возможные варианты, было принято решение о добровольном переводе всех процессов в соответствие с Правилами надлежащей дистрибьюторской практики (Good Distribution Practice, GDP) Евразийского экономического союза. Безусловно, основным критерием принятия такого решения было желание развивать функционал управления качеством в подразделениях ГК ВИК в рамках надлежащих практик (Good Practices, GxP). Если работа наших лабораторных и производственных комплексов давно и успешно основывается на принципах надлежащей лабораторной практики (Good Laboratory Practice, GLP) и GMP, так как это обязательное и неотъемлемое условие клинических исследований и производства лекарственных препаратов для ветеринарного применения, то в системе распределения сертификация в рамках GDP является добровольной. В связи с этим возник резонный вопрос – какие еще преимущества мы можем получить от имплементации системы менеджмента качества в «Торговом доме ВИК», в каких областях и сферах ее применить, какие принципы реализовать и что получить в качестве результата? Области применения – хранение и грузопереработка, организация и управление транспортировкой, эксплуатация собственного парка транспортных средств, документальное обеспечение движения материальных потоков, управление закупками и снабжением, включая взаимодействие с поставщиками, деятельность в области охраны труда, пожарной и экологической безопасности, административно-хозяйственный функционал и другие» [19].
ФГБУ «ВНИИЗЖ»
Производство расположено в городе Владимир.
В 2004 году по решению Правительства Российской Федерации была создана Федеральная служба по ветеринарному и фитосанитарному надзору (Россельхознадзор). Начиная с 2004 года ФГБУ «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»), осуществляя деятельность по контролю и надзору в сфере ветеринарии, является ее подведомственным учреждением. В настоящее время ФГБУ «ВНИИЗЖ» выпускает диагностические наборы и вакцины против болезней рогатого скота, свиней, птиц, диких плотоядных животных: всего более 100 видов продукции, в том числе около 78 видов вакцин, 21 наименование диагностических наборов и 7 наименований химиотерапевтических препаратов, которые защищены 97 патентами Российской Федерации [20].
В прошлом году был зарегистрирован новый препарат – «Вакцина против коронавирусной инфекции (COVID-19) плотоядных животных сорбированная инактивированная» (торговое наименование «Карнивак-Ков») и сделана первая производственная серия [21].
В сентябре 2021 года протоколом второго этапа рассмотрения заявок на участие в конкурсе на предоставление грантов в форме субсидий из федерального бюджета научным организациям и образовательным организациям высшего образования на реализацию отдельных мероприятий Федеральной научно-технической программы развития генетических технологий на 2019-2027 годы I очереди «Исследовательские программы» объявлено об определении победителей, в том числе одобрении заявки, подготовленной ФГБУ «ВНИИЗЖ» на тему «Создание комплекса средств защиты против экономически и социально значимых болезней животных на основе отобранных методами геномного секвенирования производственных штаммов». В ходе реализации гранта на базе подведомственных Россельхознадзору ФГБУ «ВНИИЗЖ» и ФГБУ «ВГНКИ» будут созданы новые лаборатории молекулярной биотехнологии, которые займутся созданием вакцин нового поколения против таких заболеваний как бешенство, заразный узелковый дерматит (ЗУД), а также аутогенных вакцин [22].
ООО «НИТА-ФАРМ»
Производственная площадка предприятия расположена в городе Саратов.
Портфель предприятия состоит более чем из 85 продуктов, которые на 90% закрывают потребность ветеринарных специалистов в химико-терапевтических препаратах для решения ключевых ветеринарных проблем. Компания предлагает лекарственные средства во всех основных фармацевтических группах для всех основных видов животных. 17 препаратов – это уникальные разработки компании, запатентованные на мировом уровне [23].
В интервью агропромышленному порталу AгроXXI директор компании Олег Жуков рассказал о важности локального производства субстанций: «Курс на импортозамещение актуален и в сырьевом сегменте. Правительство в лице Россельхознадзора не раз отмечало важность локализации производства субстанций на территории РФ. Наша компания тщательно изучила вопрос, оценила возможности и риски создания такого производства у себя. Действительно, мы одними из первых получили лицензию на осуществление деятельности по производству фармацевтических субстанций ветеринарного назначения. К созданию такого производства нас подтолкнуло несколько факторов. Во-первых, за последние пару лет некоторые субстанции подорожали вдвое, а это очень высокий рост цен. На ценообразование оказала влияние пандемия COVID-19, которая наглядно продемонстрировала зависимость от зарубежных поставщиков. Думаю, ни для кого не секрет, что Китай сегодня аккумулирует у себя в стране все основное производство субстанций, которые используются в фармацевтике. В последнее время власти Китая серьезно взялись за борьбу с источниками загрязнения окружающей среды, в числе которых оказались и производители фармацевтических субстанций. Требования экологического законодательства очень жесткие, поэтому перспектива закрытия предприятий, выпускающих субстанции, становится ближе, чем кажется. Уже сейчас мы наблюдаем дефицит по ряду субстанций, который естественным образом приводит к росту цен на ветеринарные препараты. Во-вторых, некоторые партии сырья, которые мы закупаем у поставщика, не проходят наш внутренний качественный аудит. Активное действующее вещество (субстанция) во многом определяет эффективность готового лекарственного средства. Именно поэтому NITA-FARM отводит качеству субстанции ключевую роль. Когда мы сами производим субстанцию, мы гарантированно обеспечиваем потребности в исходных компонентах и качество по приемлемой цене. Немаловажен тот факт, что собственное производство субстанций дает уникальные возможности в разработке препаратов. К примеру, в окситетрациклине (Нитокс) мы улучшили 3 параметра за счет проведения финишной стадии в Компании. Покупка субстанции клоксациллина у поставщиков сделала бы невозможным производство препарата Мастенит – стоимость препарата увеличилась бы в 10 раз. Мы производим основание самостоятельно и полностью управляем качеством и ценой препарата, делая его доступным для клиентов» [24].
ЗАО «НПП «Фармакс»
Производственная площадка расположена в городе Киров.
ЗАО «Научно-производственное предприятие «Фармакс» («НПП «Фармакс») – одно из ведущих фармацевтических предприятий Кировской области по производству ветеринарных препаратов. Предприятие выпускает свыше 100 наименований препаратов ветеринарного назначения в различных формах: твердых, мягких и жидких. В 2012 году компания начала выпуск первого в России противомаститного лекарственного препарата для наружного применения «Интрасан». В 2013 году был приобретен земельный участок для строительства производственной площадки в соответствии со стандартом GMP. Общая площадь участка – около 4 га. [25].
«НПП «Фармакс» предлагает услуги по контрактному производству. Компания имеет опыт разработки и вывода на рынок успешных торговых марок, присутствующих на рынке более 20 лет [26].
Помимо представленных выше предприятий, в 2016-2021 годы Россельхознадзор выдавал GMP-заключения и другим российским производителям, в частности ООО «АРЕАЛ МЕДИКАЛ», ООО «БИОН», ООО «БИОСТИМ», ООО «НПК «БИОТЕХ», ООО «Группа Фокина», ООО «ЗЭФ», Федеральное государственное бюджетное учреждение науки «ИОС УрО РАН», ООО НПФ «Исследовательский центр», ООО «НПФ «МАТЕРИА МЕДИКА ХОЛДИНГ» и ООО «НПО Петровакс Фарм».
Диалог с экспертом
Руководитель группы валидации компании «Апиценна»
Руководитель группы валидации компании «Апиценна» Александр Белинский согласился ответить на несколько вопросов, касающихся членства в Международном обществе фармацевтического инжиниринга (The International Society for Pharmaceutical Engineering, ISPE), требований GMP к производству ветеринарных лекарственных средств и внесения изменений в Правила GMP ЕАЭС [27].
Александр, как я знаю, ты являешься членом ISPE c 2015 года. Что дает членство в этой ассоциации тебе, как профессионалу фармацевтической индустрии?
В свое время мне понравился такой тезис, что GMP – это скорее отдельная философия, а не строгий свод правил. Часто возникает вопрос, как реализовать то или иное требование на практике, каким образом не только снизить регуляторные и операционные риски, но и сделать это с прицелом на возврат инвестиций. Ведь термин «возврат инвестиций» (Return on Investment, ROI) по тексту руководств ISPE встречается почти также часто, как словосочетание «оценка рисков» (Risk Assessment). В этой связи, имея доступ к форуму специалистов ISPE (так называемому CoP – Community of Practice & SIGs – Special Interest Group), реализуя возможность приобретения руководств ISPE со значительной скидкой, удается найти решения практических, рутинных вопросов, без «изобретения колеса».
В частности, таким образом можно понять, как написать спецификацию требований пользователя (User Requirement Specification, URS) – что следует в ней указать, чтобы потом «не кусать локти»; какие проекты систем водоподготовки или вентиляции и кондиционирования воздуха являются жизнеспособными и т. п. Базовые руководства в целом содержат концепции и варианты планировочных решений целых производственных участков. По сути, это своего рода «фармацевтический Клондайк», где сгенерировано огромное количество идей и решений в режиме, позволяющем осуществлять бенчмаркинг – использовать открытый международный передовой опыт для решения своих актуальных задач.
Требования GMP к производству ветеринарных лекарственных средств являются такими же, как и при производстве лекарственных средств для медицинского применения. Как ты считаешь, требования и подходы здесь действительно одинаковые?
Я не устаю акцентировать внимание на том, что, по существу, оригинальные требования EU GMP (а в рамках ЕАЭС мы, по сути, реализуем европейские требования) сформулированы недвусмысленно – «for human and veterinary use» – для медицинского и ветеринарного применения [28]. Да, существуют целевые Приложения №4 и №5, которые, отражают некоторые индивидуальные особенности производства ветеринарных лекарственных средств. Например, в случае производства стерильных ветеринарных лекарственных средств с финишной стерилизацией есть возможность их производства в чистых зонах более низкого класса, но не ниже класса D (п. 10 Приложения №4). Но в остальном идет ссылка на общие требования, сформулированные в Приложении № 1.
Поэтому мое мнение – правила и подходы должны быть идентичными, с учетом целевых требований, изложенных в Приложениях №4 и №5. Приложение №1 содержит в актуальной редакции свыше сотни пунктов, в Приложении №4 общее количество пунктов, формулирующих специальные требования к производству ветеринарных лекарственных средств, всего 10.
В свое время ты обращал внимание на некоторые различия между пунктами Главы 3 Правил GMP «Помещения и оборудование» и Приложения № 4 в отношении ветеринарных лекарственных средств, в контексте специально предназначенных и обособленных помещений и оборудования. Можешь это как-то прокомментировать?
По этому вопросу я могу констатировать, что не все так уже безоблачно и в «датском королевстве» – в ЕС по-прежнему не обновлено Приложение № 4 по отношению к обновлениям 2015 года в Главе 3 Части I EU GMP. В результате чего в Главе 3 Части I фигурируют бета-лактамы (п.3.6), а в Приложении №4 (п.7) – по-прежнему пенициллины (что соответствовало Главе 3 до 2015 года). Какой-то новой информации у меня по этому вопросу нет, помимо давнего намерения ЕМА обновить Приложение №4. Однако пока на официальном сайте нет никакой информации (в отличие, например, от «многострадального» нового Приложения №1, которое обсуждается с 2017 года, но у него хотя бы уже появился второй Проект). Поэтому пока я могу только дать ссылку на свою давнюю статью, которая написана в несколько фривольной манере, но, по сути, отражает этот диссонанс [29].
Буквально на днях должно вступить в силу Решение Совета ЕЭК о внесении изменений в Правила GMP ЕАЭС. В частности, изменится Приложение №15 «Квалификация и валидация» [30]. Скажи, пожалуйста, на какие аспекты производителям нужно обратить более пристальное внимание?
Ответ на этот вопрос заслуживает отдельной статьи. Наверное, самыми существенными изменениями обновленного Приложения №15 являются подходы к валидации процесса. Помимо того, что прямо запрещена ретроспективная валидация процесса, сформулированы три альтернативных подхода к перспективной валидации (при должном обосновании – сопутствующей): традиционный подход, непрерывная верификация процесса – при реализации разработки с концепцией «качество путем проектирования» (Quality by Design, QbD) и гибридный подход. Валидация процесса перестает быть разовым событием, что, кстати, достаточно давно, с 2011 года закреплено в США и с 2015 года в ЕС; так что для многих компаний, взаимодействующих на глобальном уровне это не новость. В связи с этим, независимо от выбранного подхода, безальтернативным дальнейшим видом деятельности является продолжающаяся верификация процесса производства в ходе жизненного цикла. Также нововведением является подход к валидации очистки на основании токсикологической оценки.
Наверное, это основные аспекты, если не считать некоторые интерпретации по отношению к европейскому оригиналу (желание «задублировать» информацию в мастер-файле производственной площадки) и изменение нумерации пунктов без существенной перекомпоновки их сути, что при этом несколько осложняет взаимодействие с международными контрагентами. По другим пунктам Правил GMP ЕАЭС такой перенумерации нет, поэтому не очень понятен мотив этого решения. Но в целом, конечно, введение измененного Приложения №15 в действие – это плюс, поскольку устаревшая редакция уж слишком сильно диссонировала с современными международными подходами. Разумеется, невыгодно было потенциально поддерживать две программы валидации для рынков государств-членов ЕАЭС и международных рынков. Сейчас такая двусмысленность уходит.
Как ты думаешь, в свете ввода в действие обновленного Приложение № 15, каким образом нужно будет поступать с лекарственными средствами, уже выпущенными на рынок, но разработка, регистрация и валидация которых выполнена еще по «старым лекалам»?
Ответ на этот вопрос лежит на поверхности. Для уже находящихся в обороте лекарственных средств даже определен специальный термин в руководствах ISPE GPG: Process Validation и PDA TR No. 60 – это «Legacy Products».
Повторюсь, если говорить о современном подходе к валидации процесса, то она перестает быть разовым событием (и это, кстати, уже не новость, поскольку существует Рекомендация Коллегии ЕЭК от 26.09.2017 №19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения», которая традиционно без ссылки на первоисточник отражает положения руководства EMA по валидации процесса – там этот тезис озвучен) [31, 32].
Выделяют три основных стадии:
- Фармацевтическая разработка.
- Собственно валидация процесса – именно для нее предлагается три подхода, упомянутых выше: традиционный, непрерывная верификация процесса (при условии использования концепции QbD) и гибридный.
- Продолжающаяся верификация процесса производства в ходе жизненного цикла.
Так вот, эти самые Legacy Products попадают сразу же в фокус продолжающейся верификации процесса производства в ходе жизненного цикла. Нужно отметить, что руководства EMA и Рекомендация Коллегии ЕЭК №19 по валидации процесса касаются стадии 2. А вот информацию по стадии 3 можно детальнее подчерпнуть в упомянутых руководствах ISPE и Ассоциации производителей парентеральных препаратов (The Parenteral Drug Association, PDA).
Если тезисно, то для таких продуктов нужно определить критические показатели качества (Сritical Quality Attributes, CQA) и критические параметры процесса (Critical Process Parameters, CPP) и ретроспективно проанализировать существующие данные по процессу, по существу, адресуясь к ежегодным обзорам качества продукции (Product Quality Review, PQR). После того, как эти данные собраны и проанализированы, могут быть идентифицированы дополнительные аспекты, требующие оценки. В любом случае эти усилия направлены на лучшее понимание процесса и выбор, в конечном счете, адекватной стратегии контроля.
Это непросто, причем не только для наших рынков. Позволю себе привести пару цитат по памяти с достаточно свежей (апрель 2021 года) статьи из ISPE Pharmaceutical Engineering – авторы отмечают, что очень немногие компании видят выгоду в валидации процесса и связанным с ней пониманием процесса [33]. И это очень резко контрастирует с большинством компаний по всему миру, которое расценивает валидацию процесса, как «трудовую повинность», как обузу. Авторы (да я думаю, что и мы с вами также) были неоднократными свидетелям «битв» между регуляторными командами и производственными командами. Первые тяготеют к тому, что валидация должна предоставить как можно большее количество данных относительно процесса, а вторые (понимая, что могут провалить валидацию процесса) хотят по возможности быть более лаконичными. Напомню, эти суждения очень даже современные, характеризующие глобальные рынки на текущем временном интервале.
Поэтому мое мнение таково: если мы чему-то не можем сопротивляться, значит нужно это возглавить. Действительное понимание процесса позволит как обосновать свою стратегию контроля (а это обязательство), так и обратить себе этот процесс на пользу.
Представленный материал подготовлен с использованием данных, актуальных на 09.02.2022. В случае получения новых или дополнительных данных статья может быть обновлена.
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
Ссылки:
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / Нормативно-правовая документация / Постановление Правительства РФ от 03.12.2015 N 1314 (ред. от 05.09.2020) «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» (вместе с «Правилами организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям»). URL: http://www.vgnki.ru/assets/files/post-1314.pdf (дата обращения 02.2022)
- Ветеринария и жизнь / Главная / Зообизнес / Эксперт рассказал, как проходят GMP-инспекции производителей ветпрепаратов. URL: https://vetandlife.ru/sobytiya/ekspert-rasskazal-kak-prohodyat-gmp-inspekcii-proizvoditelej-vetpreparatov/ (дата обращения 09.02.2022)
- Россельхознадзор / Регистрация и лицензирование / Инспектирование. Выдача заключения / Реестр заключений о соответствии производителя требованиям правил надлежащей производственной практики. URL: https://fsvps.ru/fsvps/regLicensing/conclusion/conclusionReestr.html (дата обращения 09.02.2022)
- Россельхознадзор / Новости / С 1 марта 2022 года будет введена новая процедура лицензионного контроля «Периодическое подтверждение соответствия лицензионным требованиям». URL: https://fsvps.gov.ru/fsvps/news/47268.html (дата обращения 09.02.2022)
- Авивак / О компании. URL: http://avivac.com/o-kompanii.html (дата обращения 09.02.2022)
- Авивак / О компании / GMP – сертификат европейского образца. URL: http://avivac.com/images/gmppdf (дата обращения 09.02.2022)
- Райффайзенбанк / Пресс-релизы / Райффайзенбанк и Райффайзен-Лизинг предоставили комплексное финансирование для НПП «АВИВАК». URL: https://www.raiffeisen.ru/about/press/releases/200030/ (дата обращения 09.02.2022)
- АВЗ / О компании. URL: https://avzvet.ru/about/ (дата обращения 09.02.2022)
- АВЗ / Документы / Разрешительная документация / Сертификат GMP Румыния. URL: https://avzvet.ru/upload/iblock/619/GMP_Romania.pdf (дата обращения 09.02.2022)
- АВЗ / Документы / Разрешительная документация / Сертификат GMP Болгария. URL: https://avzvet.ru/upload/iblock/1fa/GMP%20new.pdf (дата обращения 09.02.2022)
- АВЗ / О компании / Новости / Выставка Pharmtech & Ingredients. URL: https://avzvet.ru/about/news/vystavka_pharmtech_ingredients/ (дата обращения 09.02.2022)
- Апиценна / Информация / О компании. URL: https://apicenna.ru/about (дата обращения 09.02.2022)
- ISPE ЕАЭС / Новости / Новые тренды в Pharma 4.0. URL: https://ispe.ru/news/novye-trendy-v-pharma-4-0/#more-1174 (дата обращения 09.02.2022)
- Белфармаком / О компании. URL: https://belfarma.com/company/ (дата обращения 09.02.2022)
- ВИК / О компании / Группа компаний ВИК. URL: https://vicgroup.ru/about/o-kompanii/gruppa-kompaniy-vik/ (дата обращения 09.02.2022)
- ВИК / Новости / Все производственные площадки «ВИК – здоровье животных» сертифицированы по GMP. URL: https://vicgroup.ru/news/vse-proizvodstvennye-ploshchadki-vik-zdorove-zhivotnykh-sertifitsirovany-po-gmp/ (дата обращения 09.02.2022)
- ВИК / Новости / Группа компаний ВИК запускает новый таблеточный цех в Белгороде. URL: https://vicgroup.ru/news/gruppa-kompaniy-vik-zapuskaet-novyy-tabletochnyy-tsekh-v-belgorode/ (дата обращения 09.02.2022)
- ВИК / Новости / Группа компаний ВИК вошла в ТОП мировых производителей ветеринарной фармацевтики. URL: https://vicgroup.ru/news/gruppa-kompaniy-vik-voshla-v-top-mirovykh-proizvoditeley-veterinarnoy-farmatsevtiki/ (дата обращения 09.02.2022)
- ФармПром.РФ / Материалы экспертов / GDP как инструмент повышения качества операционной деятельности. URL: https://pharmprom.ru/gdp-kak-instrument-povysheniya-kachestva-operacionnoj-deyatelnosti/ (дата обращения 09.02.2022)
- ФГБУ «ВНИИЗЖ». URL: https://www.arriah.ru/main/ (дата обращения 09.02.2022)
- ФГБУ «ВНИИЗЖ» / Пресс-служба / Новости / Результаты научно-технической деятельности ФГБУ «Федеральный центр охраны здоровья животных» за 2021 год. URL: https://www.arriah.ru/press-sluzhba/news/rezultaty-nauchno-tekhnicheskoy-deyatelnosti-fgbu-federalnyy-tsentr-okhrany-zdorovya-zhivotnykh-za-2-14/ (дата обращения 09.02.2022)
- ФГБУ «ВНИИЗЖ» / Пресс-служба / Новости / Ведущие ученые Россельхознадзора объединяются для разработки вакцин нового поколения. URL: https://www.arriah.ru/press-sluzhba/news/vedushchie-uchenye-rosselkhoznadzora-obedinyayutsya-dlya-razrabotki-vaktsin-novogo-pokoleniya/ (дата обращения 09.02.2022)
- Нита-Фарм / О компании / Продукция и производство. URL: https://www.nita-farm.ru/about/products/ (дата обращения 02.2022)
- AгроXXI / Ветеринария | Животноводство / Российский новатор производства ветпрепаратов NITA-FARM запускает производство субстанций. URL: https://www.agroxxi.ru/zhivotnovodstvo/veterinarija/rossiiskii-novator-proizvodstva-vetpreparatov-nita-farm-zapuskaet-proizvodstvo-substancii.html (дата обращения 09.02.2022)
- Фармакс / О компании / История. URL: https://farmaks.com/ru/istoriya-zao-npp-farmaks (дата обращения 09.02.2022)
- Фармакс / О компании / Контрактное производство. URL: https://farmaks.com/ru/kontraktnoe-proizvodstvo (дата обращения 09.02.2022)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 09.02.2022)
- The rules governing medicinal products in the European Union – Volume 4 – EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Part 1. Chapter 4: Documentation. URL: https://ec.europa.eu/health/medicinal-products/eudralex/eudralex-volume-4_en (дата обращения02.2022)
- Объединенный фармацевтический портал PharmaPharm / Статьи / Статьи экспертов / Регуляторные квесты и лабиринты, или кому на Руси жить хорошо: старая сказка на новый лад с фарма-акцентом. URL: https://pharmapharm.ru/stati/regulyatornye-kvesty-i-labirinty-ili-komu-na-rusi-git-chorosho-staraya-skazka-na-novyy-lad-s-farma-akcentom/ (дата обращения 09.02.2022)
- Евразийский экономический союз / Распоряжение Коллегии Евразийской экономической комиссии от 19.05.2021 г. № 77 «О проекте Решения Совета Евразийской экономической комиссии «О внесении изменений в Правила надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01429302/err_24052021_77 (дата обращения 09.02.2022)
- Евразийский экономический союз / Рекомендация Коллегии ЕЭК от 26.09.2017 № 19 «О Руководстве по валидации процесса производства лекарственных препаратов для медицинского применения». URL: https://docs.eaeunion.org/docs/ru-ru/01414949/clcr_28092017_19 (дата обращения 09.02.2022)
- EMA / Guideline on process validation for finished products – information and data to be provided in regulatory submissions. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-process-validation-finished-products-information-data-be-provided-regulatory-submissions_en.pdf (дата обращения 09.02.2022)
- ISPE / Pharmaceutical Engineering / April 2021 / The History & Future of Validation. URL: https://ispe.org/pharmaceutical-engineering/march-april-2021/history-future-validation (дата обращения 09.02.2022)
Внимание!
В настоящее время на территории России и Беларуси введены ограничения на проведение работ по сертификации с международной аккредитацией. Несмотря на это, Русский Регистр в рамках принятых на себя обязательств продолжает выполнять весь комплекс работ по оценке соответствия и ищет новые пути развития для решения задач, стоящих перед нашими клиентами.
Ввиду стремительно меняющихся условий вся информация, размещаемая на официальном сайте, тщательно проверяется и актуализируется только тогда, когда мы убеждены в окончательности принятых решений и верности намеченных действий.
Для получения более подробной информации, пожалуйста, обращайтесь в центральный офис Русского Регистра или наши региональные представительства.
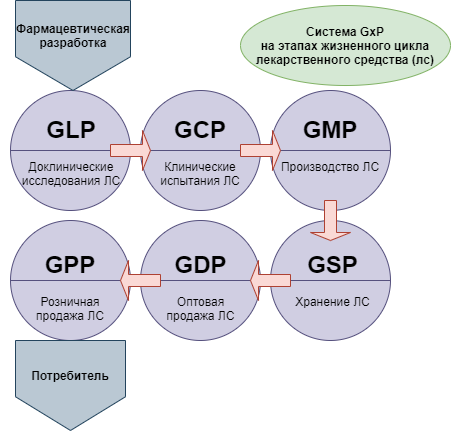
Отраслевые стандарты серии GxP (GLP/GCP/GMP)
GxP (Good … Practice, Надлежащая … практика) — признанная во всем мире система обеспечения качества лекарственных средств. Система GxP охватывает все этапы жизненного цикла лекарственного средства, от фармацевтической разработки, испытаний, изготовления, хранения до использования конечным потребителем, а именно:
- Доклинические (лабораторные) исследования, которые регулируются правилами GLP (Good Laboratory Practice, Надлежащая лабораторная практика),
- Клинические испытания, которые регулируются правилами GCP (Good Clinical Practice, Надлежащая клиническая практика),
- Производство, которое регулируется правилами GMP (Good Manufacturing Practice, Надлежащая производственная практика),
- Хранение, которое регулируется правилами GSP (Good Service Practice, Надлежащая практика обслуживания, хранения),
- Оптовая торговля, которая регулируется правилами GDP (Good Distribution Practice, Надлежащая практика оптовой продажи),
- Розничная торговля, которая регулируется правилами GPP (Good Participatory Practice, Надлежащая практика розничной продажи).
Русский Регистр оказывает услуги по сертификации на соответствие стандартам серии GxP: практикам GLP, GCP и GMP.
GLP. Надлежащая лабораторная практика
GLP (Good Laboratory Practice, Надлежащая лабораторная практика) – система качества, охватывающая организационный процесс и условия, при которых выполняются неклинические исследования лекарственных средств, связанные со здоровьем и экологической безопасностью.
Правила GLP включают в себя:
- требования к организации испытаний;
- требования к личному составу исследователей;
- требования к помещениям, в которых проводятся испытания и содержатся животные;
- требования к качеству животных, к условиям их содержания и кормления;
- требования к лабораторному оборудованию и к его калибровке;
- требования к испытуемому и контрольному веществу;
- требования к составлению и проведению подробной стандартной методики экспериментальных работ и к порядку проведения испытаний;
- требования к регистрации данных и оформлению отчета;
- требования к службе контроля за качеством испытаний;
- стандартные методики экспериментальных работ.
Национальным аналогом GLP в РФ является стандарт ГОСТ 33044–2014 Межгосударственный стандарт «Принципы надлежащей лабораторной практики», текст которого идентичен GLP.
GСP. Надлежащая клиническая практика
GCP (Good Clinical Practice, Надлежащая клиническая практика) — международный этический и научный стандарт планирования и проведения исследований с участием человека в качестве субъекта, а также документального оформления и представления результатов таких исследований.
Правила GCP призваны обеспечить достоверность результатов клинических испытаний, а также безопасность и охрану прав и здоровья людей, принимающих участие в данных испытаниях в качестве субъектов.
Национальным аналогом GCP в РФ является стандарт ГОСТ Р 52379–2005 «Надлежащая клиническая практика», текст которого идентичен GСP.
GMP. Надлежащая производственная практика
GMP (Good Manufacturing Practice, Надлежащая производственная практика) – международный стандарт, который устанавливает требования к производству и контролю качества лекарственных средств для человека и животных, а также специальные требования к производству активных фармацевтических субстанций и отдельных видов лекарственных средств. Стандарт GMP регулирует и оценивает параметры производства и лабораторной проверки.
Национальным аналогом GMP в РФ является стандарт ГОСТ Р 52249–2009 «Правила производства и контроля качества лекарственных средств», текст которого идентичен GMP.
Выгоды от внедрения и сертификации
- повышение качества и доказательности доклинических и клинических исследований при разработке новых активных фармацевтических субстанций (АФС) и лекарственных средств (ЛС);
- обеспечение качества, безопасности и эффективности лекарственных средств (ЛС) и активных фармацевтических субстанций (АФС) при их производстве;
- повышение имиджа организации, демонстрирующей приверженность требованиям международных стандартов, лучшим практикам и качеству продукции, а также соблюдение применимых законодательных и регулирующих требований;
- обеспечение экономической устойчивости организации на существующем рынке производителей медицинских изделий и возможность выхода на новые рынки сбыта;
- повышение коммерческой ценности продукции с точки зрения большего доверия со стороны потребителей и как следствие увеличение объема продаж;
- способствует успешному участию в тендерах, конкурсах на поставку продукции организации;
- четкое выстраивание бизнес‐процессов организации, эффективное распределение внутренних ресурсов, ответственности и полномочий персонала в рамках существующей системы менеджмента;
- возможность экспорта многих видов лекарственных средств в страны ЕАЭС и Евросоюза.
CE сертификация
Получите подтверждение того, что продукция вашего предприятия соответствует требованиям директив и гармонизированных стандартов Европейского Союза.
Рассчитать стоимость со скидкой
Технические условия на продукцию
Эксперты нашей компании осуществят разработку ТУ для вашей продукции, если отсутствуют соответствующие стандарты, либо существующие ГОСТы не подходят по каким-либо требованиям.
Заказать со скидкой
Декларация соответствия ТР ТС
Получите подтверждение соблюдения обязательных требований безопасности к продукции в соответствии с Техническим регламентом Таможенного союза.
Заказать со скидкой
Проверка документации ХАССП
Специалисты компании “Эксперт-Гарант” помогут вам проверить и устранить недочеты в самостоятельно разработанной документации. Получите экспертную оценку и рекомендации по исправлению несоответствий от специалистов нашей компании.
Заказать со скидкой
Подготовка предприятия к аудитам торговых сетей (Metro, X5 Retail Group, Ашан, Лента, Магнит)
Компания “Эксперт-Гарант” помогает предприятиям успешно внедрять СМБПП, необходимую для работы с крупными торговыми сетями. Специалисты нашей компании помогут вам разработать документацию и устранить имеющиеся недочеты в работе, проведут обучение персонала. Итогом работы станет успешное прохождение аудита, во время которого эксперт будет представляться сотрудником вашей компании и грамотно ответит на все вопросы аудиторов.
Заказать со скидкой
Свидетельство о государственной регистрации продукции таможенного союза (СГР)
Подтвердите соответствие продукции вашего предприятия всем санитарным и гигиеническим нормам, установленным на территории Таможенного союза. Срок действия документа бессрочный!
Заказать со скидкой
Сопровождение предприятия при прохождении аудитов РОСПОТРЕБНАДЗОРА или торговых сетей
Эксперт нашей компании поможет успешно пройти плановую проверку, представившись сотрудником вашего предприятия и грамотно отвечая на вопросы аудиторов
Заказать со скидкой
Документы по охране труда на предприятии
Эксперты нашей компании помогут вам разработать всю необходимую документацию в полном соответствии с законодательством РФ.
Заказать со скидкой
Аудит СМБПП (ХАССП)
Проведем внешний аудит предприятия на соответствие требованиям законодательства и стандартам пищевой безопасности. Дадим экспертную оценку, выявим несоответствия и поможем привести документацию в соответствие с требованиями законодательства или стандартов пищевой безопасности.
Заказать со скидкой
Проектирование с учетом требований ХАССП
Поможем спроектировать производство в соответствии с законодательством и международными стандартами.
Заказать со скидкой
Обучение персонала
Обучение в удобном для вас формате — выезд эксперта на предприятие, обучение онлайн или в формате видеоуроков. Проводим обучение по стандартам ISO 22000:2018 (ХАССП), FSSC 22000 ver. 5, GMP.
Пройти обучение со скидкой
Доработка документации
Мы поможем доработать документацию и процедуры по внедренной на предприятии СМБПП по одному из следующих стандартов — ГОСТ Р ИСО 22000:2019; ISO 22000:2018; FSSC ver.5.
Заказать со скидкой
Программа производственного контроля
Помимо системы менеджмента безопасности в соответствии со статьей 11 Федерального закона от 30.03.99 № 52-ФЗ на любом предприятии должна быть внедрена программа производственного контроля (ППК). Компания “Эксперт-Гарант” поможет разработать и внедрить ППК на вашем предприятии.
Заказать со скидкой
Технические условия (ТУ)/Стандарт организации на продукцию (СТО)
Специалисты компании “Эксперт-Гарант” имеют богатый опыт разработки, проверки и доработки ТУ и СТО для продукции, производимой не по ГОСТ.
Заказать со скидкой
Декларация соответствия на продукцию
Компания “Эксперт-Гарант” предоставляет возможность оформления Декларации соответствия. Наличие Декларации соответствия обязательно в соответствии с Федеральным Законом от 27.12.2002 N 184-ФЗ (ред. от 28.11.2018).
Заказать со скидкой
Сертификат соответствия на продукцию
Добровольная сертификация повышает доверие к продукции предприятия со стороны потребителей и деловых партнеров, что положительно сказывается на продажах.
Заказать со скидкой
Технологические карты (ТК), Калькуляционные карты (КК), Акты контрольной проработки (АКП)
Доверьте разработку технической документации экспертам нашей компании и повысьте эффективность работы вашего предприятия.
Заказать со скидкой
Спецификации
Поможем вам разработать спецификации на готовую продукцию, сырье, материалы и упаковку.
Заказать со скидкой
Лабораторные исследования
Поможем пройти любые виды лабораторных испытаний — готовой продукции, воды, оборудования и производственных помещений.
Заказать со скидкой
Регистрация торговой марки (бренда)
Поможем зарегистрировать торговую марку и защитить имя вашего бренда от несанкционированного использования.
Заказать со скидкой
Процедура получения российского сертификата GMP
Приказом от 09.08.2016 г. № 1714 был утвержден Административный регламент, предусматривающий предоставление госуслуг по выдаче заключений, удостоверяющих соответствие производителей лекарственных средств медицинского назначения правилам надлежащей производственной практики.
Осуществление процедуры сертификации было возложено на соответствующий Департамент Минпромторга РФ. Выполнением экспертных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стоимость и базовый пакет документов
Сертификат соответствия GMP ГОСТ Р – это официальное подтверждение соответствия производственных процессов определенного предприятия требованиям надлежащей производственной практики. Документом также удостоверяется высокое качество и безопасность товаров, выпускаемых сертифицируемым производством.
Чтобы оформить российский сертификат GMP, необходимо подготовить базовый пакет документов, включающий в себя:
- заявление;
- документ, подтверждающий оплату госпошлины (7500рублей);
- доверенность;
- информацию о производстве и контроле технологических процессов (Site master File);
- данные об отклонении качества, обнаруженные в течение последних 2 лет;
- номенклатуру лекарственных средств, изготавливаемых сертифицируемым производством;
- соответствующую лицензию;
- письмо-подтверждение согласия на инспектирование.
Заявление предоставляется по каждому отдельному адресу. Инспекционный контроль иностранного производителя является обязательным условием успешной сертификации.
Приказ Минпромторга от 11.01.2016 № 9 предусматривает плату за инспектирование. Формирующаяся с учетом инспекционной программы, накладных и косвенных расходов, она может достигать 2,8 млн. рублей. Ее расчет производит ФГБУ «ГИЛС и НП» на основании решения, принятого Минпромторгом.
Порядок оформления
- Передача заявителем базового пакета документов и заявления в Минпромторг.
- Изучение документации, ее правильности и полноты объема (10 рабочих дней).
- Если заявитель получает запрос на конкретизацию предоставленной информации, он обязан в течение 20 рабочих дней предоставить ответ, чтобы избежать отказа.
- Принятие решения об инспекционном контроле с дальнейшим направлением базовой документации в ФГБУ «ГИЛС и НП» для проведения инспектирования не позднее 160 рабочих дней.
- Внесение сертифицируемого производства в инспекционный график (20 рабочих дней), публикующийся в соответствующем календаре GMP, на обновление которого отводится до 3 дней, после внесения изменений.
- Заключение договора с ФГБУ «ГИЛС и НП» и внесение оплаты за проведение инспектирования (20 дней).
- Инспекционный процесс (10 дней), составление отчета по его результатам (30 дней) и его направление в Минпромторг и заявителю(3дня).
- Выдача заключения, оформленного в соответствии с приказом Минпромторга от 04.02.2016 № 261.
Российский сертификат GMP остается действительным на протяжении 3 лет с момента завершения инспектирования.