Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
- Схема гальванического элемента
- Устройство и принцип работы гальванического элемента
- Гальванический элемент: схема, принцип работы, применение
- Химические источники тока
- Простейший гальванический элемент
- Пример гальванического элемента
- Принцип действия
- Разновидности гальванических элементов
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
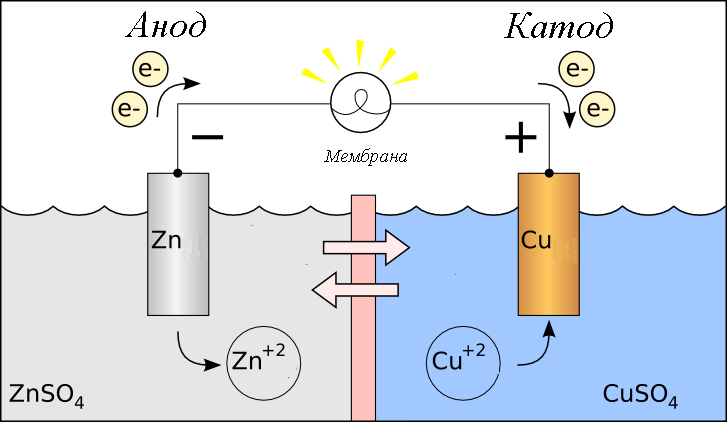
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
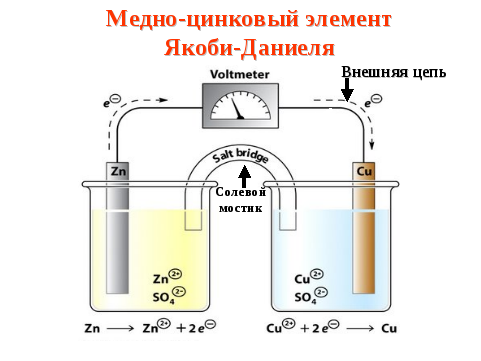
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Понравилась статья? Расскажите друзьям:
Оцените статью, для нас это очень важно:
Проголосовавших: 7 чел.
Средний рейтинг: 4.1 из 5.
Гальваническими элементами называют устройства или системы, в которых реализуется прямое окислительно-восстановительное преобразование химической энергии имеющихся в них реагентов в электрическую.
Другими словами гальванические элементы – простые химические источники электрической энергии. Гальванический элемент является необратимым источником одноразового действия. Гальванический элемент работает до тех пор, пока не израсходуется один из электродов. В таком элементе всегда растворяется наиболее активный металл.
Принцип работы гальванических элементов
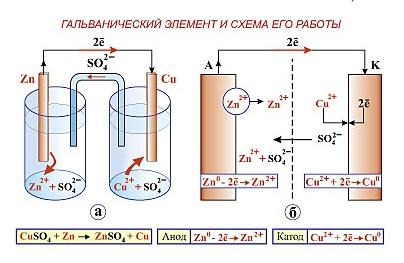
Первая такая электрохимическая система была предложена итальянским ученым Алессандро Вольта. Она представляет собой цинковые и медные пластины, между которыми находится сукно, увлажненное серной кислотой: Zn/H+/CuZn/H^+/Cu.
Согласно схеме данного гальванического элемента CuSО4CuSО_4—ZnSО4ZnSО_4, в нем происходят следующие процессы:
Катод(+) Cu2++2→Cu0Cu^{2+} +2 → Cu^0
Aнод(–) Zn0→Zn2++2Zn^0 → Zn^{2+}+ 2
Результирующий процесс Cu2++Zn0→Zn2++Cu0Cu^{2+} + Zn^0 → Zn^{2+} + Cu^0
Принципиальная схема гальванического элементаCuSО4CuSО_4—ZnSО4ZnSО_4
Электроны направляются из медного электрода к серебряному. Электрод на котором протекает процесс окисления (Zn0→Zn2+Zn^0 → Zn^{2+}, процесс окисления) будет анодом, электрод на котором происходит процесс восстановления (Cu2+→Cu0Cu^{2+} → Cu^0, процесс восстановления) – катодом. В гальваническом элементе анод заряжен отрицательно, катод – положительно.
E0=ΔE0−ΔE.0=ΔE0−ΔE0=ΔECu2+/Cu00−ΔEZn2+/Zn00=0,34−(−0,76)=1,1B{{E}^{0}}=Delta E_{}^{0}-Delta E_{.}^{0}=Delta E_{}^{0}-Delta E_{}^{0}=Delta E_{C{{u}^{2+}}/C{{u}^{0}}}^{0}-Delta E_{Z{{n}^{2+}}/Z{{n}^{0}}}^{0}=0,34-(-0,76)=1,1B
Способность каждого химического элемента подвергаться в гальваническом устройстве окислению или, наоборот, восстановлению можно установить, оценивая его электродный потенциал. Например, катод, потенциал которого имеет более высокую алгебраическую величину (более положительное значение), представляет собой положительный полюс внешнего круга гальванического элемента, тогда как анод, имея меньшую величину этого потенциала (более отрицательное значение), будет отрицательным полюсом.
Перед началом работы гальванического элемента в обоих растворах количество катионов строго соответствует числу анионов. В процессе эксплуатации гальванического элемента в раствор ZnSО4ZnSО_4 непрерывно поступают катионы цинка, поэтому анионов становится недостаточно для образования молекулярной вещества, а с раствор CuSО4CuSО_4 катионы меди постоянно восстанавливаются на медном катоде, поэтому образуется избыток анионов, которые движутся через солевой мостик или электрохимический ключ от раствора CuSО4CuSО_4 к раствору ZnSО4ZnSО_4.
В момент замыкания проводником двух электродов между двумя металлами возникает потенциал, называемый контактным.
Характеристика некоторых промышленных гальванических элементов
| Название элемента | Электрохимическая система | Контакт, состояние электролита |
|---|---|---|
| Мангано-цинковый солевой | Zn/NH4Cl/MnО2© | Постоянный, водный, пастовый |
| Мангано-цинковый щелочной | Zn/KОH/MnО2© | Постоянный, водный, пастовый |
| Воздушно-цинковый щелочной | Zn/KОH/О2© | Постоянный, водный, пастовый |
| Серебряно-цинковый щелочной | Zn/KОH/Ag2О | Постоянный, водный, пастовый |
| Ртутно-цинковый щелочной | Zn/KOH/HgO | Постоянный, водный, пастовый |
| Медно-цинковый | Zn/KOH/CuO | Постоянный, водный, незагущенный3 |
| Литий-оксид марганца (IV) | Li/LiC1О4/MnО2 | Постоянный, апротонный, матричный |
| Литий-оксид серы (IV) | Li/LiBr/SО2 | Постоянный, апротонный, матричный |
| Магний-хлорид серебра | Mg/NaCl/AgCl | Наливной, водный, незагущенный |
| Магний-оксид свинца (IV) | Mg/NaCl/PbО22 | Наливной, водный, незагущенный |
| Магний хлорид меди (I) | Mg/NaCl/CuCl | Наливной, водный, незагущенный |
| Серебро-йод | Ag/Ag4I5/I2 | Твердый, прессованный |
| Кальций-хлорид кальция | Ca/LiCl, KCl/CaCrО4 | Расплав, твердый |
Тест по теме «Гальванические элементы»
Гальванический
элемент (ГЭ)
— это устройство для превращения
химической энергии в электрическую. ГЭ
состоит из двух электродов (полуэлементов).
Простейший полуэлемент состоит из
металлической пластинки, опущенной в
раствор своей соли. Более
активный металл называется анодом.
На его поверхности протекает процесс
окисления. При работе ГЭ анод заряжается
отрицательно. На
менее активном металле, называемом
катодом,
протекает процесс восстановления. При
работе гальванического элемента катод
заряжается положительно. На рис.15
представлена схема медно-цинкового
гальванического элемента Якоби-Даниеля.
Рисунок
15. —
Медно-цинковый элемент Якоби-Даниеля
Медный и цинковый
электроды соединены металлическим
проводником, образующим внешнюю цепь
гальванического элемента. Растворы
солей CuSO4
и ZnSO4
соединены между собой солевым мостиком,
образующим внутреннюю цепь гальванического
элемента. Солевой мо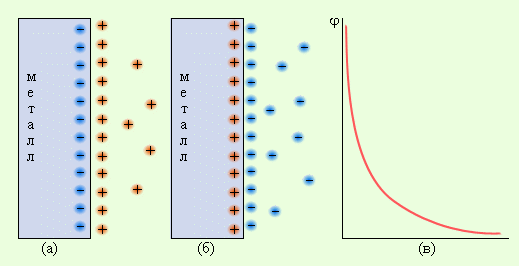
(электролитический ключ)—
это стеклянная трубка, заполненная
раствором электролита.
Цинковый электрод
является анодом; на нем протекает процесс
окисления:
Zn0
– 2e—Zn2+.
Катионы Zn2+
переходят в раствор, вследствие чего
раствор приобретает положительный
заряд, а электрод – отрицательный.
Э
отданные цинком, поступают во внешнюю
цепь и мигрируют к меди.
Медный электрод
является катодом; на нем протекает
процесс восстановления:
Cu
2+
+ 2e—Cu0.
Катионы Cu2+
принимают электроны, поступающие из
внешней цепи, восстанавливаются и
осаждаются на медном электроде. В
результате раствор приобретает
отрицательный заряд, а электрод –
положительный.
Схема медно-цинкового
гальванического элемента записывается
следующим образом:
(-)
Zn
/ Zn2+
// Cu2+/
Cu
(+),
где /
обозначает поверхность раздела
металл-раствор, а также ОВ потенциал
(электродный потенциал), возникающий
на поверхности электрода вследствие
того, что металл и раствор имеют
разноименные заряды;
// обозначают
границу раздела двух растворов, а так
же диффузионный потенциал, возникающий
из-за их разноименных зарядов.
Суммируя уравнения
окислительно-восстановительных
полуреакций, получаем уравнение суммарной
токообразующей реакции:
Катод: Zn0
– 2e—
Zn2+
1
Анод: Cu
2+
+ 2e—Cu0
1
Zn0
+ Cu2+Zn2+
+ Cu0
Эдс
гальванического элемента рассчитывают
как разность окислительно-восстановительных
потенциалов катода и анода:
Е=φ(катод)
– φ(анод).
Помимо
окислительно-восстановительных и
диффузионных потенциалов, возникновение
электрического тока в гальваническом
элементе происходит за счет мембранных
потенциалов, возникновение которых
обусловлено неравномерным распределением
заряженных частиц (например, ионов) по
обе стороны мембраны. Именно такое
распределение ионов характерно для
клеток человека (таблица 6).
Таблица
6 — Ионный состав нервной клетки
-
Ионы
Внутренняя
средаВнешняя
средаК+
400 ммоль/л
20 ммоль/л
Na+
50 ммоль/л
440 ммоль/л
Cl‾
120 ммоль/л
550 ммоль/л
Для каждого
проникающего иона мембранный потенциал
рассчитывается по уравнению Нернста:
где
[X] внешн.
среда и [x]
внутр. среда —
это концентрации иона во внешней и
внутренней средах соответственно,
моль/л;
n
— заряд иона.
Мембранные
потенциалы клеток называют биопотенциалами.
Метод регистрации
биопотенциалов используется при
исследовании деятельности различных
органов, например, при диагностике
сердечных заболеваний (электрокардиография).
Регистрация биопотенциалов мозга
(электроэнцефалограмма) в ряде случаев
позволяет судить о патологических
нарушениях центральной нервной системы.
Классификация
гальванических элементов по устройству
Различают три типа
гальванических элементов: химические,
концентрационные и топливные.
Химические
гальванические элементы состоят из
различных электродов. Примером является
медно-цинковый элемент Якоби-Даниеля.
Концентрационные элементы состоят из
одинаковых электродов и отличаются
только концентрацией электролитов них:
(–) Zn
/ ZnSO4
aq
// ZnSO4
aq
/ Zn
(+)
СМ(1)
СМ(2)
В топливных
элементах энергия, выделяющаяся при
горении топлива, превращается в
электрическую энергию:
С3Н8
+ 5 О2
→ 3 СО2
+ 4 Н2О.
Классификация
гальванических элементов по назначению
Различают элементы,
используемые как химические источники
тока, и элементы, применяемые для
потенциометрических методов анализа.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
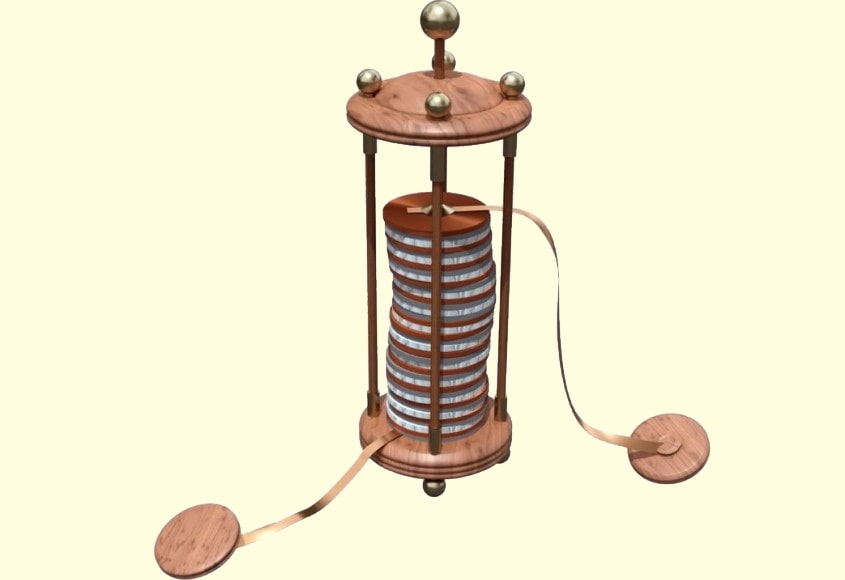
Александро Вольта предложил разделить все проводники на два рода:
- Сухие — металлы и уголь.
- Влажные — электролиты(влажные).
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
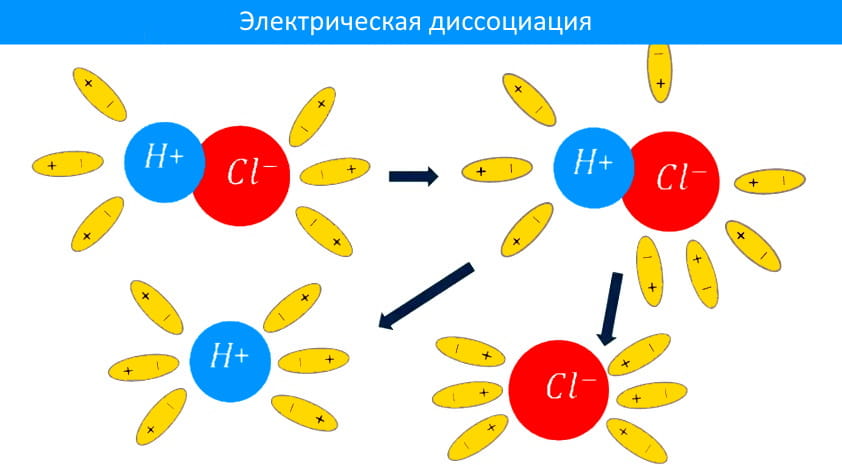
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
- Цинковый анод стал делаться в виде цинкового стаканчика.
- В стаканчике разместился катод из смеси диоксида марганца и графита.
- В центре катода находится угольный стержень, являющийся токосъемником (в некоторых источниках именно он неправильно называется катодом).
- Катод окружен электролитом из хлорида аммония с добавкой хлорида цинка.
- Электролит уже не в жидком виде, как у Лекланше, а в загущенном (гель). Это происходит путем добавления крахмала и муки, и необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Конструкция сухой батареи:
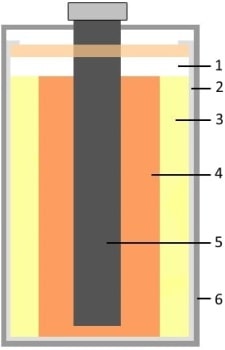 |
1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Гальванический элемент
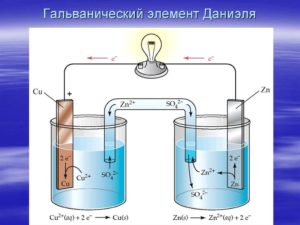
Схема гальванического элемента Даниэля-Якоби Обозначение гальванического элемента на принципиальных электрических схемах
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко.
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
| Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение.
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены.
Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси.
Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония.
Важно
Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция.
Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите.
Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3.
Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Пркимущества:
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк.
Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование.
Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
Совет
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом.
Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Предыдущая
РазноеСумеречные выключатели
Следующая
РазноеЧто такое ограничитель перенапряжения и как он работает?
На чтение 5 мин Просмотров 5.7к.
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Содержание
- Схема гальванического элемента
- Устройство гальванического элемента
- Принцип работы гальванического элемента
- Ответы на часто задаваемые вопросы
- Типы гальванических элементов
- Таблица гальванических элементов
- Назначение гальванического элемента
- Гальванический элемент в домашних условиях
- Процесс изготовления
Схема гальванического элемента
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно — цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
В современных условиях наиболее распространенными химическими источниками тока являются гальванические элементы. Несмотря на их отдельные недостатки, они получили широкое распространение в электронике, проводится постоянная работа по их совершенствованию. Принцип работы гальванического элемента достаточно прост. В водный раствор серной кислоты погружаются медная и цинковая пластины, которые, затем, играют роль положительного и отрицательного полюса.
Принцип действия гальванического элемента
При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному, то есть от цинковой пластины к медной. Движение заряженных частиц по внешней цепи будет осуществляться в обратном направлении.
При воздействии электрического тока движение остатков серной кислоты, а также ионов водорода будет происходить в различных направлениях. При этом, водород передает заряд на медную пластину, а остаток кислоты – на цинковую пластину. Таким образом, на клеммах будет осуществляться поддержка напряжения. Одновременно, на медной пластине оседают пузырьки водорода, ослабляющего общее действие элемента и создающего дополнительное напряжение.
Такое напряжение известно, как электродвижущая сила поляризации. Чтобы избежать этого явления, в состав вводится вещество, способное поглощать атомы водорода и выполнять функцию деполяризации.
Гальванические элементы: преимущества и недостатки
Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых батареек.
Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения.
Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения. Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами.
Гальванический элемент
Схема гальванического элемента Даниэля-Якоби Обозначение гальванического элемента на принципиальных электрических схемах
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
История изучения гальванических процессов[ | ]
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета (г.
Болонья, Италия) — Луиджи Гальвани в 1786 году: Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закреплённых на медных крючках, при прикосновении стального скальпеля.
Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алессандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А.
Вольта проделал серию опытов и пришёл к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение — А. Вольта заменил лапку лягушки изобретённым им электрометром и повторил все действия.В 1800 году А.
Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления.Русский учёный Петров в 1802 году использовал гальванический элемент для построения электрической дуги.
Виды электродов[ | ]
В состав гальванического элемента входят электроды.Электроды бывают:
Обратимые электроды[ | ]
- Электроды 1-го рода — электроды, состоящие из металла, погружённого в раствор его соли;
- Электроды 2-го рода — электрод, состоящий из металла, покрытого труднорастворимой солью этого же металла, погружённый в раствор соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод, каломельный электрод, металл-оксидные электроды);
- Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов: в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом — есть общий анион с первым осадком;
- Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (, водородный электрод);
- Амальгамные электроды — электроды, состоящие из раствора металла в ртути;
- Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
Характеристики гальванических элементов[ | ]
Гальванические элементы характеризуются электродвижущей силой (ЭДС), ёмкостью; энергией, которую он может отдать во внешнюю цепь; сохраняемостью.
- Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями протекающих электрохимических процессов в виде уравнения Нернста.
- Электрическая ёмкость элемента — это количество электричества, которое источник тока отдаёт при разряде. Ёмкость зависит от массы реагентов, запасённых в источнике, и степени их превращения; снижается с понижением температуры или увеличением разрядного тока.
- Энергия гальванического элемента численно равна произведению его ёмкости на напряжение. С увеличением количества вещества реагентов в элементе и до определённого предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
- Сохраняемость — это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
Классификация гальванических элементов[ | ]
Использованные источники питания различных типов и размеров
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки).
Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом.
Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Литий-ионный аккумулятор сотового телефона
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щёлочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются.
Восстановителем является водород (H2), метанол (CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый.В кислородно-водородном топливном элементе со щёлочным электролитом, происходит превращение химической энергии в электрическую.
Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов.
Применение[ | ]
- Батарейки используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления.
- Аккумуляторы используются для запуска двигателей машин; возможно так же и применение в качестве временных источников электроэнергии в местах, удалённых от населенных пунктов.
- Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
Литература[ | ]
- Ахметов Н. С. Общая и неорганическая химия
- Аксенович Л. А. Физика в средней школе: Теория. Задания.
- Еремин В. В., Каргов С. И., Успенская И. А., Кузменко Н. Е., Лунин В. В. Основы физической химии. Теория и задачи: учебное пособие для вузов
Ссылки[ | ]
Виды гальванических элементов: устройство и работа солевых, щелочных и литиевых батарей и аккумуляторов
Разные виды гальванических элементов преобразовывают свою химическую энергию в электрический ток. Своё название они получили в честь итальянского учёного Гальвани, который проводил первые подобные эксперименты и исследования. Электричество вырабатывается благодаря химическому взаимодействию двух металлов (обычно цинка и меди) в электролите.
- Принцип действия
- Разновидности элементов
- Сфера применения
Учёные помещали в ёмкости с кислотой медную и цинковую пластинку. Их соединяли проводником, на первой образовывались пузырьки газа, вторая начинала растворяться. Это доказывало то, что по проводнику протекает электрический ток.
После Гальвани опытами занялся Вольт. Он создал элемент цилиндрической формы, похожий на вертикальный столбец. В его составе были цинковые, медные и суконные кольца, предварительно пропитанные кислотой.
Первый элемент имел высоту в 50 см, и выработанное им напряжение чувствовалось человеком.
Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток.
Современные гальванические элементы и аккумуляторы называют батарейками. Их напряжение зависит от используемого металла. Устройство помещено в цилиндр из мягкой жести.
В качестве электродов выступают сетки с окислительным и восстановительным напылением.
Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток.
Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны.
Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
В обычных условиях электролит не пропускает ток, он распадается на ионы только во время замыкания цепи. Именно это обуславливает появление проводимости. В качестве электролита используют раствор кислоты, натриевые или калиевые соли.
Разновидности элементов
Батарейки используют для питания приборов, устройств, техники, игрушек. Все гальванические элементы по схеме делят на несколько видов:
- солевые;
- щелочные;
- литиевые.
Наиболее популярные — солевые батарейки, изготовленные из цинка и марганца. Элемент сочетает в себе надёжность, качество и приемлемую цену. Но в последнее время производители снижают или полностью прекращают их изготовление, так как со стороны фирм, выпускающих бытовую технику, к ним постепенно повышают требования. Основные преимущества гальванических батарей этого типа:
- универсальные параметры, позволяющие использовать их в разных областях;
- лёгкая эксплуатация;
- невысокая стоимость;
- простые условия производства;
- доступное и недорогое сырье.
Среди недостатков выделяют небольшой срок службы (не более двух лет), уменьшение свойств из-за низких температур, уменьшение ёмкости при повышении тока и снижение напряжения во время работы.
Когда солевые батарейки разряжаются, они могут потечь, так как положительный объем электрода выталкивает электролит. Проводимость повышают графит и сажа, активная смесь состоит из диоксида марганца.
Срок эксплуатации напрямую зависит от объёма электролита.
В прошлом столетии появились первые щелочные элементы. Роль окислителя в них играет марганец, а восстановителя — цинковый порошок. Корпус батарейки амальгамируют во избежание появления коррозии. Но использование ртути запретили, поэтому их покрывали смесями из цинкового порошка с ингибиторами ржавчины.
Активное вещество в устройстве гальванического элемента — это цинк, индий, свинец и алюминий. В активную массу входят сажа, марганец и графит.
Электролит изготавливают из калия и натрия. Сухой порошок значительно повышает функционирование батарейки. При таких же габаритах, как у солевых видов, щелочные имеют большую ёмкость.
Они продолжают хорошо работать даже при сильном морозе.
Литиевые элементы используют для питания современной техники. Их выпускают в виде батареек и аккумуляторов разных размеров. В составе первых находится твёрдый электролит, в других устройствах — жидкий.
Такой вариант подходит для приборов, требующих стабильного напряжения и средних зарядов тока.
Литиевые аккумуляторы можно заряжать несколько раз, батарейки используют только однажды, их не вскрывают.
Сфера применения
К производству гальванических элементов выдвигают ряд требований. Корпус батареек должен быть надёжным и герметичным. Электролит не должен вытекать, а также нельзя допускать попадания внутрь устройства посторонних веществ.
В некоторых случаях при вытекании жидкости она загорается. Повреждённый элемент нельзя использовать. Габариты у всех батареек практически одинаковы, отличаются только размеры аккумуляторов.
Элементы могут иметь разную форму: цилиндрическую, призматическую или дисковую.
У всех типов устройств есть общие достоинства: они компактны и имеют незначительный вес, приспособлены к разным диапазонам рабочей температуры, обладают большой ёмкостью и стабильно работают в разных условиях. Есть также и некоторые недостатки, но они касаются определённых типов элементов. Солевые служат недолго, литиевые устроенные так, что могут воспламеняться при разгерметизации.
Сферы применения батареек многочисленны:
- цифровая техника;
- детские игрушки;
- медицинские приборы;
- оборонная и авиационная промышленность;
- космическое производство.
Гальванические элементы легко использовать, они доступны по стоимости. Но с некоторыми видами нужно обращаться аккуратно и не использовать их в случае повреждения. Перед приобретением батареек нужно внимательно изучить инструкцию прибора, который они будут питать.
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора.
Кроме того, схема двух гальванических элементов предполагает наличие катода и анода.
Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля.
Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод).
Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим.
Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода.
Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде.
В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения.
В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Гальванические элементы. Виды и устройство. Работа и особенности
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую.
Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток.
Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов.
Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости.
Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три вида:
- Щелочные.
- Солевые.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены.
Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси.
Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония.
Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция.
Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите.
Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3.
Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк.
Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование.
Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом.
Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов.
Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение.
Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической.
Габариты практически не отличаются от других видов батареек.
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Похожие темы:
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
- Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
Источник электрической энергии
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование.
Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.
Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется.
Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания.
Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье.
Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр.
363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки.
В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось.
И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия.
Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала.
В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов.
К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения.
Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления.
Цитата Вольты из письма, адресованного редактору научного журнала:
Проводники первого рода (твёрдые тела) и второго рода (жидкости) при соприкосновении в некоторой комбинации рождают импульс электричества, сегодня нельзя объяснить причины возникновения явления. Ток течёт по замкнутому контуру и исчезает, если целостность цепи нарушена.
Вольтов столб
Лепту в череду открытий внёс Джованни Фаброни, сообщивший, что при размещении двух пластинок гальванической пары в воду, одна начинает разрушаться. Следовательно, явление имеет отношение к химическим процессам.
А Вольта тем временем изобрёл первый источник питания, долгое время служивший для исследования электричества. Учёный постоянно искал способы усиления действия гальванических пар, но не находил.
В ходе опытов создана конструкция вольтова столба:
- Попарно брались цинковые и медные кружки в плотном соприкосновении друг с другом.
- Полученные пары разделялись мокрыми кружками картона и ставились друг над другом.
Легко догадаться, получилось последовательное соединение источников тока, которые суммируясь, усиливали эффект (разность потенциалов). Новый прибор вызывал при прикосновении ощутимый для руки человека удар. Подобно опытам Мушенбрука с лейденской банкой.
Однако для повторения эффекта требовалось время. Стало очевидно, что источник энергии имеет химическое происхождение и постепенно возобновляется. Но привыкнуть к понятию нового электричества оказалось непросто.
Вольтов столб вёл себя подобно заряженной лейденской банке, но…
Эксперимент Вольта
Вольта организует дополнительный эксперимент. Снабжает каждый из кружков изолирующей ручкой, приводит в соприкосновение на некоторое время, потом размыкает и проводит исследование электроскопом.
К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается.
Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.
Вольта объяснил, что без мокрых кружков, прокладываемых между металлами, конструкция ведёт себя как две пластинки: медная и цинковая. Усиления не происходит. Вольта нашёл первый ряд электроотрицательности: цинк, свинец, олово, железо, медь, серебро.
И если исключить промежуточные металлы между крайними, «движущая сила» не изменяется. Вольта установил, что электричество существует, пока соприкасаются пластины: сила не видна, но легко чувствуется, следовательно, она истинна.
Учёный 20 марта 1800 года пишет президенту Королевского общества Лондона сэру Джозефу Бэнксу, к которому обращался впервые и Майкл Фарадей.
Английские исследователи быстро обнаружили: если на верхнюю пластину (медь) капнуть воды, в указанной точке в районе контакта выделяется газ. Они проделали опыт с обоих сторон: провода подходящей цепи заключили в колбы с водой. Газ исследовали.
Оказалось, что газ горючий, выделяется лишь с единственной стороны. С противоположной заметно окислилась проволока. Установлено, что первое является водородом, а второе явление происходит вследствие избытка кислорода.
Установлено (2 мая 1800 года), что наблюдаемый процесс — разложение воды под действием электрического тока.
Уильям Крукшенк немедленно показал, что аналогичное допустимо проделать с растворами солей металлов, а Волластон окончательно доказал идентичность вольтова столба статическому электричеству. Как выразился учёный: действие слабее, но обладает большей продолжительностью.
Мартин Ван Марум и Христиан Генрих Пфафф зарядили от элемента лейденскую банку. А профессор Хампфри Дэви установил, что чистая вода не может служить в этом случае электролитом.
Напротив, чем сильнее жидкость способна окислять цинк, тем лучше действует вольтов столб, что вполне согласовывалось с наблюдениями Фаброни.
Кислота намного улучшает работоспособность, ускоряя процесс выработки электричества. В конце концов Дэви создал стройную теорию вольтова столба.
Он пояснил, что металлы изначально обладают неким зарядом, при замыкании контактов вызывающим действие элемента.
Если электролит способен окислять поверхность донора электронов, слой истощённых атомов постепенно удаляется, открывая новые слои, способные давать электричество.
В 1803 году Риттер собрал столб из чередующихся кружков серебра и мокрого сукна, прообраз первого аккумулятора. Риттер зарядил его от вольтова столба и наблюдал процесс разрядки. Правильное толкование явлению дал Алессандро Вольта.
И лишь в 1825 году Огюст де ла Рив доказал, что перенос электричества в растворе осуществляется ионами вещества, наблюдая образование оксида цинка в камере с чистой водой, отделённой от соседней мембраной.
Заявление помогло Берцелиусу создать физическую модель, в которой атому электролита представлялись составленными из двух противоположно заряженных полюсов (ионов), способных диссоциировать. В результате получилась стройная картина переноса электричества на расстояние.